Украинские кардиологи смогут назначать оригинальный рамиприл
21-22 мая в г. Киеве в Национальном научном центре «Институт кардиологии им. Н.Д. Стражеско» АМН Украины проходила научно-практическая конференция «Сердечно-сосудистые и ассоциированные с ними болезни внутренних органов», посвященная 100-летию со дня рождения А.Л. Михнева – выдающегося кардиолога, возглавлявшего институт с 1952 по 1970 год. В рамках конференции состоялся сателлитный симпозиум, приуроченный к выходу на украинский фармацевтический рынок оригинального препарата рамиприла Тритаце производства компании «Санофи-Авентис». До этого момента один из самых назначаемых в мире ингибиторов АПФ был представлен в нашей стране только генерическими препаратами. Ведущие специалисты института напомнили участникам симпозиума историю изучения рамиприла в контексте его влияния на различные этапы сердечно-сосудистого континуума, а также систематизировали данные об эффективности, безопасности и месте препарата в современной терапевтической практике.
Заведующий отделом симптоматических гипертензий ННЦ «Институт кардиологии им. Н.Д. Стражеско» АМН Украины, доктор медицинских наук, профессор Юрий Николаевич Сиренко рассмотрел основные клинические исследования по изучению антигипертензивных, органопротективных свойств рамиприла и его влияния на прогноз у пациентов высокого сердечно-сосудистого риска.
 – Чтобы понять, каких целей мы пытаемся достичь, назначая больным ингибиторы АПФ, следует еще раз обратиться к концепции сердечно-сосудистого континуума. Термин «континуум» (от лат. continuum - непрерывное, сплошное) используется в современной кардиологии для того, чтобы подчеркнуть непрерывность процесса патологических изменений в сердечно-сосудистой системе. Процесс этот начинается в раннем детском возрасте (первые проявления атеросклероза обнаружены даже у новорожденных), сопровождает человека на протяжении всей его жизни, а зачастую преждевременно ее обрывает. Последовательность событий континуума можно представить так: факторы риска (артериальная гипертензия (АГ), дислипидемия, сахарный диабет (СД), курение и др.) ® дисфункция эндотелия сосудов ® атеросклероз ® ишемическая болезнь сердца (ИБС) ® коронарный тромбоз ® инфаркт миокарда (ИМ) ® аритмии, потеря мышечной массы миокарда ® ремоделирование и дилатация левого желудочка (ЛЖ) сердца ® систолическая сердечная недостаточность (СН) ® терминальная стадия сердечно-сосудистого заболевания. В настоящее время кардиологи и терапевты располагают мощным арсеналом лекарственных средств, которые способны свести к минимуму факторы риска, предотвратить сосудистые катастрофы или замедлить прогрессирование структурно-функциональных повреждений на более поздних этапах континуума. Назначая лечение, мы стараемся не просто вызвать регресс симптоматики, но и продлить жизнь пациенту, уберечь его от инвалидизации и социальной дезадаптации. Ренин-ангиотензин-альдостероновая система (РААС) – одна из универсальных систем поддержания гомеостаза, которая играет важную отрицательную роль на всех этапах сердечно-сосудистого континуума, и именно на ее блокирование направлено действие ингибиторов АПФ, в частности – рамиприла. Что на сегодняшний день известно об этом препарате?
– Чтобы понять, каких целей мы пытаемся достичь, назначая больным ингибиторы АПФ, следует еще раз обратиться к концепции сердечно-сосудистого континуума. Термин «континуум» (от лат. continuum - непрерывное, сплошное) используется в современной кардиологии для того, чтобы подчеркнуть непрерывность процесса патологических изменений в сердечно-сосудистой системе. Процесс этот начинается в раннем детском возрасте (первые проявления атеросклероза обнаружены даже у новорожденных), сопровождает человека на протяжении всей его жизни, а зачастую преждевременно ее обрывает. Последовательность событий континуума можно представить так: факторы риска (артериальная гипертензия (АГ), дислипидемия, сахарный диабет (СД), курение и др.) ® дисфункция эндотелия сосудов ® атеросклероз ® ишемическая болезнь сердца (ИБС) ® коронарный тромбоз ® инфаркт миокарда (ИМ) ® аритмии, потеря мышечной массы миокарда ® ремоделирование и дилатация левого желудочка (ЛЖ) сердца ® систолическая сердечная недостаточность (СН) ® терминальная стадия сердечно-сосудистого заболевания. В настоящее время кардиологи и терапевты располагают мощным арсеналом лекарственных средств, которые способны свести к минимуму факторы риска, предотвратить сосудистые катастрофы или замедлить прогрессирование структурно-функциональных повреждений на более поздних этапах континуума. Назначая лечение, мы стараемся не просто вызвать регресс симптоматики, но и продлить жизнь пациенту, уберечь его от инвалидизации и социальной дезадаптации. Ренин-ангиотензин-альдостероновая система (РААС) – одна из универсальных систем поддержания гомеостаза, которая играет важную отрицательную роль на всех этапах сердечно-сосудистого континуума, и именно на ее блокирование направлено действие ингибиторов АПФ, в частности – рамиприла. Что на сегодняшний день известно об этом препарате?
Гипотензивное средство в первую очередь должно обеспечивать адекватное снижение артериального давления (АД), и это основное свойство рамиприла было хорошо изучено в проспективном открытом исследовании CARE, проведенном в США и Канаде (N.M. Kaplan, 1996). Более 11 тыс. пациентов с мягкой или умеренной АГ в условиях рутинной клинической практики принимали рамиприл в дозе от 2,5 до 10 мг (по усмотрению врача) в качестве монотерапии длительностью 8 нед. Рамиприл в одинаковой мере снижал систолическое и диастолическое АД на 13%, что в большинстве случаев позволяло достичь целевых значений. Монотерапия рамиприлом оказалась эффективной у 86% пациентов с систоло-диастолической АГ и у 70,4% пациентов с изолированной систолической АГ. При этом рамиприл хорошо переносился больными. Частота всех нежелательных явлений на фоне приема препарата не превышала 12,8%, а самый характерный для всего класса ингибиторов АПФ побочный эффект – кашель – наблюдался лишь у 3% пациентов.
Когда у антигипертензивных препаратов обнаружились органопротективные свойства, началась новая эра исследований, посвященных изучению влияния ингибиторов АПФ на процессы патологического ремоделирования миокарда, течение патологии почек и других органов-мишеней на фоне АГ.
В рамках мультицентрового рандомизированного исследования RACE (RAmipril Cardioprotective Evaluation) сравнивалось влияние рамиприла и популярного бета-адреноблокатора атенолола на уровень АД, гипертрофию ЛЖ и другие эхокариографические параметры у пациентов с АГ (E. Agabiti-Rosei et al., 1995). 193 пациента в возрасте от 25 до 70 лет с мягкой или умеренной АГ, индексом массы ЛЖ (ИМЛЖ) >98 г/м2 у женщин и >120 г/м2 у мужчин получали рамиприл в дозе 2,5 мг/сут или атенолол в дозе 50 мг/сут (с последующим удвоением дозы через 2 нед или присоединением гипотиазида в дозе 25 мг при необходимости). Снижение АД было сравнимым в обеих группах с небольшим преимуществом рамиприла. Эхокардиографическое исследование проводилось слепым методом в момент набора больных через 3 и 6 мес от начала лечения и показало значительное снижение массы миокарда ЛЖ у пациентов, принимавших рамиприл (р<0,001 по сравнению с исходным значением ИМЛЖ и р=0,04 по сравнению с атенололом по прошествии 6 мес).
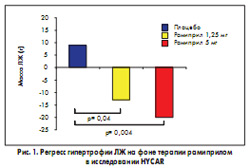
В многоцентровом рандомизированном двойном слепом плацебо-контролируемом исследовании HYCAR (HYpertrophie CArdiaque et Ramipril) данные о способности рамиприла вызывать регресс гипертрофии ЛЖ подтвердились, причем кардиопротективный эффект препарата через 6 мес лечения проявлялся уже в дозе 1,25 мг, которая не влияет на уровень АД (Michel Lievre et al., 1995) (рис. 1).
 Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование REIN (Ramipril Efficacy In Nephropathy) было спланировано для изучения нефропротективного эффекта рамиприла и полностью оправдало ожидания исследователей, послужив основой для включения ингибиторов АПФ в стандарты лечения хронической нефропатии. В исследовании приняли участие 352 пациента в возрасте 18-70 лет с хронической нефропатией недиабетического генеза (скорость клубочковой фильтрации (СКФ) 20-70 мл/мин/1,73 м2; протеинурия >1 г/24 ч), которые были случайным образом распределены в группы приема рамиприла или плацебо в течение 27 мес; дополнительное контрольное обследование проводилось еще через 36 мес. Первичной конечной точкой служили динамика снижения СКФ и период времени до наступления терминальной стадии хронической почечной недостаточности. По результатам повторного обследования на 72-м месяце рамиприл статистически достоверно замедлял прогрессирование хронической почечной недостаточности на 56% по сравнению с плацебо (р=0,01). В подгруппе больных с протеинурией >3 г/сут исследование было остановлено досрочно через 2 года в связи с прогрессированием нефропатии на фоне приема плацебо, после чего все пациенты были переведены на прием рамиприла. В дальнейшем было показано, что рамиприл предотвращает снижение СКФ как при раннем назначении, так и после 2 лет приема плацебо.
Многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование REIN (Ramipril Efficacy In Nephropathy) было спланировано для изучения нефропротективного эффекта рамиприла и полностью оправдало ожидания исследователей, послужив основой для включения ингибиторов АПФ в стандарты лечения хронической нефропатии. В исследовании приняли участие 352 пациента в возрасте 18-70 лет с хронической нефропатией недиабетического генеза (скорость клубочковой фильтрации (СКФ) 20-70 мл/мин/1,73 м2; протеинурия >1 г/24 ч), которые были случайным образом распределены в группы приема рамиприла или плацебо в течение 27 мес; дополнительное контрольное обследование проводилось еще через 36 мес. Первичной конечной точкой служили динамика снижения СКФ и период времени до наступления терминальной стадии хронической почечной недостаточности. По результатам повторного обследования на 72-м месяце рамиприл статистически достоверно замедлял прогрессирование хронической почечной недостаточности на 56% по сравнению с плацебо (р=0,01). В подгруппе больных с протеинурией >3 г/сут исследование было остановлено досрочно через 2 года в связи с прогрессированием нефропатии на фоне приема плацебо, после чего все пациенты были переведены на прием рамиприла. В дальнейшем было показано, что рамиприл предотвращает снижение СКФ как при раннем назначении, так и после 2 лет приема плацебо.
 Одним из самых масштабных и знаменательных для мировой кардиологии стало исследование HOPE (Heart Outcomes Prevention Evaluation study) с участием 9297 пациентов (2480 женщин, 6817 мужчин) в возрасте 55 лет и старше, имевших сердечно-сосудистое заболевание или СД 2 типа в анамнезе и один дополнительный фактор риска. Дополнительно к базисной терапии заболевания пациенты получали рамиприл, препарат витамина Е или плацебо. За 5 лет наблюдения было отмечено значительное влияние терапии рамиприлом на первичные и вторичные конечные точки. Впервые было показано, что применение ингибитора АПФ у пациентов высокого сердечно-сосудистого риска достоверно снижает вероятность смерти от всех причин, сердечно-сосудистую смертность, риск развития инфаркта миокарда, инсульта, потребность в реваскуляризации, а также частоту новых случаев СД 2 типа и его осложнений (рис. 2, 3). В группе витамина Е исследование было прекращено на 6 мес раньше в связи с убедительной демонстрацией преимуществ рамиприла.
Одним из самых масштабных и знаменательных для мировой кардиологии стало исследование HOPE (Heart Outcomes Prevention Evaluation study) с участием 9297 пациентов (2480 женщин, 6817 мужчин) в возрасте 55 лет и старше, имевших сердечно-сосудистое заболевание или СД 2 типа в анамнезе и один дополнительный фактор риска. Дополнительно к базисной терапии заболевания пациенты получали рамиприл, препарат витамина Е или плацебо. За 5 лет наблюдения было отмечено значительное влияние терапии рамиприлом на первичные и вторичные конечные точки. Впервые было показано, что применение ингибитора АПФ у пациентов высокого сердечно-сосудистого риска достоверно снижает вероятность смерти от всех причин, сердечно-сосудистую смертность, риск развития инфаркта миокарда, инсульта, потребность в реваскуляризации, а также частоту новых случаев СД 2 типа и его осложнений (рис. 2, 3). В группе витамина Е исследование было прекращено на 6 мес раньше в связи с убедительной демонстрацией преимуществ рамиприла.
 Столь впечатляющие результаты послужили поводом к продолжению исследования, которое получило название HOPE-TOO (The Ongoing Outcomes, 2005). В нем согласились продолжить участие 4528 пациентов из исследования HOPE: 72% из группы рамиприла и 68% – плацебо. Период наблюдения в HOPE-TOO составил 2,6 года, в течение которых рамиприл принимали 90% пациентов обеих групп. Первичная комбинированная конечная точка включала инфаркт миокарда, инсульт и сердечно-сосудистую смерть. В результате суммарный риск этих событий на фоне продолжения приема рамиприла снизился дополнительно на 17% (р=0,0002 по сравнению с плацебо). Преимущества рамиприла в снижении сердечно-сосудистой смертности, частоты ИМ, инсульта и госпитализации, обусловленной СН, сохранялись в течение всего периода наблюдения после окончания исследования HOPE. Частота ИМ снизилась на 19%, новых случаев СД 2 типа – на 31%, мозгового инсульта – на 21%, а сердечно-сосудистой смерти – на 14%. Дополнительное снижение частоты ИМ, потребности в реваскуляризации миокарда и новых случаев СД 2 типа на фоне лечения рамиприлом наблюдалось несмотря на сравнимую частоту приема ингибиторов АПФ в обеих группах. Анализ в подгруппах продемонстрировал, что дополнительные преимущества терапии рамиприлом распространяются на всех пациентов, независимо от исходного уровня сердечно-сосудистого риска. Исследователями был сделан вывод, что снижение частоты сердечно-сосудистых событий, продемонстрированное в HOPE, вероятно, было недооценено в сравнении с более полным эффектом длительного приема рамиприла.
Столь впечатляющие результаты послужили поводом к продолжению исследования, которое получило название HOPE-TOO (The Ongoing Outcomes, 2005). В нем согласились продолжить участие 4528 пациентов из исследования HOPE: 72% из группы рамиприла и 68% – плацебо. Период наблюдения в HOPE-TOO составил 2,6 года, в течение которых рамиприл принимали 90% пациентов обеих групп. Первичная комбинированная конечная точка включала инфаркт миокарда, инсульт и сердечно-сосудистую смерть. В результате суммарный риск этих событий на фоне продолжения приема рамиприла снизился дополнительно на 17% (р=0,0002 по сравнению с плацебо). Преимущества рамиприла в снижении сердечно-сосудистой смертности, частоты ИМ, инсульта и госпитализации, обусловленной СН, сохранялись в течение всего периода наблюдения после окончания исследования HOPE. Частота ИМ снизилась на 19%, новых случаев СД 2 типа – на 31%, мозгового инсульта – на 21%, а сердечно-сосудистой смерти – на 14%. Дополнительное снижение частоты ИМ, потребности в реваскуляризации миокарда и новых случаев СД 2 типа на фоне лечения рамиприлом наблюдалось несмотря на сравнимую частоту приема ингибиторов АПФ в обеих группах. Анализ в подгруппах продемонстрировал, что дополнительные преимущества терапии рамиприлом распространяются на всех пациентов, независимо от исходного уровня сердечно-сосудистого риска. Исследователями был сделан вывод, что снижение частоты сердечно-сосудистых событий, продемонстрированное в HOPE, вероятно, было недооценено в сравнении с более полным эффектом длительного приема рамиприла.
В отдельной ветке исследования – MICRO-HOPE – оценивалось влияние длительного приема рамиприла и/или препаратов витамина Е на сердечно-сосудистую заболеваемость и смертность у 3654 пациентов с СД 2 типа (39,3% популяции HOPE). Первичная комбинированная конечная точка – ИМ, инсульт или сердечно-сосудистая смерть – наступала в группе рамиприла на 25% реже. Кроме того, рамиприл на 24% снижал риск развития диабетической нефропатии. Таким образом, подтвердился универсальный нефропротективный эффект этого ингибитора АПФ.
После открытия нового класса кардиологических средств – блокаторов рецепторов ангиотензина ІІ (БРА) их сразу же начали сравнивать с ингибиторами АПФ. Самым масштабным и длительным из подобных сравнительных исследований стало исследование ONTARGET (2008), в котором монотерапия рамиприлом сравнивалась с монотерапией телмисартаном или комбинацией телмисартан + рамиприл по влиянию на частоту сердечно-сосудистых событий у пациентов высокого риска. Ожидалось, что стратегия более мощной блокады РААС телмисартаном или его комбинацией с ингибитором АПФ обеспечит дополнительные преимущества, однако за 4 года наблюдения эффекты БРА или комбинированной терапии так и не превзошли эффекты монотерапии рамиприлом.
Таким образом, рамиприл на сегодняшний день остается непревзойденным стандартом гипотензивной терапии и способен улучшать клинический прогноз на всех этапах сердечно-сосудистого континуума, что нашло отражение в официальных руководствах по ведению пациентов с различной патологией. Если для лечения неосложненной АГ рекомендованы все препараты класса ингибиторов АПФ, то при ИБС и ее последствиях влияние на прогноз доказали немногие представители класса:
– при СН: эналаприл, каптоприл, рамиприл, лизиноприл, трандалоприл;
– у больных с дисфункцией ЛЖ: эналаприл, каптоприл, рамиприл;
– после ИМ: каптоприл, эналаприл, рамиприл, трандалоприл, лизиноприл;
– при стабильной ИБС: рамиприл, периндоприл;
– при цереброваскулярных заболеваниях: рамиприл, периндоприл в комбинации с индапамидом;
– при дисфункции почек: все ингибиторы АПФ, но такие масштабные и показательные исследования, как с рамиприлом, у пациентов с нефропатией не проводились.
Как видим, Тритаце® (рамиприл) обладает самым широким спектром официально утвержденных показаний, базирующихся на достоверных данных доказательной медицины.
Руководитель отдела атеросклероза и хронической ишемической болезни сердца ННЦ «Институт кардиологии им. Н.Д. Стражеско» АМН Украины, доктор медицинских наук, профессор Михаил Илларионович Лутай представил анализ доказательной базы в отношении свойства ингибиторов АПФ вызывать регресс атеросклероза и улучшать клинический прогноз у пациентов с ИБС.
 – Еще 20 лет назад теоретически предполагалось, что препараты, блокирующие эффекты ангиотензина ІІ, должны замедлять образование и рост атеросклеротических бляшек исходя из того, что ангиотензин ІІ играет важную роль в процессах проникновения липидов в клетки, повреждения эндотелия и тромбообразования. Кроме того, известно, что блокирование ангиотензинпревращающего фермента, с одной стороны – приводит к торможению перехода ангиотензина І в ангиотензин ІІ, а с другой – препятствует деградации брадикинина, эффекты которого противоположны отрицательным влияниям ангиотензина ІІ. Рамиприл выделяется в своем классе высокой липофильностью, которая обеспечивает эффективное ингибирование АПФ в различных тканях, особенно в кардиомиоцитах и сосудистой стенке (N. Bender et al., 1989). Это свойство послужило предпосылкой для проведения многих экспериментальных исследований, где подтвердились ангиопротективные эффекты препарата, однако доказать антиатеросклеротический эффект ингибиторов АПФ в клинике оказалось не так легко.
– Еще 20 лет назад теоретически предполагалось, что препараты, блокирующие эффекты ангиотензина ІІ, должны замедлять образование и рост атеросклеротических бляшек исходя из того, что ангиотензин ІІ играет важную роль в процессах проникновения липидов в клетки, повреждения эндотелия и тромбообразования. Кроме того, известно, что блокирование ангиотензинпревращающего фермента, с одной стороны – приводит к торможению перехода ангиотензина І в ангиотензин ІІ, а с другой – препятствует деградации брадикинина, эффекты которого противоположны отрицательным влияниям ангиотензина ІІ. Рамиприл выделяется в своем классе высокой липофильностью, которая обеспечивает эффективное ингибирование АПФ в различных тканях, особенно в кардиомиоцитах и сосудистой стенке (N. Bender et al., 1989). Это свойство послужило предпосылкой для проведения многих экспериментальных исследований, где подтвердились ангиопротективные эффекты препарата, однако доказать антиатеросклеротический эффект ингибиторов АПФ в клинике оказалось не так легко.
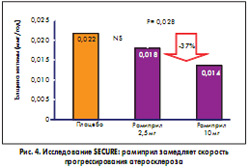
Впервые способность ингибиторов АПФ улучшать клинический прогноз у пациентов высокого сердечно-сосудистого риска была показана в исследованиях НОРЕ и НОРЕ-ТОО, о которых уже говорилось. В рамках этого крупного международного проекта проводилось субисследование SECURE, в котором с помощью ультразвукового метода удалось подтвердить дозозависимый эффект уменьшения толщины комплекса интима-медиа сонной артерии на фоне приема рамиприла в дозе 2,5-10 мг/сут (E.M. Lonn et al., 2001) (рис. 4). Толщина комплекса интима-медиа является суррогатным показателем выраженности атеросклеротического процесса. Учитывая эти данные, исследователи склонны объяснять результаты НОРЕ именно универсальным влиянием рамиприла (Тритаце) на механизмы атерогенеза.
 Рамиприл параллельно изучался у пациентов с различными формами ИБС, в том числе с ИМ и нарушенной функцией ЛЖ. В рандомизированном двойном слепом плацебо-контролируемом исследовании AIRЕ (Acute Infarction Ramipril Efficacy) рамиприл назначался на 3-10-й день после ИМ пациентам с клинически подтвержденной тяжелой СН по NYHA (AIRE, 1993). Начальная доза рамиприла составила 2,5 мг 2 раза в день с увеличением до 5 мг 2 раза в день. Всего в исследовании приняли участие 2006 пациентов, за которыми наблюдали в среднем 15 мес.
Рамиприл параллельно изучался у пациентов с различными формами ИБС, в том числе с ИМ и нарушенной функцией ЛЖ. В рандомизированном двойном слепом плацебо-контролируемом исследовании AIRЕ (Acute Infarction Ramipril Efficacy) рамиприл назначался на 3-10-й день после ИМ пациентам с клинически подтвержденной тяжелой СН по NYHA (AIRE, 1993). Начальная доза рамиприла составила 2,5 мг 2 раза в день с увеличением до 5 мг 2 раза в день. Всего в исследовании приняли участие 2006 пациентов, за которыми наблюдали в среднем 15 мес.
В качестве первичной конечной точки регистрировались все случаи смерти. В результате к 30-му месяцу наблюдения кумулятивная смертность в группе рамиприла была на 27% ниже, чем в группе плацебо (р=0,002). Снижение смертности наблюдалось в ранний период до 30 дней во всех подгруппах пациентов, получавших рамиприл, независимо от возраста, пола, наличия сопутствующей патологии и других назначений.
Это исследование также имело продолжение – AIRE Extension. 603 пациента продолжили прием рамиприла по схеме 5 мг 2 раза в день, и через 5 лет общая смертность среди них была на 36% ниже по сравнению с группой плацебо (A.S. Hall et al., 1997). Таким образом, назначение рамиприла пациентам с СН после ИМ (с 3-10-го дня) приводило к значительному и достоверному снижению частоты всех случаев смерти при длительной терапии на протяжении нескольких лет.
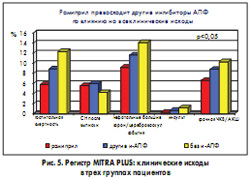 По данным проспективного многоцентрового регистра MITRA PLUS (Maximal Individual Therapy of Acute Myocardial Infarction PLUS registry) проводилось сравнение уровня смертности пациентов, перенесших ИМ с элевацией сегмента ST, в трех группах: принимавших после ИМ рамиприл, другой ингибитор АПФ или не получавших препаратов этого класса (Wienbergen et al., 2002). Из 14 608 пациентов, включенных в регистр, 43,7% принимали какой-либо ингибитор АПФ, причем 10,7% из них получали рамиприл (5 мг 2 раза в сутки). 56,3% больных не получали терапию ингибиторами АПФ. В рамках 21-дневного срока от момента назначения лечения группа рамиприла характеризовалась самой низкой смертностью, а в группе больных, которые не получали ингибиторы АПФ, этот показатель был самым высоким. В группе рамиприла оказались лучшими и другие клинические исходы (рис. 5).
По данным проспективного многоцентрового регистра MITRA PLUS (Maximal Individual Therapy of Acute Myocardial Infarction PLUS registry) проводилось сравнение уровня смертности пациентов, перенесших ИМ с элевацией сегмента ST, в трех группах: принимавших после ИМ рамиприл, другой ингибитор АПФ или не получавших препаратов этого класса (Wienbergen et al., 2002). Из 14 608 пациентов, включенных в регистр, 43,7% принимали какой-либо ингибитор АПФ, причем 10,7% из них получали рамиприл (5 мг 2 раза в сутки). 56,3% больных не получали терапию ингибиторами АПФ. В рамках 21-дневного срока от момента назначения лечения группа рамиприла характеризовалась самой низкой смертностью, а в группе больных, которые не получали ингибиторы АПФ, этот показатель был самым высоким. В группе рамиприла оказались лучшими и другие клинические исходы (рис. 5).
Небольшое, но показательное исследование APRES (Angiotensin-converting enzyme inhibition Post REvascularisation Study) было спланировано для оценки влияния терапии рамиприлом на частоту сердечно-сосудистых событий у пациентов со стенокардией напряжения и асимптомной дисфункцией ЛЖ средней степени тяжести, подвергнутых реваскуляризации миокарда (L. Kjoller-Hansen et al., 2000). 159 пациентов с фракцией выброса ЛЖ 30-50%, подтвержденной вентрикулографией или эхокардиографией, были рандомизированы к приему плацебо или рамиприла с начальной дозы 2,5 мг до 10 мг/день на 1-2-е сутки после чрескожного вмешательства или на 3-5-е сутки после аорто-коронарного шунтирования. Продолжительность лечения рамиприлом в среднем составила 2,5 года (минимум 1 год, максимум – 4). Комбинированная первичная конечная точка включала сердечно-сосудистую смерть, ИМ, СН, возврат стенокардии. Через 4 года в группе рамиприла этих событий было зарегистрировано на 58% меньше, чем в группе плацебо (р=0,031).
Следует отметить, что при ИБС с нарушенной функцией ЛЖ положительное влияние на прогноз оказывают практически все ингибиторы АПФ, однако у пациентов с ишемией миокарда без СН и дисфункции ЛЖ подробно изучены эффекты лишь некоторых представителей класса, в частности рамиприла и периндоприла, что нашло отражение в современных консенсусах и клинических протоколах.
Согласно европейскому руководству по ведению пациентов со стабильной стенокардией (Guidelines on the management of stable angina, 2006) ингибиторы АПФ рекомендованы для вторичной профилактики ИБС у больных с сопутствующими показаниями: АГ, СН, дисфункцией ЛЖ, ИМ в анамнезе, СД (класс рекомендаций I, A). У всех остальных пациентов со стенокардией и подтвержденной ИБС ингибиторы АПФ могут применяться с учетом соотношения пользы, стоимости лечения и побочных эффектов (класс IIa, B). В руководстве указано, что для вторичной профилактики должны использоваться препараты с доказанной эффективностью – рамиприл и периндоприл.
Таким образом, Тритаце® (рамиприл) остается одним из самых изученных препаратов своего класса и может применяться в самых разнообразных клинических ситуациях, в том числе при сочетании различных форм ИБС с нарушением насосной функции сердца. Кардиологи и врачи других специальностей в западных странах давно оценили преимущества работы с оригинальным рамиприлом, а в скором времени их смогут оценить и украинские врачи.
Подготовил Дмитрий Молчанов
СТАТТІ ЗА ТЕМОЮ
Як відомо, біль у спині ускладнює рух і чинить негативний вплив на якість життя та психічне благополуччя людини. За даними Всесвітньої організації охорони здоров’я (ВООЗ), від болю в нижній частині спини страждають близько 619 млн людей у всьому світі, і за прогнозом, до 2050 року переважно через збільшення чисельності населення та його старіння кількість таких випадків може зрости до 843 млн (WHO, 2020). Попри проведення численних досліджень причини дорсалгій досі лишаються суперечливими, а результат лікування – здебільшого незадовільним....
Полінейропатії – це захворювання всього організму з реалізацією патологічного процесу на рівні периферичної нервової системи як множинного ураження периферичних нервів із порушенням їх функції. Більшість полінейропатій є хронічними станами, що значно порушують якість життя пацієнтів. Це зумовлює актуальність пошуку ефективних підходів до лікування цих захворювань....
Головний біль (ГБ) як один із найчастіших неврологічних розладів є причиною стану, що характеризується порушенням повсякденної життєдіяльності людини. Поширеність цефалгій і значний їх вплив на якість життя свідчать про важливість проблеми діагностування та лікування ГБ. За даними Глобального дослідження тяжкості хвороб, оновленими 2019 р., ГБ посідає третє місце (після інсульту та деменції) серед неврологічних причин за загальним тягарем захворювань (виміряним роками життя з поправкою на інвалідність [DALY]) (WHO, 2014). При цьому лише незначна кількість осіб із ГБ у всьому світі проходять відповідну діагностику та отримують адекватне лікування....
Біль є однією з найчастіших причин звернення по медичну допомогу. На хронічний біль, який чинить негативний вплив на загальний стан здоров’я, страждають щонайменше четверо з п’яти хворих із хронічною патологією спинного мозку. Основними типами болю, на який скаржаться такі пацієнти, є ноцицептивний і нейропатичний (у 49 і 56% випадків відповідно) (Felix et al., 2021). Пропонуємо до вашої уваги огляд доповіді директорки Інституту медичних та фармацевтичних наук Міжрегіональної академії управління персоналом, д.мед.н., професорки Наталії Костянтинівни Свиридової, присвяченої особливостям ведення хворих із ноцицептивним і нейропатичним болем у практиці сімейного лікаря, яку вона представила у лютому цього року під час Науково-практичної конференції «Дискусійний клуб сімейного лікаря»....




