Научные доказательства оптимизации терапии больных c хронической сердечной недостаточностью на фоне ишемической болезни сердца

Сердечно-сосудистые заболевания (ССЗ) являются самой распространенной причиной смерти во всем мире. В 2013 году из 54 млн всех умерших пациенты с ССЗ составили 31,5%. В глобальном масштабе 80% смертей от CCЗ приходится на cтраны со средним и низким уровнем доходов, к которым относится и Украина. И если в развитых странах мира количество смертей от ССЗ снижается, то в нашей стране это число стремительно возрастает [5].
В последнее время структура смертности взрослого населения в Украине остается неизменной, лидируют болезни системы кровообращения – 67%, или 968 на 100 тыс. населения (по данным 2013 года). При этом 50% фатальных инсультов и 45% фатальных осложнений ишемической болезни сердца (ИБС) связаны с наличием у больного артериальной гипертензии. C другой стороны, необходимо отметить, что в лечении CCЗ, в частности инфаркта миокарда (ИМ), достигнуты значительные успехи, при этом с уменьшением смертности от ИМ увеличилось количество больных хронической сердечной недостаточностью (ХСН), которая стала одной из актуальных медико-социальных проблем. Это обусловлено ее широкой распространенностью, постоянным ростом заболеваемости и неблагоприятным исходом. В общей популяции распространенность ХСН составляет в среднем 10-20 тыс. на 1 млн населения, или 0,4-2% от общей популяции [18]. Смертность больных зависит от функционального класса по NYHA и составляет, согласно данным Фремингемского исследования, около 20% в год, а 4-5-летняя выживаемость – 25-50% [14]. Таким образом, СН является одной из основных причин смертности.
С позиции медицины, основанной на доказательствах, в лечении ХСН достигнуты значительные успехи. К основным направлениям терапии СН относятся инотропная стимуляция миокарда, гемодинамическая и нейрогуморальная разгрузка сердца [3]. Тем не менее лечение ИБС (включая хирургические методы лечения), совершенствование свойств лекарственных средств, используемых в лечении ХСН на фоне ИБС, не приводит к дальнейшему снижению смертности и частоты регоспитализаций по поводу декомпенсации ХСН. Поэтому идет поиск принципиально новых по механизму действия препаратов для лечения СН.
Общеизвестно, что с каждой декомпенсацией часть кардиомиоцитов безвозвратно повреждается, что подтверждается повышением уровня тропонинов. В связи с этим большой интерес представляет новое направление в лечении ИБС – цитопротекция. В основе принципа действия современных цитопротекторов лежит их свойство повышать устойчивость миокарда к ишемии, способствовать быстрому восстановлению функциональной активности. Метаболические и энергетические нарушения приводят в конечном счете к снижению сократительной способности миокарда и дальнейшему прогрессированию СН [2]. Поэтому нормализация энергетического метаболизма в кардиомиоцитах является важным и перспективным методом лечения больных СН. Как правило, все цитопротекторы являются гемодинамически нейтральными.
Одним из широко изученных цитопротекторов является фосфокреатин (ФК) – N-фосфорил(N-метил)-гуанидино-уксусная кислота. В высокой концентрации он содержится в миокарде, скелетной мускулатуре, гладких мышцах и клетках нервной ткани. ФК ингибирует накопления фосфолипидов в ишемизированном миокарде, тем самым препятствуя накоплению в мышце сердца продуктов их деградации, ингибирует агрегацию тромбоцитов, улучшая микроциркуляцию. Одним из основных положительных механизмов экзогенного ФК является ограничение объема ишемизированного и некротизированного миокарда.
В доступной литературе опубликовано большое количество работ, посвященных изучению эффективности препарата для лечения ХСН. Приведены данные о применении экзогенного ФК при лечении СН на фоне ИБС, при проведении кардиохирургических вмешательств, при ишемии/реперфузии головного мозга [11].
ФК является ключевым компонентом внутриклеточной системы энергетической буферизации и транспортировки энергии с места синтеза к месту использования, обеспечивая высокие и динамичные потребности сердца [1, 2]. Для сокращения мышцы используется энергия гидролиза аденозинтрифосфата (АТФ), и мышечная клетка имеет высокоэффективную систему регенерации запаса АТФ. Фермент фосфокреатинкиназа катализирует реакцию между аденозиндифосфатом (АДФ) и ФК, в результате чего образуется АТФ и креатин. ФК содержит больше запасенной энергии, чем АТФ. Благодаря этому механизму при интенсивной потребности мышечной клетки падает содержание именно ФК, а количество универсального источника энергии – АТФ – не изменяется. Именно поэтому возрос интерес к изучению экзогенного ФК.
Многочисленные экспериментальные и клинические исследования (КИ), проводившиеся в течение последних 40 лет, продемонстрировали, что соответствующие уменьшения содержания ФК встречаются в широком спектре патофизиологических состояний. Снижение внутриклеточной концентрации креатина и ФК приводит к нарушению сократительной способности сердечной мышцы. Во многих исследованиях оценивалась возможность улучшения работы сердечной и скелетной мышц за счет экзогенного введения ФК.
Целый ряд экспериментальных исследований продемонстрировал, что ФК может играть две важные роли в регуляции мышечной энергетики и работы. Во-первых, ФК поддерживает локальные пулы АТФ и стабилизирует клеточные мембраны из-за электростатических взаимодействий с фосфолипидами. Второй механизм уменьшает продукцию лизофосфоглицеридов при гипоксии сердечной мышцы, защищает сарколемму кардиомиоцитов от ишемического повреждения, уменьшает частоту аритмий и увеличивает постишемическое восстановление сократительной функции [4].
В течение последних лет исследования по ФК показали положительные клинические результаты у пациентов с СН, острой ишемией миокарда, хронической ИБС, при кардиохирургических вмешательствах и церебральной ишемии [20].
В одном из самых крупных метаанализов обобщены результаты КИ, проводившихся в течение последних 40 лет, в котором представлены доказательства в поддержку дополнительного использования ФК при различных патологических состояниях c целью оптимизации энергетического метаболизма [24].
Недостатком предыдущих КИ было изучение только лишь вторичных конечных точек. В современном подходе с точки зрения доказательной медицины важны жесткие конечные точки и в первую очередь ближайшая и отдаленная выживаемость. В 2016 году были опубликованы данные метаанализа всех рандомизированных и контролируемых исследований, в которых сравнивали ФК с плацебо или стандартным лечением у пациентов с ИБС или ХСН либо их сочетание по влиянию на выживание. Предполагалось, что ФК может снижать смертность от всех причин у пациентов с острыми и хроническими заболеваниями сердца.
С этой целью был проведен систематический обзор по данным электронного поиска в PubMed/Medline, Embase, Scopus, Cochrane Central Register и базах данных Google Scholar до 1 ноября 2015 года. Для поиска использовались релевантные ключевые слова: ФК, фосфорилкреатин, креатинфосфат, неотон, рандомизированные (РКИ) и контролируемые КИ. Также для идентификации материалов были использованы данные производителя препарата ФК, торговое название – Неотон (Alfa Wassermann S.p.A., Италия).
Методы
В анализе изучались КИ, которые отвечали следующим критериям: РКИ, оценка эффективности ФК по сравнению с плацебо или стандартным лечением у пациентов с ИБС, ХСН, при операциях на сердце, при наличии информации о смертности (первичная конечная точка), измерение фракции выброса левого желудочка (ФВ ЛЖ), определение МВ-фракции креатинфосфокиназы (МВ-КФК) или тропонина I, изучение частоты сложных аритмий сердца – желудочковая тахикардия (ЖТ) и фибрилляция желудочков (ФЖ), проведение дефибрилляции, информация о выживании, в том числе после аортокоронарного шунтирования (АКШ), других кардиохирургических вмешательств.
Поиск не ограничивался исследованиями только на английском языке.
Анализ данных. Анализ был выполнен в соответствии с принципом intention-to-treat (анализ результатов исследования исходя из распределения по группам на этапе рандомизации). Для расчета отношения шансов (ОШ) с 95% доверительным интервалом (ДИ) использовался метод Mantel-Haenszel. Также вычислялась разность средних значений (mean difference – MD) по сравнению с плацебо или контролем. Вычислялся показатель эффективности лечения NNT (number needed to treat) – число больных, которых необходимо лечить определенным методом в течение определенного времени, чтобы достичь определенного благоприятного исхода или предотвратить один неблагоприятный исход.
Результаты
Характеристика включенных исследований. Из 4182 публикаций вышеизложенным критериям включения отвечало 41 исследование. В анализ были включены 5069 пациентов, среди которых было 32 РКИ с 3629 пациентами, 4 контролируемых КИ с 610 пациентами и 5 исследований случай-контроль (matched case-control study) с 830 пациентами.
В 23 исследованиях изучались исходы у пациентов, перенесших кардиохирургические вмешательства, в 12 КИ – у пациентов с ИБС и в 6 исследованиях – у пациентов с ХСН. Среди исследований у пациентов с кардиохирургическими вмешательствами было 10 КИ с АКШ, 7 – у пациентов с имплантацией клапанов, 5 – со смешанными вмешательствами и 1 – среди пациентов, перенесших операцию по поводу врожденного порока сердца.
4 исследования были многоцентровыми РКИ, в 8 исследованиях было набрано более 100 пациентов, 4 исследования – с плацебо-контролем, в 37 КИ сравнение проводилось со стандартным лечением.
19 исследований было опубликовано на английском языке, 9 – на русском, 8 – на итальянском, 3 – на китайском и 2 – на чешском.
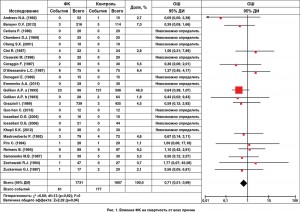
Количественный анализ данных. Смертность среди пациентов, у которых использовался ФК (23 исследования), была достоверно ниже по сравнению с контролем (61/1731, или 3,5%, против 177/1667, или 10,6%; OШ 0,71, 95% ДИ 0,51-0,99; p=0,04; NNT=14, то есть в 3,5 раза) (рис. 1). Продолжительность наблюдения ограничивалась госпитальным периодом. Достоверное уменьшение смертности (по данным 17 исследований) также было подтверждено и при субанализе РКИ. Исходная клиническая характеристика пациентов, инструментальные и лабораторные данные были сопоставимы в обеих группах. Проведенный анализ в подгруппах относительно уменьшения смертности при использовании экзогенного ФК показал, что среди пациентов, у которых проводились кардиохирургические вмешательства, OШ составило 0,80, ИБС – 0,71, ХСН – 0,40.
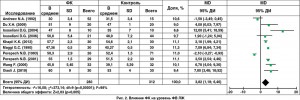
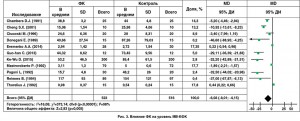
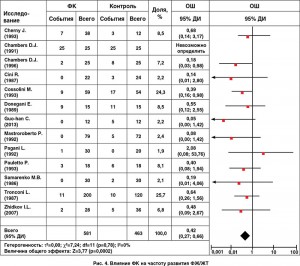
Использование ФК ассоциировалось с увеличением ФВ ЛЖ (MD 3,82, 95% ДИ 1,18-6,46; p=0,005; рис. 2); более низким уровнем МВ-КФК (MD -6,08, 95% ДИ -8,01, -4,15; p<0,001; рис. 3) и более низким уровнем тропонина I (MD -45,59, 95% ДИ -50,97, -40,22; p<0,001) по сравнению с контрольной группой. Кроме того, использование ФК у пациентов с кардиохирургическими вмешательствами способствовало снижению частоты жизнеугрожающих аритмий (11,9 против 21,6%; OШ 0,42, 95% ДИ 0,27-0,66; p<0,001; рис. 4); реже использовались инотропные препараты (OШ 0,39, 95% ДИ 0,25-0,61; p<0,001). Разница в необходимости использования дефибрилляции составила 20,6 против 64,8%; OШ 0,25, 95% ДИ 0,07-0,87; p=0,03.
Обсуждение
Наиболее важным результатом метаанализа является то, что использование ФК может способствовать улучшению краткосрочной выживаемости у пациентов с ИБС, ХСН, а также среди пациентов, которым проводились кардиохирургические вмешательства. Лечение с использованием ФК дополнительно к стандартной терапии приводило к улучшению насосной функции сердца – увеличению ФВ ЛЖ у пациентов с ХСН и после кардиохирургических вмешательств. Кроме того, у пациентов с ХСН отмечалось снижение пика МВ-КФК после кардиохирургических вмешательств, а у пациентов с ИБС был достоверно ниже уровень тропонина I при проведении сердечной хирургии. Использование ФК среди этих пациентов ассоциировалось со снижением частоты ФЖ/ЖТ, снижением использования инотропных препаратов по сравнению с контрольной группой.
Предполагается несколько механизмов действия, за счет чего улучшалась функция сердца, при использовании ФК [20]. Все они подтверждены в многочисленных экспериментальных исследованиях, где показано, что ФК является важным метаболитом в цепи транспорта энергии в кардиомиоцитах [25, 26]. В частности, креатин взаимодействует с АТФ с помощью фермента креатинкиназы, путем присоединения третьей фосфорильной группы образуется ФК. Энергия фосфорильных связей транспортируется с помощью ФК к месту потребления энергии, включая миозин АТФ-азу, которая обеспечивает сокращение актомиозина [6, 25]. Уменьшение концентрации ФК или снижение активности ферментов, ответственных за синтез и потребление ФК, приводит к сократительной дисфункции [12, 16]. Снижение регуляции системы транспорта креатина в мембранах клеток рассматривается как один из основных факторов снижения внутриклеточного содержания ФК [15, 23]. Это было продемонстрировано в модели на мышах: при пороговом уровне ФК и креатина существенно снижалась сократительная способность сердца, а острый стресс приводил к большему повреждению миокарда [22]. И напротив, при гиперэкспрессии системы транспорта креатина, при моделировании ишемического/реперфузионного повреждения отмечается защитный эффект (некроз миокарда меньше в среднем на 27%) и улучшается функциональное восстановление миокарда [13].
В другом исследовании у 58 пациентов с неишемической кардиомиопатией при использовании магнитно-резонансной спектроскопии было показано, что низкий уровень креатинкиназы является независимым предиктором как смертности от всех причин, так и сердечно-сосудистой смертности [7].
Таким образом, руководствуясь логическим обоснованием результатов экспериментальных исследований, можно заключить, что увеличение или экспрессия системы транспорта энергии имеет терапевтическое приложение, другими словами, лечение экзогенным ФК обеспечивает защиту миокарда от ишемии, уменьшает размер зоны некроза [9, 17, 19]. Также можно утверждать, что экзогенный ФК оказывает универсальное антиишемическое действие, так как было показано, что ФК и креатин могут уменьшать морфологическое повреждение и апоптоз нейронов головного мозга при ишемии-реперфузии [8, 10, 21, 27].
Также ФК является мощным мембраностабилизатором. ФК может непосредственно связываться с мембранными фосфолипидами, изменять структурные и конформационные характеристики фосфолипидов и за счет этого защитить мембрану от литических факторов.
При острых и хронических состояниях для обеспечения адекватной насосной функции сердце должно динамично и в достаточных количествах обеспечиваться энергетическими ресурсами. Для этого требуются легкодоступные субстраты для производства, транспортировки и утилизации энергии [16]. И ФК играет ключевую роль в процессе буферизации энергии и транспорта в сердце [26].
Таким образом, использование экзогенного ФК в дополнение к стандартной терапии у пациентов с острыми и хроническими заболеваниями сердца может улучшать ближайший прогноз, снижая риск смерти от всех причин. Кроме того, ФК способствует повышению насосной функции сердца, уменьшает ишемическое/реперфузионное повреждение миокарда, предупреждает жизнеугрожающие нарушения ритма сердца.
Литература
1. Пархоменко А.Н., Иркин О.И., Кожухов С.Н. Возможности фармакологической защиты миокарда при синдроме ишемии-реперфузии в эксперименте и клинической практике. // Лiки України. – 2002. – № 7-8. – С. 2-11.
2. Пархоменко А.Н., Кожухов С.Н., Иркин О.И., Брыль Ж.В. Применение неотона при ишемии и реперфузии миокарда. // Журнал неврології ім. Б.М. Маньковського. – 2014. – № 1. – С. 38-43.
3. 2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure. European Heart Journal. 128; 356: 1140-1151.
4. Akki A., Su J., Yano T., Gupta A., Wang Y., Leppo M., Chacko V., Steenbergen C., Weiss R. Creatine kinase overexpression improves ATP kinetics and contractile function in postischemic myocardium. Am. J. Physiol. Heart Circ. Physiol. 2012; Vol. 303 (7): H844-H852.
5. Benjamin E.J., Blaha M.J., Chiuve S.E., Cushman M., Das S.R., Deo R. Heart Disease and Stroke Statistics – 2017 Update: A Report From the American Heart Association. Circulation. 2017; 135 (10): e146-e603.
6. Bessman S.P., Geiger P.J. Transport of energy in muscle: the phosphorylcreatine shuttle. Science. 1981; 211: 448-452.
7. Bottomley P.A., Panjrath G.S., Lai S., Hirsch G.A., Wu K., Najjar S.S., et al. Metabolic rates of ATP transfer through creatine kinase (CK Flux) predict clinical heart failure events and death. Sci. Transl. Med. 2013; 5: 215re3.
8. Genius J., Geiger J., Bender A., Mоller H.J., Klopstock T., Rujescu D. Creatine
protects against excitoxicity in an in vitro model of neurodegeneration. PLoS One. 2012; 7: e30554.
9. Kryzhanovskii S.A., Kandelaki I.N., Sharov V.G., Kaverina N.V., Saks V.A. Effect of exogenous phosphocreatine on the size of experimental myocardial infarction. Kardiologiia. 1988; 28: 88-91.
10. Li T., Wang N., Zhao M. Neuroprotective effect of phosphocreatine on focal cerebral ischemia-reperfusion injury. J. Biomed. Biotechnol. 2012; 2012: 168756.
11. Ling-Hua Tang, Zhong-Yuan Xia, Bo Zhao, Xiao-Dong Wei, Tao Luo, Qing-Tao Meng. Phosphocreatine Preconditioning Attenuates Apoptosis in Ischemia-Reperfusion Injury of Rat Brain. J. of Biomed and Biotech. 2011. doi: 10.1155/2011/107091.
12. Lygate C.A., Schneider J.E., Neubauer S. Investigating cardiac energetics in heart failure. Exp. Physiol. 2013; 98: 601-605.
13. Lygate C.A., Bohl S., ten Hove M., Faller K.M., Ostrowski P.J., Zervou S., et al. Moderate elevation of intracellular creatine by targeting the creatine transporter protects mice from acute myocardial infarction. Cardiovasc. Res. 2012; 96: 466-475.
14. McKee P.A., Castelli W.P., McNamara P.M., Kannel W.B. The natural history of congestive heart failure: the Framingham study. N. Engl. J. Med. 1971; 285: 1441-1446.
15. Neubauer S., Remkes H., Spindler M., Horn M., Wiesmann F., Prestle J., et al. Downregulation of the Na(+)-creatine cotransporter in failing human myocardium and in experimental heart failure. Circulation. 1999; 100: 1847-1850.
16. Neubauer S. The failing heart – an engine out of fuel. N. Engl. J. Med. 2007 Mar 15; 356 (11): 1140-51.
17. Prabhakar G., Vona-Davis L., Murray D., Lakhani P., Murray G. Phosphocreatine restores high-energy phosphates in ischemic myocardium: implication for off-pump cardiac revascularization. J. Am. Coll. Surg. 2003; 197: 786-791.
18. Remme W., Swedberg K. Task Force for the diagnosis and Treatment of chronic Heart failure. Eur. Heart. J. 2001: 22; 1527-1560.
19. Sharov V.G., Afonskaya N.I., Ruda M.Y., Cherpachenko N.M., Pozin E.Y., Markosyan R.A., et al. Protection of ischemic myocardium by exogenous phosphocreatine (neoton): pharmacokinetics of phosphocreatine, reduction of infarct size, stabilization of sarcolemma of ischemic cardiomyocytes, and antithrombotic action. Biochem. Med. Metab. Biol. 1986; 35: 101-114.
20. Strumia E., Pelliccia F., D’Ambrosio G. Creatine Phosphate: Pharmacological and Clinical Perspectives. Adv. Therapy. 2012; 29: 99-123.
21. Tang L.H., Xia Z.Y., Zhao B., Wei X.D., Luo T., Meng Q.T. Phosphocreatine preconditioning attenuates apoptosis in ischemia-reperfusion injury of rat brain. J. Biomed. Biotechnol. 2011; 2011: 107091.
22. ten Hove M., Lygate C.A., Fischer A., Schneider J.E., Sang A.E., Hulbert K., et al. Reduced inotropic reserve and increased susceptibility to cardiac ischemia/reperfusion injury in phosphocreatine-deficient guanidinoacetate-N-methyltransferase-knockout mice. Circulation 2005; 111: 2477-2485.
23. Tokarska-Schlattner M., Epand R.F., Meiler F., Zandomeneghi G., Neumann D., Widmer H.R., et al. Phosphocreatine interacts with phospholipids, affects membrane properties and exerts membrane-protective effects. PLoS One. 2012; 7: e43178.
24. Tokarska-Schlattner M., Epand R.F., Meiler F., Zandomeneghi G., Neumann D., et al. Phosphocreatine Interacts with Phospholipids, Affects Membrane Properties and Exerts Membrane-Protective Effects. PLoS One 2012; Vol. 7 (8): e43178.
25. Wallimann T., Tokarska-Schlattner M., Schlattner U. The creatine kinase system and pleiotropic effects of creatine. Amino. Acids. 2011; 40: 1271-1296.
26. Wyss M., Kaddurah-Daouk R. Creatine and creatinine metabolism. Physiol. Rev. 2000; 80: 1107-213.
27. Zhang W., Zhang H., Xing Y. Protective effects of phosphocreatine administered post-treatment combined with ischemic post-conditioning on rat hearts with myocardial ischemia/reperfusion injury. J. Clin. Med. Res. 2015; 7: 242-247.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....