Кардіотоксичність протипухлинних препаратів: епідеміологія, діагностика, клінічний моніторинг і профілактика
 Кардіотоксична побічна дія хіміотерапевтичних препаратів є однією з основних причин захворюваності й смертності серед пацієнтів, які вижили після онкологічних захворювань. Кардіотоксичні ускладнення можуть проявлятися у вигляді аритмій, гіпертензії, ішемії міокарда, тромбоемболії, серцевої недостатності (СН), систолічної дисфункції міокарда чи іншими побічними ефектами. Антрацикліни (АЦ) і трастузумаб є хіміотерапевтичними препаратами, які найчастіше застосовуються та мають велику частку побічних реакцій з боку серцево-судинної (СС) системи. Наразі вивчають багато нових молекул протиракових препаратів, удосконалюють схеми застосування, але їх побічні ефекти потребують вивчення. Проте вже на сьогодні існують потенційні стратегії для зниження ризику розвитку СС-ускладнень у хворих на рак. У цій статті узагальнено дані про основні СС-прояви токсичної дії протиракових препаратів, наведено методи діагностики та моніторингу побічних явищ, а також показано роль біомаркерів як для діагностики, так і для раннього виявлення кардіотоксичності (КТ). Ми також розглянули використання кардіопротекторної терапії як фармакологічних втручань із метою профілактики й лікування ускладнень. Наша мета полягає в тому, щоб дати клініцистам широкого загалу короткий і стислий алгоритм із виявлення та профілактики КТ, а також із ведення хворих під час проведення хіміотерапії (ХТ).
Кардіотоксична побічна дія хіміотерапевтичних препаратів є однією з основних причин захворюваності й смертності серед пацієнтів, які вижили після онкологічних захворювань. Кардіотоксичні ускладнення можуть проявлятися у вигляді аритмій, гіпертензії, ішемії міокарда, тромбоемболії, серцевої недостатності (СН), систолічної дисфункції міокарда чи іншими побічними ефектами. Антрацикліни (АЦ) і трастузумаб є хіміотерапевтичними препаратами, які найчастіше застосовуються та мають велику частку побічних реакцій з боку серцево-судинної (СС) системи. Наразі вивчають багато нових молекул протиракових препаратів, удосконалюють схеми застосування, але їх побічні ефекти потребують вивчення. Проте вже на сьогодні існують потенційні стратегії для зниження ризику розвитку СС-ускладнень у хворих на рак. У цій статті узагальнено дані про основні СС-прояви токсичної дії протиракових препаратів, наведено методи діагностики та моніторингу побічних явищ, а також показано роль біомаркерів як для діагностики, так і для раннього виявлення кардіотоксичності (КТ). Ми також розглянули використання кардіопротекторної терапії як фармакологічних втручань із метою профілактики й лікування ускладнень. Наша мета полягає в тому, щоб дати клініцистам широкого загалу короткий і стислий алгоритм із виявлення та профілактики КТ, а також із ведення хворих під час проведення хіміотерапії (ХТ).
Протягом останніх років прогрес у лікуванні онкологічних захворювань сприяв підвищенню виживання хворих на рак, але водночас це спричинило збільшення захворюваності та смертності через побічні явища/побічні ефекти протипухлинних препаратів.
За даними американської статистики, 5-річне виживання хворих на рак серед дорослого населення становить 67%. Однак використання в лікуванні ХТ і променевої терапії (ПТ) часто стає причиною різних CC-ускладнень, що може зумовлювати передчасну захворюваність і смертність серед осіб, що вижили після раку. Так, за даними Управління з нагляду за якістю харчових продуктів і медикаментів США (FDA), протягом 7 років після виявлення онкологічного захворювання з 1807 хворих 33% померло від захворювань серця й 51% – від онкологічної патології.
Дані багатьох досліджень свідчать як про пряму кардіотоксичну дію окремих хіміотерапевтичних препаратів та їх комбінацій, так і про їх здатність прискорювати розвиток СС-захворювань (ССЗ), особливо у хворих із факторами СС-ризику (G. Curigliano et al., 2016). Водночас припинення протипухлинного лікування через кардіоваскулярні ускладнення може зумовити прогресування чи рецидив раку. Найчастіше онкологам доводиться зважувати, чи продовжувати протипухлинне лікування як терапію виживання в разі розвитку кардіальних ускладнень, що може призвести до передчасної смерті пацієнта. Лікування хворого на рак вимагає від онколога не тільки застосування різних сучасних комплексних підходів і стратегій, а й залучення фахівця-кардіолога для оцінювання ризику можливих ускладнень у конкретного пацієнта.
У зв’язку з цим у 2016 р. Європейське товариство кардіологів опублікувало перший програмний документ, у якому систематизовано накопичені дані про СС-ускладнення на тлі протипухлинного лікування та запропоновано стратегії виявлення й терапевтичні підходи до ведення пацієнтів із кардіотоксичними проявами.
СС-ускладнення на тлі протипухлинного лікування можна поділити на дев’ять основних категорій:
- дисфункція міокарда лівого шлуночка (ЛШ) та СН;
- захворювання коронарних артерій, ішемічна хвороба серця (ІХС);
- ураження клапанів серця;
- аритмії, особливо в разі застосування препаратів, які подовжують інтервал QT;
- артеріальна гіпертензія (АГ);
- тромбоемболічні ускладнення;
- захворювання периферичних артерій та інсульт;
- легенева гіпертензія;
- захворювання перикарда.
Кардіотоксичність
Терміном КТ найчастіше характеризують розвиток у хворого дисфункції міокарда ЛШ або СН. КТ є найчастішим ускладненням протиракової терапії й причиною, що обтяжує перебіг захворювання та підвищує смертність онкологічних хворих. КТ може розвиватися на тлі проведеного протипухлинного лікування після першого введення препарату, через рік або навіть через декілька років.
Так, клінічні прояви СН розвинулися в 17% пацієнтів, які вижили завдяки агресивному лікуванню неходжкінської лімфоми протягом 5 років. Ризик розвитку СН зростає в 15 разів у пацієнтів, які лікувалися АЦ та/або отримували ПТ і вижили після раку в дитячому віці. Частина протипухлинних препаратів, таких як АЦ, зумовлюють пошкодження кардіоміоцитів, що в подальшому призводить до розвитку кардіоміопатії. Інші спричиняють лише транзиторну кардіальну дисфункцію ЛШ без віддалених наслідків (табл. 1).
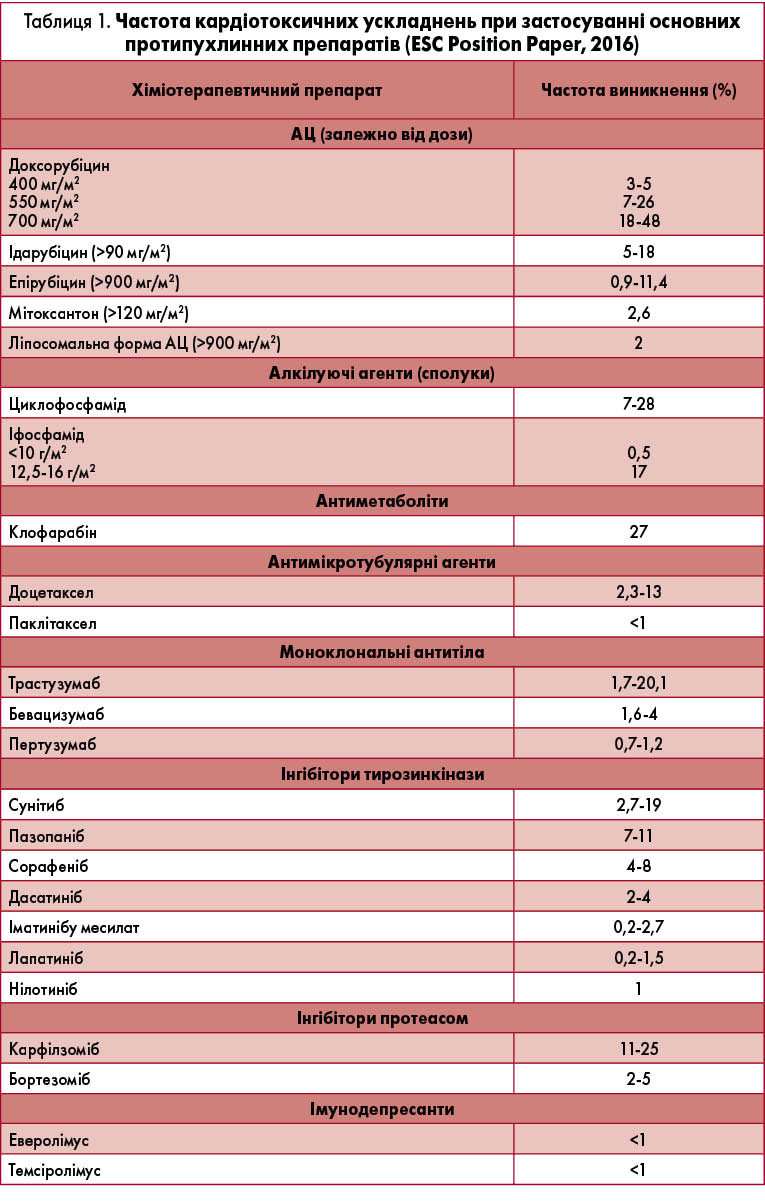
На сьогодні виділяють два типи КТ: ранню (тип 1), яка розвивається протягом 1 року, та відстрочену (тип 2), яка може маніфестувати через декілька років після лікування. Віддалений прогноз є досить складним, оскільки пацієнт з онкологічним захворюванням найчастіше отримує комбіноване протипухлинне лікування, а також ПТ. Взаємодія різних терапевтичних методів потенціює КТ, тому в разі призначення протипухлинного лікування необхідно виявляти насамперед фактори ризику можливих СС-ускладнень. Визначення факторів ризику в конкретного хворого включає ретельний збір анамнезу для виявлення факторів СС-ризику чи вже наявних ССЗ, а також попереднього лікування з приводу онкологічного захворювання, фізикальний огляд та обстеження серця перед призначенням ХТ (електрокардіографія – ЕКГ, візуалізація серця) (табл. 2).
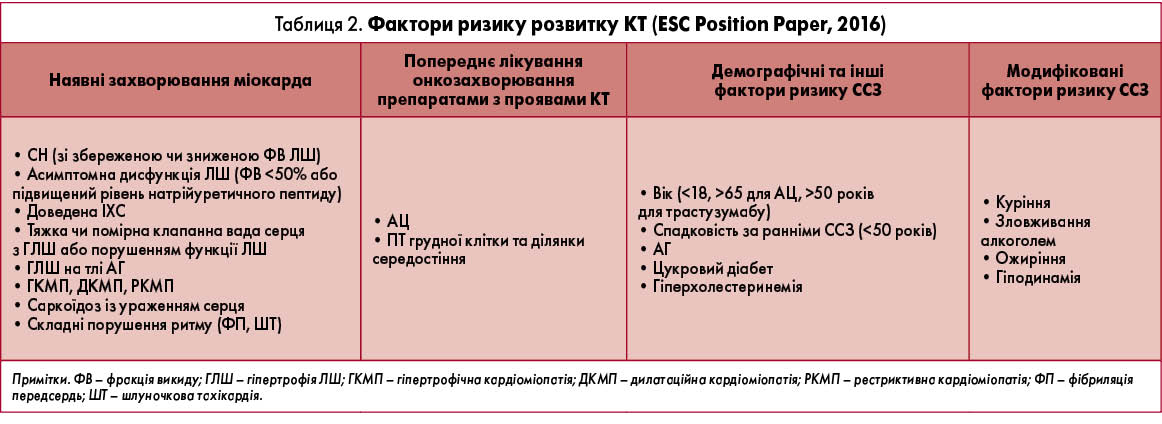
Важливим є виявлення субклінічних порушень функції серця (наприклад, асимптомної дисфункції ЛШ), які можуть впливати на рішення щодо вибору ХТ, дозування препарату, призупинення ХТ, показань до призначення кардіопротекторної терапії та строків моніторингу пацієнта. Визначення біомаркерів пошкодження міокарда (рівні тропонінів, натрійуретичних пептидів) може бути додатково використано для порівняння їх значень у динаміці під час подальшого спостереження за пацієнтом. Зазвичай обстеження пацієнта виконує команда фахівців-онкологів. Однак у пацієнтів із високим ризиком СС-ускладнень до обстеження пацієнта й рішення про подальшу тактику лікування необхідно залучати кардіолога чи кардіоонколога. Високий ризик визначають за кількістю й тяжкістю виявлених факторів ризику. Одним з основних факторів ризику є кумулятивна доза АЦ або часовий інтервал між призначенням різних схем ХТ.
Стратегія виявлення та оцінювання тяжкості КТ на тлі специфічного лікування включає візуалізацію серця й визначення біомаркерів крові. Візуалізацію серця може бути здійснено одним із можливих методів: ехокардіографія (ЕхоКГ), сцинтиграфія серця, магнітно-резонансна томографія (МРТ) (табл. 3).
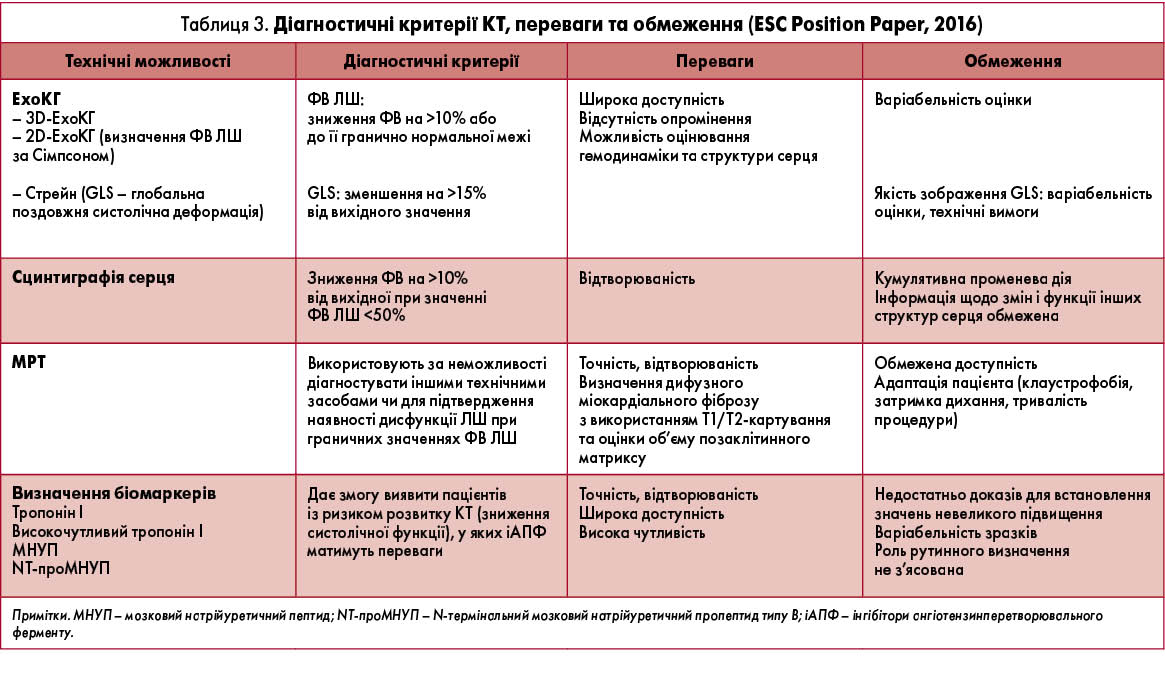
Необхідна частота обстежень (візуалізація серця й визначення біомаркерів) залежить від типу протипухлинного лікування, кумулятивних доз одержуваних препаратів, їх комбінації та тривалості лікування, а також від вихідного СС-ризику.
У разі виявлення ознак КТ пацієнт має отримати консультацію кардіолога для призначення ефективної СС-терапії та вирішення питання про можливість проведення подальшого протипухлинного лікування чи змін у схемі ХТ.
Нині даних щодо вибору кардіопротективного лікування для запобігання та лікування КТ недостатньо, при цьому виявлення біомаркерів дає змогу вирізнити пацієнтів із більш високим її ризиком, у яких більш раннє призначення кардіологічного лікування може бути досить ефективним. Так, у дослідженні D. Cardinale, дані котрого опубліковано у 2015 р., у 2625 пацієнтів, які лікувалися з приводу раку (середній вік – 50±13 років, середня ФВ ЛШ до початку лікування – 63±4%, середній період спостереження після лікування – 5,2 року), у 9% пацієнтів розвинулася КТ. При цьому в 98% із них ознаки КТ було виявлено в перший рік лікування, а медіана розвитку КТ по закінченню лікування становила 3,5 міс. Раннє призначення кардіопротекторної терапії (поєднання іАПФ із β-блокаторами) дало змогу досягти часткової чи повної нормалізації функції серця (що визначалась як приріст ФВ на 5% і досягнення значень >50% або повернення до вихідного рівня) у 82% пацієнтів протягом 8±5 міс лікування.
Діагностичні критерії КТ
ЕКГ. ЕКГ-обстеження рекомендовано виконувати всім пацієнтам до призначення й під час протипухлинного лікування. Зміни на ЕКГ не є специфічними, але можуть бути ознакою токсичного ураження міокарда: тахікардія в спокої, зміни сегмента ST і зубця T, порушення провідності, подовження інтервалу QT або наявність аритмій. Зміни на ЕКГ можуть бути тимчасовими й не пов’язаними з подальшим розвитком кардіоміопатії.
ЕхоКГ. Є методом вибору для визначення дисфункції міокарда до початку, на тлі протиракового лікування й під час подальшого спостереження пацієнтів. Найінформативнішою є 3D-ЕхоКГ, яка дає змогу оцінити функцію ендокарда, проте для визначення розмірів та об’ємів серця, а також ФВ ЛШ із використанням методу Сімпсона може бути рекомендовано 2D-ЕхоКГ. Дисфункцію ЛШ унаслідок побічної кардіотоксичної дії хіміотерапевтичних препаратів визначають як зниження ФВ ЛШ більш ніж на 10% до значення нижньої межі її норми (<50%). Таке зниження ФВ ЛШ має бути підтверджено повторним обстеженням пацієнта протягом 2-3 тиж. Зниження ФВ ЛШ може бути асимптомним або з проявами ознак СН. ЕхоКГ-обстеження слід повторювати під час подальшого моніторингу пацієнта для підтвердження нормалізації функції міокарда чи виявлення незворотної дисфункції ЛШ. Наразі немає чітких критеріїв строків проведення ЕхоКГ. Як правило, це залежить від схем протиракового лікування та препаратів, тяжкості проявів КТ, наявності СС-патології. ЕхоКГ дає також змогу виявити клапанні ураження серця, захворювання перикарда, легеневу гіпертензію, які також можуть бути пов’язані з токсичною дією протипухлинних препаратів. Для зменшення похибки методу ЕхоКГ має виконувати один і той самий кваліфікований фахівець на одному й тому самому обладнанні, за потреби можна також використовувати стрес-ЕхоКГ, доплерівське картування й різні технології контрастування.
Останні декілька років для виявлення ранніх змін скоротливості міокарда досить широко використовують метод оцінювання деформації (Стрейн) і швидкості деформації (Стрейн-рейт) відповідних сегментів ЛШ. Показник глобальної поздовжньої систолічної деформації (GLS) є предиктором зниження ФВ ЛШ. Зниження GLS більш ніж на 15% від вихідного рівня вважається патологічним і є маркером субклінічної дисфункції ЛШ (J.C. Plana et al., 2014).
Діастолічну дисфункцію ЛШ часто виявляють у хворих на онкологічні захворювання до початку ХТ або під час лікування. Проте на сьогодні недостатньо даних, які вказували би на необхідність переривання протиракового лікування в разі виявлення змін діастолічної функції.
Сцинтиграфія. Використовують для виявлення дисфункції міокарда протягом багатьох років завдяки точності й відтворюваності результатів. Однак у зв’язку з кумулятивним променевим впливом, а також обмеженою інформацією щодо структурних змін і серцевої гемодинаміки застосування її нині обмежено.
МРТ серця. Цей метод застосовують для виявлення причин дисфункції ЛШ і оцінювання ступеня ураження як лівого, так і правого шлуночка. МРТ показано для виявлення змін перикарда, що може бути особливо важливим при опроміненні грудної порожнини, дає змогу визначити вогнища фіброзу й рубцеві зміни міокарда, а також є методом для точного визначення маси міокарда та проявів інфільтративних змін. Використання Т1/Т2-картування дає змогу виявляти такі зміни в тканинах, як набряк і запалення, а також визначати їх об’єм.
Біомаркери. Визначення біомаркерів пошкодження міокарда дає змогу виявити раннє ураження міокарда на тлі ХТ. Доведено, що підвищення рівнів біомаркерів у крові пов’язано зі збільшеним ризиком розвитку КТ. Однак згідно з літературними даними залишається досить багато невизначеностей у використанні певних тестів і критеріїв їх оцінки; зокрема, це стосується строків проведення лабораторних обстежень, визначення верхньої межі норми для конкретного тесту, використання різних лабораторних аналізаторів. Найголовнішим питанням є відсутність чітких стратегічних рішень, яких необхідно дотримуватися в разі отримання результату, що виходить за межі норми. Немає чітких доказів стосовно переривання чи припинення ХТ у разі отримання результату, що виходить за межі норми, особливо при застосуванні чутливіших аналізаторів. В окремих клінічних дослідженнях показано, що на тлі ХТ (із використанням високих доз і комбінованого лікування) підвищення рівня тропоніну I (Тр І) за умови його нормального вихідного рівня дає змогу виокремити пацієнтів, у яких може розвинутися дисфункція ЛШ із несприятливим прогнозом, особливо за тривало підвищеного рівня Тр І. Також показано, що в цієї групи пацієнтів може бути ефективним лікування іАПФ.
Визначення рівнів натрійуретичних пептидів широко використовують для виявлення СН, і навіть його граничні значення дають змогу ідентифікувати пацієнтів високого ризику КТ і призначати патогенетичне лікування. У пацієнтів, які отримують хіміотерапевтичні препарати, можливе визначення рівнів МНУП і NT-проМНУП, однак роль цих біомаркерів у рутинній практиці для виявлення пацієнтів високого ризику КТ мало вивчена.
КТ на тлі застосування різних класів протипухлинних препаратів
АЦ широко використовують у ХТ злоякісних пухлин: ці препарати посідають друге місце після алкілуючих сполук, є ефективними при солідних пухлинах і лейкозах. Водночас терапія АЦ найбільш часто призводить до розвитку тяжкої КТ. Так, на тлі прийому кумулятивної дози доксорубіцину (400 мг/м2) застійну СН спостерігають у 5% випадків, а збільшення дози препарату зумовлює експоненціальне збільшення ризику розвитку СН, що досягає 48% випадків у разі застосування дози 700 мг/м2. Механізми кардіотоксичної дії АЦ пов’язують із гіпотезою оксидативного стресу, утворенням вільних радикалів і перекисним окисленням ліпідів, що ушкоджує клітинну мембрану кардіоміоцитів. АЦ є хінонами, що здатні продукувати вільні радикали, які ушкоджують мембрани, білки й ліпіди. Комплекси заліза й АЦ тісно зв’язуються з клітинними мембранами, чим спричиняють спонтанне руйнування саркоплазматичного ретикулуму, що призводить до виникнення Са2+-залежного некрозу міокарда. АЦ також порушують структуру саркомера в кардіоміоциті за рахунок прискорення деградації ключових саркомерних білків і пригнічення синтезу нових білків, зміни процесу транскрипції.
Кардіотоксичний вплив АЦ може бути гострим, раннім і пізнім. Гостра КТ виявляється суправентрикулярними аритміями, транзиторною дисфункцією ЛШ і змінами на ЕКГ. Розвивається зазвичай одразу після інфузії АЦ у менш ніж 1% пацієнтів і в більшості випадків є зворотною. Однак наразі немає критеріїв, що дають змогу визначити подальший прогноз пацієнта з гострою КТ. Виявлення в крові підвищеного рівня біомаркерів (тропонінів) може бути предиктором відстроченої КТ. Рання КТ проявляється протягом 1 року лікування, тоді як пізня може маніфестувати через декілька років після лікування. Токсичне ураження міокарда на тлі лікування АЦ може починатися безсимптомно й клінічно маніфестувати через роки, часто під впливом інших тригерних факторів (D. Cardinale et al., 2015).
Лікування дисфункції ЛШ, спричиненої АЦ, на ранніх етапах часто має позитивні результати й приводить до відновлення функції серця. Слід зазначити, що КТ, діагностована в пізні строки, складно піддається лікуванню.
Фактори ризику КТ на тлі лікування АЦ:
- кумулятивна доза;
- жіноча стать;
- вік:
– >65 років (ризик на 10% вище, ніж у молодших);
– дитячий вік;
- ниркова недостатність;
- супутня чи попередня ПТ, що включає ділянку серця;
- супутня ХТ:
– алкілуючі препарати;
– імуномодулятори (моноклональні антитіла – МКАТ);
- наявні фактори:
– захворювання серця;
– АГ;
– генетичні фактори.
МКАТ (anti-HER2). Трастузумаб. Інгібування HER2-сигнального шляху з використанням антитіл (трастузумаб) або деяких інгібіторів протеїнтирозинкінази (наприклад, лапітиніб) є ефективним у лікуванні пацієнтів із HER2-позитивним раком молочної залози. Однак показано, що лікування трастузумабом у поєднанні з АЦ збільшує ризик розвитку дисфункції ЛШ і СН. Застосування трастузумабу після АЦ або без лікування АЦ істотно знижує ризик розвитку СН. При цьому тривалий прийом (24 міс) частіше призводить до розвитку КТ, ніж коротший курс (12 міс). Хоча при монотерапії ризик КТ мало вивчений, він частіше є низьким, якщо в пацієнта не було факторів ризику ССЗ. Частота розвитку дисфункції ЛШ на тлі застосування трастузумабу становить від 7 до 34%, СН – від 0 до 4%. На відміну від АЦ на тлі терапії трастузумабом КТ зазвичай маніфестує й рідко буває відстроченою.
Фактори ризику КТ під час лікування трастузумабом:
– попередній або теперішній прийом АЦ;
– короткі перерви між циклами АЦ і МКАТ (3 тиж замість 3 міс);
– АГ;
– похилий вік (>65 років);
– індекс маси тіла >30 кг/м2;
- попередня дисфункція ЛШ (знижена ФВ ЛШ);
– попередня ПТ.
КТ – найчастіша причина відмови від терапії трастузумабом (13,5%). Часто лікування переривають за наявності клінічних проявів СН або через зниження ФВ ЛШ <45%. Переривання протипухлинного лікування часто призводить до рецидиву проявів онкологічного захворювання. Спричинені дією трастузумабу дисфункція ЛШ і СН зазвичай є зворотними, якщо лікування переривається та/або починається лікування СН.
Інгібітори ендотеліального фактора росту (ІЕФР) індукують дисфункцію ЛШ у 2% пацієнтів, а розвиток СН (функціональний клас III-IV за NYHA) – у 1% пацієнтів. За даними окремих досліджень, ризик розвитку всіх стадій застійної СН підвищується у 2,7 раза на тлі застосування різних препаратів цього класу (сунітиніб, сорафеніб, пазопаніб). ІЕФР часто зумовлюють розвиток АГ або істотно погіршують її перебіг. Вважають, що контроль артеріального тиску може зменшити прояви СН у цих пацієнтів. Оскільки ці препарати часто використовують у тяжких хворих при паліативному лікуванні, оцінити їхню дію на міокард досить складно. Прояви СН у разі використання препаратів цієї групи можуть бути зворотними за умови призначення стандартної терапії СН.
Фактори ризику КТ при лікуванні ІЕФР:
– попередня СН;
– наявна ІХС;
– клапанні ураження (мітральна регургітація);
– ішемічна кардіоміопатія;
– АГ.
Циклофосфамід та інші алкілуючі препарати рідше спричиняють КТ, яка частіше виникає на тлі введення високих доз циклофосфаміду (>140 мг/кг). Прояви КТ спостерігають часто в день уведення препарату. Один із механізмів дії цієї групи лікарських засобів – ішемія міокарда.
До факторів ризику розвитку КТ належать: болюсне введення, комбінація з іншими протипухлинними препаратами й опромінення середостіння.
Препарати платини зумовлюють розвиток КТ на тлі попередньо наявного пошкодження міокарда й перевантаження об’ємом (зазвичай уводять із великою кількістю рідини).
Таксани можуть бути альтернативою АЦ, але їхня побічна кардіотоксична дія на сьогодні недостатньо вивчена.
Інгібітори протеасом застосовують для лікування мієломної хвороби. Карфілзоміб – найпотужніший препарат із цієї групи. З його застосуванням пов’язаний високий ризик розвитку СН – понад 25%.
Іматиніб є інгібітором протеїнтирозинкінази, який застосовують у лікуванні хронічної лейкемії та деяких форм гастроінтестинальних пухлин. На тлі лікування іматинібом може виникати КТ, але переважно розвиток КТ стосується нових препаратів цієї групи (нілотиніб, понатиніб) і асоціюється із СС-ускладненнями.
Променева терапія. Ризик розвитку КТ на тлі ПТ визначити досить складно через відстрочені прояви дисфункції ЛШ. ПТ зазвичай застосовують у комбінації з ХТ, при цьому існують різні схеми застосування. Відносний ризик фатальних СС-подій на тлі ПТ становить від 2,2 до 12,7 раза для лімфоми Ходжкіна та від 1 до 2,2 – для раку молочної залози. При цьому абсолютний ризик смерті становить від 9,3 до 28 на 10 тис. хворих на рік. Серед тих, хто вижив після раку й отримував ПТ, ризик розвитку СН підвищується в 4,9 раза, при цьому ризик істотно збільшується за умови поєднання ПТ із ХТ. ПТ спричиняє розвиток інтерстиціального кардіофіброзу. В одному з досліджень у 22% пацієнтів, які отримували тільки ПТ, розвинулися прояви діастолічної дисфункції ЛШ і у 27,4% спостерігали зниження фізичної активності (<450 м за даними 6-хвилинного тесту з ходьбою). СН може ускладнюватися за рахунок клапанних уражень серця та загострення ІХС, які, у свою чергу, є також ускладненнями ПТ.
Стратегії спостереження й лікування
Усім пацієнтам, які отримують лікування з потенційним ризиком розвитку КТ, необхідно виконати кардіологічне обстеження до початку терапії, що має включати визначення ФВ ЛШ, ЕКГ у 12 відведеннях, вимірювання артеріального тиску. Повторне обстеження потрібно проводити після закінчення ХТ. Тривале спостереження показано пацієнтам, у яких КТ розвинулася на тлі протипухлинного лікування, і тим, кому було призначено кардіопротекторну терапію. Дорослим пацієнтам, які отримали високу кумулятивну дозу АЦ та/або високі дози опромінення грудної клітки, рекомендовано довічне спостереження. Нині довічне спостереження рекомендовано особам, які перенесли онкологічне захворювання в дитячому віці. Усім пацієнтам, кому призначають потенційно кардіотоксичне протипухлинне лікування, рекомендовано виконання ЕхоКГ, незалежно від анамнезу захворювання, для визначення вихідного ризику. Для пацієнтів низького ризику (нормальна ЕхоКГ до початку ХТ, відсутність факторів ризику) рекомендовано повторне обстеження з використанням ЕхоКГ кожні 4 цикли на тлі лікування ІЕФР або за умови досягнення кумулятивної дози АЦ, що є еквівалентними дозі доксорубіцину 200 мг/м2. Частіші обстеження можуть бути необхідні пацієнтам із вихідними порушеннями функції серця за даними ЕхоКГ (знижена чи гранична нормальна ФВ ЛШ, структурні ураження серця), із високим вихідним ризиком КТ (попередня терапія АЦ, інфаркт міокарда чи анамнез лікування з приводу СН). Пацієнтам, які вижили після онкологічного захворювання й отримали кумулятивну дозу доксорубіцину ≥300 мг/м2, або тим, у кого розвинулася КТ, яка потребувала лікування, показано контрольну ЕхоКГ через 1 і 5 років. Дані про тривалість спостереження пацієнтів з асимптомною КТ є суперечливими та ґрунтуються більше на думці окремих експертів, ніж на доказовій базі. Ретроспективний аналіз виявив, що в осіб, які лікувалися АЦ, ризик розвитку застійної СН може зберігатися понад 10 років.
Терміни моніторингу хворих із ризиком розвитку КТ (із використанням ЕхоКГ і тестів на біомаркери) мають бути персоналізовані й залежати від вихідного СС-ризику та протоколу специфічного лікування онкологічного захворювання. Основний принцип – найбільш раннє спостереження дає змогу виявити ранні ознаки токсичного ураження міокарда.
Пацієнтам, у яких розвинулися прояви асимптомної дисфункції ЛШ або ознаки СН на тлі ХТ, показано призначення іАПФ або блокаторів рецепторів ангіотензину II (БРА) та β-блокаторів згідно із загальними принципами лікування СН. За даними декількох досліджень було показано, що в разі розвитку КТ під час терапії АЦ раннє призначення кардіопротекторного лікування іАПФ та/або β-блокаторами може частково чи повністю відновити функцію серця, а комбінована терапія є ефективнішою порівняно з монотерапією.
Ведення пацієнтів, які лікувалися АЦ. До призначення лікування АЦ пацієнт має пройти початкове обстеження для виявлення факторів ризику чи супутніх ССЗ і визначення систолічної функції ЛШ. У разі виявлення дисфункції ЛШ необхідно вирішити питання про можливе альтернативне лікування та/або призначення кардіопротекторної терапії. Якщо було прийнято рішення про призначення АЦ, повторне обстеження функції ЛШ потрібно проводити наприкінці лікування, особливо якщо в пацієнта є високий ризик розвитку ураження міокарда чи якщо в подальшому буде призначено наступний препарат із можливими кардіотоксичними побічними діями. У разі призначення високих доз АЦ, а також у пацієнтів із високим вихідним ризиком КТ додаткове обстеження серця слід призначити при досягненні кумулятивної дози препарату (для доксорубіцину – 240 мг/м2) (M.S. Ewer et al., 2013). Визначення одного з біомаркерів (Тр I або МНУП) показано до початку лікування, а Тр I – після кожного циклу ХТ. Це дасть змогу виявити пацієнтів із вищим ризиком КТ і вчасно призначити кардіопротекторну терапію (G. Curigliano et al., 2013).
Ведення пацієнтів, які лікувалися трастузумабом. Даних рандомізованих досліджень, які показали б ефективність терапії СН (за звичайною схемою), спричиненої трастузумабом, наразі немає. Проте з огляду на досвід лікування КТ, зумовленої АЦ, можна очікувати, що терапія іАПФ буде ефективною. Початкове обстеження (ЕКГ, ЕхоКГ, визначення рівня тропоніну, консультація кардіолога, виявлення факторів ризику КТ) показано всім хворим до призначення лікування трастузумабом. Кардіомоніторинг рекомендовано кожні 3 міс під час лікування й через 1 міс після закінчення протипухлинної терапії. Визначення рівня Тр I після кожного циклу ХТ показано пацієнтам високого ризику.
Згідно з рекомендаціями Національного інституту вивчення раку Великої Британії (National Cancer Research Institute) визначено (A.L. Jones et al., 2009):
- за умови зниження ФВ ЛШ <45 або на >10% від початкової до значень ФВ між 45 і 49% призначення трастузумабу має бути припинено, необхідно призначити іАПФ;
- трастузумаб може бути знову призначено, якщо ФВ ЛШ відновилася до рівня >49%;
- зниження ФВ ЛШ <50, але >44% – прийом трастузумабу можна продовжити, але за одночасного призначення іАПФ;
- у разі тривалого зниження ФВ ЛШ показано консультацію кардіолога, можливе призначення β-блокаторів.
Для профілактики розвитку КТ інтервал між призначенням АЦ і трастузумабом має бути по можливості більш тривалим. Рекомендовано призначати іАПФ для профілактики АГ та дисфункції ЛШ.
КТ на тлі застосування ІЕФР може розвинутись як безпосередньо після лікування, так і через декілька місяців. Тому в пацієнтів із високим ризиком повторне обстеження функції ЛШ потрібно проводити через 2-4 тиж після початку терапії. Надалі рекомендовано ЕхоКГ-обстеження кожні 6 міс до стабілізації функції ЛШ. Дані щодо спостереження таких пацієнтів є обмеженими. Відповідно до результатів одного дослідження повторні обстеження виконували кожні 2-3 міс (із визначенням рівнів тропоніну чи МНУП/NT-проМНУП), що дало змогу виявити 33% випадків КТ у хворих із карциномою нирки на тлі лікування ІЕФР.
Отож хворі на онкологічні захворювання, які отримують протипухлинне лікування з потенційним розвитком КТ, мають високий ризик виникнення СН і повинні бути обстежені для виявлення та контролю факторів ризику СС-ускладнень. ФВ ЛШ слід визначати до лікування й періодично на тлі прийому протипухлинної терапії для раннього виявлення дисфункції міокарда ЛШ. Значення ФВ ЛШ <50% є нижнім граничним рівнем функції ЛШ, оскільки саме це значення найчастіше використовують у більшості досліджень. Пацієнтам з істотним зниженням ФВ ЛШ (на >10%) та нижче нижньої межі норми необхідно повторювати ЕхоКГ після кожного курсу ХТ або якщо того потребує клінічна ситуація. За умови зниження ФВ ЛШ на >10% і нижче нижньої межі норми показано лікування іАПФ (або БРА) в комбінації з β-блокаторами для профілактики подальшої дисфункції ЛШ і розвитку клінічних проявів СН. ІАПФ (або БРА) та β-блокатори рекомендовано пацієнтам із симптоматичною СН і з асимптомною дисфункцією міокарда ЛШ за відсутності протипоказань.
Отже, незважаючи на те що на сьогодні ми не маємо конкретних відповідей на багато запитань, а доказова база тільки починає накопичуватися, лікарі мають достатньо інструментів для раннього виявлення КТ протипухлинних препаратів, ретельного моніторування клінічних проявів під час ведення таких пацієнтів. Це дає можливість стратифікувати пацієнтів високого ризику, вибирати схеми лікування з меншою КТ, вчасно їх коригувати, застосовувати доступні методи кардіопротекції з метою покращення якості життя та виживання онкологічних пацієнтів.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....
Кору та листя верби тисячоліттями використовували як знеболювальний та жарознижувальний засіб. У ХІХ ст. із цих рослинних продуктів кристалізовано активну речовину – саліцин, згодом синтезували саліцилову кислоту, а в 1899 році її ацетильовану форму – ацетилсаліцилову кислоту (АСК) запатентовано як удосконалений лікарський засіб під назвою «аспірин» [1]. Лише в другій половині ХХ ст. детально вивчено молекулярні мішені АСК; зокрема, отримав належну оцінку та пояснення її антитромботичний ефект....




