Интенсивная терапия ревматических заболеваний
По материалам III Научно-практической конференции «Междисциплинарные проблемы в ревматологии» (17 мая, г. Киев)
Открытие и клиническое использование глюкокортикоидов (ГК) неразрывно связано с ревматологией. Впервые в лечении ревматических заболеваний их стали использовать в 1948 году – именно тогда американские ученые Philip Showalter Hench, Charles Slocumb и Howard Polley применили кортизол в дозе 100 мг у 29-летней пациентки с тяжелым ревматоидным артритом. Новые возможности в лечении тяжелых пациентов, открывшиеся благодаря применению ГК, выглядели по-настоящему революционными, и в 1950 году Edward Calvin Kendall, Tadeush Reichsten и Philip Showalter Hench стали лауреатами Нобелевской премии в области медицины за клиническое использование ГК. В 1976 году E.S. Cathcart и соавт. сообщили о положительном эффекте инфузий сверхвысоких доз метилпреднизолона у пациентов с волчаночным гломерулонефритом и быстрым ухудшением функции почек. Фактически с этого момента началось формирование концепции пульс-терапии ГК, и эти препараты со временем заняли новую важную нишу – использование в интенсивной терапии ревматических заболеваний.

Современным методам интенсивной терапии ревматических заболеваний был посвящен доклад доктора медицинских наук, профессора Ирины Юрьевны Головач (Клиническая больница «Феофания» Государственного управления делами, г. Киев).
Интенсивные методы терапии часто используются в неотложной ревматологии, при угрожающих состояниях у пациентов с системной красной волчанкой, антифосфолипидным синдромом, дермато- и полимиозитами, ревматоидным артритом, системными васкулитами. Как долговременная стратегия (для подавления обострений, индукции ремиссии и в качестве поддерживающей терапии во время ремиссии) интенсивная терапия применяется при системных васкулитах. Данный подход может также использоваться как стартовое лечение при III морфологическом типе люпус-нефрита.
Основой интенсивного лечения ревматических заболеваний чаще всего является пульс-терапия ГК или цитостатиками (ЦС) – интермиттирующее введение препаратов в супрафармакологических дозах для усиления терапевтического и снижения побочных эффектов (F. Buttgerent, J. da Silva, M. Boers et al. Ann. Rheum. Dis., 2002; 61: 718-722). ГК при этом применяются в дозах >250 мг (в пересчете на преднизолон) в течение 1-5 дней. Пульс-терапия ГК (чаще всего метилпреднизолоном) и ЦС (чаще всего циклофосфаном) применяется для усиления и ускорения развития терапевтического эффекта, а также для снижения риска побочных реакций как самостоятельно, так и в комбинации или синхронно с другими методами. С.К. Соловьев и соавт. (2001) предлагают следующие варианты интенсивной терапии в ревматологии:
– ежемесячная пульс-терапия метилпреднизолоном в дозе 1000 мг в течение 3 дней (до 6 мес);
– ежемесячная пульс-терапия циклофосфаном в дозе 1000 мг в течение 3 дней (до 6 мес);
– комбинированная ежемесячная пульс-терапия метилпреднизолоном и циклофосфаном: 1000 мг метилпреднизолона в течение 3 дней + 1000 мг циклофосфана на 2-й день (до 6-12 мес);
– синхронная интенсивная терапия с применением плазмафереза (или других экстракорпоральных методов) и пульс-терапии в течение 6-12 мес (рис.);
– внутривенный иммуноглобулин (ВВИГ) самостоятельно или в составе синхронной интенсивной терапии.
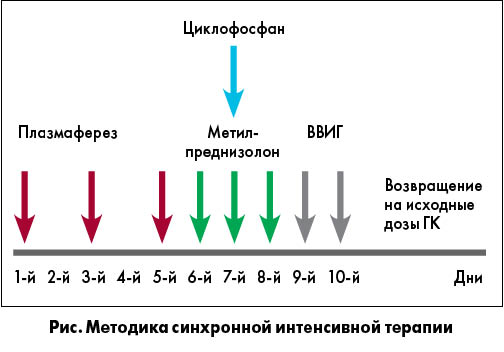
Пульс-терапия ГК и циклофосфаном применяется в ревматологии при таких тяжелых состояниях, как тромбоцитопенический панцитопенический криз, тяжелая гемолитическая или аутоиммунная анемия, тяжелые миокардиты/перикардиты, коронарит, пульмонит, васкулит, гломерулонефрит, поражения нервной системы при системных заболеваниях соединительной ткани и васкулитах, поражения центральной нервной системы (нейролюпус, парезы, параличи и т. д.) (A. Sinha et al., 2008).
Установлено, что в реализации выраженного терапевтического действия высоких доз ГК важную роль играют геномные эффекты, среди которых – стабилизация клеточных мембран и мембран органелл, снижение проницаемости капиллярного эндотелия, защита клеток от цитотоксического воздействия и др. Негеномные эффекты проявляются при высокой концентрации ГК (10-4) и развиваются стремительно – в течение нескольких секунд, в отличие от геномных, время проявления которых при использовании низких доз ГК составляет 30 мин и более, и рецептор-опосредованных (1-2 мин при назначении средних доз ГК). Кроме того, применение высоких доз ГК (внутривенное (в/в) введение метилпреднизолона в дозе ≥1000 мг) обеспечивает взаимодействие препарата со всеми ГК-рецепторами, их перезагрузку и экспрессию, что также вносит существенный вклад в повышение эффективности лечения.
В настоящее время в зависимости от клинической ситуации и индивидуальных особенностей пациента используются разные режимы пульс-терапии ГК: 1) классическая (метилпреднизолон в дозе 1000 мг/сут в/в, капельно в течение 3 дней); 2) средней интенсивности (доза метилпреднизолона – 500 мг/сут); 3) низкой интенсивности (доза метилпреднизолона – 250 мг/сут) (В. А. Насонова и соавт., 2012).
Абсолютных противопоказаний для пульс-терапии ГК не так много. Отказаться от использования данного подхода следует при наличии у пациента инфекционного заболевания, язвы желудка (на момент лечения), глаукомы, плохо контролируемой артериальной гипертензии (АГ), декомпенсированного сахарного диабета (СД). Относительными противопоказаниями являются выраженная, но контролируемая АГ, субкомпенсированный СД, отягощенный семейный анамнез глаукомы.
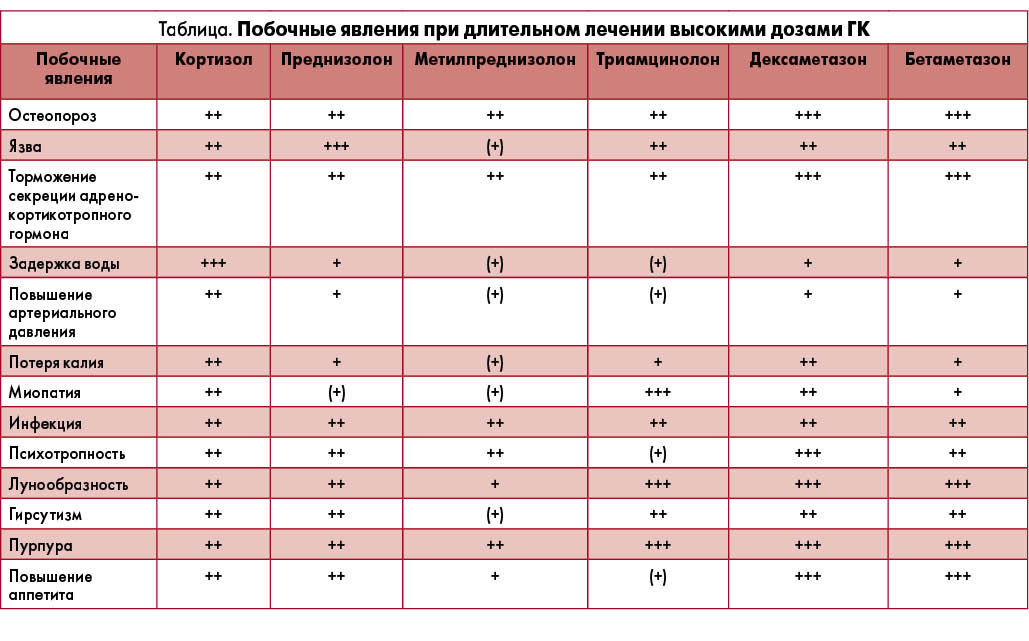
Чаще всего для проведения пульс-терапии ГК в клинической практике используется метилпреднизолон, характеризующийся продолжительным действием (24-72 ч после инфузии) и линейным характером связывания с белками плазмы крови (концентрация метилпреднизолона в плазме крови соответствует дозе вводимого препарата). Противовоспалительный эффект метилпреднизолона превосходит по выраженности таковой у кортизона, гидрокортизона, преднизолона и преднизона, а минералокортикоидный – практически не проявляется, что выгодно отличает метилпреднизолон от вышеперечисленных препаратов. Метилпреднизолон также характеризуется наиболее благоприятным профилем безопасности (табл.) по сравнению с другими ГК, что позволяет применять его у широкого круга пациентов. Расчет дозы для внутривенной инфузии метилпреднизолоном осуществляется следующим образом: 15-20 мг на 1 кг массы тела с разведением на 250 мл физиологического раствора; время инфузии составляет 30-45 мин (F. Buttgerent et al., 2002). В зависимости от индивидуальных особенностей пациента и клинической ситуации врач может использовать один из вариантов пульс-терапии ГК: классический (метилпреднизолон в дозе 1000 мг/сут в/в, капельно 3 дня подряд); средней интенсивности (метилпреднизолон в дозе 500 мг/сут в/в, капельно, 3 дня подряд) и низкой интенсивности (метилпреднизолон в дозе 250 мг/сут в/в, капельно, 3 дня подряд).
Украинские врачи широко используют в своей практике известный препарат метилпреднизолона – Медрол. На отечественном фармацевтическом рынке представлены три формы выпуска препарата: таблетированная для перорального применения с дозировками 4; 16 и 32 мг (Медрол); инъекционная для внутривенного и внутримышечного введения (Солу-Медрол) с дозировками 40; 125; 500 и 1000 мг; инъекционная для местного, внутрисуставного и внутримышечного введения в дозировке 40 мг (Депо-Медрол).
Разные формы выпуска позволяют применять Медрол в любых режимах ГК-терапии у пациентов ревматологического профиля на различных этапах развития заболевания: при неотложных или жизнеугрожающих состояниях, обострениях, для поддерживающего лечения. Дозировки инъекционной формы – Солу-Медрол – удобны для проведения пульс-терапии любой интенсивности.
Подготовила Наталья Очеретяная
СТАТТІ ЗА ТЕМОЮ Кардіологія
Кору та листя верби тисячоліттями використовували як знеболювальний та жарознижувальний засіб. У ХІХ ст. із цих рослинних продуктів кристалізовано активну речовину – саліцин, згодом синтезували саліцилову кислоту, а в 1899 році її ацетильовану форму – ацетилсаліцилову кислоту (АСК) запатентовано як удосконалений лікарський засіб під назвою «аспірин» [1]. Лише в другій половині ХХ ст. детально вивчено молекулярні мішені АСК; зокрема, отримав належну оцінку та пояснення її антитромботичний ефект....
Артеріальна гіпертензія (АГ) є провідною причиною смерті та інвалідизації у всьому світі. Відповідно до серії досліджень Global Burden of Disease, ≈13% смертей так чи інакше пов’язані з АГ (Forouzanfar M.H. et al., 2017; Lewington S. et al., 2002; World Health Organization, 2009)....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....
Інколи саме з цього перерізу вдається візуалізувати тромбоемболи в основних гілках легеневої артерії або вегетації на стулках легеневого клапана (що трапляється надзвичайно рідко). Нахиливши датчик до самої верхівки серця, можна отримати її переріз по короткій осі, на якому, знову ж таки, порожнина лівого шлуночка має круглясту форму, а правого шлуночка – близьку до трикутника із виразною трабекулярністю (рис. 22.9). Розглядаючи зображення, також звертають увагу на те, що в нормі всі сегменти ЛШ скорочуються синхронно, не випереджаючи інші і не відстаючи. ...




