Дифференциальная диагностика тромбоцитозов
Тромбоцитоз – это состояние, при котором отмечается чрезмерное увеличение количества тромбоцитов в периферической крови. Верхний предел их нормального содержания обычно находится между значениями 350×109/л и 400×109/л, что зависит от референтных интервалов,установленных в разных лабораториях.
По данным A. Schafer [1], в образцах крови 10 тыс. здоровых взрослых в возрасте от 18 до 65 лет только
99 человек (1%) имели показатели тромбоцитов больше чем 400×109/л. Порог клинически значимого превышения нормы количества тромбоцитов, определяемого как тромбоцитоз, является переменной величиной и зависит от каждого конкретного пациента. В соответствии с данными литературы количество тромбоцитов ≥450×109/л считается общепринятым значением превышения нормы [2]. Тромбоцитоз имеет много потенциальных этиологий, поэтому клиническая оценка пациента с тромбоцитозом требует внимательного рассмотрения истории его болезни, сопутствующих заболеваний и некоторых лабораторных параметров [3]. Исходя из показателя количества тромбоцитов в периферической крови, придерживаются следующей градации тромбоцитоза: мягкий (450-700×109/л), умеренный (700-900×109/л), тяжелый (900-1000×109/л), экстремальный тромбоцитоз (>1000×109/л).
 У детей наблюдаются такие тенденции: количество тромбоцитов >500×109/л при рождении отмечается у 13%; в течение первого месяца жизни – у 36% детей, родившихся с пониженным весом; на протяжении 6-11 мес жизни – также у 13%. Затем количество тромбоцитов постепенно снижается до нормального уровня примерно к 11-му году жизни или несколько позже.
У детей наблюдаются такие тенденции: количество тромбоцитов >500×109/л при рождении отмечается у 13%; в течение первого месяца жизни – у 36% детей, родившихся с пониженным весом; на протяжении 6-11 мес жизни – также у 13%. Затем количество тромбоцитов постепенно снижается до нормального уровня примерно к 11-му году жизни или несколько позже.
Тромбоцитозы подразделяются на первичные (клональные, опухолевые), вторичные (реактивные), ложные (псевдотромбоцитоз) и наследственные (семейные) (табл. 1).
Существуют фундаментальные отличия между первичным и вторичным тромбоцитозом в отношении этиологии, патогенеза и клинических проявлений. Однако очень часто бывает трудно отличить клональный тромбоцитоз от реактивного на основании исключительно клинических проявлений и лабораторных данных. Степень повышения количества тромбоцитов также четко не разграничивает эти виды тромбоцитозов [4].
I. Первичный тромбоцитоз
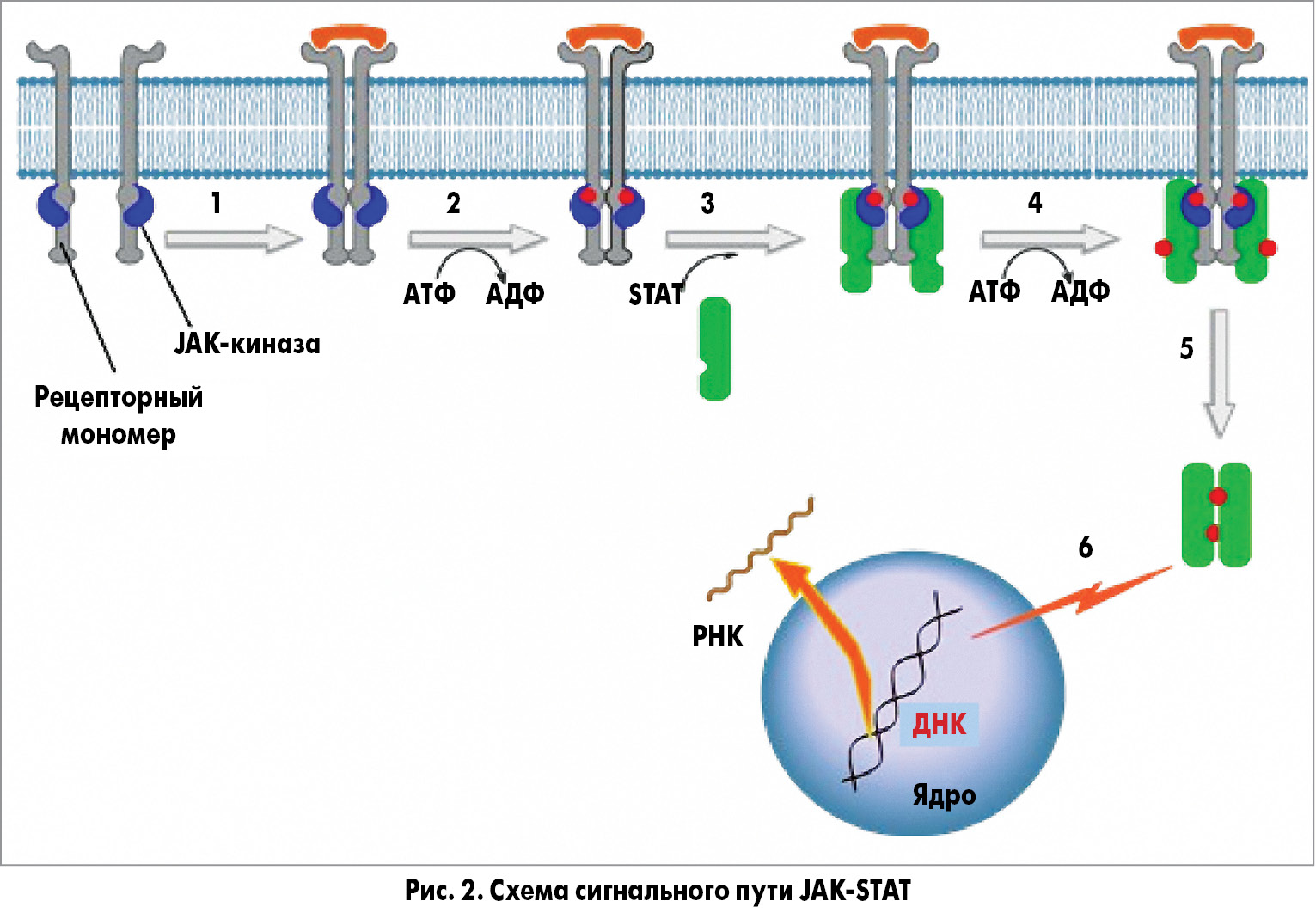
Первичный тромбоцитоз составляет 10-15% в структуре пациентов с тромбоцитозом и обусловлен клональной пролиферацией мегакариоцитов при опухолях системы крови. Классические миелопролиферативные новообразования (MPNs – myeloproliferative neoplasms) включают эссенциальную тромбоцитемию (ЭТ; 24,0%), хронический миелоидный лейкоз (ХМЛ; 19,3%), истинную полицитемию (ИП; 44,6%) и первичный миелофиброз (ПМФ; 10,4%) [5]. Эта группа заболеваний характеризуется клональной экспансией определенных линий зрелых и/или созревающих миелоидных клеток, которые образуются из гемопоэтических стволовых клеток.
1. Эссенциальная тромбоцитемия
ЭТ – хроническое миелопролиферативное заболевание клональной природы, проявлениями которого являются пролиферация мегакариоцитов и персистирующий тромбоз [8]. Впервые данные об ЭТ были представлены в работах G. de Gugliemo в 1920 г. [6] и E. Epstein, A. Goedel в 1934 г. [7]. Заболеваемость ЭТ составляет 2,53 случая на 100 тыс. населения [9]. Эта цифра, вероятно, увеличилась за последние годы в связи с внедрением в медицинскую практику новых методов лабораторной диагностики и изменением Всемирной организацией здравоохранения (ВОЗ) количества тромбоцитов, необходимого для подтверждения диагноза ЭТ, с 600×109/л до 450×109/л. Болезнь проявляется во всех возрастных группах с медианой в 60 лет [10]. Клиническими осложнениями при ЭТ являются сосудистые события, включая тромбоз (чаще артериальный) и микрососудистые окклюзии. Неврологические симптомы, характерные для ЭТ, – головная боль, нарушение зрения и головокружение.
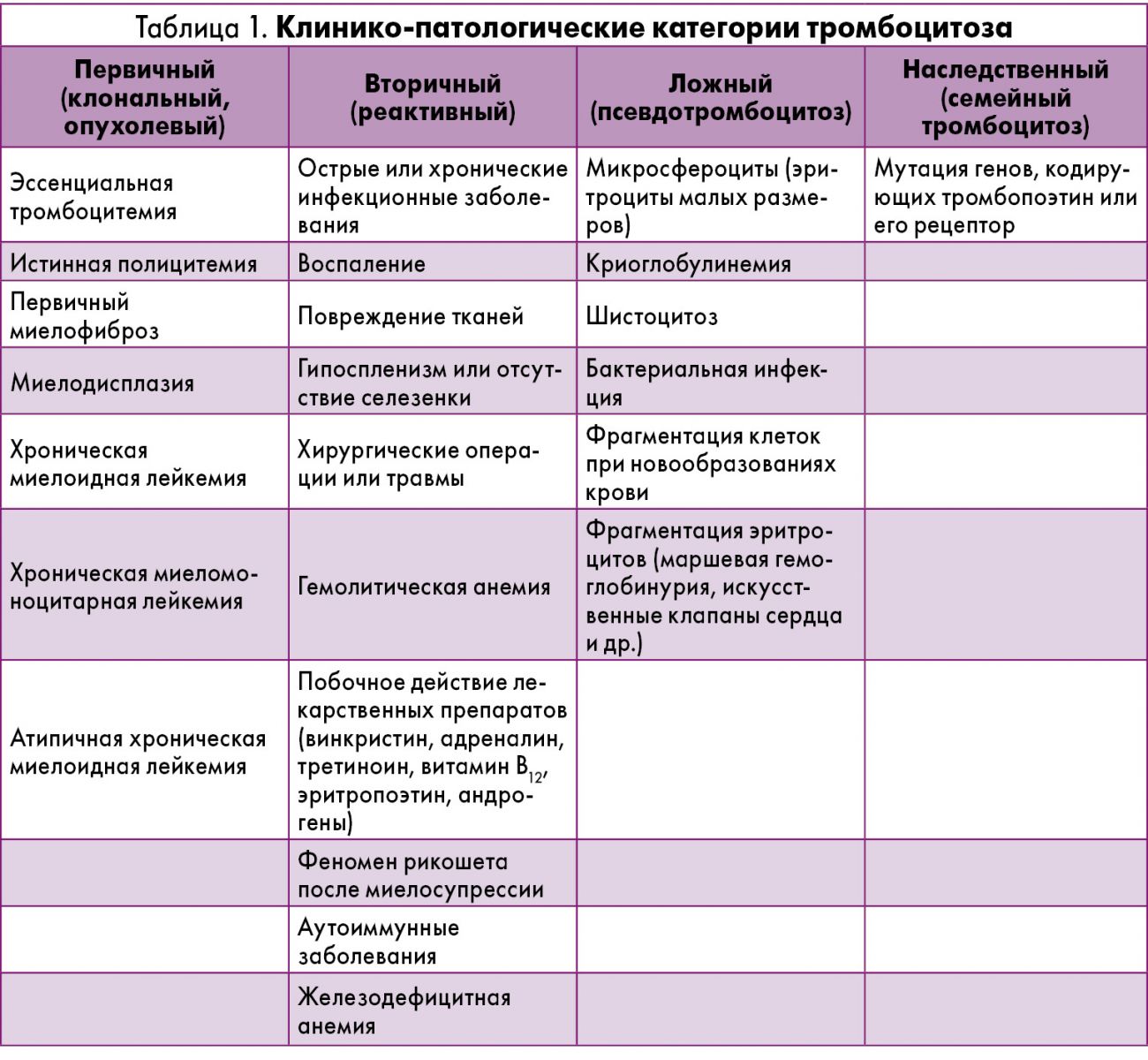
Этиология и патогенез
 Одной из основных гипотез этиологии ЭТ является предрасположенность к заболеванию, которая реализуется под действием внешних факторов, повреждающих геном нормальной клетки, что приводит к злокачественной трансформации [11]. Наследственная предрасположенность обусловлена носительством гена JAK2, что приводит к активации сигнального пути JAK-STAT (Signal Transducers and Activators of Transcription) [12, 13]. Семейство JAK-киназы представлено четырьмя белками: JAK1, JAK2, JAK3 и TYK2. Молекула JAK2 имеет молекулярный вес около 130 кДа и содержит в своем составе 1132 аминокислоты; структурно состоит из 7 гомологичных участков (JH1-JH7), формирующих 4 домена: киназный (JH1), псевдокиназный (JH2), домены SH2 и FERM. Домен JH1 является типичной тирозинкиназой, которая обладает каталитической активностью; следующий домен JH2 структурно похож на тирозинкиназный, но лишен каталитической активности и выполняет регуляторные функции [14]. Предназначение домена SH2 состоит в связывании других белков с JAK-киназой, а домен FERM взаимодействует с трансмембранными белками – рецепторами некоторых цитокинов, регулируя активность JAK-киназы (рис. 1) [15].
Одной из основных гипотез этиологии ЭТ является предрасположенность к заболеванию, которая реализуется под действием внешних факторов, повреждающих геном нормальной клетки, что приводит к злокачественной трансформации [11]. Наследственная предрасположенность обусловлена носительством гена JAK2, что приводит к активации сигнального пути JAK-STAT (Signal Transducers and Activators of Transcription) [12, 13]. Семейство JAK-киназы представлено четырьмя белками: JAK1, JAK2, JAK3 и TYK2. Молекула JAK2 имеет молекулярный вес около 130 кДа и содержит в своем составе 1132 аминокислоты; структурно состоит из 7 гомологичных участков (JH1-JH7), формирующих 4 домена: киназный (JH1), псевдокиназный (JH2), домены SH2 и FERM. Домен JH1 является типичной тирозинкиназой, которая обладает каталитической активностью; следующий домен JH2 структурно похож на тирозинкиназный, но лишен каталитической активности и выполняет регуляторные функции [14]. Предназначение домена SH2 состоит в связывании других белков с JAK-киназой, а домен FERM взаимодействует с трансмембранными белками – рецепторами некоторых цитокинов, регулируя активность JAK-киназы (рис. 1) [15].
 Мутация JAK-киназы вызывает замену 1849 нуклеотида G→T, которая, в свою очередь, приводит к замене в 14 экзоне гена JAK2 фенилаланина на валин в кодоне 617, что сопровождается независимой активацией JAK-киназы.
Мутация JAK-киназы вызывает замену 1849 нуклеотида G→T, которая, в свою очередь, приводит к замене в 14 экзоне гена JAK2 фенилаланина на валин в кодоне 617, что сопровождается независимой активацией JAK-киназы.
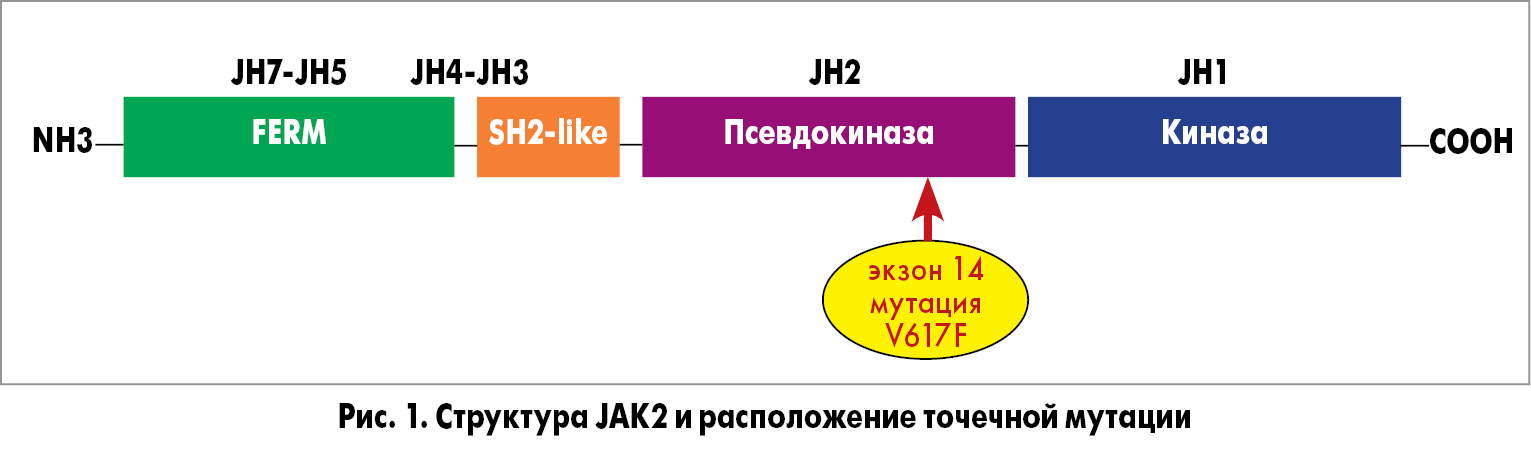
Одним из наиболее важных процессов, в котором участвует JAK-киназа, является передача цитокинового сигнала в ядро с целью стимуляции пролиферации посредством сигнального пути JAK-STAT (рис. 2).
Механизм сигнального пути JAK-STAT состоит в следующем (рис. 2):
- присоединение цитокина к рецептору и объединение его мономеров;
- трансфосфорилирование JAK-киназы;
- присоединение STAT-фактора;
- фосфорилирование STAT-фактора;
- димеризация STAT-фактора и его перемещение в ядро;
- взаимодействие STAТ-фактора с ДНК и активация транскрипции (регуляция экспрессии генов).
Это основной путь передачи сигнала от рецепторов эритропоэтина и тромбопоэтина (ТPO) посредством JAK2-киназы в клетках-предшественниках миелопоэза, что обусловливает общий патогенез хронических миелопролиферативных заболеваний [16].
У 4-8% больных ЭТ обнаружены мутации в гене MPL, кодирующем рецептор ТPO [17]. В норме цитоплазматическая часть рецептора при взаимодействии с ТPO формирует рецепторный комплекс с JAK-киназой. Мутации в положении 515 гена MPL, а именно W515L (замена триптофана на лейцин) и W515K (замена триптофана на лизин), приводят к изменению конформации белка, проявляющейся постоянной независимой от действия ТPO активацией сигнального пути JAK-STAT и гиперплазией миелоидного ростка.
Диагностические критерии ЭТ [18]
- Постоянный тромбоцитоз более 450×109/л.
- В препарате костного мозга пролиферация в основном мегакариоцитарного ростка с повышенным количеством крупных зрелых мегакариоцитов.
- Не соответствует критериям ВОЗ для диагностики ИП, ПМФ, ХМЛ, миелодиспластического синдрома или других миелоидных новообразований.
- Наличие мутации JAK2 V617F.
2. Хронический миелоидный лейкоз
ХМЛ характеризуется дисрегуляцией клональной экспрессии всех клеток гранулоцитарного ростка. Диагностируют ХМЛ с помощью выявления филадельфийской хромосомы (Рh’-хромосомы) – цитогенетической аномалии, характеризующейся нарушением в локусе 22q11. Чаще всего она обнаруживается в виде реципрокной транслокации t (9; 22) (q34; q11). Образование филадельфийской хромосомы происходит по ошибке, когда часть хромосомы 9 (ген ABL) присоединяется к хромосоме 22 (ген BCR). В результате этого образуется новый ген BCR-ABL [19]. В зависимости от точки разрыва гена BCR могут возникать три основных типа гена BCR-ABL. Основной гибридный ген, характерный для классического миелолейкоза, возникает при разрыве в области M-bcr (major breakpoint cluster region). Его считывание приводит к образованию двух типов химерной мРНК: b2a2 или b3a2. В итоге такой генной перестройки образуется цитоплазматический белок p210BCR-ABL с молекулярной массой 210 кДa, который является онкопротеином, ответственным за фенотипические аномалии, возникающие при ХМЛ. Ген BCR-ABL определяется у всех пациентов с ХМЛ с помощью цитогенетических исследований методом FISH (флуоресцентная гибридизация in situ) или с использованием полимеразной цепной реакции [20]. Приблизительно у 50% пациентов с ХМЛ отмечается тромбоцитоз в сочетании с лейкоцитозом.
3. Истинная полицитемия
ИП – клональное миелопролиферативное заболевание, которое характеризуется пролиферацией эритроидного, гранулоцитарного и мегакариоцитарного ростков миелопоэза с преимущественной пролиферацией эритроидного ростка кроветворения, увеличением числа эритроцитов и повышением уровня гемоглобина, тромбоцитозом, лейкоцитозом. Почти все больные с ИП являются носителями мутации JAK2 V617F. Патогенез тромботических осложнений ИП состоит в увеличении массы циркулирующих эритроцитов, замедлении тока крови и повышении ее вязкости. Их развитию способствуют тромбоцитоз и качественные нарушения тромбоцитов. В плазме крови больных с ИП нередко определяются циркулирующие агрегаты тромбоцитов.
Диагностические критерии ИП
Диагноз ИП должен быть установлен в соответствии с критериями ВОЗ на основании комплексной оценки клинической картины и лабораторных показателей:
- гемоглобин более 185 г/л для мужчин и 165 г/л для женщин или другие признаки повышения объема циркулирующих эритроцитов;
- мутации гена JAK2 (V617F или мутация в 12 экзоне).
4. Первичный миелофиброз
Для ПМФ характерны клональная пролиферация стволовых клеток, аномальная экспрессия цитокинов, фиброз костного мозга, гепатоспленомегалия. Диагноз ПМФ согласно классификации ВОЗ должен быть основан на сочетании клинических, морфологических, молекулярных, цитогенетических характеристик, в т. ч.:
- пролиферация мегакариоцитов, сочетающаяся с коллагеновым фиброзом костного мозга;
- отсутствие критериев ИП, ХМЛ или других миелопролиферативных заболеваний;
- наличие мутаций (JAK2 V617F, MPL W515L или MPL W515K, CALR (кальретикулина), в случае их отсутствия – исключение реактивного фиброза.
II. Реактивный тромбоцитоз
Реактивный/вторичный тромбоцитоз (РТ) – результат повышенной активации мегакариоцитопоэза, который составляет 80-90% случаев всех тромбоцитозов [21]. Причинами РТ могут быть воспалительные процессы (язвенный колит, ревматоидный артрит, остеомиелит), инфекции, стресс, повреждение тканей (травмы, операции, ожоги), острая/хроническая кровопотеря, железодефицитные состояния, злокачественные новообразования (рак почки, рак предстательной железы, неходжкинские лимфомы), гемолитическая анемия, состояние после спленэктомии.
Факторами, стимулирующими мегакариоцитопоэз, являются интерлейкины (IL) и колониестимулирующие ростовые факторы. ТРО – основной регулятор тромбоцитов, однако такие цитокины, как IL-1 [22], IL-4 [23], IL-6 [24], IL-11 [25] и фактор некроза опухоли (TNF), также играют важную роль в тромбоцитопоэзе. В частности, уровень IL-6 значительно увеличен у пациентов с РТ, индуцированным острой инфекцией, злокачественным новообразованием, хроническим воспалительным процессом, в то время как у больных с ЭТ он низкий. В связи с этим определение IL-6 может быть использовано для дифференциальной диагностики тромбоцитозов [26].
Одна из сложностей использования циркулирующих цитокинов в качестве диагностического инструмента для дифференцировки тромбоцитозов состоит в том, что их уровень к моменту возникновения тромбоцитоза может быть нормальным. Это привело к поиску суррогатных маркеров, которые могли бы коррелировать с концентрацией цитокинов (особенно с IL-6). Такими маркерами стали С-реактивный белок (СРБ), ферритин и скорость оседания эритроцитов (СОЭ). A. Tefferi и соавт. [27] показали корреляцию между IL-6 и СРБ в исследовании 91 пациента с тромбоцитозом (независимо от этиологии). 76% участников с РТ имели повышенный уровень СРБ (>1,0 мг/дл), в то время как в группе пациентов с клональным тромбоцитозом повышение СРБ было зафиксировано лишь у 10%. Таким образом, СРБ и другие острофазовые показатели могут служить суррогатными маркерами изменений цитокинов.
1. Железодефицитная анемия
Железодефицитная анемия является одной из причин РТ (5% случаев) [28]. Поэтому при обследовании каждого пациента с подозрением на РТ необходимо измерение содержания в крови ферритина и железа. Патофизиология РТ при железодефицитной анемии остается до сих пор не совсем ясной. Так, по данным H. Akan и соавт. [29], уровни цитокинов (IL-6, IL-11 и TPO) не были повышены у больных с дефицитом железа и РТ по сравнению с пациентами с дефицитом железа и нормальным уровнем тромбоцитов. В других исследованиях отмечалось, что количество тромбоцитов было выше нормы у лиц со сниженными показателями сывороточного железа, ферритина, среднего объема тромбоцитов и увеличенной общей железосвязывающей способностью сыворотки.
2. Инфекционные и воспалительные заболевания
При инфекционных и воспалительных заболеваниях в 40% случаев отмечается повышение количества тромбоцитов [30]. Кроме своей главной функции, которая заключается в участии в системе гемостаза, тромбоциты также активно проявляют себя в антимикробной защите организма. Они могут захватывать и нейтрализовать патогены, продуцировать бактерицидные вещества, способные уничтожать некоторые виды бактерий и грибов. Обеспечивая межклеточные взаимодействия эндотелиальных клеток и лейкоцитов, тромбоциты помогают последним осуществлять миграцию к очагу воспаления. Стимулированные бактериями тромбоциты синтезируют альфа-гранулы, которые содержат целый арсенал активных пептидов, таких как хемокины и факторы роста эндотелиальных, гладкомышечных клеток и фибробластов [31].
3. Аутоиммунные заболевания
Тромбоцитоз также имеет место в ряде случаев хронических аутоиммунных заболеваний (ювенильный хронический артрит, узелковый полиартериит, болезнь Кавасаки, ревматоидный артрит, ревматизм, системная красная волчанка, склеродермия, дерматомиозит, болезнь Крона, синдром Бехчета, гранулематоз Вегенера) [32].
4. Солидные опухоли
У больных с солидными опухолями нередко отмечается развитие РТ, при этом механизм данного явления длительное время оставался не вполне понятным [33]. Однако недавние исследования показали, что одной из основных причин опухолевого тромбоцитоза является увеличение продукции как тканями хозяина, так и самой опухолью тромбоцитопоэтических цитокинов. В частности, этот процесс опосредован синтезом ТPO печенью, который увеличивается в ответ на чрезмерную продукцию опухолью IL-6. Усиленный синтез TPO ведет к увеличению количества тромбоцитов, которые, в свою очередь, способствуют росту опухоли.
5. Травмы и операции
У посттравматических пациентов количество тромбоцитов демонстрирует бимодальное изменение со снижением этого показателя ниже базового уровня и последующим нарастанием выше нормального уровня после 1-й недели от момента получения травмы [34]. В клинических исследованиях продемонстрировано, что примерно у 25% больных с травмой развивается тромбоцитоз >450×109/л. Однако на сегодняшний день имеется недостаточное представление об этиологии и клиническом значении тромбоцитоза у пациентов с травмой.
6. Спленэктомия
Селезенка является органом, регулирующим кроветворение. Известно ее влияние на тромбоцитопоэз. Вырабатываемые этим органом гормоны воздействуют на выработку тромбоцитов. Участие селезенки в кроветворении подтверждают качественные и количественные изменения в гемограмме, возникающие после спленэктомии. Так, после удаления селезенки в крови увеличивается число ретикулоцитов, лейкоцитов и тромбоцитов. Подобные изменения в гемограмме объясняются феноменом «растормаживания» костного мозга, усилением продукции форменных элементов крови и замедленным их разрушением. Увеличение числа тромбоцитов после спленэктомии происходит постепенно с максимальными цифрами 400-600×109/л на 7-10-е сутки. M. Steele и соавт. у 247 больных после спленэктомии по поводу повреждения селезенки наблюдали возрастание количества тромбоцитов в среднем до 485×109/л. Максимальное их увеличение в крови до 976×109/л отмечалось на 13-14-й день после операции. В последующем число тромбоцитов постепенно возвращалось к норме.
III. Ложный тромбоцитоз
Гематологический анализатор может ошибочно сортировать мелкие частицы и относить их к тромбоцитам. Причинами подобного ложного тромбоцитоза могут быть фрагменты клеток (например, бластных клеток во время химиотерапии), эритроциты малых размеров (сфероциты или фрагментоциты), шистоциты. Количество тромбоцитов возрастает также при криоглобулинемии.
IV. Наследственный тромбоцитоз
В последние годы был достигнут значительный прогресс в понимании биологии наследственного тромбоцитоза [35]. Сейчас известно, что его могут вызывать мутации в двух генах – THPO и MPL. THPO – ген, кодирующий ТPO (при его мутации развивается вторичный тромбоцитоз с высоким уровнем ТРО). MPL – ген, кодирующий рецептор ТPO (при его мутации развивается первичный тромбоцитоз с низким или нормальным уровнем TPO).
Характеристиками наследственного тромбоцитоза являются:
- количество тромбоцитов >450×109/л;
- отсутствие ЭТ (отсутствие мутации JAK2 V617F);
- отсутствие вторичного тромбоцитоза вследствие воспаления, дефицита железа, асплении и т. д.;
- отсутствие миелодиспластического синдрома и острой миелоидной лейкемии;
- молодой возраст;
- наследственная предрасположенность.
Дифференциальная диагностика тромбоцитозов
 Для подтверждения случайно обнаруженного тромбоцитоза необходимо проведение повторного анализа крови через несколько недель (особенно это относится к пограничным референтным значениям). Если количество тромбоцитов составляет >450×109/л, первым шагом должно являться исключение любого сопутствующего заболевания, которое могло бы вызвать тромбоцитоз. В дифференциальной диагностике первичных и вторичных тромбоцитозов большое значение имеют лабораторные данные. Поэтому при отсутствии каких-либо клинических проявлений и отклонений в лабораторных показателях как диагностический тест первой линии рекомендуется генотипирование JAK2 V617F, характерное для истинной полицитемии, ЭТ и первичного миелофиброза (рис. 3) [36]. При отсутствии мутации JAК2 и клинико-лабораторных признаков, свидетельствующих о возможном миелопролиферативном заболевании, требуется исследование костного мозга.
Для подтверждения случайно обнаруженного тромбоцитоза необходимо проведение повторного анализа крови через несколько недель (особенно это относится к пограничным референтным значениям). Если количество тромбоцитов составляет >450×109/л, первым шагом должно являться исключение любого сопутствующего заболевания, которое могло бы вызвать тромбоцитоз. В дифференциальной диагностике первичных и вторичных тромбоцитозов большое значение имеют лабораторные данные. Поэтому при отсутствии каких-либо клинических проявлений и отклонений в лабораторных показателях как диагностический тест первой линии рекомендуется генотипирование JAK2 V617F, характерное для истинной полицитемии, ЭТ и первичного миелофиброза (рис. 3) [36]. При отсутствии мутации JAК2 и клинико-лабораторных признаков, свидетельствующих о возможном миелопролиферативном заболевании, требуется исследование костного мозга.
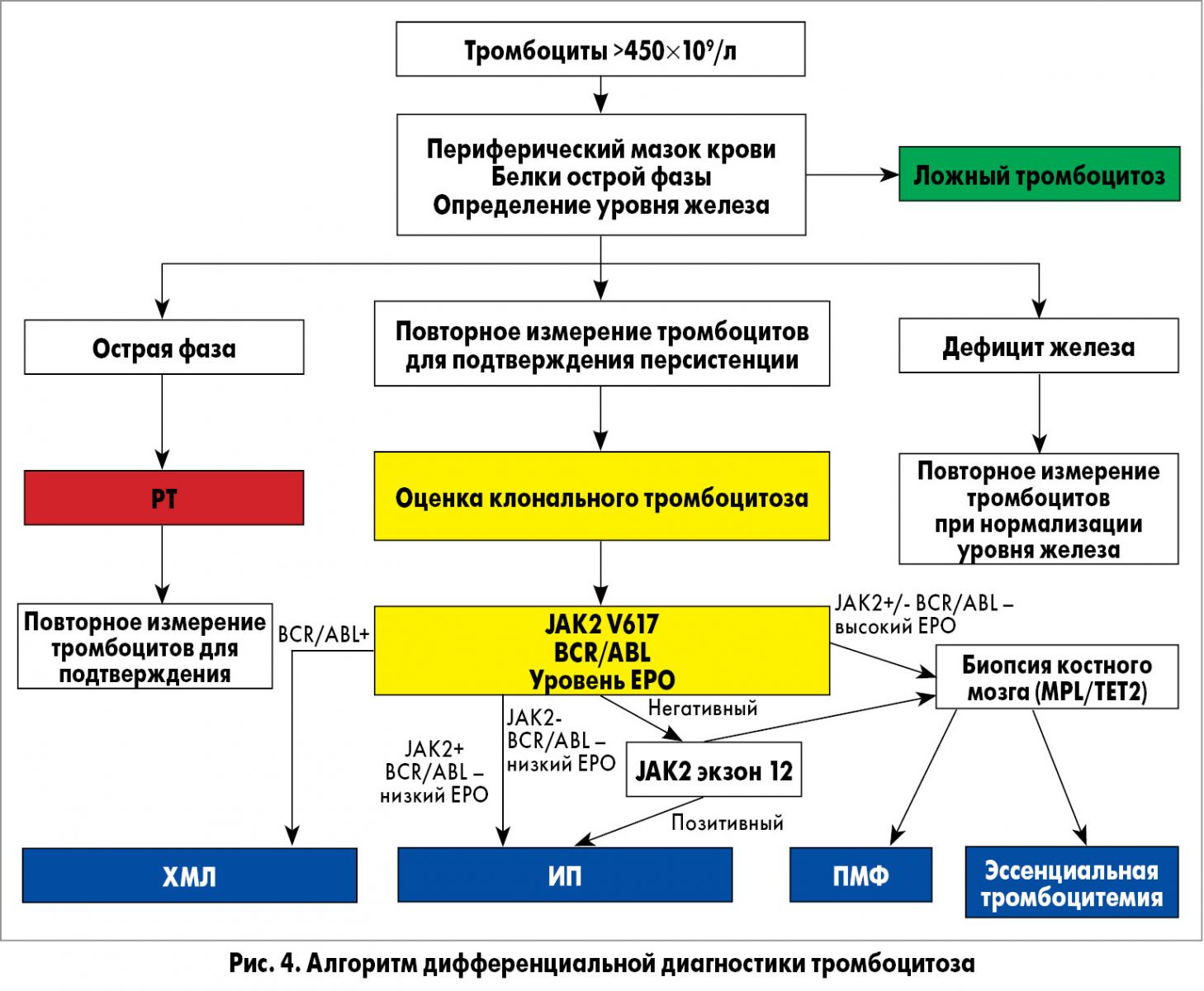 При подозрении на хронический миелолейкоз проводится молекулярно-генетическое исследование гена BCR/ABL. На РТ приходится большинство случаев экстремального тромбоцитоза (количество тромбоцитов >1000×109/л). Если в случае РТ обычно наблюдается снижение среднего объема тромбоцитов, то при неопластическом тромбоцитозе происходит его увеличение. Мазок периферической крови может служить доказательством лежащего в основе инфекционного или воспалительного процесса. При РТ обычно фиксируется повышение следующих маркеров: СРБ, фибриногена, ферритина, фактора VIII, СОЭ. Уровень ТРО сыворотки, как правило, увеличен, что является непосредственным результатом гиперпродукции ТРО или увеличения уровня IL-6, который, в свою очередь, индуцирует экспрессию ТРО в клетках печени (рис. 4).
При подозрении на хронический миелолейкоз проводится молекулярно-генетическое исследование гена BCR/ABL. На РТ приходится большинство случаев экстремального тромбоцитоза (количество тромбоцитов >1000×109/л). Если в случае РТ обычно наблюдается снижение среднего объема тромбоцитов, то при неопластическом тромбоцитозе происходит его увеличение. Мазок периферической крови может служить доказательством лежащего в основе инфекционного или воспалительного процесса. При РТ обычно фиксируется повышение следующих маркеров: СРБ, фибриногена, ферритина, фактора VIII, СОЭ. Уровень ТРО сыворотки, как правило, увеличен, что является непосредственным результатом гиперпродукции ТРО или увеличения уровня IL-6, который, в свою очередь, индуцирует экспрессию ТРО в клетках печени (рис. 4).
Выводы
- Степень тромбоцитоза не является показателем его этиологии.
- Дифференциальная диагностика тромбоцитоза проводится по совокупности результатов лабораторных исследований.
- При первичном тромбоцитозе необходимо проведение лабораторно-генетического тестирования для определения мутаций в генах JAK2, BCL/ABL, MPL и CALR.
- Для РТ характерно увеличение СРБ, фибриногена, лейкоцитов, провоспалительных цитокинов, фактора Виллебранда и уменьшение концентрации гемоглобина.
- При РТ количество тромбоцитов нормализуется после лечения основного заболевания.
- Пациентам с тромбоцитозом требуется активное диагностическое и лечебное вмешательство с неотложным определением причины тромбоцитоза.
- При наличии у больного симптомов соматических, хирургических или опухолевых заболеваний увеличение количества тромбоцитов в подавляющем большинстве случаев носит реактивный характер.
Список литературы находится в редакции.
Медична газета «Здоров’я України 21 сторіччя» № 7 (428), квітень 2018 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....




