Кишковий мікробіом: склад, функції та терапевтичні можливості його відновлення
 Гастроентерологія – дуже захоплива наука. Постійно оприлюднюються нові відомості та цікаві факти, які іноді повністю змінюють наше уявлення про норму та патологію. Нещодавно активно використовували поняття «мікрофлора», але зараз воно втратило свою актуальність. Завдяки масштабним дослідженням, проведеним у рамках проекту «Мікробіом людини» (Human Microbiome Project), стало відомо, що майже 90% клітин у людському тілі належать не людині, а мікробам. При цьому геном людини становить лише невелику частину усієї ДНК сукупного біому (мікробіому): генетична потужність бактеріального генома у 150 разів перевищує таку генома людини [1]. Таким чином з’явилося нове поняття «мікробіом», яке пояснює, що наше тіло є місцем проживання численної популяції мікроорганізмів, свого роду мікробною екосистемою, яка має власну генетичну регуляцію, реагує на вплив факторів зовнішнього і внутрішнього середовища та взаємодіє з ними. Ця система настільки унікальна, що в світі не знайдеться двох людей з ідентичними мікробіомами. Сукупність генома людини та мікробіому називають гологеномом, який визначає метаболічні характеристики організму.
Гастроентерологія – дуже захоплива наука. Постійно оприлюднюються нові відомості та цікаві факти, які іноді повністю змінюють наше уявлення про норму та патологію. Нещодавно активно використовували поняття «мікрофлора», але зараз воно втратило свою актуальність. Завдяки масштабним дослідженням, проведеним у рамках проекту «Мікробіом людини» (Human Microbiome Project), стало відомо, що майже 90% клітин у людському тілі належать не людині, а мікробам. При цьому геном людини становить лише невелику частину усієї ДНК сукупного біому (мікробіому): генетична потужність бактеріального генома у 150 разів перевищує таку генома людини [1]. Таким чином з’явилося нове поняття «мікробіом», яке пояснює, що наше тіло є місцем проживання численної популяції мікроорганізмів, свого роду мікробною екосистемою, яка має власну генетичну регуляцію, реагує на вплив факторів зовнішнього і внутрішнього середовища та взаємодіє з ними. Ця система настільки унікальна, що в світі не знайдеться двох людей з ідентичними мікробіомами. Сукупність генома людини та мікробіому називають гологеномом, який визначає метаболічні характеристики організму.
Мікробіом – це сукупність бактерій, вірусів, грибів та архебактерій усередині людини та на поверхні її шкіри. Дуже часто це поняття звужують, розуміючи під ним сукупність бактерій, а для інших спільнот вводять окремі назви, наприклад, віром для сукупності вірусів і мікобіом для популяцій грибів. Мікробіом розподілений у нашому організмі нерівномірно, за його локалізацією та видовим складом розрізняють мікробіом шкіри, ротової порожнини, дихальних шляхів, урогенітального тракту і кишечнику (рис. 1).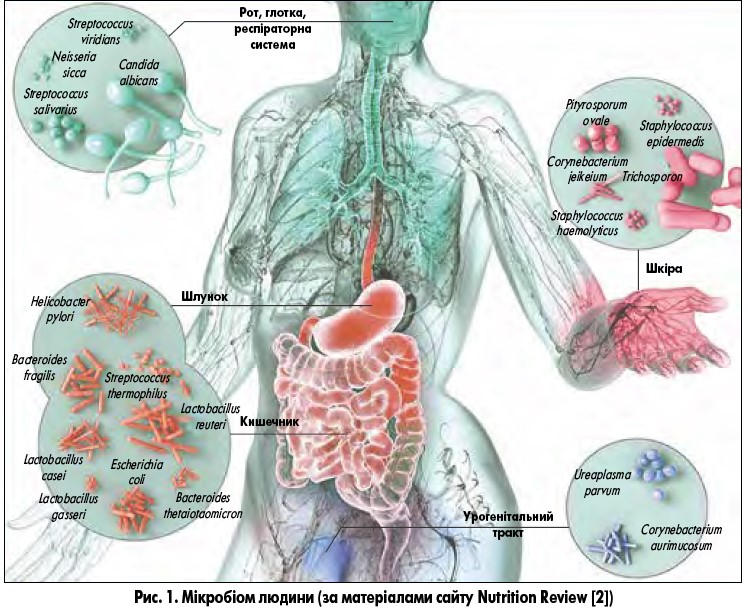
У цій статті ми розглянемо особливості формування кишкового мікробіому, його склад, функції та сучасні можливості його відновлення.
Склад і функції кишкового мікробіому
Найбільшим мікробіомом нашого тіла є, безсумнівно, кишковий. Бактерії (бактеріом), гриби (міком) та віруси (віром) живуть разом у гармонії та динамічній рівновазі у кишковому тракті. Незважаючи на те що вірусам приділяють небагато уваги, вони відіграють важливу роль у кишковій екосистемі: 90% інтестинального вірому складається з бактеріофагів, тоді як решта 10% припадає на різноманітні рослинні та тваринні віруси, які постійно надходять до організму з їжею.
Ця мікробна спільнота починає колонізувати організм ще до народження дитини і живе у ньому у тісному взаємозв’язку до смерті людини [3]. Донедавна вважали, що розвиток плода відбувається у стерильній матці, а перший контакт організму людини з мікробами відбувається після пологів. Проте нині з’являється все більше доказів, що плід розвивається в середовищі, яке не є повністю вільним від мікробів. У низці досліджень переконливо доведено, що у плаценті, навколоплідних водах, пуповинній крові та первинному калі присутні різноманітні бактерії Enterococcus, Escherichia, Leuconostoc, Lactococcus і Streptococcus, а у недоношених немовлят – сліди Enterobacter, Enterococcus (менше, ніж у доношених), Lactobacillus, Photorhabdus і Tannerella. При цьому наявність зазначених бактерій не асоціюється з погіршенням самопочуття малюків або розвитком захворювання.
Після народження дитина отримує мікроби з навколишнього середовища, їжі та людей, котрі її оточують (батьків, членів сім’ї). У перший місяць життя мікробіота кишечнику є відносно стабільною, а протягом наступних декількох місяців її біологічна різноманітність значно зростає. Одночасно з мікробною колонізацією імунна система людини стикається з великою кількістю антигенів, що сприяє розвитку та становленню імунної системи.
Спочатку кишкова мікробіота представлена переважно Firmicutes та Bacteroidetes (на їх частку припадає до 70% мікробів від всієї мікробіоти), згодом до них приєднуються Proteobacteria, Verrucomicrobia, Actinobacteria, Fusobacteria, Cyanobacteria, але в значно меншій кількості. Склад кишкової мікробіоти неоднорідний: бактерії, що перебувають у просвіті кишечнику (просвітна флора), значно відрізняються від таких біля його слизової оболонки (мукозна флора) [1, 3]. У просвіті кишечнику домінують представники родів Bacteroides, Bifidobacterium, Streptococcus, Enterobacteriaceae, Enterococcus, Clostridium, Lactobacillus та Ruminococcus, тоді як біля слизової оболонки переважають Bifidobacterium, Lactobacillus, Enterococcus, Clostridium та Аkkermansia. Мукозна мікробіота відіграє дуже велику роль у підтриманні гомеостазу через її тісний контакт з кишковим епітелієм та імунну активність слизової оболонки кишечнику [3].
Кишковий мікробіом сприяє перетравленню поживних речовин, підтримує метаболічні функції, стимулює імунну систему, захищає організм хазяїна від різноманітних патогенів. Дистальний відділ кишечнику можна назвати своєрідним «анаеробним біореактором» з високою метаболічною активністю – її можна порівняти з такою печінки. Саме тому мікробіоту вважають реальним органом: він отримує, зберігає та перерозподіляє енергію, сприяє перебігу фізіологічно важливих хімічних процесів і перетворень, здатний самостійно підтримувати свій склад і чисельність, а також відновлюватися завдяки самореплікації. Як і всі органи тіла людини, мікробіота виконує цілу низку важливих функцій (рис. 2).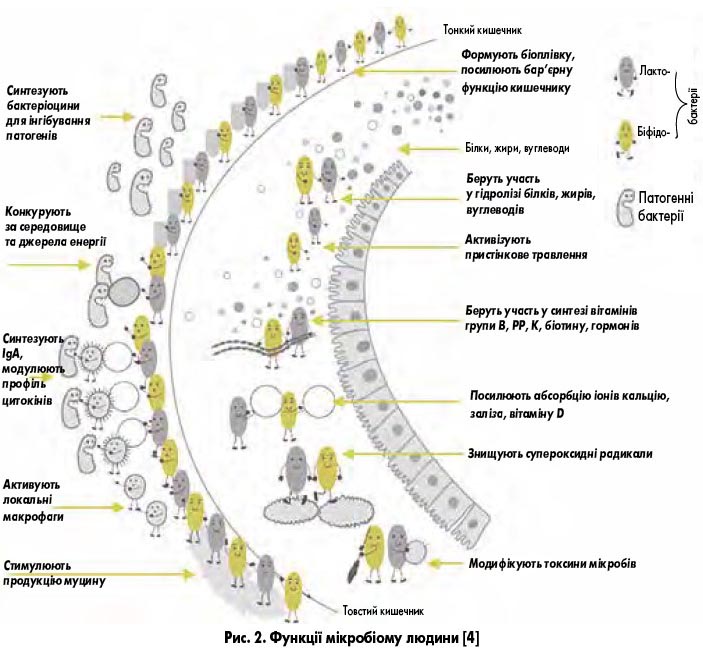
Відомо, що мукозна флора підвищує колонізаційну резистентність стінки кишечнику, запобігаючи її заселенню патогенними мікроорганізмами, та здатна вибірково пригнічувати ріст і розмноження багатьох із них. Доведено, що кишковий мікробіом виконує такі функції:
- посилює фагоцитарну активність макрофагів, моноцитів і гранулоцитів, збільшує синтез секреторного імуноглобуліну (Ig) A, цитокінів і підтримує роботу інших імунокомпетентних органів;
- бере участь у порожнинному травленні, перетравлюючи ті речовини, які не могли бути перетравлені у тонкому кишечнику, посилює перистальтику травного тракту та сприяє підвищенню активності травних ферментів;
- продукує низку гормоноподібних речовин, може регулювати секрецію гормонів іншими ендокринними органами;
- формує нормальну слизову оболонку кишечнику (бере участь у фізіологічному запаленні слизової оболонки та заміні епітелію), забезпечуючи її функціонування;
- бере участь в обміні ліпідів, білків, стероїдних гормонів, холестерину та жовчних кислот;
- забезпечує організм людини різними вітамінами (В1, В2, В6, В12, К; нікотинова, пантотенова, фолієва кислоти);
- впливає на вивільнення кортизолу (гормону надниркових залоз, який синтезується завдяки сигналам гіпоталамуса та гіпофіза);
- проявляє антимутагенну та антиканцерогенну активність;
- впливає на функцію мозку та поведінкові реакції [1, 3-6].
Фактори, що впливають на мікробіом
Склад і функціональна активність мікробіому може змінитися під впливом різноманітних факторів. Перша масивна колонізація кишечнику у немовлят залежить від способу народження (вагінальні пологи або кесарів розтин), типу харчування (грудне, змішане або штучне вигодовування), прийому ліків та антибіотиків, рівня гігієни, впливу навколишнього середовища та генетичного фону. У дорослих на стан і функції мікробіому впливають їжа та деякі харчові компоненти (забруднюючі речовини та харчові добавки), використання про-, пре-, синбіотиків, тривала антибіотикотерапія, зловживання алкогольними напоями. Стрес, патологія травного тракту, спосіб життя, інфекційні захворювання чинять значний вплив на мікробіоту [3]. Небезпечні та нераціональні харчові звички негативно позначаються на складі та функціональній активності мікробіоти.
Інтестинальний дисбіоз
Нобелівський лауреат Ілля Мечников стверджував: «Більшість захворювань починається у травному тракті, коли «хороші» бактерії не можуть контролювати «погані» бактерії, що призводить до розвитку дисбіозу». Нині переконливо доведено, що батько вітчизняної імунології мав рацію: порушення рівноваги в екосистемі кишечнику призводить до домінування потенційно патогенних мікробів над корисними мікроорганізмами, зменшення загальної мікробної різноманітності.
Інтестинальний дисбіоз деякі автори класифікують на дефектний, гнильний, ферментативний, грибковий і дисбіоз, асоційований з порушенням чутливості [3]. Дефектний дисбіоз характеризується зменшенням загальної кількості корисних бактеріальних видів/штамів (наприклад, лактобактерій і/або біфідобактерій); він розвивається внаслідок дотримання нераціональної дієти, тривалої антибіотикотерапії або може бути пов’язаний з непереносимістю їжі внаслідок дефіциту травних ферментів (молока чи м’яса). Гнильний дисбіоз отримав свою назву через зростання при ньому кількості гнильних бактерій (переважно бактероїдів) у разі споживання великої кількості жирів, м’яса та незначному вживанні харчових волокон. Перетравлювання такої їжі відбувається з утворенням аміаку, амінів і фенолів, саме вони можуть стати причиною появи позакишкових симптомів і вплинути на стан всього організму. У деяких випадках дисбіоз асоціюється із синдромом надмірного бактеріального росту у тонкому кишечнику, тоді його називають ферментативним. Ферментативний дисбіоз часто спостерігається при синдромі подразненого кишечнику (СПК), після проведення антибіотикотерапії або у разі незначного споживання вуглеводів. Дисбіоз, асоційований зі зниженням або втратою толерантності імунної системи до інтестинальної мікробіоти, проявляється виникненням аномальної імунної відповіді на компоненти кишкового мікробіому. При цьому типі дисбіозу порушення екосистеми кишечнику характеризується зменшенням кількості пробіотичних бактерій, збільшенням числа потенційних патогенів, зміною рухомості кишечнику, запаленням його стінки. Грибковий дисбіоз характеризується надмірним розвитком представників роду Candida або інших грибів у кишковій мікробіоті, цьому сприяє дієта з великим умістом цукру та низьким – харчових волокон.
У різних клінічних дослідженнях встановлено, що дисбіоз кишечнику пов’язаний із виникненням або прогресуванням різноманітних захворювань: СПК, бронхіальної астми, харчової алергії, запальних захворювань кишечнику (виразкового коліту, хвороби Крона), цукрового діабету 2 типу, метаболічного синдрому, атеросклерозу, патології печінки, аутизму, целіакії, хвороби Паркінсона, неопластичних процесів, депресії, шизофренії, аутоімунних захворювань.
Відновлення балансу екосистеми кишечнику
Доведено, що при виникненні дисбіозу мікробіота не може належним чином виконувати свої численні функції, що позначається на функціональний активності багатьох органів. Тому наукове співтовариство визнало важливість підтримання балансу кишкової мікробіоти задля підтримання належного рівня здоров’я. З метою відновлення та/або підтримання еубіотичного стану кишкової мікробіоти використовують декілька терапевтичних стратегій: прийом пробіотиків (які сприяють витісненню потенційно патогенних бактерій і відновленню балансу), пребіотиків (нутрієнти, що переважно або винятково метаболізуються пробіотичними бактеріями) та синбіотиків; також застосовують фаготерапію, фекальну трансплантацію та трансплантацію бактеріального консорціуму.
Пробіотики, пребіотики та синбіотики
Всесвітня гастроентерологічна організація (ВГО) у своєму практичному керівництві «Пробіотики та пребіотики» (2017) наводить такі дефініції пробіотиків та пребіотиків:
- пробіотики – живі мікроорганізми, прийом яких в адекватній кількості чинить позитивний вплив на стан здоров’я людини;
- пребіотики – селективно ферментовані інгредієнти, які утворюються при специфічних змінах у складі і/або активності шлунково-кишкової мікробіоти, і, таким чином, справляють позитивний вплив на стан здоров’я людини;
- синбіотики – продукти, які містять пробіотики та пребіотики та позитивно впливають на стан здоров’я людини.
Пробіотики використовують для запобігання розвитку дисбіозу при впливі провокувальних факторів, а також як терапевтичне втручання з метою корекції вже наявного дисбіозу. Серед низки необхідних вимог, що пред’являються до пробіотичних штамів, найголовнішими є:
- належність до GRAS-мікроорганізмів (generally regarded as safe; загалом визнані безпечними);
- перебування в активному та життєздатному стані при потраплянні у кишкове середовище;
- висока резистентність до впливу кислого вмісту шлунка та лужного – дванадцятипалої кишки (жовч, секрет підшлункової залози).
Корисні ефекти пробіотичних штамів умовно поділяють на імунологічні та неімунологічні. Імунологічні переваги включають активацію місцевих макрофагів, збільшення продукції імуноглобулінів, модуляцію профілів цитокінів та індукцію гіповідповіді на харчові антигени. Неімунологічні ефекти включають поліпшення процесу травлення, конкуренцію з потенційними патогенами за нутрієнти та місця адгезії, зміну рН, продукцію бактеріоцинів. Пробіотикам також притаманні протипухлинні властивості. Вони діють як антимутагени та можуть впливати на різні стадії канцерогенезу.
Нині у клінічній практиці досить активно використовують лакто- та біфідобактерії, ентерококи, дріжджі Saccharomyces boulardii, молочні пропіонобактерії, штами Bacillus spp. та грамнегативний штам Escherichia coli Nissle 1917. Лактобактерії є модуляторами активності кишкового запалення та агресивності імунної відповіді. Прийом лактобактерій рекомендований при різноманітних гастроентерологічних захворюваннях, що характеризуються високою активністю запального процесу, а також з профілактичною метою для запобігання розвитку діареї, інфекційних захворювань, спровокованих кишковими патогенами. Лактобактерії призначають немовлятам, що страждають від кольок, з профілактичною або лікувальною метою.
Біфідобактерії здатні продукувати вітаміни, ензими, оцтову та молочну кислоти. Вони знижують рН товстої кишки, інгібують збудників різноманітних захворювань та активують імунну систему. Доведено, що пероральний прийом Bifidobacterium bifidum асоційований з пригніченням вироблення специфічного IgЕ та підвищенням рівня IgА, що використовується при різноманітних алергічних захворюваннях. Біфідобактерії домінують у мікробіоті немовлят, які перебувають на грудному вигодовуванні. Наявність цих пробіотичних штамів позитивно корелює з добрим самопочуттям і задовільним станом здоров’я. Кишкова мікробіота немовлят, що перебувають на змішаному або штучному вигодовуванні, навпаки характеризується зменшенням кількості біфідобактерій і збільшенням представників виду Bacteroides та Escherichia coli. Поява цих штамів у кишковій мікробіоті асоціюється зі зростанням ризику розвитку кольок та інших порушень кишкового тракту.
Деякі штами ентерококів, а саме Enterococcus faecium, використовуються як пробіотики. Доведено, що E. faecium впливає на структуру мікробіома кишечнику, регулює активність імунної системи, інгібує ріст деяких кишкових патогенів, сприяє синтезу молочної кислоти. Наприклад, у деяких джерелах описані E. faecium M‑74 і E. faecium SF68 – два комерційно доступні пробіотичні штами. Науковцями відзначено, що E. faecium SF68 відіграє важливу роль у зниженні періоду відновлення гострої діареї та зниженні рівня холестерину в крові [11]. Інші дані присутні в літературі щодо антибактеріальної активності E. faecium у відношенні до Vibrio cholerae та інших патогенів [12]. Слід зауважити, що E. faecium не належить до GRAS-мікроорганізмів, тому деякі автори сумніваються у доцільності його клінічного застосування. Вчені упереджено ставляться до E. faecium, вважаючи, що якщо інші представники роду ентерококів можуть провокувати розвиток деяких інфекційних захворювань, то клінічне застосування окремого з них не є безпечним, незважаючи на відсутність даних про патогенну дію зазначеного штаму.
Пребіотики можна порівняти зі специфічним «паливом», яке допомагає існувати та рости пробіотичним бактеріям. Пребіотики становлять собою переважно дієтичні компоненти продуктів харчування та містяться у печиві, кашах, шоколаді, спредах, молочних продуктах. Найбільш відомі пребіотики – це олігофруктоза, інулін, галактоолігосахариди, лактулоза, олігосахариди грудного молока. У клінічній практиці деякі пребіотики використовують самостійно, наприклад, лактулозу застосовують для усунення запорів і печінкової енцефалопатії. Пребіотики зазвичай вводять до складу синбіотичних продуктів, які містять пробіотичні бактерії, з метою забезпечення їх швидкого росту в кишковому середовищі. Такі пребіотики, як правило, у незміненому вигляді можуть досягнути товстої кишки, де вони частково метаболізуються пробіотичними штамами. Перетравлення пребіотиків зазвичай супроводжується значним зниженням рН, що створює несприятливе середовище для росту патогенних бактерій (наприклад, клостридій).
Синбіотики володіють усіма властивостями, притаманними пробіотикам і пребіотикам, котрі входять до їх складу.
Особливості клінічного застосування про-, пре- та синбіотиків
В еру доказової медицини майже усі рішення про призначення та відміну медикаментів приймають на основі практичних рекомендацій, сформованих за результатами різноманітних метааналізів, систематичних оглядів і рандомізованих клінічних досліджень. Існують декілька відомих міжнародних практичних керівництв, що регулюють особливості терапії про-, пре- та синбіотичними препаратами. Найбільш відомі практичні рекомендації ВГО «Пробіотики та пребіотики» (2017), у яких наведені сучасні дані щодо безпеки, ефективності та доцільності застосування зазначених засобів.(табл.) [5].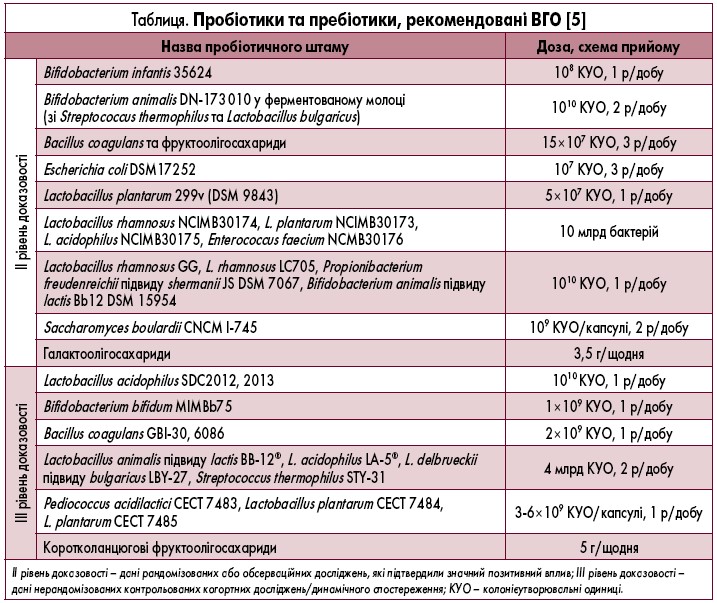
Підкреслюючи переваги деяких препаратів, експерти ВГО визнають: «Зменшення абдомінального метеоризму та здуття живота при СПК – це незмінний результат застосування пробіотиків; деякі штами мають властивість зменшувати біль та забезпечувати поліпшення самопочуття, якості життя пацієнтів з функціональним абдомінальним болем».
Підтримку клінічного застосування пробіотиків можна знайти у положеннях Римського консенсусу IV: «Пробіотики модифікують мікробіоту, поліпшують імунну та бар’єрну функції слизової оболонки кишечнику, а також дію нейроендокринних клітин та ферментацію… Bifidobacterium infantis 35624 значно зменшує абдомінальний біль/дискомфорт, здуття і/або утруднену перистальтику кишечнику порівняно з плацебо» [6].
Нині пробіотики використовують для лікування гострої та антибіотикасоційованої діареї, профілактики Clostridium difficile-асоційованої діареї, підвищення ефективності ерадикаційної терапії, а також при печінковій енцефалопатії, неалкогольній жировій хворобі печінки, в тому числі неалкогольному стеатогепатиті, СПК, функціональному запорі, дивертикулярній хворобі, асоційованому з прийомом нестероїдних протизапальних препаратів ураженні тонкого кишечнику, запальних захворюваннях кишечнику (виразковому коліті).
Вибір клініциста
Нині на вітчизняному фармацевтичному ринку представлена велика кількість пробіотичних препаратів. Серед цього різноманіття виділяється торгова марка Лінекс® (Sandoz, Словенія), до складу якої входять декілька вартих уваги комбінацій пробіотиків, у тому числі з додаванням пребіотика. Зазначений препарат має декілька форм випуску.
Одна капсула Лінекс® містить не менше ніж 1,2×107 КУО антибіотикорезистентних молочнокислих бактерій: L. acidophilus (sp. L. gasseri) (не менше ніж 4,5×106 КУО), B. іnfantis (не менше ніж 3 ×106 КУО) та E. faecium (не менше ніж 4,5×106 КУО). Показаннями до застосування є, зокрема, й запобігання та лікування діареї, спричиненої вірусними та бактеріальними інфекціями, включаючи ротавірусну.
У Лінекс Форте® кількість пробіотичних бактерій збільшена: L. acidophilus (не менше ніж 1×109 КУО) та Bifidobacterium animalis підвиду lactis BB‑12 (не менше ніж 1×109 КУО), крім цього, додатково введений унікальний пребіотичний комплекс – Beneo® Synergy, що складається з двох пребіотиків: інуліну та олігофруктози.
Таке різноманіття складу дозволяє диференційовано призначати цей синбіотичний препарат, за необхідності (наявності тяжкої клінічної симптоматики, обтяженого анамнезу, дії декількох провокувальних факторів) підвищуючи дозу пробіотичних штамів і використовуючи пребіотик. Ефективність і безпечність штамів, що входять до складу Лінекс® та Лінекс Форте®, доведена у багатьох клінічних дослідженнях [7-10].
Ми поділяємо думку вітчизняних і зарубіжних вчених щодо доцільності клінічного застосування найбільш фізіологічних, безпечних і ефективних пробіотичних і синбіотичних препаратів, а саме – лінійки препаратів Лінекс®. Адже, до їх складу входять пробіотичні бактерії, котрі є представниками нормальної кишкової мікробіоти, продукують молочну кислоту, підтримують та регулюють фізіологічну рівновагу мікрофлори та сприяють відновленню порушеного балансу мікроорганізмів у кишечнику у випадках діареї, здуття та інших порушень з боку травного тракту, спричинених вірусними або бактеріальними інфекціями та діареєю, зумовленою застосуванням антимікробних засобів.
Список літератури знаходиться в редакції.
Інформація для спеціалістів сфери охорони здоров’я.
4-64-ЛИН-ОТС‑0918
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (49), жовтень 2018 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...




