Сучасний погляд на курацію пацієнтів зі змішаними аутоімунними хворобами печінки
 Аутоімунний печінковий перехресний синдром (ПС), або оверлап-синдром характеризується проявом в одного і того ж хворого ознак двох різних аутоімунних захворювань печінки, які, найімовірніше, мають спільний генез [5, 17]. Аутоімунний гепатит (АІГ), як найчастіша складова змішаних аутоімунних хвороб печінки, має два основних варіанти фенотипу, у яких прояви класичного захворювання змішуються з симптомами первинного біліарного холангіту (ПБХ) або первинного склерозуючого холангіту (ПСХ). Значно рідшим є варіант поєднання ПБХ і ПСХ [3, 16].
Аутоімунний печінковий перехресний синдром (ПС), або оверлап-синдром характеризується проявом в одного і того ж хворого ознак двох різних аутоімунних захворювань печінки, які, найімовірніше, мають спільний генез [5, 17]. Аутоімунний гепатит (АІГ), як найчастіша складова змішаних аутоімунних хвороб печінки, має два основних варіанти фенотипу, у яких прояви класичного захворювання змішуються з симптомами первинного біліарного холангіту (ПБХ) або первинного склерозуючого холангіту (ПСХ). Значно рідшим є варіант поєднання ПБХ і ПСХ [3, 16].
Етіологія хронічних захворювань печінки, перебіг яких характеризується наявністю ПС, до теперішнього часу не вивчена. Розглядається фактор спадкової схильності, а також ціла низка тригерних механізмів, здатних запустити кожне з двох захворювань, які включені в ПС. Патогенні механізми, що відповідають за поєднаний перебіг аутоімунних захворювань печінки, до кінця не зрозумілі. На жаль, на сучасному етапі ми не маємо стратегій лікування, ефективність яких є доведеною. Останній факт, передусім, пов’язаний із невеликою поширеністю цих захворювань і ще більш рідкісним їх поєднанням [6, 12]. Частота перехресту АІГ із ПБХ становить 1-14,2%, а частота перехресту з АІГ з ПСХ – 1,4-17% [4, 8, 10]. Згідно з даними останніх досліджень вважається, що поширеність істинного оверлап-синдрому з наявністю ПБХ, який чітко відповідає сучасним критеріям, становить не більше 2% [8]. Визначення ПС необхідне переважно для ідентифікації пацієнтів, які погано реагують на стандартне лікування.
Найчастішим варіантом ПС є поєднання АІГ і ПБХ, що може спостерігатися у двох варіантах: одночасному та послідовному [16, 17]. При одночасному ознаки обох захворювань виникають майже в один той самий час. При другому варіанті є 2 різновиди. Один із них характеризується початком захворювання з ознаками АІГ, після чого з’являються ознаки ПБХ із серологічними маркерами (антимітохондріальні антитіла до піруватдегідрогеназного комплексу – АМА-М2) і біохімічними змінами у вигляді зростання рівня ферментів холестазу. За іншого варіанту послідовного ПС спочатку у пацієнтів виникає клінічна картина ПБХ, після чого з’являються ознаки АІГ (високий цитоліз, позитивні антинуклеарні антитіла, антигладеньком’язові антитіла тощо) [5, 16]. У двох дослідженнях показано, що близько у 2,5% хворих на ПБХ розвивається гострий АІГ, але за даними найбільшого дослідження встановлено, що тільки у 8 з 1476 пацієнтів з ПБХ пізніше розвинувся АІГ [6, 8].
Враховуючи специфічні особливості ведення таких хворих, важливість правильного та своєчасного визначення наявності оверлап-синдрому складно переоцінити. Тому треба знати та використовувати стандартні міжнародні критерії. Найбільш часто застосовуваною та рекомендованою всіма останніми міжнародними настановами є система під назвою «Паризькі критерії» [5, 7, 16]. Відповідно до цієї системи діагноз ПС ПБХ/АІГ при початковому розвитку ПБХ вимагає наявності двох із таких трьох діагностичних критеріїв:
рівень аланінамінотрансферази мінімум у 5 разів перевищує верхню межу норми (ВМН);
показник IgG щонайменше в 2 рази вищий за ВМН та/або позитивний тест на антитіла до гладеньком’язових клітин;
наявність ознак помірного або тяжкого інтерфейсного гепатиту* за даними гістологічного дослідження біоптату печінки.
Діагноз ПС ПБХ/АІГ при початковому розвитку АІГ вимагає наявності двох із таких трьох діагностичних критеріїв:
- активність лужної фосфатази ≥2×ВМН або гамма-глутамілтрансферази ≥5×ВМН;
- наявність АМА;
- виражені ураження жовчних проток у біопсії препарату печінки.
Встановлено, що ці критерії з високою чутливістю (92%) і специфічністю (97%) дозволяють виявити пацієнтів із клінічним діагнозом варіанта АІГ-ПБХ [6, 12].
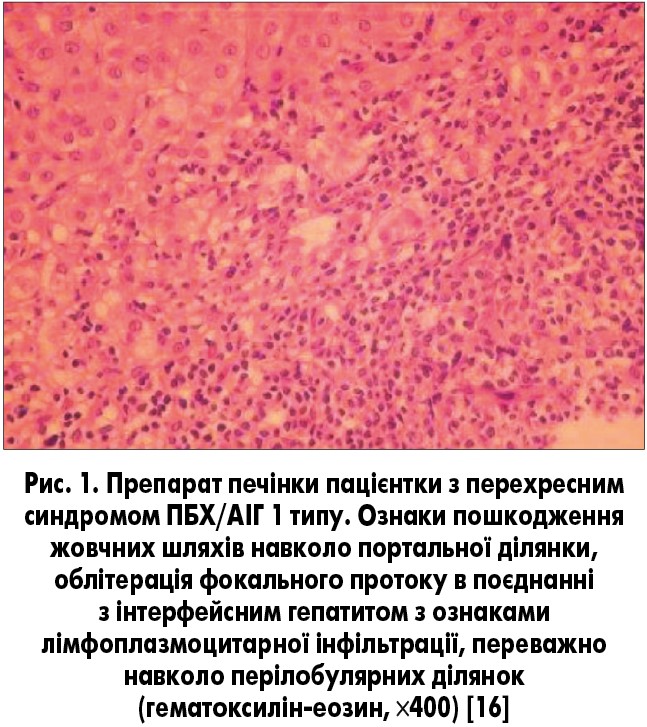 Важливо, що термін «перехресний синдром» не повинен стосуватися пацієнтів з ПБХ, у яких виявляються позитивні лабораторні маркери АІГ, і легким ступенем інтерфейсного гепатиту (рис. 1), оскільки такі ознаки можуть зустрічатися при ПБХ [6, 12].
Важливо, що термін «перехресний синдром» не повинен стосуватися пацієнтів з ПБХ, у яких виявляються позитивні лабораторні маркери АІГ, і легким ступенем інтерфейсного гепатиту (рис. 1), оскільки такі ознаки можуть зустрічатися при ПБХ [6, 12].
За наявності ознак ПС перебіг захворювання є більш тяжким, ніж при наявності однієї хвороби, і характеризується вищою частотою поширеного фіброзу на момент встановлення діагнозу (навіть у пацієнтів молодого віку). Клінічний перебіг ПС (АІГ/ПБХ), як правило, більшою мірою визначається АІГ. Темпи прогресування в цьому випадку вищі, ніж при ізольованому ПБХ, та зумовлені вираженістю запально-некротичних змін у паренхімі печінки [5, 17].
На етапі сформованого цирозу печінки встановити діагноз ПС за гістологічною картиною тканини печінки майже неможливо. У цьому випадку клінічне значення має своєчасна й адекватна корекція ускладнень цирозу печінки [5]. У більшості публікацій відзначається також несприятливий прогноз щодо біохімічної відповіді на прийом урсодезоксихолевої кислоти (УДХК), прогресування фіброзу і смерті, пов’язаної з печінковою недостатністю [6].
Незважаючи на відсутність контрольованих досліджень, у рекомендаціях Європейської асоціації з дослідження печінки (EASL) на підставі результатів невеликих досліджень зазначено про необхідність додавання кортикостероїдів (преднізолону або будесоніду) або на момент встановлення діагнозу ПС, або d разі недостатньої біохімічної відповіді після 3 міс застосування УДХК [6, 7, 16]. Цікавими є результати великого багатоцентрового дослідження E. Ozaslan (2014) за участю 88 пацієнтів, у ході якого 30 хворих як терапію першої лінії отримували УДХК, 58 – комбінацію УДХК та імунодепресантів (преднізон±азатіоприн). У пацієнтів із помірним перипортальним гепатитом ефективність монотерапії УДХК і комбінованої терапії, судячи з біохімічної відповіді, була подібною (80%), тоді як у хворих на гепатит тяжкого ступеня ефективність монотерапії УДХК була значно нижчою (14 vs 71%). Наявність поширеного фіброзу була пов’язана з відсутністю відповіді на комбіновану терапію, але не на монотерапію УДХК. У результаті терапії другої лінії імуносупресивними препаратами (циклоспорином, такролімусом і мікофенолату мофетилом) досягнуто біохімічної ремісії у половини пацієнтів з відсутністю відповіді на початкову імуносупресію [14]. Ці дані свідчать на користь доцільності застосування комбінації УДХК та імунодепресантів як терапії першої лінії у пацієнтів із ПБХ і тяжким перісептальним гепатитом.
Існує думка, що при тривалому лікуванні за наявності відповіді дозу імуносупресивних препаратів можна зменшити, а частота успішного припинення лікування є вищою, ніж при класичному АІГ [6]. У пацієнтів із ПБХ, у яких розвивається АІГ (послідовний варіант) та які отримували УДХК, необхідно застосовувати імунодепресанти [6, 8, 18].
В останніх рекомендаціях щодо терапії ПСХ пропонується розглядати обетіхолеву кислоту як препарат, що використовується при недостатній ефективності УДХК. Слід зазначити, що стосовно ПС ПБХ/АІГ такої рекомендації немає [6, 18].
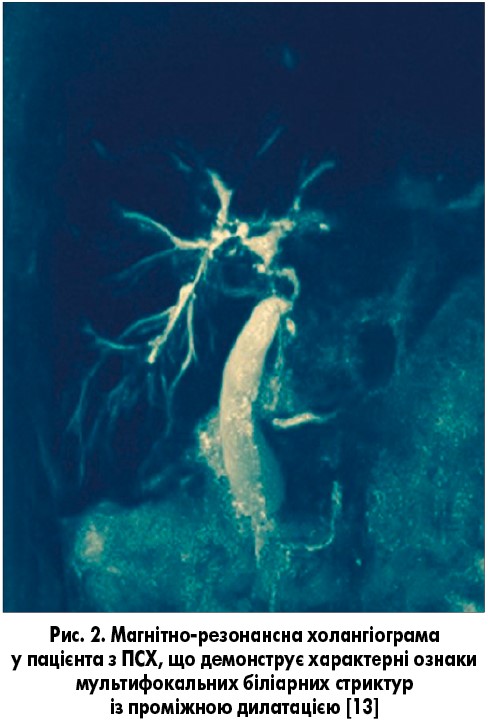 ПС ПСХ/АІГ переважно зустрічається у дітей, підлітків і дорослих молодого віку [1, 9]. Синонімом є термін «аутоімунний склерозуючий холангіт». Його характеристики включають клінічні, біохімічні та гістологічні особливості АІГ і холангіографічні ознаки, характерні для ПСХ (рис. 2) [8, 9]. Ретроспективна діагностика ПС ПСХ/АІГ, згідно з сучасними критеріями, дозволила встановити його наявність у 1,4-17% пацієнтів [13]. У дітей і підлітків з ПС ПСХ/АІГ частіше виявляли хронічні запальні захворювання кишечнику, вони частіше були позитивними за показником p-ANCA у сироватці, ніж ті, хто має тільки АІГ. Трансамінази сироватки зазвичай є вищими при АІГ, але лабораторні показники холестазу можуть бути нормальними при оверлап-синдромі ПСХ/АІГ [1].
ПС ПСХ/АІГ переважно зустрічається у дітей, підлітків і дорослих молодого віку [1, 9]. Синонімом є термін «аутоімунний склерозуючий холангіт». Його характеристики включають клінічні, біохімічні та гістологічні особливості АІГ і холангіографічні ознаки, характерні для ПСХ (рис. 2) [8, 9]. Ретроспективна діагностика ПС ПСХ/АІГ, згідно з сучасними критеріями, дозволила встановити його наявність у 1,4-17% пацієнтів [13]. У дітей і підлітків з ПС ПСХ/АІГ частіше виявляли хронічні запальні захворювання кишечнику, вони частіше були позитивними за показником p-ANCA у сироватці, ніж ті, хто має тільки АІГ. Трансамінази сироватки зазвичай є вищими при АІГ, але лабораторні показники холестазу можуть бути нормальними при оверлап-синдромі ПСХ/АІГ [1].
Таким чином, у пацієнтів з АІГ, які мають ознаки холестазу та/або є стійкими до імуносупресії, слід виключати ПС ПСХ/АІГ.
При оверлап-синдромі ПСХ/АІГ також використовувалася УДХК в поєднанні з імуносупресивними схемами [9]. Таких пацієнтів лікували з УДХК (15-20 мг/кг/добу), преднізолон (0,5-1 мг/кг/добу і 50-75 мг азатіоприну з хорошою біохімічною реакцією.
При проведенні початкового лікування пацієнт із ПС ПСХ/АІГ часто відповідає на іммуносупресивну терапію [1, 13]. Лабораторні показники в більшості випадків нормалізуються протягом кількох місяців лікування, хоча довгостроковий прогноз є гіршим, ніж при ізольованому АІГ, оскільки ураження жовчних протоків продовжує прогресувати приблизно у 50% пацієнтів.
Оптимальна тривалість імуносупресивної терапії не визначена, але її припинення можливе лише при значному зменшенні запального процесу за даними гістологічного дослідження. Відповідь на лікування можна контролювати, оцінюючи концентрацію IgG і титри аутоантитіл, коливання яких корелюють з активністю захворювання [5, 6, 16]. Важливо відмітити, що відсутність сироваткових аутоантитіл не виключає ризик розвитку рецидиву. Встановлено, що повна відміна лікування в перші 2 роки зазвичай супроводжується рецидивами [6, 17]. Таким чином, про повне припинення лікування може йтися тільки після фіксації стабільно нормальних функціональних проб печінки протягом 1-2 років, нормальних рівнів IgG і негативних титрів аутоантитіл при відсутності запальної активності за даними біопсії печінки.
Відносно нещодавно почали виділяти окреме захворювання, яке потребує дуже ретельної диференційної діагностики з ПСХ. Це імуноглобулін G4-асоційований холангіт (IgG4-АХ). На цей час IgG4-АХ розглядається як прояв IgG4-асоційованого склерозуючого захворювання та діагностується на підставі сукупної оцінки характерних клінічних, рентгенографічних, серологічних, гістологічних та імуногістохімічних ознак [2]. При цьому гістопатологічним дослідженням надається першочергове значення. Виявлення трьох основних гістологічних ознак (щільного лімфоплазматичного інфільтрату, багатоярусного фіброзу і облітеруючого флебіту) дозволяє вчасно діагностувати захворювання. А при збільшенні співвідношення IgG4-позитивних плазматичних клітин (ППК) / IgG-ППК >40% діагноз IgG4-асоційованого склерозуючого захворювання не підлягає сумніву [2, 9].
IgG4-АХ являє собою біліарне захворювання невідомої етіології, що має біохімічні та холангіографічні особливості, які не відрізняються від ПСХ, найчастіше супроводжується позабіліарними проявами, реагує на терапію кортикостероїдами, часто асоціюється з аутоімунним панкреатитом і характеризується підвищенням сироваткового IgG4 та інфільтрацією IgG4-ППК у жовчних протоках і тканині печінки [2]. На відміну від ПСХ, IgG4-АХ не пов’язаний із запальними захворюваннями кишечнику. Попередні дані свідчать про те, що імунопатогенез IgG4-АХ відрізняється від інших аутоімунних холестатичних захворювань печінки, таких як ПСХ і ПБХ. Переважно зустрічається у чоловіків, середній вік при встановленні діагнозу – 60 років.
Були запропоновані критерії IgG4-АХ [11]. Для встановлення такого діагнозу пацієнт із біліарною стриктурою, що локалізована у внутрішньопечінкових, проксимально позапечінкових і/або інтрапанкреатичних жовчних протоках, повинен мати:
- нещодавнє панкреатичне/біліарне хірургічне втручання в анамнезі,
- або гістологічні ознаки аутоімунного панкреатиту (AIП) / IgG4-АХ,
- або класичні ознаки AIП і підвищений IgG4,
- або два з наведених критеріїв (підвищення IgG4 у сироватці крові; типові рентгенологічні дані ураження підшлункової залози; інші ознаки ураження органів, включаючи склерозуючий сіалоаденіт, ретроперитонеальний фіброз, абдомінальну лімфаденопатію з інфільтрацією IgG4-ППК; >10 IgG4-ППК у біоптатах жовчних проток), а також адекватну відповідь на 4-тижневий курс лікування кортикостероїдами, що дозволяє видалення стента без рецидиву обструктивного холестазу, щоб досягти зниження печінкових показників <2 ВМН і зменшення IgG4 і CA 19-9 [9].
На противагу молодим пацієнтам із ПС ПСХ/АІГ у більшості хворих на IgG4-АХ захворювання дебютує у старшому віці (60 років) жовтяницею (77%) та клінічними проявами АІП (92%). Стриктури виявляються при магнітно-резонансній холангіопанкреатографії або ендоскопічній ретроградній холангіопанкреатографії ізольовано в інтрапанкреатичній ділянці Вірсунгової протоки у 51% хворих. В інших випадках вони розташовані у жовчовивідних протоках. Рівень сироваткового IgG4 значно вищий, ніж при ПСХ. У разі наявності ПСХ холангіографічні особливості проявляються у вузлуватих стриктурах жовчних проток, що мають вигляд дерева з обрізаними гілками, тоді як пацієнти з IgG4-АХ мають сегментарні стриктури і звуження дистальної третини загальної жовчної протоки. При гістологічному вивченні печінки виявляється облітеруючий фіброзний холангіт тільки у хворих на ПСХ; при IgG4-АХ він спостерігається рідко. На відміну від ПСХ для IgG4-АХ типовою є виражена інфільтрація IgG4-ППК портальних трактів печінки [2, 9].
Холангіографічні дослідження у більшості випадків не виявляють поліпшення при ПСХ після стероїдної терапії, на відміну від IgG4-АХ. Крім того, холангіокарцинома розвивається у 10-30% хворих на ПСХ і не характерна для IgG4-АХ [2, 9].
Показано, що імуносупресивне лікування помітно впливає на запальну активність IgG4-АХ, при цьому тривалої ремісії можна досягти вже через 3 міс лікування. Проте тяжкість захворювання може впливати на довгостроковий ефект. Ретроспективний аналіз показав, що пацієнти зі змінами проксимальних позапечінкових і внутрішньопечінкових жовчних проток мають вищий ризик рецидиву після припинення лікування, ніж пацієнти зі стриктурами дистальної жовчної протоки [159]. Кортикостероїди розглядаються як препарати вибору при цьому захворюванні. Використання азатіоприну в дозі до 2 мг/кг/добу має розглядатися у хворих із проксимальними і внутрішньопечінковими стриктурами в разі недостатнього ефекту після терапії кортикостероїдами та при рецидиві. Лікування тривалістю 3 міс може бути достатнім для деяких пацієнтів, але тривала підтримувальна терапія низькими дозами може знадобитися при наявності високого ризику рецидиву [9, 11].
Трансплантація печінки показана пацієнтам із будь-яким типом ПС, якщо хвороба маніфестує за типом фульмінантної печінкової недостатності, і тим, у кого, незважаючи на лікування, розвивається термінальна стадія захворювання печінки. Після трансплантації рецидив АІГ описується в 12-46% випадків, а рецидив ПС ПСХ/АІГ – близько в 70% і частіше при наявності активного запального захворювання кишечнику. Діагностика рецидиву ґрунтується на зміні біохімічних показників, серопозитивності аутоантитіл, розвитку интерфейсного гепатиту за даними гістології та наявності холангіопатії при ПС ПСХ/АІГ. Рецидив може виникнути навіть через кілька років після трансплантації, а успіх лікування значною мірою залежить від ранньої діагностики [2, 6, 9, 16].
За наявності показань при ПСХ проводиться стентування жовчовивідних шляхів.
Таким чином, аутоімунні оверлап-синдроми є дуже складною проблемою сучасної гепатології. Багато в чому ці стани є недостатньо дослідженими, але вони являють собою клінічну реальність, яку необхідно приймати. Існує декілька напрямів подальшого розвитку терапії змішаних аутоімунних захворювань. По-перше, це продовження досліджень щодо виявлення й уточнення етіопатогенетичних чинників, що дозволить призначати відповідне лікування. По-друге, це розроблення і використання нових імуносупресивних агентів. По-третє, дуже важливим аспектом для будь-яких хронічних захворювань печінки, у тому числі ПС, є уповільнення прогресування фіброзу печінки, тому перспективною є розробка нових схем із використанням антифібротичних агентів. Діагностика та лікування таких станів мають проводитися відповідно до чинних міжнародних рекомендацій у спеціалізованих гепатологічних центрах.
Література
- Костырко Е.В., Шумилов П.В. Современные методы лечения детей с аутоиммунными заболеваниями печени // Педиатрическая фармакология. – 2015. – № 12 (6). – С. 679-685.
- Степанов Ю.М., Гайдар Ю.А. Імуноглобулін G4-асоційовані склерозуючі захворювання органів травлення // Журнал НАМН України. – 2015, т. 21. – № 1. – С. 54-60.
- Boberg K.M., Chapman R.W., Hirschfield G.M. et al. Overlap syndromes: the International Autoimmune Hepatitis Group (IAIHG) position statement on a controversial issue. J Hepatol 2011; 54: 374-385.
- Bonder A., Retana A., Winston D.M. et al. Prevalence of primary biliary cirrhosis-autoimmune hepatitis overlap syndrome. Clin Gastroenterol Hepatol 2011; 9: 609-612.
- Czaja A.J. The overlap syndromes of autoimmune hepatitis. Dig Dis Sci. 2013; 58(2): 326-343.
- Chazouilleres O., Dalekos G., Drenth J. EASL Clinical Practice Guidelines: Autoimmune hepatitis J of Hepatol, 2015: 63.
- Chazouilleres O., Wendum D., Serfaty L. et al. Long term outcome and response to therapy of primary biliary cirrhosis-autoimmune hepatitis overlap syndrome. J Hepatol, 2006; 44: 400-406.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: management of cholestatic liver diseases. Journal of Hepatology 2009; 51: 237-267.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: The diagnosis and management of patients with primary biliary cholangitis. Journal of Hepatology 2017; 67: 145-172.
- European Association for the Study of the Liver. EASL Clinical Practice Guidelines: Management of cholestatic liver diseases. Journal of Hepatology 2009; 51: 237-257.
- Chapman R., Fevery J., Kalloo A. et al. Diagnosis and Management of Primary Sclerosing Cholangitis // Hepatology 2010; 51(2): 660-678.
- Ghazale A., Chari S.T., Zhang L. et al. Immunoglobulin G4-associated cholangitis: clinical profile and response to therapy. Gastroenterology 2008; 134: 706-715.
- Lindor K.D., Bowlus C.L., Boyer J. et al. Practice Guidance from the American Association for the Study of Liver Diseases: Primary Biliary Cholangitis Hepatology, 2018.
- Marchioni Beery R.M., Forouhar F., Vaziri H. Primary Biliary Cirrhosis and Primary Sclerosing Cholangitis: a Review Featuring a Women’s Health Perspective. J. Clin. Transl. Hepatol. 2014; 2, I.4: 266-284.
- Ozaslan E., Efe C., Heurgue-Berlot A. et al. Factors associated with response to therapy and outcome of patients with primary biliary cirrhosis with features of autoimmune hepatitis. Clin Gastroenterol Hepatol 2014; 12: 863-869.
- Pamfil C., Candrea E., Berki E. et al. Primary biliary cirrhosis – autoimmune hepatitis overlap syndrome associated with dermatomyositis, autoimmune thyroiditis and antiphospholipid syndrome J Gastrointestin Liver Dis 2015; 24(1): 101-104.
- Silveira M.G. Overlap syndromes of autoimmune liver disease. J Clin Cell Immunnol. 2013; 4: 4.
- Yokokawa J., Saito H., Kanno Y. et al. Overlap of primary biliary cirrhosis and autoimmune hepatitis: characteristics, therapy, and long term outcomes. J Gastroenterol Hepatol 2010; 25: 376-82.
- Zhang H., Li S., Yang J. et al. A meta-analysis of ursodeoxycholic acid therapy versus combination therapy with corticosteroids for PBC-AIH-overlap syndrome: evidence from 97 monotherapy and 117 combinations. Prz Gastroenterol 2015; 10: 148-55.
*Інтерфейсний гепатит (ступінчасті некрози, або перипортальний гепатит) характеризується проникненням запальних лімфоплазмоцитарних інфільтратів у паренхіму печінки з відділенням («відшнуруванням») і руйнуванням ізольованих гепатоцитів або їх невеликих груп.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 2 (52), травень 2019 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...




