Преимущества и недостатки различных стратегий профилактики НПВП-гастропатий
Нестероидные противовоспалительные препараты (НПВП) – одни из наиболее популярных медикаментов, которые регулярно принимают десятки миллионов пациентов во всем мире. Основными показаниями к применению НПВП являются артриты и другие мышечно-скелетные расстройства, ревматические заболевания, воспалительные состояния, острые и хронические болевые синдромы различного генеза, ишемическая болезнь сердца, цереброваскулярная патология.
Ежегодно в мире выписывается около 500 млн рецептов на НПВП, вместе с тем реальное число больных, которые принимают их без врачебного контроля, в несколько раз больше. Предполагается, что частота использования НПВП в будущем будет неуклонно возрастать, чему способствуют постарение населения (НПВП регулярно принимает 10-20% популяции в возрасте >65 лет), бесконтрольный свободный доступ к безрецептурным препаратам, широкое применение аспирина в качестве профилактического кардиопротектора.
К сожалению, широкое применение НПВП ограничено их неблагоприятными побочными эффектами, в первую очередь способностью вызывать повреждение слизистой оболочки желудочно-кишечного тракта (ЖКТ), включая развитие пептических язв желудка и/или двенадцатиперстной кишки (регистрируются примерно у 25-30% лиц, получающих НПВП в течение длительного времени) и их осложнений, чаще всего кровотечений и перфораций (возникают приблизительно у 2-4% принимающих НПВП). В США гастроинтестинальные побочные эффекты НПВП ежегодно приводят к госпитализации более чем 100 тыс. пациентов и обусловливают от 7 до 10 тыс. летальных исходов. В Великобритании НПВП являются основным классом лекарств, прием которых ассоциирован с развитием нежелательных эффектов (в среднем у 30% больных), а НПВП-индуцированные язвы и кровотечения стали причиной 61% случаев смерти, связанных с побочным действием медикаментов.
В настоящее время термином «НПВП-гастропатия» обозначают определяемое при эзофагогастродуоденоскопии повреждение слизистой оболочки желудка и/или двенадцатиперстной кишки с развитием эрозий, язв и угрожающих жизни осложнений (кровотечение, перфорация). К сожалению, значительная часть НПВП-гастропатий протекает малосимптомно либо асимптомно, нередко сразу манифестируя желудочно-кишечным кровотечением (ЖКК). Установлено, что около половины жизнеугрожающих ЖКК спровоцированы приемом НПВП.
Гастродуоденальная токсичность НПВП объясняется блокадой продукции гастропротекторных соединений, опосредованных циклооксигеназой (ЦОГ) 1 типа, таких как простагландин Е2 и простациклин. Существенной связи между способом введения НПВП (перорально, парентерально или ректально) и частотой развития эрозивно-язвенных поражений не выявлено, так как основной ульцерогенный эффект обусловлен системным токсическим действием НПВП. Высокоселективные ингибиторы ЦОГ-2 вызывают менее выраженные гастродуоденальные повреждения, чем неселективные НПВП, которые угнетают как ЦОГ-1, так и ЦОГ-2.
Факторы риска развития НПВП-гастропатий
По данным масштабного метаанализа, средний относительный риск гастроинтестинальных осложнений при приеме НПВП составляет 2,4, однако в группах высокого риска этот показатель многократно увеличивается. Эпидемиологические исследования свидетельствуют о том, что относительный риск возникновения НПВП-гастропатий и их осложнений повышается у лиц старше 65 лет (отношение шансов – ОШ – 4,7), при приеме высоких доз НПВП (ОШ 8,0), относительно коротком анамнезе их использования (менее 1 месяца, ОШ 7,2), на фоне терапии стероидами (ОШ 4,4) или антикоагулянтами (ОШ 12,7), в случае наличия сопутствующих кардиоваскулярных заболеваний (ОШ 1,84). Хотя риск НПВП-гастропатий через 3 мес приема НПВП снижается, полностью он не исчезает и при длительном применении все равно остается повышенным. В большом эпидемиологическом исследовании, проведенном в Испании, уровень смертности среди пациентов, принимающих НПВП, оказался равным 15,3 на 100 тыс. Около 50% участников, скончавшихся в течение периода наблюдения, имели один или несколько факторов риска, таких как пептическая язвенная болезнь (21,6%), желудочные кровотечения (15,3%), диспепсия (13,3%), кардиальная патология (65,1%), артериальная гипертензия (40%). Средний возраст умерших от осложнений, связанных с приемом НПВП и аспирина, составил 70±13,5 лет, а 89,7% были старше 60 лет.
Имеющиеся в литературе данные относительно роли Helicobacter pylori (Нр) при НПВП-гастропатиях носят противоречивый характер. Тем не менее последние исследования позволяют сделать вывод, что H. pylori является важным фактором риска развития НПВП-гастропатий. Так, по данным сравнительного метаанализа 16 рандомизированных клинических исследований (РКИ), инфекция H. pylori повышала вероятность возникновения язвенных кровотечений в 1,79 раза, прием НПВП – в 4,85 раза, а сочетание указанных факторов – в 6,13 раза, то есть имел место отчетливый аддитивный эффект.
В настоящее время при рассмотрении проблемы НПВП-гастропатий и их осложнений особо актуальным представляется применение низких доз аспирина (НДА; ≤325 мг/сут) в качестве антиагреганта с целью профилактики кардио- и цереброваскулярных осложнений. Чрезвычайно широкому использованию аспирина с кардиопротекторной целью способствует то, что многие фармацевтические компании рекламируют НДА (особенно формы, выпускающиеся в кишечнорастворимой оболочке или дополнительно включающие буферные гастропротекторные компоненты) как безопасные препараты для длительного применения. К сожалению, это не всегда соответствует истине, поскольку использование НДА даже при отсутствии других факторов риска сопровождается повышением вероятности НПВП-гастропатий и кровотечений. Это связано с тем, что аспирининдуцированная гастропатия лишь отчасти связана с локальным повреждающим влиянием препарата на слизистую оболочку желудка (преимущественно она обусловлена системным повреждающим действием лекарственного средства). Именно поэтому использование кишечнорастворимых форм ацетилсалициловой кислоты не может решить проблему безопасного приема НДА. Применение буферных форм аспирина (например, комбинация аспирина с антацидом) выглядит более предпочтительным, однако, в связи с тем что антациды имеют короткий период действия и защищают слизистую оболочку желудка только в течение 1-2 ч, это также не снимает вопрос предупреждения возникновения гастропатии.
Установлено, что изолированное применение НДА дозозависимо увеличивает риск развития кровотечения из верхних отделов ЖКТ с более чем 4-кратным возрастанием вероятности при дозе 300 мг/сут. Метаанализ 14 РКИ, охвативший 57 тыс. больных, принимавших НДА (75-325 мг ежедневно), показал увеличение относительного риска значительных ЖКК более чем в 2 раза. Исследование с участием пациентов, принимавших аспирин в кишечнорастоворимой оболочке (81 мг/сут), показало, что через 12 нед у 7,3% из них при эндоскопии обнаруживались язвы и эрозии. Данные другого исследования показали, что у 48% асимптомных пациентов, получавших аспирин (100 или 325 мг/сут) более чем 3 мес, развивались эндоскопически выявляемые язвы и эрозии.
В проспективном исследовании типа «случай – контроль», проведенном в Испании, оценивалось применение аспирина у пациентов, направленных в 4 госпиталя с язвенным кровотечением. После поправки на неизвестные факторы, потенциально способные повлиять на результаты испытания, было установлено, что использование НДА (≤300 мг/сут) было тесно связано с возникновением гастроинтестинального кровотечения (ОШ 6,5) и образованием пептических язв (ОШ 2,1). Применение ингибиторов протонной помпы (ИПП) у пациентов, принимавших НДА, было связано со значительно более низкой вероятностью таких осложнений (ОШ 0,4). Метаанализ 22 плацебо-контролируемых исследований с участием в общей сложности более 57 тыс. пациентов показал, что суммарная частота возникновения гастроинтестинальных кровотечений в группе плацебо составляла 0,12% в год, а применение НДА удваивало этот риск (относительный риск – ОР – 2,07). Прием аспирина повышал вероятность любого значительного кровотечения (гастроинтестинального или внутричерепного) в 1,7-2,1 раза по сравнению с соответствующим показателем на фоне плацебо. При сравнении терапии аспирином в дозе от 162 до 325 мг/сут с таковой при использовании дозировки 75-162 мг/сут данных о повышении риска кровотечения не выявлено.
Таким образом, ни НДА, ни покрытый кишечнорастворимой оболочкой или буферизованный аспирин не показали преимуществ в снижении частоты возникновения гастроинтестинальных осложнений.
К сожалению, большая часть пациентов, принимающих НДА, являются пожилыми людьми и имеют множественную коморбидную патологию, в частности кардиальную, и нередко принимают не только НДА, но и НПВП, стероиды или антикоагулянты, многократно повышающие риск осложнений. Установлено, что у пациентов, получающих одновременно неселективный НПВП и НДА, риск язвенного кровотечения вдвое больше, чем у лиц, принимающих один препарат. Так, по данным двойного слепого плацебо-контролируемого исследования, риск образования гастродуоденальных язв был достоверно выше у больных, леченных напроксеном и аспирином (27%), чем у получавших ингибитор ЦОГ-2 (целекоксиб) и аспирин (19%; р=0,016) или плацебо и аспирин (8%; р<0,001).
Профилактические стратегии при НПВП-гастропатиях
Учитывая широкое повсеместное применение НПВП в клинической практике, профилактика гастроинтестинальных осложнений, связанных с приемом указанных медикаментов, рассматривается как серьезная медико-социальная задача. Согласно современным положениям, первичная профилактика НПВП-гастропатий включает в себя три основные стратегии. Первая предусматривает переход на более безопасные НПВП, не оказывающие существенного негативного влияния на ЖКТ, такие как селективные ингибиторы ЦОГ-2, в первую очередь коксибы; вторая – профилактическое назначение совместно с неселективными НПВП мощных кислотоснижающих или гастропротекторных препаратов, значительно уменьшающих риск развития НПВП-индуцированных повреждений слизистой оболочки; третья стратегия основывается на проведении эрадикационной терапии Нр-инфекции (при ее наличии). Каждый из этих методов имеет свои достоинства и недостатки, которые будут рассмотрены ниже.
Прием селективных ингибиторов ЦОГ-2
Для уменьшения частоты развития НПВП-гастропатий и их жизнеугрожающих осложнений был создан новый класс НПВП – селективные ингибиторы ЦОГ-2. К ним относятся коксибы (целекоксиб, рофекоксиб, эторикоксиб и др.), мелоксикам, нимесулид и др. Результаты ряда крупных исследований, таких как MELISSA, CLASS, VIGOR, TARGET, SUCCESS, MEDAL и др., подтвердили, что на фоне приема этих препаратов серьезные НПВП-индуцируемые повреждения ЖКТ и их осложнения (язвенные кровотечения и перфорации) возникают значительно реже, чем при использовании традиционных неселективных НПВП.
Основное преимущество коксибов (в настоящее время применяются в основном целекоксиб и эторикоксиб) – избирательное действие на различные изоферменты ЦОГ. В обычных терапевтических дозах эти препараты практически не влияют на физиологический фермент ЦОГ-1, обеспечивающий гастропротекцию слизистой оболочки желудка, а подавляют лишь его индуцируемую разновидность ЦОГ-2, ответственную за воспаление. Такое селективное действие позволяет уменьшить негативное влияние ингибиторов ЦОГ-2 на гастропротекторный потенциал слизистой оболочки ЖКТ и тем самым снизить вероятность возникновения НПВП-гастропатий.
Уменьшение риска развития НПВП-гастропатий при применении коксибов было показано в ряде исследований. Так, по данным метаанализа R. Moore, основанного на данных 31 РКИ и включившего 39 605 больных артритами, было зафиксировано всего 184 эпизода клинически выраженных язв и ЖКК, причем опасные осложнения на фоне приема целекоксиба возникали более чем в 2 раза реже по сравнению с контролем. Еще в 2 РКИ (n=659 и n=400) оценивалось появление язв желудка и/или двенадцатиперстной кишки у пациентов с ревматоидным артритом на фоне приема целекоксиба 400 мг/сут, напроксена
1000 мг/сут и диклофенака 150 мг/сут. Период наблюдения составил 3 и 6 мес, в течение которого язвы были выявлены у 4 и 25% (р=0,001) и 4 и 15% (р=0,001) участников соответственно. По данным метаанализа G. Singh и соавт., проанализировавших 52 РКИ (n=51 048), в которых целекоксиб сравнивался с плацебо и неселективными НПВП (диклофенаком, ибупрофеном и напроксеном), общая частота осложнений со стороны ЖКТ, включая ЖКК и перфорации верхних и нижних отделов ЖКТ, язвы желудка и двенадцатиперстной кишки, а также железодефицитные анемии, на фоне приема целекоксиба составила 1,8%. Это было недостоверно выше, чем на фоне плацебо (1,2%), но гораздо меньше, чем при использовании неселективных НПВП (5,3%; p<0,0001).
Серьезным подтверждением снижения риска опасных осложнений НПВП-гастропатий при использовании целекоксиба стали 2 больших РКИ – CLASS и SUCCESS-1. В исследовании CLASS сравнивались целекоксиб (800 мг/сут), диклофенак (150 мг/сут) и ибупрофен (2400 мг/сут), назначаемые в течение 6 мес соответственно у 3987, 1996 и 1985 больных ревматоидным артритом и остеоартрозом. При наличии показаний пациенты также дополнительно принимали НДА (около 20% участников). Результаты исследования показали, что серьезные осложнения НПВП-гастропатий возникли у 0,76% больных, получавших целекоксиб, и у 1,45% лиц в группе контроля, где применялись диклофенак и ибупрофен (разница оказалась хотя и очевидной, но статистически недостоверной). В подгруппах больных, не получавших аспирин, различия достоверны – 0,44 и 1,27% (р<0,05). В более коротком (3 мес) исследовании SUCCESS-1 пациенты с остеоартритом получали целекоксиб в дозе 200 или 400 мг (n=8800), а также диклофенак 100 мг либо напроксен 1000 мг (n=4394). Аспирин дополнительно применялся гораздо реже (у 7,1% участников), поэтому результаты сразу оказались достоверными: язвенные кровотечения и перфорации возникли соответственно у 2 и 7 больных (р=0,008).
В конце 2012 г. J. Castellsague и соавт. представили результаты метаанализа 28 эпидемиологических исследований (выполненных в период с января 1980 по май 2011 г.), в которых оценивался ОР развития гастроинтестинальных осложнений при использовании различных НПВП. Целекоксиб демонстрировал минимальный ОР – 1,45. Опасность развития гастроинтестинальных осложнений была отчетливо выше при использовании ибупрофена (1,84), диклофенака (3,34), мелоксикама (3,47), нимесулида (3,83), кетопрофена (3,92), напроксена (4,10) и индометацина (4,14).
Таким образом, по сравнению с неселективными НПВП селективные ингибиторы ЦОГ-2 оказывают меньшее повреждающее действие на верхние отделы ЖКТ, однако считать их полностью безопасными нельзя. В частности, разразившийся в начале 2000-х гг. кризис коксибов, который остро поставил вопрос не только о гастроинтестинальной, но и о кардиоваскулярной безопасности селективных ингибиторов ЦОГ-2, привел к отзыву с фармацевтического рынка рофекоксиба. Масштабное исследование, проведенное в Канаде, показало, что ОР развития ЖКК у пациентов пожилого возраста, принимавших рофекоксиб (n=14 583), оказался почти в 2 раза выше, чем у лиц, не получавших НПВП. В крупном популяционном исследовании, проведенном в Европе, оценивался риск развития ЖКК на фоне различных НПВП. Среди селективных НПВП наименьший риск был показан для целекоксиба (ОШ 0,3), промежуточный – для нимесулида (OШ 3,2) и мелоксикама (OШ 5,7), а наибольший – для рофекоксиба (OШ 7,2). Удивительно, но риск развития ЖКК был ниже на фоне приема некоторых неселективных НПВП, в частности диклофенака (OШ 3,6).
К сожалению, накопленный практический опыт показал, что главным недостатком высокоселективных ингибиторов ЦОГ-2 и более серьезной проблемой могут быть не гастроинтестинальные, а кардиоваскулярные осложнения, связанные с приемом этих лекарств. Так, в упоминавшемся выше исследовании SUCCESS-1 за 3-месячный период наблюдения инфаркт миокарда возник у 10 больных, принимавших целекоксиб, и лишь у одного из получавших неселективные НПВП сравнения. P. McGettigan и D. Henry оценили данные 30 исследований типа «случай – контроль», включавших 184 946 больных с кардиоваскулярными осложнениями, и 21 когортное исследование с участием в общей сложности 2,7 млн пациентов, выполненные к 2011 г. Суммарный риск кардиоваскулярных осложнений при использовании целекоксиба составил 1,17, что было несколько больше, чем на фоне приема напроксена (1,09), и сопоставимо с таковым при приеме ибупрофена (1,18). При использовании других НПВП данный показатель оказался хуже: 1,20 для мелоксикама, 1,30 для индометацина, 1,40 для диклофенака и 2,05 для эторикоксиба. В 2011 г. S. Trelle и соавт. опубликовали результаты метаанализа 31 РКИ (n=116 429), в котором изучалась безопасность целекоксиба, эторикоксиба, лумиракоксиба и рофекоксиба; контролем служили различные традиционные НПВП, а также плацебо. Критерием оценки являлся риск развития ИМ, инсульта и кардиоваскулярной смерти. В соответствии с полученными данными ни один из НПВП нельзя считать полностью безопасным. Так, риск ИМ на фоне приема целекоксиба оказался выше, чем при приеме эторикоксиба: ОШ 1,35 и 0,75 соответственно, а также препаратов сравнения – диклофенака (0,82) и напроксена (0,82), но ниже, чем в случае терапии ибупрофеном (1,61). В то же время целекоксиб практически не повышал риск развития ишемического инсульта (1,12) в отличие от эторикоксиба (2,67), напроксена (1,76), диклофенака (2,86) и ибупрофена (3,36). При использовании целекоксиба увеличивался общий риск кардиоваскулярной смерти (2,07), особенно в сравнении с таковым на фоне приема напроксена (0,98), при этом он все же был несколько ниже при сопоставлении с соответствующим показателем для ибупрофена (2,39) и значительно меньше – для диклофенака (3,98) и эторикоксиба (4,07).
Таким образом, основными клиническими преимуществами селективных ингибиторов ЦОГ-2 являются более низкая частота осложнений со стороны всех отделов ЖКТ и лучшая, чем у традиционных НПВП, переносимость. К сожалению, высокоселективные НПВП способны более существенно повышать риск кардиоваскулярных катастроф, чем неселективные НПВП (по крайней мере напроксен и ибупрофен), поэтому при сопутствующей кардиальной патологии для уменьшения риска тромбоэмболических осложнений их обычно комбинируют с приемом аспирина, что, в свою очередь, существенно увеличивает вероятность развития НПВП-гастропатий и ЖКК. Учитывая эти недостатки, основными кандидатами для применения данной стратегии являются пациенты молодого и среднего возраста без сопутствующей кардиоваскулярной патологии, нуждающиеся в применении НПВП, но имеющие повышенный риск осложнений со стороны ЖКТ.
Комбинация НПВП и гастропротектора
Еще одним методом профилактики НПВП-гастропатий является дополнительное применение гастропротекторов – препаратов, способных защищать ЖКТ от негативных последствий приема НПВП. Еще в начале 1980-х гг. был создан мизопростол – синтетический аналог простагландина Е1, который уменьшал неблагоприятные последствия блокады ЦОГ-1 и примерно в 2 раза снижал риск гастроинтестинальных осложнений, связанных с НПВП. К сожалению, плохая переносимость мизопростола (часто вызывает диспепсию и диарею), высокая стоимость и неудобная схема применения существенно ограничили его использование в реальной практике, а после появления селективных ингибиторов ЦОГ-2 и начала широкого использования ИПП мизопростол потерял свою популярность. Кроме того, мизопростол в Украине не зарегистрирован и никогда не применялся, поэтому более подробно мы его рассматривать не будем. В качестве альтернативы мизопростолу в последние годы для профилактики НПВП-гастропатий рекомендуется использование такого синтетического аналога простагландинов, как ребамипид.
Начиная с 1988 г., когда впервые на фармацевтическом рынке появился омепразол, ИПП быстро завоевали популярность в качестве действенных и удобных гастропротекторов. Омепразол (Омез® 20, Омез® 40 и другие генерические омепразолы) был первым ИПП, внедренным в клиническую практику, и вплоть до 2000 г. оставался самым назначаемым и продаваемым препаратом в мире. В настоящее время он рассматривается как золотой стандарт лечения любой кислотозависимой патологии. Омепразол и другие ИПП угнетают Н+/К+-АТФазу желудка путем ковалентного связывания с цистеиновыми остатками протонной помпы и таким образом резко снижают желудочную секрецию. Различные ИПП (омепразол, пантопразол, лансопразол, эзомепразол, рабепразол) признаны эффективными и хорошо переносимыми агентами, защищающими желудок и двенадцатиперстную кишку во время приема НПВП.
Большое число масштабных РКИ четко подтвердили эффективность ИПП не только в лечении гастроэзофагеальной рефлюксной болезни и пептических язв, но и в терапии и профилактике НПВП-гастропатий. В одном из более ранних РКИ по профилактике НПВП-индуцированных язв Ekstrom и соавт. сравнивали прием 20 мг омепразола и плацебо у пациентов с диспепсией или неосложненной пептической язвой в анамнезе, которые нуждались в длительном применении НПВП. Через 3 мес развитие язв было зафиксировано только у 4,7% участников, принимавших омепразол, тогда как в группе плацебо соответствующий показатель равнялся 16,7%. Уровень диспепсии составил 15,3% в группе омепразола по сравнению с 35,6% в группе плацебо. Уровень ремиссии по окончании 3-месячного периода исследования оценивался в 74 и 48% соответственно. В подобном исследовании OPPULENT участвовали только пациенты с легкой диспепсией, которые продолжали прием НПВП. По окончании 6 мес вероятность отсутствия эндоскопически выявляемых пептических язв или эрозий, а также умеренных и тяжелых диспепсических симптомов для омепразола составила 0,78 по сравнению с 0,53 для плацебо (уменьшение ОР на 32%; р=0,004). У пациентов, получавших плацебо, язвы развивались в 4 раза чаще (16,5 против 3,6%), чем у больных, получавших омепразол. Еще в одном коротком исследовании сравнивалось применение омепразола и плацебо для первичной профилактики возникновения язв у пациентов с артритом, которые нуждались в приеме индометацина, диклофенака или кетопрофена. В конце испытания ни у одного участника, принимавшего омепразол, не было выявлено язв желудка, в то время как в группе плацебо таковые имели место у 12% пациентов (р<0,01). В другом РКИ, в котором сравнивался пантопразол с плацебо, первый был признан более эффективным в предотвращении НПВП-ассоциированных язв. В этом 12-недельном исследовании у 72% пациентов с артритом, которые продолжали лечение НПВП и ежедневно принимали 40 мг пантопразола, пептические язвы не выявлялись, тогда как в группе плацебо они отсутствовали в только в 59% случаев.
Результаты метаанализа (Rostom A. et al., 2002), который объединил данные 5 РКИ, показали, что по сравнению с плацебо использование ИПП у больных с НПВП-гастропатиями было связано с более низким риском эндоскопического выявления язв желудка (ОР 0,40; 95% ДИ 0,32-0,51) и двенадцатиперстной кишки (ОР 0,19; 95% ДИ 0,09-0,37). Общее количество эндоскопически выявляемых язв равнялось 14,5% при применении ИПП против 35,6% в группе плацебо.
Scheiman и соавт. опубликовали данные 2 рандомизированных плацебо-контролируемых исследований VENUS (США, n=844) и PLUTO (международное, n=585). Оба испытания включали пациентов высокого риска (возраст ≥65 лет или язвенный анамнез в пределах 5 лет) без наличия пептических язв, которые продолжали принимать неселективные НПВП либо ингибиторы ЦОГ-2 на постоянной основе. Применение эзомепразола (20 или 40 мг 1 р/сут) сравнивалось с плацебо в отношении степени язвообразования в течение 6 мес. Доля ремиссий по окончании периода изучения составила 79,6% в группе плацебо, 94,7% в группе эзомепразола в дозе 20 мг/сут и 95,3% в группе эзомепразола в дозе 40 мг/сут (в обоих случаях р<0,001 по сравнению с плацебо) в исследовании VENUS и 87% в группе плацебо, 94,8% в группе эзомепразола в дозе
20 мг/сут (p=0,018) и 95,6% в группе эзомепразола в дозе 40 мг/сут (р=0,002) в исследовании PLUTO. Обе эти работы продемонстрировали эффективность ИПП в предотвращении гастроинтестинальных повреждений при длительном использовании неселективных ИПП и ингибиторов ЦОГ-2 в популяции высокого риска.
В исследовании ASTERIX по первичной профилактике гастродуоденальных язв у пациентов, которым было показано ежедневное применение НДА (75-325 мг) для вторичной профилактики сердечно-сосудистой патологии, было показано, что за 26 нед эндоскопически выявляемые язвы развились у 5,4% пациентов в группе плацебо против 1,6% в группе эзомепразола в дозе 20 мг/сут. Аналогичные параметры, оцененные через 6 мес, составили 6,2 против 1,8% (уменьшение ОР на 71%; р<0,001).
Таким образом, комбинированное применение неселективного НПВП и ИПП значительно снижает частоту развития НПВП-гастропатий и ЖКК, хорошо переносится и считается наименее опасным в плане развития кардиоваскулярных осложнений (особенно сочетание напроксена и ИПП). Основными кандидатами для назначения данной стратегии профилактики НПВП-гастропатий являются пожилые пациенты, нуждающиеся в приеме НПВП и имеющие умеренный риск со стороны ЖКТ и сердечно-сосудистой системы. Главным недостатком данного подхода является то, что он не снижает риск развития НПВП-энтеропатий и может сопровождаться побочными эффектами, связанными с длительным приемом ИПП.
Имеются данные нескольких исследований, сравнивающих эффективность 2 представленных выше профилактических стратегий. Так, Chan и соавт. рандомизировали 287 принимающих НПВП пациентов, у которых недавно возникло язвенное кровотечение, для терапии только целекоксибом (400 мг/сут) или диклофенаком (75 мг/сут) в сочетании с омепразолом (20 мг/сут) в течение 6 мес. Авторы не выявили разницы в частоте возникновения повторных эпизодов гастродуоденальных язв между этими 2 группами (18,7 против 25,6%; р=0,21). Следует отметить, что небольшая часть пациентов обеих групп также дополнительно принимали аспирин, фитотерапию или курили. Независимыми предикторами рецидива язвы были признаны спровоцированная лечением выраженная диспепсия, возраст >75 лет и сопутствующие заболевания. В другом исследовании Lai и соавт. рандомизировали 242 пациента с зарубцевавшимися НПВП-индуцированными язвами для терапии целекоксибом в дозе 200 мг/сут или напроксеном 750 мг/сут в комбинации с лансопразолом 30 мг/сут после эрадикации Н. pylori. По прошествии последующих 24 нед удельный вес пациентов с рецидивом язвы был статистически сходным в обеих группах (3,7 против 6,3%; разница статистически недостоверна), однако у большинства пациентов, принимавших целекоксиб, наблюдалось развитие диспепсии (15 против 5,7%; р=0,02). Пожилой возраст и наличие сопутствующих заболеваний были отмечены как независимые факторы риска. В более новом исследовании F. Chen и соавт. участвовали пациенты (n=441) с артритом и наличием в анамнезе серьезного кровотечения из язв верхних отделов ЖКТ, возникшего на фоне приема НПВП. После успешного заживления язв и эрадикации H. pylori (если этот микроорганизм был выявлен) все больные в течение 12 мес получали целекоксиб 400 мг/сут без дополнительной профилактики либо в комбинации с эффективным гастропротектором эзомепразолом
(20 мг/сут). Согласно полученным результатам, в течение периода наблюдения рецидив кровотечения возник у 8,9% больных, принимавших только целекоксиб, в то время как среди лиц, получавших комбинированную терапию, подобных случаев не было.
Эрадикация Нр-инфекции
Эрадикация Нр-инфекции у пациентов высокого риска до начала приема НПВП значительно снижает риск последующих изъязвлений. В 2 систематических обзорах было показано, что эрадикация Нр-инфекции как единственный метод первичной профилактики НПВП-гастропатий была достоверно эффективнее, чем плацебо (ОШ 0,35), однако недостаточно результативной для вторичной профилактики язвенных кровотечений у пациентов, длительно принимающих НПВП. Кроме того, по сравнению с поддерживающей терапией ИПП эрадикационное лечение у больных с НПВП-гастропатиями менее эффективно. Согласно основным положениям Маастрихтского консенсуса IV (2010), инфекция Hp является единственным модифицируемым фактором риска, который снижает вероятность возникновения НПВП-гастропатий. Поэтому всем больным, у которых планируется длительный прием НПВП, коксибов или аспирина, рекомендуется стратегия test & treat, заключающаяся в диагностике H. pylori и проведении эрадикации у инфицированных больных.
Практические подходы к профилактике НПВП-гастропатий
Практические врачи, назначающие НПВП, сталкиваются с двумя основными проблемами:
- идентификация групп повышенного риска возникновения НПВП-гастропатий и кардиоваскулярных осложнений;
- выбор оптимальной стратегии профилактики развития пептических язв и их осложнений с учетом кардиоваскулярного риска.
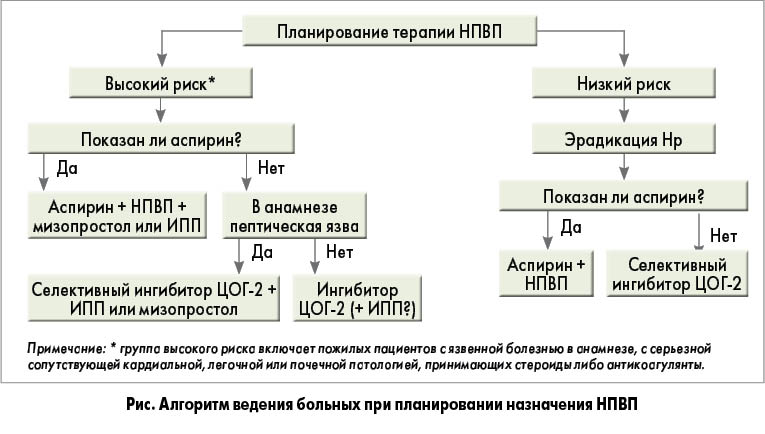
Согласно рекомендациям Американской коллегии гастроэнтерологии (American College of Gastroenterology) по предотвращению осложнений НПВП-гастропатии (2009), по степени риска токсического воздействия НПВП на пищеварительный тракт всех пациентов можно разделить на следующие группы:
- высокого риска (осложненная язва в анамнезе, особенно недавняя; множественные (>2) факторы риска);
- умеренного риска (1-2 фактора риска – возраст >65 лет; высокая доза НПВП; неосложненная язва в анамнезе; одновременный прием аспирина, в том числе в низких дозах, стероидов или антикоагулянтов);
- низкого риска (отсутствие факторов риска).
В рамках данных рекомендаций H. pylori рассматривается как независимый и дополнительный фактор риска, который нужно оценивать отдельно.
В графическом виде алгоритм ведения пациентов при планировании длительного применения НПВП представлен на рисунке.
Согласно рекомендациям Американской ревматологической ассоциации (2009), при высоком риске возникновения НПВП-гастропатий (≥2 фактора риска, наличие осложнений в анамнезе) вместо классических НПВП необходимо назначать селективные ингибиторы ЦОГ-2 в комбинации с ИПП или мизопростолом. При умеренном риске (1-2 фактора риска) можно ограничиться только приемом селективного ингибитора ЦОГ-2. При низком риске (факторов риска нет) можно применять классические НПВП. У всех пациентов с Нр-инфекцией перед назначением курсового приема НПВП рекомендуется проводить эрадикацию причинного патогена. Во всех случаях сочетанного лечения НПВП (селективным или неселективным) и аспирином необходим дополнительный профилактический прием ИПП. Поскольку пептические язвы, кровотечение и перфорация могут развиться в любой период НПВП-терапии и часто без предвестников, то при возникновениии любой НПВП-ассоциированной диспепсии обязательна эндоскопия, хотя возможно и эмпирическое применение ИПП.
Выводы
Таким образом, гастродуоденальные повреждения, связанные с приемом НПВП
и/или аспирина, являются серьезной и крайне актуальной проблемой, особенно если учитывать объемы использования этих препаратов. Поскольку популяция старшего возраста находится в группе высокого риска и именно ее представителями преимущественно используются НПВП и аспирин, клиницисты, вероятно, все чаще будут сталкиваться с такими пациентами и повышенным сопутствующим риском язвенных кровотечений и других осложнений. Профилактика серьезных осложнений со стороны ЖКТ у больных, нуждающихся в приеме НПВП, – непростая задача, требующая индивидуального подхода и тщательной оценки важнейших факторов риска со стороны как ЖКТ, так и сердечно-сосудистой системы. Многолетний клинический опыт изучения возможных рисков, связанных с применением НПВП, дает врачам возможность рационализировать подходы к профилактике НПВП-гастропатий. Среди различных превентивных фармакологических стратегий у пациентов, которым показан постоянный прием НПВП, наиболее клинически эффективной, безопасной и хорошо переносимой является сопутствующая терапия ИПП. Применение ИПП у пациентов высокого риска, принимающих неселективные НПВП, эквивалентно использованию ингибиторов ЦОГ-2, однако экономически более выгодно и предпочтительно в отношении возникновения диспепсических явлений. В клинических испытаниях значительной разницы между профилактической эффективностью тех или иных ИПП в отношении клинических или эндоскопических конечных точек выявлено не было, поэтому различные представители группы ИПП считаются сравнимыми по своей эффективности. Эталонным и наиболее изученным ИПП, золотым стандартом гастропротекторной кислотоснижающей терапии по-прежнему считается омепразол (Омез® и другие препараты).
Медична газета «Здоров’я України 21 сторіччя» № 18 (391), вересень 2016
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...