Современные подходы к диагностике врожденных пороков сердца
Врожденная патология сердца и магистральных сосудов является частой причиной ранней инвалидизации и смерти новорожденных и детей первого года жизни, что обусловливает актуальность изучения факторов риска и моделей патогенеза, дающих ключ к повышению возможностей профилактики, улучшению качества пренатальной и постнатальной диагностики, качества лечения.
Так, в США ежегодно рождается 30-35 тыс. детей с врожденными пороками сердца (ВПС), в России – 20-22 тыс., в Украине – 5-7 тыс. [1-5]. По данным патологоанатомических заключений, ВПС составляют до 1,9% среди причин смерти [6]. По частоте распространенности ВПС занимают третье место после врожденной патологии опорно-двигательного аппарата и центральной нервной системы (ЦНС) у детей [7-10]. Естественная летальность при всех ВПС высока и составляет более 42%.
Известно, что первое описание сердца как мышечного органа принадлежит Гиппократу, однако и к настоящему времени причины возникновения врожденных сердечных аномалий до конца не изучены. Структурная патология сердца формируется вследствие нарушения нормального развития системы кровообращения в эмбриональный период. Патогенные факторы оказывают существенное влияние на развитие сердечно-сосудистой системы (ССС), особенно с 3-й по 8-ю неделю эмбриогенеза, когда происходит формирование камер и перегородок сердца, магистральных сосудов.
Значительные позитивные изменения в прогнозе для жизни и относительно полного восстановления здоровья пациентов с врожденными пороками сердца произошли в 70-90-х годах прошлого столетия в связи с бурным развитием кардиохирургии, в том числе отечественной, а также благодаря появлению более совершенных ультразвуковых технологий. Уровень кардиохирургии в Украине на сегодняшний день не уступает мировому и, по сути, предоставляет возможность радикальной коррекции пороков для всех возрастных категорий пациентов с ВПС – от новорожденных первых часов жизни до подростков. В настоящее время оперируются все «простые» и «сложные» пороки сердца. Это дает возможность полного восстановления анатомии и физиологии сердца практически при всех ВПС. Исключение составляет синдром гипоплазии левых отделов сердца – сложный комбинированный порок, при котором гипоплазия левого желудочка сочетается с обструкцией его выходного отдела и поражением аорты на протяжении (стеноз аорты – СтАо, гипоплазия дуги аорты, коарктация аорты – КоАо) и митрального клапана (стеноз, гипоплазия). При этом варианте критических ВПС осуществляется ряд последовательных паллиативных операций высокой степени риска (коррекция по Norwood).
Благодаря развитию ультразвуковых технологий, разработке и внедрению допплеровских методов (в том числе цветового допплеровского картирования 3D, тканевого допплера, МРТ сердца и сосудов, ангиографии) достигнуты значительные успехи в диагностике ВПС и детальном уточнении топики пороков.
Вышеуказанные обстоятельства обусловили значимый качественный скачок в вопросах раннего выявления пороков сердца и достижения лучших результатов при проведении своевременной кардиохирургической коррекции. По мере накопления опыта расширялась сеть кардиохирургических центров в Украине и доступность оказания специализированной помощи, что обусловило постепенное снижение показателей смертности при врожденных пороках сердца вообще и при критических ВПС у новорожденных в частности. Однако вопросы снижения смертности и инвалидизации детей с ВПС остаются актуальными.
В настоящее время реальным ресурсом улучшения качества оказания помощи новорожденным и детям с ВПС является пренатальная диагностика, охватывающая весь контингент беременных женщин, в первую очередь из группы риска. Этому вопросу уделено большое внимание в Клиническом протоколе по акушерской помощи «Ведення вагітності та пологів у вагітних із пренатально встановленими вродженими вадами серця плода» (2012), в создании которого приняли участие ведущие специалисты Украины.
Для реализации качественной пренатальной диагностики необходима ультразвуковая аппаратура экспертного класса и плановая подготовка высококвалифицированных специалистов. Последняя успешно реализуется в Украине сотрудниками Научно-практического центра детской кардиологии и кардиохирургии г. Киева под руководством профессора И.Н. Емца, на кафедре детской кардиологии и кардиохирургии НМАПО им. П.Л. Шупика (заведующая кафедрой профессор Н.Н. Руденко), в ГУ «Национальный институт сердечно-сосудистой хирургии им. Н.М. Амосова НАМН Украины» (директор профессор В.В. Лазоришинец), на кафедре хирургии сердца, магистральных сосудов и детской хирургии ХМАПО (заведующий кафедрой доцент Ю.Н. Скибо).
Не менее пристальное внимание в настоящее время уделяется уточнению патогенетических моделей врожденных аномалий сердца. Среди этиологических факторов ВПС выделяют: генетические (хромосомные аномалии или дефект одного гена – до 8%), факторы внешней среды (физические, химические или биологические тератогены – до 2%), мультифакториальные влияния (90%). Так, при синдроме Еdwards у 90% детей диагностируют ВПС (дефекты межжелудочковой (ДМЖП) и межпредсердной перегородок (ДМПП), открытый артериальный проток (ОАП), клапанный стеноз легочной артерии – СтЛА); при синдроме Раtau – у 80%; при синдроме Down – у 40% (атриовентрикулярная коммуникация (АВК), ДМЖП, ДМПП), при синдроме Тurnеr – у 10% (чаще – КоАо), при синдроме Шерешевского-Тернера – у 40% (КоАо, СтАо) [2, 5, 10, 11].
Исследования, проведенные за последние два десятилетия, установили чрезвычайно важную роль генетических аномалий в развитии ВПС [1, 11, 12]. Выделяют «синдромальные» и «несиндромальные» ВПС, которые обычно характеризуются множественными мутациями, затрагивающими сложные взаимосвязанные этапы развития ССС [11-13].
Ключевую роль в генетике ВПС отводят гену NKX2-5 – сердечному фактору транскрипции [11]. На сегодняшний день в этом гене выявлено около 50 различных мутаций, лишь немногие из них функционально охарактеризованы. Мутация NKX2-5-фактора может регулировать количество отходящих цепей последующих нуклеотидов, тем самым способствовать развитию ВПС. Таким образом, необходимость скрининга мутаций NKX2-5 для установления высокой вероятности рождения ребенка с ВПС является очевидной [11, 12]. По мере накопления данных относительно массива вариаций копий нуклеотидов (ВКН) и с появлением возможности микрочипирования с высокой разрешающей способностью обнаружение ранее неописанных редких ВКН потенциально может помочь в выявлении критических генов и разработке новых патогенетических моделей развития ВПС.
Систематический скрининг пробандов семейных случаев ВПС на множестве генетических тестов для оценки распространенности и идентификации повреждающих вариантов провели R. ElMalti, H. Liu (2016). Предложенный авторами подход позволил идентифицировать причину ВПС в 10,4% семей, что значительно улучшило качество генетического консультирования, обнаруживая лиц, которые подвергаются риску передачи различных вариантов генов и, кроме того, подвержены развитию сердечных осложнений во взрослой жизни [11].
При анализе последовательности экзонов у 1200 пациентов и их родителей было установлено, что у больных с ВПС и нарушениями развития нервной системы значительно повышен уровень спонтанно возникавших разрушительных мутаций, особенно в генах, одновременно ответственных за развитие сердца и мозга. Вероятно, именно поэтому дети с ВПС имеют высокий риск развития нарушений со стороны нервной системы [13].
M.I. Martinez-Biarge, V.C. Jowett (2013) сообщают, что дети с ВПС имеют несколько факторов, повышающих риск поздних осложнений со стороны ЦНС, и рекомендуют проведение долгосрочного психомоторного контроля пациентов с ВПС с целью своевременного выявления изменений со стороны ЦНС и их лечения [14].
Результаты исследования спонтанно возникающих мутаций у 362 пациентов с тяжелыми комбинированными ВПС и у 264 пациентов контрольной группы путем анализа секвенирования экзома в связке «родитель-потомок» опубликованы S. Zaidi, M. Choi (2013) [15]. Авторы выявили значительное превышение белок-изменяющих спонтанно возникающих мутаций в генах, ответственных за развивающееся сердце, с повышением вероятности повреждения в 7,5 раз [15]. Это исследование свидетельствует о спонтанно возникающих точечных мутациях в нескольких сотнях генов (H3K4, H2BK120, SMAD2 и др.), которые способствуют развитию примерно 10% тяжелых ВПС [15].
J.T. Glessner, A.G. Bick (2014) изучили данные 538 пациентов с ВПС и 1301 здорового человека, используя массивы единичного нуклеотидного полиморфизма в геноме и секвенирование экзома. С помощью дополнительных технологий с высоким разрешением авторами определены 63 спонтанно возникающие варианта копий в МЕНП у 51 пациента с ВПС. Интеграция вновь возникших копий в целый секвенированый экзом и наличие ВПС у одного и того же пациента позволило предположить, что ETS1 является патогенным геном, связанным с делецией хромосомного сегмента 11q24.2-q25 при синдроме Jacobsen, а CTBP2 – патогенным геном, ответственным за субтеломерную делецию 10q [16].
R. Soemedi, I.J. Wilson (2012) полагают, что редкие генетические делеции, связанные со спорадическим возникновением ВПС, встречаются у 4% населения. Копирование нуклеотидов в генах 1q21.1, делеции 15q11.2 и Wnt-ген являются наиболее значительными факторами риска спорадических ВПС, которые передаются по отцовской линии [17].
Редкие спонтанно возникающие варианты копирования нуклеотидов у 9,8% больных с врожденной атрезией ЛА описали L. Xie, J.L. Chen (2014), показав, что причины данного ВПС гетерогенны и плейотропны [18].
Анализ числа вариантов копий генома для врожденных ДМЖП в китайской популяции изучили Y. An, W. Duan (2016). По мнению авторов, результаты исследования подтверждает потенциальную клиническую и диагностическую значимость геномного дисбаланса у больных ДМЖП [19].
Редкие ВКН у взрослых с тетрадой Фалло (ТФ, наиболее распространенной формой «синих» ВПС) описаны C.K. Silversides, A.C. Lionel (2012). Авторы полагают, что редкие ВКН являются новыми генами-кандидатами, представляющими интерес для изучения причин развития ТФ, в том числе рассматриваются PLXNA2 и связанные с ним процессы развития ССС [20]. D.C. Bittel, X.G. Zhou (2014) определили большое количество мелких ВКН в генах с различной ассоциацией с развитием сердца, проиллюстрировали сложность человеческого генома и подчеркнули необходимость многофакторной оценки потенциальных генетических/геномных факторов, которые способствуют развитию ВПС, в том числе ТФ [21].
Локус TRPM2 в аутосомах у пациентов с несиндромальной КоАо в спорадических и семейных случаях выявили J. Moosmann, S. Uebe (2015) [22]. Результаты исследований J. Zhang, Q. Wu (2015) доказывают, что полиморфизм GDF1 rs4808863 способствует увеличению риска фетальных ВПС, особенно подтипов AVSD (атриовентрикулярный септальный дефект), LVOTO (обструкция пути оттока левого желудочка) и латеральные пороки левых и правых отделов сердца [23].
По данным I. Ruchonnet-Metrailler, B. Bessieres (2014), с наличием ВПС может быть связана легочная гипоплазия (ЛГ). Авторы полагают, что ВПС с обструкцией оттока из правых камер сердца являются существенным фактором риска для развития гипоплазии легких. Была определена распространенность ЛГ, связанная с ВПС, и проведена оценка связи ВПС с обструкцией оттока из правых отделов с высоким риском замедления роста легких [24].
Существует обоснованное мнение, что если в семье есть ребенок с изолированным врожденным пороком сердца или кто-то из родителей имеет ВПС, риск рождения второго ребенка с врожденным пороком в среднем составляет 3,5% [2, 7, 10].
В МКБ-10 ВПС отнесены к классу врожденных аномалий (пороки крови), деформаций и хромосомных нарушений; блоку «Врожденные аномалии (пороки развития) системы кровообращения»; шифр, в соответствии с МКБ-10 (Q20-Q26), включает следующую патологию:
Q20.0 Общий aртериaльный ствол
Q20.3 Дискордaнтное желудочково-aртериaльное соединение
Трaнспозиция крупных сосудов (полнaя)
Q20.4 Удвоение входного отверстия желудочкa
Общий желудочек
Трехкaмерное двухпредсердное сердце
Единственный желудочек
Q21.2 Дефект предсердно-желудочковой перегородки
Общий aтриовентрикулярный кaнaл
Q21.3 Тетрaдa Фaлло
Q23.4 Синдром левосторонней гипоплaзии сердцa
Q25.0 Открытый aртериaльный проток
Q25.1 Коaрктaция aорты
Коaрктaция aорты (предуктaльнaя, постдуктaльнaя)
Q25.2 Атрезия aорты
Q25.5 Атрезия легочной aртерии
Q26.2 Тотaльнaя aномaлия соединения легочных вен.
Оценка удельного веса различных пороков сердца в профессиональной литературе достаточно вариабельна. Наиболее распространенными считаются пороки так называемой «большой шестерки»: ДМЖП (28,0%), ОАП (7,2%), транспозиция магистральных сосудов (ТМС) (6,4%), ДМПП (6,3%), ТФ (6,1%) и КоАо (5,8%), к которым ряд авторов предлагает добавить объединенную группу стенозов артерий и ЛА [26]. Совокупно эти пороки составляют более 66% всех ВПС (приведенные цифры касаются относительной частоты отдельных пороков среди новорожденных с ВПС) [5, 9]. По сути, для большинства указанных структурных аномалий сердца на сегодня определены генетические факторы, предопределяющие их развитие.
Кроме полигенно-мультифакториальной наследственности, к факторам риска антенатального формирования ВПС относят факторы внешней среды (прием определенных медикаментов во время первого триместра беременности – тетрациклин, сульфаниламиды, антидепрессанты, психоагрессоры), злоупотребление родителями алкоголем и слабоалкогольными напитками (как до, так и во время беременности), химические вещества, физические воздействия, гестоз первого триместра, инфекции перинатального периода (ТОRСН-инфекции) и др. Наиболее угрожающие инфекции перинатального периода относят к группе биологических тератогенов, значительно повышающих риск рождения ребенка с ВПС:
- вирус краснухи, вызывающий развитие триады Грега (ОАП в сочетании с аномалиями развития аорты и ЛА; нарушение зрения вплоть до слепоты, нарушение слуха);
- цитомегаловирус;
- энтеровирусы, вирусы Коксаки В, полиовирусы I-III типов.
К химическим тератогенам относят ядохимикаты, лакокрасочные вещества, химические реагенты и ряд лекарственных препаратов (талидомид, гормоны, варфарин, антиконвульсанты, алкоголь, кофеин); к физическим тератогенам – ионизирующую радиацию, воздействие вибрации, шума и т.д.). Очевидно, что воздействие различных тератогенов особенно опасно в первом триместре беременности [2, 7, 10, 26, 27].
В возрастной структуре смертности от врожденных аномалий сердца и крупных сосудов 91% составляют дети первого года жизни, из них более 50% – новорожденные (первые 28 дней жизни). Более 35% летальных исходов встречается в ранний неонатальный период (первые 7 суток жизни). Именно в этот период в структуре ВПС значительно чаще (до 30%) встречаются так называемые критические пороки сердца – такие, при которых тяжелые гемодинамические нарушения приводят к смерти новорожденного при отсутствии возможности срочной кардиохирургической коррекции анатомической аномалии сердца или магистральных сосудов. К критическим (часто дуктус-зависимым) ВПС относят транспозицию магистральных артерий, критический стеноз, гипоплазию или КоАо, синдром гипоплазии левых камер сердца (СГЛС), критический стеноз или атрезию ЛА, общий артериальный ствол (ОАС), тотальный аномальный дренаж легочных вен (ТАДЛВ) [4, 5, 25].
У пациентов старше года естественная летальность значительно снижается. От года до 14 лет умирает около 9% больных с ВПС (средний возраст смерти для неоперированных больных с ВПС составил 0,66±0,07 года) [7]. Удельный вес этой патологии в структуре детской смертности в разные годы колеблется от 8,2 до 16,6% и в среднем составляет 12%. Практически у каждого восьмого-десятого ребенка, который умер в возрасте до года, основной или сопутствующей причиной смерти были ВПС [7].
У детей первого года жизни весомый удельный вес могут иметь сложные комбинированные пороки развития сердца и сосудов, часто несовместимые с жизнью, если оперативная коррекция не проведена своевременно: ОАС – 14,4%, транспозиция магистральных артерий – 13,9%, единый желудочек сердца – 9,0%, гипоплазия отделов сердца – 4,4%. В структуре летальности детей с ВПС старших возрастных групп редко встречаются сложные аномалии (12%), а большая часть (58,6%) приходится на дефекты перегородок, ТФ, ОАП [7, 26, 27].
Таким образом, чем меньше возраст пациента с ВПС, тем более сложные комбинированные аномалии сердечно-сосудистой системы у него диагностируются с первых дней жизни и тем чаще ВПС проявляются значительными нарушениями гемодинамики. Естественная летальность в группе сложных пороков сердца и магистральных сосудов достигает 94%.
Сопутствующая патология может существенно влиять на состояние ребенка, подчас определяя прогноз не в меньшей степени, чем ВПС. Если при осмотре ребенка обнаруживают более трех аномалий развития, имеет место высокая вероятность синдромальной формы патологии (до 90%), включающей синдромы, влияющие на анатомию и функцию ССС или на функцию других систем и органов, или потенциально летальные. На сегодняшний день к важнейшим синдромам, встречающимся в кардиологической практике, относят синдром CATCH 22 (Сardiac defects, аbnormal facies, Thymic hypoplasia, Cleft palate, Hypocalcemia, deletion of chromosome 22 – пороки сердца, аномалии строения лицевого черепа, гипоплазия тимуса, волчья пасть и делеция 22 хромосомы) [8].
Все чаще внимание кардиологов и кардиохирургов привлекает феномен/синдром гетеротаксии, определяемый клинически и рентгенологически, который описывают под разными названиями (синдром асплении-полисплении, изометризм). Большинство авторов признают эти аномалии родственными по происхождению и считают сегментарный подход лучшим в диагностике. Как правило, пациенты с правосторонним изометризмом имеют два правых легких (трехдолевое легкое) и асплению, а пациенты с левосторонним изометризмом – два левых легких (двухдолевое легкое) и полиспленизм [8]. ВПС у пациентов с гетеротаксией являются, как правило, сложными, поэтому для их распознавания необходимо допплер-эхокардиографическое обследование, при этом рентгенолог может помочь распознать аномальное положение сердца и сосудов, аномальную анатомию бронхов и определить сопутствующую мальформацию. Радиографическое обследование таких пациентов в настоящее время дополняется ультразвуковым для определения положения печени и наличия одной или нескольких селезенок. Однако селезенка может иметь аномальное положение, поэтому для ее обнаружения может понадобиться радионуклидное сканирование печени и селезенки. Ядерно-магнитно-резонансное исследование (ЯМР) наиболее информативно в диагностике абдоминальных и сердечных аномалий [8].
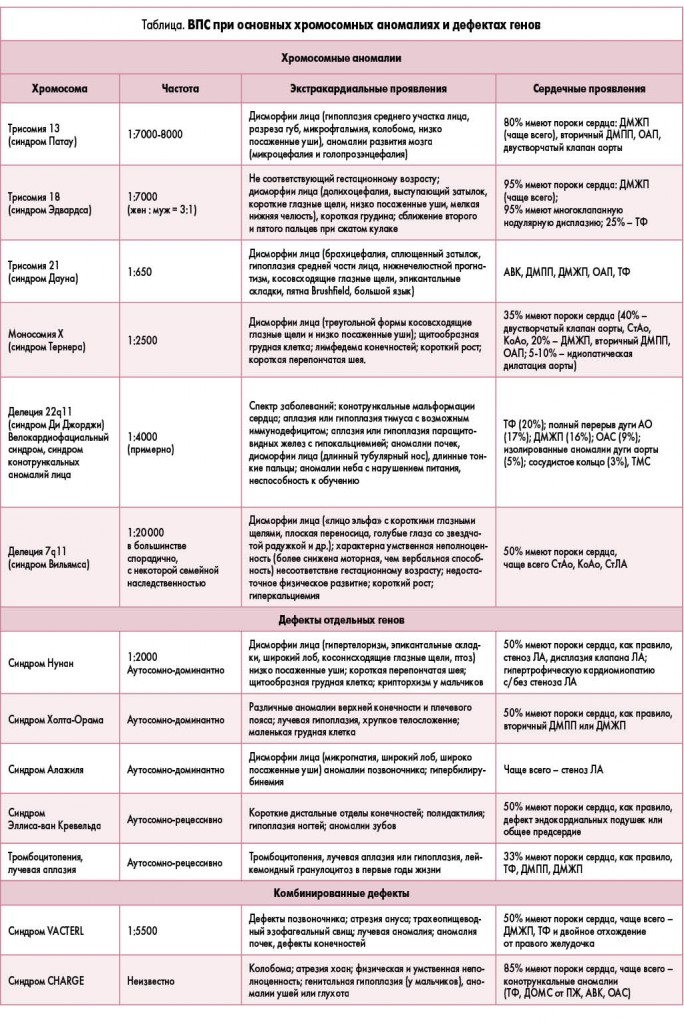
Главные синдромальные формы ВПС приведены в таблице [27].
Если в семейном анамнезе одного из родителей есть указания на наличие ВПС и/или других врожденных дефектов, то перед будущей беременностью должна быть рекомендована генетическая консультация. Врач, проводящий генетическую консультацию, обращает внимание на весь комплекс аномалий развития в семейном анамнезе, а не только на пороки сердечно-сосудистой системы, поскольку в настоящее время описано достаточное количество ВПС, которые имеют установленный тип наследственности и часто сочетаются с характерными экстракардиальными аномалиями [25-28].
В случае изолированного ВПС (не ассоциированного с другими дефектами развития и без отягощенного кардиологического анамнеза) у ребенка генетическая консультация может быть сведена к предоставлению информации о том, что риск развития порока сердца у сиблингов варьирует в зависимости от вида анатомического дефекта и составляет в среднем 3,5%.
Помимо генетического консультирования семей, все большее распространение получает пренатальная диагностика ВПС с проведением трансвагинальной эхокардиографии плода на сроке 12-16 недель [5, 25, 27]. Первичный ультразвуковой осмотр сердца плода выполняется на сроке от 11 недель + 1 день до 13 недель + 6 дней беременности с обязательным выведением сердца плода в четырехкамерном срезе, а также срезе выходных трактов правого и левого желудочков и трех сосудов. При подозрении на патологию сердца плода (с записью в протоколе обследования) беременная направляется в учреждение II-III уровня оказания медицинской помощи для ультразвукового исследования (УЗИ). Беременным с высоким риском рождения детей с ВПС, первое УЗИ плода может сразу выполняться специалистами II-III уровня (с желательным осмотром сердца в четырехкамерной позиции, срезе выходных трактов правого и левого желудочков и срезе трех сосудов) при наличии высокотехнологичной диагностической аппаратуры и опытного специалиста с обязательным повторным углубленным обследованием ССС плода в 18-20 недель + 6 дней [25].
ВПС при проведении фетальной эхокардиографии в группе беременных с высоким риском выявляют с частотой около 0,4% [9].
Показаниями для проведения фетальной эхокардиографии служат:
- наличие у матери факторов риска развития ВПС у плода:
– возраст матери старше 35 лет;
– наличие предыдущих спонтанных выкидышей и (или) абортов;
– наличие семейных сердечно-сосудистых заболеваний;
– наличие наследственных заболеваний в семье;
– многоводие;
– несоответствие размеров плода и таза;
- воздействие профессиональных и бытовых вредных факторов на мать:
– шум более 82 дБ;
– текстильная пыль;
– контакт с лаками, красками, ядохимикатами;
- соматические заболевания матери во время беременности:
– сахарный диабет;
– эпилепсия;
– артериальная гипертензия;
– системная красная волчанка;
– фенилкетонурия, фенилаланинемия у матери (уровень в крови более 16 мг/100 мл);
- инфекционные заболевания матери во время беременности:
– краснуха;
– токсоплазмоз;
– инфекции, вызванные вирусами герпеса 1 и 2 типа;
- злоупотребление алкоголем во время беременности;
- употребление лекарств:
– антиконвульсанты;
– гормональные препараты;
– талидомид;
- ВПС у родственников первой степени родства [27].
Таким образом, современная пренатальная диагностика служит для выявления генетического заболевания у плода в семье, которая имеет повышенный риск возникновения данного заболевания у потомства. Если же плод оказывается больным (положительный результат теста), родители имеют достаточно времени, чтобы принять взвешенное решение о целесообразности сохранения или прерывания данной беременности. При сохранении беременности очень важным является правильный выбор места родоразрешения: в условиях родовспомогательного учреждения ІІІ уровня аккредитации, в непосредственной близости от кардиохирургического центра или с учетом того, что транспортировку новорожденного с критическим ВПС осуществляют в специально оборудованном реанимобиле на расстояние, преодоление которого не должно занимать более 6 ч [25].
С учетом появления новых патогенетических моделей развития ВПС [11-24] чрезвычайно важным и необходимым является расширение генетического консультирования семей, планирующих потомство, беременных женщин с определением генетических факторов высокой вероятности развития ВПС у ребенка.
Пройдет определенное время, прежде чем экспериментальные данные, полученные исследователями разных стран, будут трансформированы в своеобразный «генетический паспорт сердца» плода и новорожденного. При условии практической реализации такого проекта может стать осуществимой высококачественная профилактика врожденных аномалий сердца и магистральных сосудов, экономический и социальный эффекты которой трудно переоценить.
В реалиях сегодняшнего дня с появлением ряда крупных перинатальных центров в различных регионах Украины становится возможным использование алгоритма диагностики и лечения новорожденных с подозрением на врожденный порок сердца, в котором уделено особое внимание этапу пренатальной ультразвуковой диагностики и генетического обследования семьи и новорожденного (рис.).
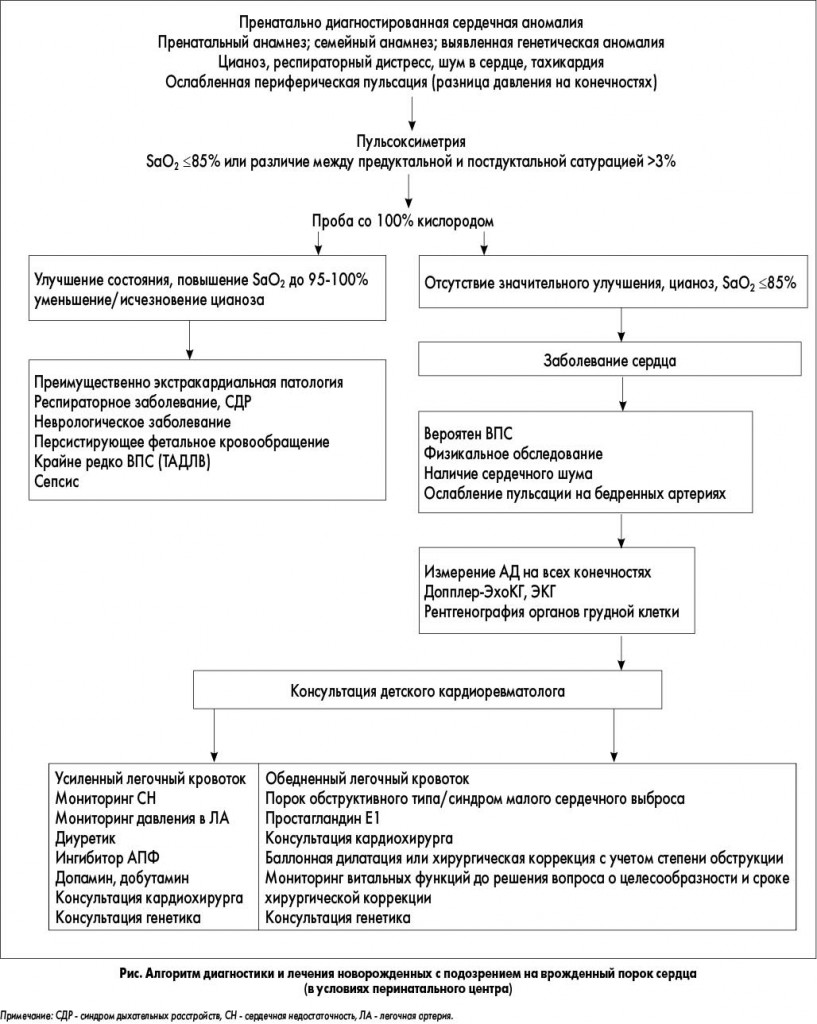
Данный алгоритм внедрен в практику работы регионального перинатального центра г. Харькова (руководитель – кандидат медицинских наук, доцент И.Ю. Кондратова) сотрудниками кафедры педиатрии №1 и неонатологии Харьковского национального медицинского университета.
Литература
- Клайнман Ч.С. Гемодинамика и кардиология. Проблемы и противоречия в неонатологии / Клайнман Ч.С., Сери И.; под ред. Р. Полина; пер. с англ.; под ред. В.А. Кокорина. – М.: Логосфера, 2015. – 512 с.
- Вроджені вади серця: медико-генетичне консультування, діагностика, лікування / Галаган В.О., Руденко Н.М., Козєлкова М.Б., Калашнікова Р.В. // Таврический медико-биологический вестник. – 2009. – Т. 12, № 2 (46). – С. 35-37.
- Руденко Н.М. Дорослі пацієнти із коригованими вродженими вадами серця / Руденко Н.М., Куриляк О.Б., Мальская А.А. // Таврический медико-биологический вестник. – 2009. – Т. 12, № 2 (46). – С. 55-56.
- Детская кардиология / Под ред. Дж. Хоффмана; пер. с англ. – М.: Практика, 2006. – 543 с.
- Волосовець О.П. Діагностика та моніторинг вроджених вад серця у новонароджених: навчальний посібник / Волосовець О.П., Сенаторова Г.С., Гончарь М.О., Бойченко А.Д. – Харків, 2013. – 108 с.
- Морфологический анализ патогенеза острой сердечной недостаточности при операциях на сердце / Бокерия Л.А., Серов Р.А., Артюхина Т.В. и др. // Грудная и сердечно-сосудистая хирургия. – 2001. – № 3. – С. 7-14.
- Миролюбов Л.М. Врожденные пороки сердца у новорожденных и детей первого года жизни / Л.М. Миролюбов. – Казань: Медицина, 2008. – 150 с.
- Зиньковский М.Ф. Врожденные пороки сердца / Под ред. А.Ф. Возианова. – К.: Книга-плюс, 2010. – 1200 с.
- Американська Асоціація серця: Рекомендації для оцінки та ведення типових вроджених вад серця у немовлят, дітей та підлітків // Світовий та вітчизняний досвід допомоги дітям з вродженими вадами серця у ранньому віці: матеріали Всеукраїнського форуму. – К., 2004. – С. 12-26.
- Сухарева Г.Э. Врожденные пороки сердца у детей с генными синдромами / Г.Э. Сухарева // Здоровье ребенка. – 2008. – № 4. – С. 22-30.
- El Malti R., Liu H. // Eur. J. Hum. Genet. – 2016. – Vol. 24 (2). – P. 228-36. Epub 2015 May.
- Chung I.M., Rajakumar G. // Genes (Basel). – 2016. – Vol. 7 (2).
- Jason Homsy, Samir Zaidi // Science. – 2015. – Vol. 350, Issue 6265. – P. 1262-1266.
- Martinez-Biarge M.I., Jowett V.C. // Semin Fetal Neonatal. Med. – 2013. – Vol. 18 (5). – P. 279-285. Epub 2013 May 23.
- Zaidi S., Choi M. // Nature. – 2013. – Vol. 498 (7453). – P. 220-223. Epub 2013 May 12.
- Glessner J.T., Bick A.G. // Circ. Res. – 2014. – Vol. 115 (10). – P. 884-896. Epub 2014 Sep 9.
- Soemedi R., Wilson I.J. // Am. J. Hum. Genet. – 2012. – Vol. 91 (3). – P. 489-501. Epub 2012 Aug 30.
- Xie L., Chen J.L. // Ploys One. – 2014. – Vol. 9 (5). – P. e96471.
- An Y., Duan W. // BMC Med Genomics. – 2016. – Vol. 9 (1). – P. 2.
- Silversides C.K., Lionel A.C. // PLoS Genet. – 2012. – Vol. 8 (8). –
P. e1002843. - Bittel D.C., Zhou X.G. / PLoS One. – 2014. Vol. 9 (1). – Р. e87472.
- Moosmann J., Uebe S. // PLoS One. – 2015. – Vol. 10 (5). – Р. e0126873.
- Zhang J., Wu Q. // BMJ Open. – 2015 – Vol. 5 (12). Р. e009352.
- Ruchonnet-Metrailler I., Bessieres B. // PLoS One. – 2014. – Vol. 9 (4). –
Р. e93557. - Клінічний протокол з акушерської допомоги «Ведення вагітності та пологів у вагітних із пренатально встановленими вродженими вадами серця плода», Наказ МОЗ України від 01.10.2012 р. № 764.
- Лазоришинець В.В. Невідкладна допомога при основних патологічних синдромах у немовлят з уродженими вадами серця / Лазоришинець В.В., Руденко Н.М., Книшів Г.В. – К.: Український науково-дослідний інститут спеціальних видів друку, 2001. – 90 с.
- Педіатричні аспекти ведення дітей з природженими вадами серця
/ За ред. О.П. Волосовця, Г.С. Сенаторової, М.О. Гончарь. – Тернопіль: Укрмедкнига, 2008. – 175 с. - Протокол надання медичної допомоги хворим з вродженими вадами серця: Наказ МОЗ України від 03.07.2006 р. № 436. – www.moz.gov.ua.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Вроджена дисфункція кори надниркових залоз (ВДКНЗ) – це захворювання з автосомно-рецесивним типом успадкування, в основі якого лежить дефект чи дефіцит ферментів або транспортних білків, що беруть участь у біосинтезі кортизолу. Рання діагностика і початок лікування пацієнтів з ВДКНЗ сприяє покращенню показників виживаності та якості життя пацієнтів....
Алергічний риніт (АР) є поширеним запальним захворюванням верхніх дихальних шляхів (ВДШ), особливо серед педіатричних пацієнтів. Ця патологія може знижувати якість життя, погіршувати сон та щоденну продуктивність. Метою наведеного огляду є надання оновленої інформації щодо епідеміології АР та його діагностики, з урахуванням зв’язку з бронхіальною астмою (БА). ...
Американська академія педіатрії (AAP) оновила рекомендації щодо контролю грипу серед дитячого населення під час сезону 2023-2024 рр. Згідно з оновленим керівництвом, для профілактики та лікування грипу в дітей необхідно проводити планову вакцинацію з 6-місячного віку, а також своєчасно застосовувати противірусні препарати за наявності показань. ...
Поширеність і вплив алергічних захворювань часто недооцінюють [1]. Ключовим фактором алергічної відповіді є імуноглобулін (Ig) Е, присутній на поверхні тучних клітин і базофілів. Взаємодія алергену з IgЕ та його рецепторним комплексом призводить до активації цих клітин і вивільнення речовин, у тому числі гістаміну, які викликають симптоми алергії [2]. Враховуючи ключову роль гістаміну в розвитку алергічних реакцій, при багатьох алергічних станах, включаючи алергічний риніт і кропив’янку, пацієнту призначають антигістамінні препарати [3, 4]....





