Болевой синдром в плечелопаточной области: оптимизация комплексного лечения комбинацией препаратов Ксефокам и Келтикан
Болевые синдромы плечевого региона являються актуальной междисциплинарной проблемой современной медицины, которой занимаются как врачи-неврологи, так и ортопеды-травматологи, а также врачи общей практики и ревматологи. Боль в плечевом поясе в работе врача-невролога встречается почти так же часто, как и боль в спине, и в 85% случав ее возникновение связано с патологией скелетно-мышечных структур в области плечевого сустава.
Выбор пациентов в пользу обращения за медицинской помощью к неврологу обусловлен несколькими факторами: прежде всего – наличием болевого синдрома, отсутствием предшествующей травмы (в то же время травма возможна в далеком анамнезе), ярких общих (повышения температуры тела, общей слабости) и местных симптомов (отечности, покраснения кожных покровов), а также тенденцией к хроническому течению болевого синдрома с наличием иррадиирующих болей и их частым сочетанием с болями в области шеи.
Болевые синдромы плечевого региона достаточно часто сопровождаются развитием так называемого плечелопаточного периартроза, или синдрома «замороженного плеча». Согласно статистическим данным его распространенность среди взрослого населения составляет 3-4% в возрасте 40-44 года, увеличиваясь до 15-20% к возрасту 60-70 лет [2].
Синдром «замороженного плеча» является общим термином, используемым для описания тяжелой дисфункции плечевого сустава с ограничением сгибания, отведения, внутренней и наружной ротации до половины нормального объема движений [3, 4, 5, 6].
Наиболее распространенными этиологическими факторами, приводящими к возникновению синдрома «замороженного плеча», являются: чрезмерная нагрузка на мышцы плечевого пояса, травматические повреждения плечевого сустава в анамнезе, перерастяжение и частичные надрывы связок плечевого сустава, нарушения биомеханики сустава, возникающие из-за боли и ограничения движений в суставе при невропатии плечевого сплетения, эндопротезировании плечевого сустава, иммобилизации вследствие перелома, вертеброгенная радикулопатия с развитием рефлекторно-дистрофических нарушений в соответствующих мышцах, связках и капсуле сустава [2, 3, 5]. Каким бы этиологическим фактором не вызывалось развитие «синдрома замороженного плеча», в его патогенезе участвуют мышечные структуры с формированием миофасциальной дисфункции на фоне вышеуказанных факторов. Кроме того, имеющаяся миофасциальная дисфункция шейно-плечевой локализации, к развитию которой часто приводят нарушения биомеханики позвоночного столба, возникающие вследствие нарушений осанки, асимметрии нижних конечностей, асимметрии костей таза и т.п., сегодня называется одной из наиболее часто встречающихся самостоятельных причин развития синдрома «замороженного плеча» [2, 7]. При миофасциальной дисфункции происходит укорочение мышц шеи и плеча с образованием в них миофасциальных триггерных точек и нарушением функции плечевого сустава вследствие изменения положения и подвижности лопатки [5]. При этом лопатка часто приподнимается, сдвигается латерально и фиксируется в таком положении укороченными подлопаточной и надостной мышцей. Компрессионные силы, возникающие вследствие укорочения мышц шейно-плечевого и лопаточного региона, приводят к снижению вместимости суставной капсулы и к плотному охвату ею головки плечевой кости [3, 6]. Все эти факторы вызывают ограничение подвижности и возникновение боли в плечевом суставе [2, 3]. Значительно уменьшается объем активных движений в плечевом суставе, формируется аномальный плечелопаточный ритм (любая попытка сгибания или отведения плеча приводит к значительному подъему и смещению лопатки) [3, 8].
Таким образом, в любом случае терапевтическая тактика данного контингента больных должна учитывать наличие биомеханической патологии в сочетании с миофасциальной дисфункцией и их коррекции.
Для лучшего понимания роли миофасциальной дисфункции и биомеханической патологии, а также для обоснования терапевтических схем у указанного контингента больных представляется необходимым вспомнить кровоснабжение и иннервацию плечелопаточной области. Кровоснабжение плечевого сустава обеспечивают надлопаточная артерия, передняя и задняя артерии, огибающие плечевую кость, а иногда к нему подходят грудоакромиальная и подлопаточная артерии. Относительно плохо кровоснабжается дистальная часть сухожилия надостной мышцы, а иногда также сухожилия подостной и подлопаточной мышц. Это так называемая критическая зона, считается, что из-за ишемии и гипоксии здесь происходит выброс лизосомных ферментов, рвутся коллагеновые волокна и в итоге развивается тендинит. Регенеративная способность сухожилий в этих участках снижена. Кроме того, сухожилия мышц, образующих мышечную капсулу, над головкой плечевой кости резко перегибаются, что ведет к сдавлению сосудов и усугубляет ишемию. А если в соответствующих мышцах развивается миофасциальная дисфункция (а при синдроме замороженного плеча указанные мышцы обязательно вовлекаются в процесс), то ишемия еще больше усугубляется [8-10].
Что касается иннервации, то плечевой сустав иннервируют два чувствительных нерва: подмышечный и надлопаточный. Эти нервы являются короткими ветвями, отходящими от первичных пучков (верхнего, среднего, нижнего) надключичной части плечевого сплетения. Подмышечный нерв огибает плечевую кость снизу и сзади, отдавая ветви к капсуле плечевого сустава. Надлопаточный нерв отходит от надключичной части плечевого сплетения, идет латерально и вниз под трапециевидной и надостной мышцами к вырезке лопатки и, пройдя под верхней поперечной связкой лопатки, попадает в подостную ямку, где распадается на конечные ветви. Он иннервирует верхние и задние отделы капсулы плечевого сустава, акромиально-ключичный сустав и большую часть влагалища сухожилия длинной головки двуглавой мышцы.
Оба нерва иннервируют также клювовидно-ключичную, клювовидно-акромиальную, клювовидно-плечевую и суставно-плечевые связки. Клювовидный отросток и акромиально-ключичный сустав иннервируются ветвями длинного грудного нерва [10, 11].
Рассмотренные особенности коротких ветвей надключичной части плечевого сплетения обязывают врача при курации пациента с болью в плечелопаточной области и/или ограничении объема движений в плечевом суставе и/или нарушении плечелопаточного ритма обязательно рассматривать в качестве возможной причины данных патологических процессов патологию (первичную или вторичную) коротких ветвей надключичной части плечевого сплетения в целях исключения гипердиагностики изолированной артикулярной и/или периартикулярной плечелопаточной патологии (Laesus De Liro, 2011).
Таким образом, компрессия ветвей коротких нервов в сочетании с ишемией, которые могут развиваться и усугубляться при усилении мышечного спазма в результате рефлекторно-мышечно-тонических синдромов и миофасциальной дисфункции, могут активно участвовать в развитии «синдрома замороженного плеча» [8-11].
Это подтверждается результатами терапии, направленной на ликвидацию биомеханических и миофасциальных нарушений, а также электронейромиографии при эндопротезировании плечевых суставов [12].
Основоположник прикладной кинезиологии Дэвид Лиф считает, что синдром замороженного плеча является результатом скрытой компрессии периферических нервов [13] .
Таким образом, для эффективного лечения болевого синдрома плечелопаточного региона с синдромом «замороженного плеча» должен применяться комплекс лечебных мероприятий в виде немедикаментозных и медикаментозных методов воздействия, направленных на устранение болевого синдрома и мышечно-фасциального гипертонуса, симметризацию мышечного корсета, нормализацию двигательного стереотипа пациента и восстановление объема движений в плечевом суставе [14-17].
Что касается медикаментозной терапии, она должна быть направлена на быстрое купирование болевого синдрома, уменьшение отека, а также улучшение трофики и проводимости периферических нервов, подвергающихся компрессии спазмированными мышцами.
Для купирования боли при синдроме «замороженного плеча» традиционно используются нестероидные противовоспалительные средства (НПВС) [17-20]. Фармакологический эффект применения НПВС основывается на их способности ингибировать фермент циклооксигеназу, участвующий в образовании из арахидоновой кислоты простагландинов E2 и F2α. Являясь медиаторами воспалительной реакции, простагландины E2 и F2α сенсибилизируют рецепторы к медиаторам боли – гистамину и брадикинину, а также к механическим воздействиям, снижая порог болевой чувствительности. Одним из наиболее эффективных НПВС с хорошим профилем безопасности, широко применяющихся на сегодняшний день в клинической практике, является лорноксикам (Ксефокам) – сильнодействующий сбалансированный ингибитор ЦОГ‑1/ЦОГ‑2, обладающий мощным обезболивающим и противовоспалительным действием, сочетающимся с коротким периодом полувыведения и высокой биодоступностью (90-100%) [20-24]. Лорноксикам не только нарушает генерацию болевых импульсов, но и ослабляет восприятие боли, усиливая выработку эндогенных опиоидов, а также активируя физиологическую антиноцицептивную систему организма [20-21]. Именно этим объясняется его мощное обезболивающее действие, сопоставимое в некоторых случаях с опиоидами [25]. Короткий период полувыведения лорноксикама, составляющий 4 часа, снижает вероятность развития побочных эффектов и риска кумуляции препарата в плазме [20, 21].
Учитывая роль компрессионно-ишемических факторов с вовлечением нервных структур в развитии и усугублении клинической картины патологии данного региона, патогенетически обоснованным будет использование препарата Келтикан, созданного на основе полинуклеотидного комплекса, который содержит цитидин‑5-монофосфат и фосфаты уридина. Доказано, что использование полинуклеотидных комплексов увеличивает площадь поверхности миелина и толщину аксона, стойко улучшает скорость проведения импульса по нервному волокну, а также способствует сокращению выраженности болевого синдрома у больных цервикалгией, люмбалгией, диабетической невропатией и невралгией [15, 18, 23, 24]. Использование Келтикана позволяет восстановить структуру спинальных корешков, что приводит к сбалансированности прохождения по ним афферентных потоков импульсов разной модальности и способствует «закрытию ворот» для потока болевой импульсации [8]. Кроме того, полинуклеотидные комплексы на основе цитидин‑5-монофосфата и уридин‑5-трифосфата оказывают собственный аналгезирующий эффект, способствуя уменьшению болевого синдрома, в частности, при компрессионных нейропатиях [26].
Целью нашего исследования была оптимизация комплексной терапии синдрома «замороженного плеча» с использованием препаратов Ксефокам и Келтикан, представленных в Украине компанией Takeda.
Материалы и методы исследования. Мы наблюдали 43 пациента обоего пола в возрасте от 38 до 60 лет с болевым синдромом в плечелопаточной области, сопровождающимся синдромом «замороженного плеча». Все пациенты на момент исследования имели болевой синдром плечелопаточной локализации и ограничение подвижности в плечевом суставе длительностью от 3 до 6 недель. Всем больным было проведено клинико-неврологическое обследование, вертебро-неврологическое обследование, мануальная диагностика с выявлением мышечного напряжения и триггерных точек, а также визуальная диагностика и функциональное исследование с оценкой симметричности конечностей, объема активных и пассивных движений в конечностях и позвоночнике [5, 16]. Для оценки объема движений в плечевом суставе использовали гониометрию, которую проводили перед началом лечения, а также на 5-е и 10-е сутки от начала лечения.
Выраженность болевого синдрома оценивали с помощью визуальной аналоговой шкалы боли (ВАШ) [17]. Оценку динамики болевого синдрома с использованием ВАШ проводили на 5-е и 10-е сутки от начала лечения.
Пациентам была разработана программа терапии с использованием комплекса немедикаментозного лечения, включающего в себя мануальную терапию с коррекцией биомеханических нарушений позвоночного столба, применение нейромышечных техник, рефлексотерапии, массажа и лечебной физкультуры.
Для выполнения поставленной цели исследования все пациенты были разделены на 2 группы наблюдения, которые различались по применяемой медикаментозной терапии. Критериями исключения из исследования были непереносимость или аллергия на Келтикан, Ксефокам и их компоненты.
В 1 группу (основную) вошли 22 пациента (14 женщин, 8 мужчин в возрасте от 36 до 58 лет), получавших Ксефокам в дозе 8 мг по 1 таблетке 2 раза в сутки (5-10 дней в зависимости от скорости достижения аналгетического эффекта) и Келтикан по 2 капсулы 2 раза в сутки в течение месяца.
В лечении 2 группы (сравнения), состоящей из 21 пациента (11 женщин и 10 мужчин в возрасте от 38 до 60 лет), использовался Ксефокам в дозе 8 мг 2 раза в сутки.
Группы были сопоставимы по давности заболевания и выраженности болевого синдрома.
Результаты исследования и их обсуждение
Основными жалобами пациентов обеих исследуемых групп были боль в области плечевого сустава и ограничение подвижности в нем. Кроме того, пациенты жаловались на онемение в области плеча ночью или при попытке поднять руку вверх. У 86% пациентов болевой синдром локализовался в области передней и задней поверхности дельтовидной мышцы, у 32,6% пациентов отмечалась иррадиация боли в руку дистальнее локтевого сустава. Выраженность болевого синдрома при оценке с помощью ВАШ в обеих группах соответствовала средней степени. Длительность заболевания на момент обследования у 74% пациентов составила 4 недели, у 16% – 3 недели и у 10% – 6 недель.
Визуальная диагностика. При осмотре формы грудной клетки было установлено наличие асимметрии реберных дуг, ключиц, вырезки грудины, лопаток в виде их латерофлексии. Плечо на одноименной стороне поражения опущено и находится во флексии, укорочена малая грудная мышца, противоположное – в экстензии и поднято (рис. 1).
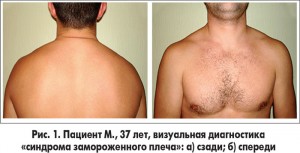
Визуальная диагностика выявила следующие варианты биомеханических нарушений: асимметрия нижних конечностей – у 65% больных, у 32,6% пациентов длина конечностей была сохранена, но отмечался дисбаланс мышц тазового региона. Кососмещенный таз был выявлен в 63% наблюдений, кифотическая деформация грудной клетки – в 18,6% случаев, шейный сколиоз – в 46,6%, грудной и грудопоясничный сколиоз – в 41,9% случаев. В 100% наблюдений выявлена асимметрия плечевого пояса, в 30,2% – смещение центра тяжести в сагиттальной плоскости, в 67,4% – смещение центра тяжести во фронтальной плоскости.
Асимметрия нижних конечностей приводила к деформации контуров тела во фронтальной плоскости с формированием кососмещенного или кососкрученного таза, к компенсаторной перестройке всего осевого скелета и перегрузке мышц шейного отдела позвоночника, а также плечевого пояса как компенсаторного механизма смещения центра тяжести от вертикальной оси.
При вертебро-неврологическом и мануальном обследовании у пациентов с болью в плечелопаточной области, сопровождающейся синдромом «замороженного плеча», в обеих группах выявлялось ограничение подвижности на уровне С7-Т 1 (95,3%), функциональные блоки в области кранио-цервикального перехода (97,7%). В 76,6% случаев наблюдалось смещение лопатки латерально и кпереди вдоль задней поверхности грудной клетки, смещение лопатки кпереди, кверху и латерально вдоль задней поверхности грудной клетки (у 23,3%), что говорило о патологии передней зубчатой мышцы и длинного нерва грудной клетки, а также задних пучков надключичной части верхнего ствола плечевого сплетения. У 97,7% была выявлена миофасциальная дисфункция большой и малой грудных мышц и связанных с ними, что свидетельствовало о заинтересованности передних грудных нервов. У 74% пациентов определялась невозможность преодолеть сопротивление врача при отведении руки на 15° и/или наружной ротации согнутой в локтевом суставе руки, что свидетельствовало о заинтересованности надлопаточного нерва.
У всех пациентов выявлены гипертонус и активные триггерные точки в подлопаточной мышце, дельтовидной мышце, большой грудной мышце, передней зубчатой мышце, надостной и подостной мышцах, большой и малой круглой мышце, лестничных мышцах. В 86,04% наблюдений выявлены гипертонус и локализация активных триггерных точек в широчайшей мышце спины, в двуглавой и трехглавой мышцах плеча. У 95,34% пациентов выявлены как активные, так и латентные триггерные точки в грудино-ключично-сосцевидной, лестничных мышцах шеи, нижней косой мышце головы, больших и малых прямых мышцах головы на стороне патологического процесса.
Патобиомеханический паттерн в 100% наблюдений характеризовался укорочением лестничных мышц, приводящих мышц плеча, больших и малых грудных мышц, передней зубчатой мышцы в сочетании с функциональной слабостью их антагонистов – ромбовидных мышц, верхних и нижних пучков трапециевидной мышцы на стороне патологического процесса. При этом контрлатерально отмечалось компенсаторное удлинение мышц шеи и надплечья. У всех пациентов обеих групп было выявлено нарушение динамической составляющей двигательного стереотипа – аномальный плечелопаточный ритм.
При проведении гониометрии до лечения у первой группы пациентов в 81,8% наблюдений активная флексия в плечевом суставе была ограничена до 35-40° (при норме – 90°), в 18,2% наблюдений отмечалось ограничение активной флексии в плечевом суставе до 60°. Ограничение абдукции в плечевом суставе до 30° (норма – 90°) отмечалось у 77,3% пациентов, до 45-50° – в 18,1% случаев и до 60° – в 4,6% наблюдений. Ограничение внутренней ротации до 10-15° (при норме – 90°) наблюдалось в 54,5% наблюдений, до 20-25° – в 31,8% случаев, до 50-55° – у 9,1% пациентов, до 80-85° – у 4,6% больных. Наружная ротация составляла 20-25° (норма – 60°) у 36,4% пациентов, 40-45° – у 45,5% больных, 50-55° – в 18,1% случаев.
Во второй исследуемой группе гониометрия выявила ограничение активной флексии в плечевом суставе до 45-50° у 81% пациентов. У 19% – активная флексия была ограничена до 70°. Ограничение абдукции в плечевом суставе до 30° наблюдалось у 76,2% пациентов, до 45-50° – в 19,05% случаев и до 60° – в 4,6% наблюдений. Ограничение внутренней ротации до 10-15° наблюдалось у 61,9% обследованных пациентов, до 20-25° – в 23,8% случаев, до 50-55° – у 9,5% больных, до 80-85° – у 4,7% пациентов. Наружная ротация составляла 20-25° у 38% пациентов, 40-45° – у 41% больных, 50-55° – в 21% наблюдений.
Под влиянием проведенного лечения у пациентов обеих исследуемых групп отмечалась ликвидация или уменьшение выраженности болевого синдрома и восстановление двигательного паттерна в плечевом суставе.
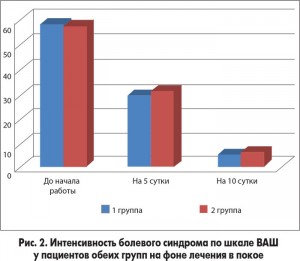
При анализе оценки выраженности болевого синдрома с использованием ВАШ на 5-е сутки лечения в обеих группах пациентов в покое отмечались достоверное уменьшение выраженности болевого синдрома (p≤0,05), что свидетельствовало о высокой эффективности Ксефокама. Причем у 54,5% пациентов основной группы и у 52,4% больных группы сравнения это позволило уменьшить дозу Ксефокама до 8 мг в сутки, а у 27,2 и 24,3% пациентов соответственно отменить НПВС вообще. На 10-е сутки болевой синдром в покое находился в пределах низкой интенсивности всего у 4,5% пациентов основной группы и у 4,6% больных группы сравнения, причем достоверных различий между группами не наблюдалось. Такая динамика болевого синдрома позволила полностью отменить Ксефокам пациентам обеих групп (рис. 2).
Что касается динамики болевого синдрома при движении, то в этом случае наблюдалась более выраженная динамика в основной группе (принимавшей Келтикан+Ксефокам), достоверно отличающаяся от группы сравнения (р≤0,5) (рис. 3).
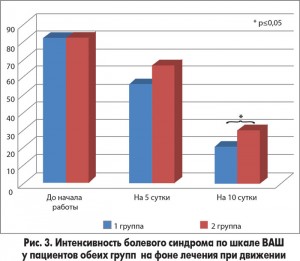
Снижение выраженности болевого синдрома сочеталось с увеличением объема движений, который был более широким у пациентов основной группы. При проведении гониометрии на 5-е сутки от начала лечения в первой группе пациентов объем активной флексии в плечевом суставе увеличился на 25-30° у 68,2% пациентов и на 15-20° у 31,8% больных, объем абдукции в плечевом суставе увеличился на 40° в 63,6% наблюдений, на 30-35° – в 36,4% случаев. Наблюдалось увеличение объема внутренней ротации на 20-25° у 54,6% пациентов, на 10-15° – у 45,4% больных. Объем наружной ротации увеличился на 5-10° у 45,45% пациентов, на 10-15° – в 36,36% случаев и на 20-25° – у 18,19% больных.
Во второй исследуемой группе (сравнения) на 5-е сутки от начала лечения объем активной флексии в плечевом суставе увеличился на 5-10° у 33,3% пациентов, 15-20° – у 47,62% больных и на 25-30° – в 19,05% случаев, объем абдукции в плечевом суставе увеличился на 20-25° в 57% наблюдений, 30-35° – в 39% случаев, на 40° – в 4% наблюдений. Увеличение объема внутренней ротации на 5-10° отмечалось у 47,61% пациентов, на 10-15° – у 42,86% больных и на 20-25° – у 9,53% пациентов. Объем наружной ротации увеличился на 5-10° у 52,38% пациентов, на 10-15° – у 33,33% и на 20-25° – у 14,29% больных.
На 10-е сутки от начала терапии в первой группе исследуемых пациентов гониометрия выявила восстановление физиологического объема активной флексии в плечевом суставе у 94,3% пациентов, у 5,7% больных активная флексия в плечевом суставе была ограничена до 75-80°. Объем абдукции в плечевом суставе увеличился до 90° в 94,3% наблюдений, до 80-85° – в 5,7% случаев. Увеличение объема внутренней ротации до 90° наблюдалось у 86,4% исследуемых пациентов, до 80-85° – у 13,7% больных. Объем наружной ротации увеличился до 60° у 86,4% пациентов, до 50-55° – в 13,6% случаев.
При проведении гониометрии во второй группе пациентов на 10-е сутки от начала терапии: восстановление физиологического объема активной флексии в плечевом суставе отмечалось у 85,7% пациентов, у 9,5% больных активная флексия в плечевом суставе была ограничена до 75-80°, у 4,3% – до 70°. Объем абдукции в плечевом суставе увеличился до 90° в 85,7% наблюдений, до 80-85° – в 14,29% случаев. Увеличение объема внутренней ротации до 90° наблюдалось у 53,8% исследуемых пациентов, до 75-80° – у 38,1% больных и до 75-80° – у 18,1% пациентов. Объем наружной ротации увеличился до 60° у 85,71% пациентов, до 50-55° – у 14,29% больных.
Как видно из приведенных результатов, у пациентов основной группы динамика восстановления объема движений была более выраженной, что сочеталось с меньшей выраженностью болевого синдрома при движении.
Таким образом, применение Келтикана в сочетании с Ксефокамом и немедикаментозной терапией приводило к более раннему восстановлению физиологического объема движений и более выраженному улучшению подвижности плечевого сустава. Результаты наблюдений показали положительное влияние на процессы восстановления функций, по-видимому за счет воздействия Келтикана на «скрытую компрессионно-ишемическую нейропатию периферических нервов», что имеет важное значение для восстановительной медицины. Следует отметить, что побочных эффектов, требующих отмены или коррекции дозы препаратов у наблюдаемых пациентов, выявлено не было. Наблюдаемым нами больным после окончания курса терапии были назначены лечебная гимнастика и прием препарата Келтикан еще в течение двух месяцев в стандартной дозировке.
Исходя из представленных данных, можно сделать вывод об эффективности использования комбинации препаратов Ксефокам и Келтикан в комплексном лечении плечелопаточного болевого синдрома, связанного с миофасциальной дисфункцией и компрессионно-ишемической нейропатией, сопровождающегося синдромом «замороженного плеча». Включение в терапевтическую схему полинуклеотидного комплекса на основе цитидин‑5-монофосфата и уридин‑5-трифосфата приводит к ускорению восстановления объема активных движений в плечевом суставе, способствуя более быстрому восстановлению трудоспособности пациентов.
Выводы
Ксефокам в сочетании с немедикаментозной терапией является высокоэффективным при лечении миофасциального болевого синдрома плечелопаточной локализации, сочетающегося с «синдромом замороженного плеча», способствуя ликвидации болевых ощущений в покое в течение 5-10 дней.
Включение комбинации препаратов Ксефокам и Келтикан в комплексное лечение миофасциального болевого синдрома и компрессионно-ишемической нейропатии плечелопаточной локализации, сочетающихся с «синдромом замороженного плеча», способствует более быстрому его регрессу за счет ускорения процесса восстановления объема движений в плечевом суставе, сокращению сроков терапии в целом и более быстрому восстановлению трудоспособности пациентов.
Препарат Келтикан как эффективное и безопасное лекарственное средство можно рекомендовать для лечения пациентов с болевыми синдромами плечелопаточной локализации.
Литература
1. Беленький А.Г. Патология плечевого сустава. Плечелопаточный периартрит. Прощание с термином: от приблизительности – к конкретным нозологическим формам. «Consiliummedicum», 2004, т. 6, № 2.
2. Мисиков В.К. Синдром плечелопаточного периартроза. Клиника, диагностика, лечение. «Русский медицинский журнал», № 10, 2014, с. 722.
3. Л.У. Фергюсон, Р. Гервин. Лечение миофасциальной боли. Клиническое руководство. Москва «МЕДпресс – информ», 2008.
4. Weber M., Prim J., Bugglin R. Long-term follow up of patients with frozen shoulder after mobilization under anesthesia, with special reference to the rotator cuff. Clin Rheum 1995; 14: 686-691.
5. Simons D.G., Travall J.G., Simons L.S. Myofascial Pain and Dysfunction: The Trigger Point Manual, vol. 1, 2 Ed. Baltimore: Williams & Wilkins, 1999.
6. Ozaki J., Nakagawa Y., Sakurai G. Recalcitrant chronic adhesive capsulitis of the shoulder. J. Bone Joint Surg Am 1989; 71: 1511-1515.
7. Ярошевский А.А. Особенности патобиомеханических паттернов у пациентов, страдающих цервикальными рефлекторными мышечно-тоническими синдромами. «Вісник проблем біології та медицини»,2010, вип. 2
8. Василевский С.С. Мышечно-фасциальные болевые синдромы верхних конечностей / С.С. Василеский, А.П. Спиваков, С.М. Маньевич. – Минск: БелМАПО, 2009. – 45 с.
9. Москвитин А.В. Роль неоптимального дыхательного паттерна в патогенезе туннельных синдромов плечелопаточной области / А.В. Москвитин, А.В. Стефаниди, Н.П. Елисеев // Мануальная терапия. – 2009. – С. 47-52.
10. Кипервас И.П. Периферические нейроваскулярные синдромы / И.П. Кипервас. – Москва: Медицина, 1985. – 176 с.
11. Лобзин В.С. Туннельные компрессионно-ишемические невропатии / В.С. Лобзин, А.Р. Рахимжанов, Н.М. Жулев. – Ташкент: Медицина, 1988. – 185 с.
12. Зубарева Т.В. Стабилизирующая роль мышц плечевого пояса при эндопротезировании плечевого сустава / Т.В. Зубарева, С.В. Гюлбназарова, В.И. Мамаев // Журнал клинической и экспериментальной ортопедии имени Г.А. Илизарова. – 2015. – С. 21-24.
13. Лиф Д. Прикладная кинезиология: руководство в таблицах / Дэвид Лиф. – Санкт-Петербург, 2013.
14. Наумов А.В. Боль в спине: от клинических рекомендаций к рутинной практике. «Эффективная фармакотерапия». 40, 2015.
15. Дзяк Л.А., Мизякина Е.В., Хаитов П.А. Опыт применения препарата Нуклео ЦМФ форте у пациентов с дегенеративно-дистрофическими изменениями позвоночника. «Новости медицины и фармации» № 11, 2015.
16. Васильева Л.Ф. Клиника и визуальная диагностика укороченных мышц: Уч. Пособие /Л.Ф.Васильева. – М.: Медицина, 2003. – 169 с.
17. Вейн А.М. Болевые синдромы в неврологической практике / А.М. Вейн, Т.Г. Вознесенская, А.Б. Данилов; Под ред. А.М. Вейна. – М.: Медпресс-информ, 2001. – 372 с.
18. Клиническая фармакология: национальное руководство (серия «Национальные руководства»). М.: ГЭОТАР-Медиа, 2009. – 976 с.
19. Нестероидные противовоспалительные средства (редакц. статья) // Клин. фармакол. и фармакотер. 1994. № 3. С. 6-7.
20. Клиническая фармакология и фармакотерапия / под ред. В.Г. Кукеса, А.К. Стародубцева. М.: ГЭОТАР-Медиа, 2012. – 832 с.
21. Berg J., Fellier H., Christoph T., Grarup J., Stimmeder D. The analgesic NSAID lornoxicam inhibits cyclooxygenase (COX)-1/-2, inducible nitric oxide synthase (iNOS), and the formation of interleukin (IL)-6 in vitro // Inflamm Res. 1999. Vol. 48 (7). Р. 369-379.
22. В.В. Петрова, Н.А. Осипова, В.А. Береснев, Т.В. Долгополова, В.И. Бирюков, Е.В. Торчинская. Лорноксикам (ксефокам) как средство профилактики и лечения послеоперационного болевого синдрома среди других НПВП. Анестезиология и реаниматология, № 5, 2005.
23. Товажнянская Е.Л. Современные подходы к комплексной терапии болевых синдромов в области спины. Международный неврологический журнал 2 (48), 2012.
24. Морозова О.Г., Ярошевский А.А. Патогенетическая терапия миофасциальных болевых синдромов. Здоров’я України, 2, 2013.
25. Rosenow D.E., Albrechtsen M., Stolke D.A comparison of patient-controlled analgesia with lornoxicam versusmorphine in patients undergoing lumbar disk surgery. Anesth Analg 1998; 86 (5): 1045-50.
26. Goldberg H. et al. Neural compression-induced neuralgias: clinical evaluation of the effect of nucleotides associated with vitamin B12. Revista Brasileira de Medicina. 2009; 66: 11: 380-5.
UA/XEF/0516/0040
СТАТТІ ЗА ТЕМОЮ Неврологія
Як відомо, біль у спині ускладнює рух і чинить негативний вплив на якість життя та психічне благополуччя людини. За даними Всесвітньої організації охорони здоров’я (ВООЗ), від болю в нижній частині спини страждають близько 619 млн людей у всьому світі, і за прогнозом, до 2050 року переважно через збільшення чисельності населення та його старіння кількість таких випадків може зрости до 843 млн (WHO, 2020). Попри проведення численних досліджень причини дорсалгій досі лишаються суперечливими, а результат лікування – здебільшого незадовільним....
Полінейропатії – це захворювання всього організму з реалізацією патологічного процесу на рівні периферичної нервової системи як множинного ураження периферичних нервів із порушенням їх функції. Більшість полінейропатій є хронічними станами, що значно порушують якість життя пацієнтів. Це зумовлює актуальність пошуку ефективних підходів до лікування цих захворювань....
Головний біль (ГБ) як один із найчастіших неврологічних розладів є причиною стану, що характеризується порушенням повсякденної життєдіяльності людини. Поширеність цефалгій і значний їх вплив на якість життя свідчать про важливість проблеми діагностування та лікування ГБ. За даними Глобального дослідження тяжкості хвороб, оновленими 2019 р., ГБ посідає третє місце (після інсульту та деменції) серед неврологічних причин за загальним тягарем захворювань (виміряним роками життя з поправкою на інвалідність [DALY]) (WHO, 2014). При цьому лише незначна кількість осіб із ГБ у всьому світі проходять відповідну діагностику та отримують адекватне лікування....
Біль є однією з найчастіших причин звернення по медичну допомогу. На хронічний біль, який чинить негативний вплив на загальний стан здоров’я, страждають щонайменше четверо з п’яти хворих із хронічною патологією спинного мозку. Основними типами болю, на який скаржаться такі пацієнти, є ноцицептивний і нейропатичний (у 49 і 56% випадків відповідно) (Felix et al., 2021). Пропонуємо до вашої уваги огляд доповіді директорки Інституту медичних та фармацевтичних наук Міжрегіональної академії управління персоналом, д.мед.н., професорки Наталії Костянтинівни Свиридової, присвяченої особливостям ведення хворих із ноцицептивним і нейропатичним болем у практиці сімейного лікаря, яку вона представила у лютому цього року під час Науково-практичної конференції «Дискусійний клуб сімейного лікаря»....






