Світові тенденції у лікуванні множинної мієломи
Протягом останніх 20 років накопичена велика база знань, що змінили уявлення світової медичної спільноти щодо тактики ведення пацієнтів із множинною мієломою (ММ). Зокрема, результати низки досліджень демонструють покращення виживаності та досягнення глибшої відповіді на лікування при включенні у терапевтичні схеми у хворих на ММ моноклонального антитіла даратумумабу.
У рамках ХІІ Науково-практичної конференції з міжнародною участю «Сучасні підходи до діагностики та лікування лімфопроліферативних захворювань» про нові можливості терапії при ММ розповіли фахівці з Іспанії, а вітчизняний експерт та організатор заходу професор Ірина Анатоліївна Крячок зосередила увагу слухачів на стані медичної допомоги хворим на ММ в Україні.
 Голова медицини Університету Наварри (Іспанія), медичний директор клініки Університету, доктор філософії та медицини, професор Джесус Сан-Мігель розповів про тактику лікування при рецидиві ММ.
Голова медицини Університету Наварри (Іспанія), медичний директор клініки Університету, доктор філософії та медицини, професор Джесус Сан-Мігель розповів про тактику лікування при рецидиві ММ.
– Завдяки розробці нових лікарських засобів і впровадженню сучасних терапевтичних стратегій вдалося досягти хороших результатів у лікуванні хворих на ММ.
У проспективному дослідженні IFM 2013-04 за участю пацієнтів з уперше встановленим діагнозом множинна мієлома порівнювали ефективність двох схем індукційної терапії перед проведенням аутологічної трансплантації стовбурових клітин (АТСК): бортезоміб + талідомід + дексаметазон (VTD) та бортезоміб + циклофосфамід + дексаметазон (VCD). Після 4 циклів терапії загальна відповідь (ЗВ) досягнута у 92,3% пацієнтів групи VTD та у 83,4% групи VCD, при цьому дуже добру часткову відповідь (ддЧВ) виявлено у 66,3% хворих групи VTD та 56,2% – VCD (P. Moreau et al., 2016). Переваги схеми VTD над VCD у пацієнтів перед проведенням АТСК також продемонстрували результати італійського дослідження: рівень повної відповіді (ПВ) становив 19 та 6%, ддЧВ – 64 та 37%, часткової відповіді – 93 та 81% відповідно (M. Cavo et al., 2015).
У дослідженні, проведеному в Іспанії, порівнювали ефективність схем бортезоміб + леналідомід + дексаметазон (VRD) та VTD до та після АТСК. Результати дослідження показали переваги VRD над VTD: ддЧВ склала 66 та 51% після індукційної терапії і 74 та 53% після виконання АТСК відповідно. Застосування схеми VRD також супроводжувалося меншою токсичністю порівняно з VTD (L. Rosinol et al., 2018). У рандомізованому клінічному дослідженні III фази ENDURANCE за участю 1087 пацієнтів з уперше встановленою ММ (критерієм виключення була наявність високого ризику) не виявлено істотної різниці між виживаністю без прогресування (ВБП) та загальною виживаністю (ЗВ) у пацієнтів, котрі отримували індукційну терапію за схемами VRD та карфілзоміб* + леналідомід + дексаметазон (КRD; S. Kumar et al., 2020). Враховуючи дані досліджень, схеми VTD та VRD із подальшим виконанням АТСК є стандартом терапії пацієнтів з уперше встановленим діагнозом ММ.
Сьогодні у лікуванні пацієнтів похилого віку з ММ використовують два підходи: із застосуванням режиму на основі алкілуючих агентів (бортезоміб + мелфалан + преднізолон – VMP) або без них (леналідомід + дексаметазон – Rd). Проте уже доступні дані про покращення виживаності у цієї категорії хворих при доповненні стандартної схеми препаратами моноклональних антитіл.
Рандомізоване дослідження III фази ALCYONE. Дослідження охоплювало 162 медичних центри 25 країн Північної та Південної Америки, Європи та Азіатсько-Тихоокеанського регіону. Критеріями включення у дослідження були вперше встановлений діагноз ММ пацієнтам, котрі не були кандидатами на проведення високодозової хіміотерапії з подальшою АТСК (через вік ≥65 років та наявність коморбідної патології), >2 балів за ECOG. Хворі були розподілені на дві групи (1:1): учасники 1-ї групи (n=356) отримали 9 циклів VMP, 2-ї (n=350) – 9 циклів VMP + даратумумаб (D-VMP) із подальшим прийомом даратумумабу як підтримувальної терапії. Первинною кінцевою точкою дослідження була ВБП.
Протягом періоду спостереження з медіаною 40,1 міс ПВ досягнута у 46% хворих групи D-VMP та у 25% – VMP, із них MRD-негативний статус досягнутий у 28 та 7% пацієнтів відповідно. Згідно з оновленими даними медіана ВБП у групі D-VMP склала 36,4 міс, у групі VMP – 29,3 міс. 42-місячна ВБП досягнута у 48% хворих групи D-VMP та у 14% – VMP (ВР 0,42; 95% ДІ 0,34-0,51; р<0,0001); 42-місячна ЗВ – у 75 та 62% відповідно (ВР 0,60; 95% ДІ 0,46-0,80; р=0,0003). Таким чином, застосування схеми D-VMP знижує ризик смерті на 40%. Найчастішим побічним явищем, асоційованим з підтримувальною терапією даратумумабом у групі D-VMP, були респіраторні інфекції (M.‑V. Mateos et al., 2020).
 Доктор філософії та медицини, професор Університету Саламанки (Іспанія) Марія-Вікторія Матеос представила світові дані та власний досвід користі застосування даратумумабу у лікуванні пацієнтів з рецидивуючою/рефрактерною ММ (ррММ).
Доктор філософії та медицини, професор Університету Саламанки (Іспанія) Марія-Вікторія Матеос представила світові дані та власний досвід користі застосування даратумумабу у лікуванні пацієнтів з рецидивуючою/рефрактерною ММ (ррММ).
– У разі симптоматичної ММ необхідно застосовувати найкращу комбінацію препаратів у 1-й лінії терапії, що дає можливість досягти оптимальної відповіді на лікування. Завданнями терапії при ррММ є подовження виживаності, відтермінування прогресування захворювання та забезпечення задовільної якості життя. Для цього необхідно усунути або принаймні зменшити кількість пухлинних клонів. Основними факторами сприятливого прогнозу для пацієнта є досягнення ПВ і стійкого MRD-негативного статусу.
У 2016 р. Міжнародна робоча група з мієломи (Іnternational Myeloma Working Group, IMWG) розробила нові критерії для оцінки відповіді на терапію, у які включила визначення MRD (S. Kumar et al., 2018).
Незважаючи на застосування інгібіторів протеасом та імуномодулюючих агентів у перших лініях терапії, більшість хворих на ММ мають рецидив захворювання та рефрактерність до цих засобів, що супроводжується погіршенням виживаності. Медіана ЗВ пацієнтів з рефрактерністю до бортезомібу і щонайменше до 1 імуномодулюючого агента складає 9 міс (S. Kumar et al., 2012). Тому важливим напрямом покращення виживаності пацієнтів з ррММ є застосування засобів з принципово новим механізмом дії, якими є моноклональні антитіла, зокрема даратумумаб. Так, за даними суміжного аналізу досліджень GEN501 та SIRIUS (MMY2002) у пацієнтів з ррММ, які отримували монотерапію даратумумабом після ≥2 (у GEN501) або ≥3 (у SIRIUS) ліній терапії інгібіторами протеасом та імуномодуляторами, медіана ЗВ склала 20,5 міс із 3-річною ЗВ 36,5%. ЗВ відмічена у 30,4%, включаючи 14% пацієнтів з ддЧВ та 5% з ПВ. Найчастішими побічними явищами, пов’язаними з терапією, були анемія (3 ступінь – у 18%; 4 ступінь не виявлено) та тромбоцитопенія (3 ступінь – у 9%; 4 ступінь – у 5%). У 43% пацієнтів спостерігали патологічну реакцію на інфузію, яка здебільшого була 1-2 ступеня тяжкості (3 ступінь – у 5%, 4 ступінь не виявлено), проте у жодному випадку вона не стала причиною відміни основного лікування (S.Z. Usmani et al., 2020).
Відповідно до настанов Європейського товариства медичної онкології (ESMO, 2017) даратумумаб у вигляді монотерапії/комбінованої терапії може використовуватися у 3-й лінії у пацієнтів з ррММ.
Рандомізоване дослідження III фази POLLUX. Метою дослідження було порівняти ефективність і безпеку схем Rd та D-Rd у пацієнтів з ррММ, які раніше отримували щонайменше одну лінію терапії. Пацієнти були рандомізовані на 2 групи: Rd (n=283) та D-Rd (n=286). Протягом періоду спостереження з медіаною 44,3 міс лікування за схемою з даратумумабом сприяло збільшенню виживаності: медіана ВБП у групах D-Rd та Rd склала 44,5 та 17,5 міс відповідно (ВР 0,44; 95% ДІ 0,35-0,55; P<0,0001). У групі D-Rd отримано вищу ОВ – 92,9 та D-Rd – 76,4% відповідно (P<0,0001). У групі з даратумумабом спостерігали глибшу відповідь: ПВ досягнута у 56,6% пацієнтів групи D-Rd та 23,2% – Rd (P<0,0001). Частка MRD-негативного статусу істотно відрізнялася на користь групи з даратумумабом (30,4 та 5,3% відповідно; P<0,0001). У MRD-негативних пацієнтів схема D-Rd сприяла істотному збільшенню тривалості ВБП порівняно з Rd: медіана ВБП не досягнута та 42,0 міс відповідно (ВР 0,46; 95% ДІ 0,19-1,08; P=0,0667). У MRD-позитивних хворих схема з даратумумабом також забезпечувала більшу ВБП: медіана 29,4 та 16,0 міс відповідно (ВР 0,60; 95% ДІ 0,48-0,76; P<0,0001). При застосуванні даратумумабу спостерігали збільшення часу до наступної лінії терапії: 50,6 та 23,1 міс відповідно (ВР 0,39; 95% ДІ 0,31-0,50; P<0,0001; N.J. Bahlis et al., 2020).
Рандомізоване дослідження III фази CASTOR. У дослідженні вивчали ефективність і безпеку ще однієї можливої терапевтичної опції при ррММ після 1-ї лінії терапії – даратумумаб + бортезоміб + дексаметазон (D-Vd) та порівнювали її зі схемою без даратумумабу (Vd). Пацієнти були рандомізовані на дві групи: D-Vd (n=251) та Vd (n=247). Підтримувальну терапію у групі D-Vd проводили даратумумабом. Після внесення змін до протоколу пацієнтам, які отримували Vd, пропонували монотерапію даратумумабом після прогресування захворювання. Оновлені результати дослідження свідчать про значне переважання медіани ВБП у групі D-Vd порівняно з Vd – 16,7 та 7,1 міс відповідно (ВР 0,31; 95% ДІ 0,25-0,40; P<0,0001). У хворих, котрі отримували попередню терапію, медіана ВБП становила 27,0 та 7,9 міс відповідно (ВР 0,22; 95% ДI 0,15‑0,32; P<0,0001). У хворих із рефрактерністю до леналідоміду медіана ВПБ становила 7,8 та 4,9 міс відповідно. Таким чином, застосування даратумумабу знижує ризик прогресування хвороби у пацієнтів з ррММ на 69%, а у хворих, які попередньо отримували терапію, – на 88%. Частка ЗВ у групах D-Vd та Vd становила 85 та 63% відповідно, ПВ досягнута у 30% хворих, які лікувалися даратумумабом, та у 10% – без даратумумабу. MRD-негативний статус підтверджений у 14 та 2% хворих, що приймали D-Vd та Vd відповідно (M.-V. Mateos et al., 2020).
На основі результатів досліджень POLLUX та CASTOR можна зробити такі висновки:
- при агресивному перебігу ММ, однією з ознак якого є ранній рецидив хвороби (≤12 міс після 1-ї лінії терапії), застосування схеми з даратумумабом істотно подовжує ВБП;
- у терапію пацієнтів старше 65 років можливе включення моноклональних антитіл, оскільки вони характеризуються прийнятним профілем безпеки та хорошою переносимістю;
- застосування даратумумабу зі стандартною схемою дозволяє подовжити ВБП у хворих на ММ із високим цитогенетичним ризиком;
- основними протипоказаннями до застосування даратумумабу є тяжкий перебіг хронічного обструктивного захворювання легень і бронхіальної астми; у таких випадках пацієнтам необхідно виконати функціональні дихальні тести (при зниженому об’ємі форсованого видиху за 1 с ≥50% не слід призначати даратумумаб).
 Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ, Україна), доктор медичних наук, професор Ірина Анатоліївна Крячок доповідь присвятила сучасному стану діагностики та лікування ММ у нашій країні.
Завідувачка науково-дослідного відділення хіміотерапії гемобластозів та ад’ювантних методів лікування Національного інституту раку (м. Київ, Україна), доктор медичних наук, професор Ірина Анатоліївна Крячок доповідь присвятила сучасному стану діагностики та лікування ММ у нашій країні.
– Основним показником роботи онкогематологічної служби в Україні є дані Національного канцер-реєстру. Рівень захворюваності на ММ в Україні нижчий, ніж у США та країнах Європи (2,4 на 100 тис. населення проти 6,2 та 4,1 тис. на 100 тис. населення відповідно). У всьому світі й Україні зокрема зберігається тенденція до збільшення кількості нових випадків захворювання. Невтішною є 5-річна загальна виживаність хворих на ММ, яка в Україні становить 25% (за даними Національного інституту раку США цей показник досягає 53,9%).
Стадіювання ММ відбувається за оновленою шкалою Міжнародної системи стадіювання (R-ISS, 2015), котра окрім рівня альбуміну та β2-мікроглобуліну (ISS, 2005) включає оцінку рівня лактатдегідрогенази та наявність цитогенетичних аномалій, а також за критеріями CRAB: C – збільшення рівня кальцію в крові (кальцій сироватки >10,5 мг/дл або вище норми), R – ниркова недостатність (рівень креатиніну в сироватці >2 мг/100 мл), A – анемія (рівень гемоглобіну <10 г/100 мл або на 2 г менше за норму), B – літичні ураження кісток або остеопороз. Для стратифікації ризику проводиться цитогенетичний аналіз: визначення транслокації t(4; 14), делеції del(17р) та транслокації t(14; 16), а також аномалії хромосоми 1. Пацієнти з ≥1 аномалією належать до групи високого ризику; відсутність аномалій свідчить про стандартний ризик для хворого. При оцінюванні ризику також враховуються й інші критерії, зокрема тривалість ремісії.
Уніфікований клінічний протокол щодо ведення пацієнтів з ММ уже застарілий, проте після набуття чинності наказу Міністерства охорони здоров’я України № 1422 від 29 грудня 2016 р. українські лікарі отримали можливість використовувати у своїй роботі міжнародні клінічні протоколи. Тому у клінічній практиці для лікування хворих на ММ застосовуються настанови NCCN та ESMO.
Що стосується діагностичних можливостей при ММ, то в Україні широко доступні рентгенографія, комп’ютерна томографія, позитронно-емісійна комп’ютерна томографія, дослідження кісткового мозку, магнітно-резонансна томографія всього тіла. Однак такі необхідні дослідження, як визначення М-градієнта, легких ланцюгів імуноглобулінів і FLC ratio, цитогенетичні аналізи, проводяться лише в кількох медичних центрах, що не дає змоги покрити усі потреби в них.
Першочергове завдання при обранні стратегії ведення пацієнта з ММ – визначення, чи є він кандидатом на проведення АТСК, після чого ухвалюється подальша тактика терапії. На сьогодні в Україні доступні більшість лікарських засобів, які входять у найновіші міжнародні стандарти лікування ММ: цитостатики, талідомід, леналідомід, помалідомід, бортезоміб, бендамустин, даратумумаб.
Важливим правилом ведення пацієнтів з ММ є застосування максимально ефективної комбінації у 1-й лінії терапії, що дає можливість досягти більш глибокої відповіді та тривалої ВБП і ЗВ.
У всьому світі золотим стандартом лікування ММ є АТСК. За даними Європейського товариства з трансплантації крові та кісткового мозку (EBMT), на 2018 р. всього було виконано 13 562 трансплантації стовбурових клітин (ТСК). У розрахунку на 100 тис. населення має виконуватися 6 ТСК. В Україні потреба в ТСК складає 190 операцій на рік. На сьогодні у нашій країні ТСК проводиться в 4 медичних центрах, у яких за 2019 р. загалом було виконано 52 ТСК.
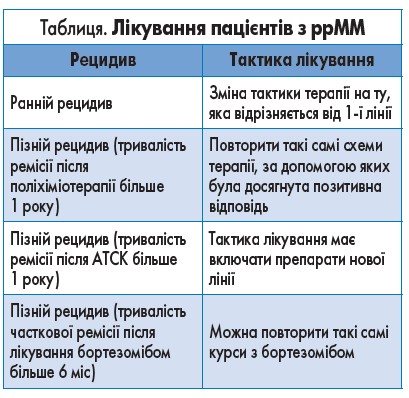 При вирішенні питання щодо подальшої терапії у пацієнта з ррММ необхідно відрізняти клінічний рецидив від біохімічного, коли виявляють підвищення рівня М-протеїну без наявності симптомів. У разі біохімічного рецидиву застосовують стратегію активного спостереження. За наявності симптомів, тобто клінічного рецидиву хвороби, потрібне лікування (H. Ludwig et al., 2012). При виборі тактики лікування ррММ необхідно враховувати час виникнення рецидиву після попередньої лінії терапії (табл.).
При вирішенні питання щодо подальшої терапії у пацієнта з ррММ необхідно відрізняти клінічний рецидив від біохімічного, коли виявляють підвищення рівня М-протеїну без наявності симптомів. У разі біохімічного рецидиву застосовують стратегію активного спостереження. За наявності симптомів, тобто клінічного рецидиву хвороби, потрібне лікування (H. Ludwig et al., 2012). При виборі тактики лікування ррММ необхідно враховувати час виникнення рецидиву після попередньої лінії терапії (табл.).
У цілому можливості діагностики та лікування хворих на ММ в Україні відповідають світовим стандартам, проте ще існують проблеми, які потребують негайного вирішення: доступність деяких діагностичних процедур і лікарських препаратів, забезпечення необхідної кількості аутологічних ТСК та створення умов для проведення алогенної ТСК.
Підготувала Ілона Цюпа
CP-199876
* В Україні не зареєстрований.
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (66) 2020 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...




