Набряк гортані як потенційно життєзагрожувальний прояв спадкового ангіоневротичного набряку: особливості перебігу, лікування, профілактика
Спадковий ангіоневротичний набряк (САН) – рідкісне потенційно життєзагрожувальне захворювання, що характеризується нападами шкірного та підслизового набряку. За допомогою наукових досліджень останніх кількох декад було виявлено, що патофізіологічним підґрунтям САН є дефіцит білка-інгібітора С1-естерази (С1-інгібітора) внаслідок мутації гена SERPING1 і брадикінін-опосередкований набряк (Donaldson V. H., Evans R. R., 1963; Rosen F. S. et al., 1965; Curd J. G. et al., 1980; Fields T. et al., 1983).
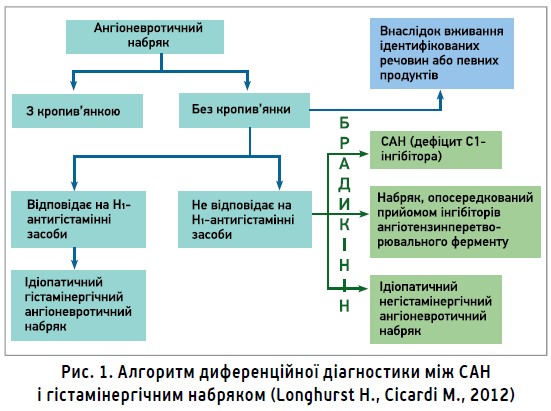 Брадикінінова природа набряку при САН є одним із провідних діагностичних критеріїв, які дозволяють відрізнити останній від гістамінергічного чи алергічного набряку за рахунок відсутності відповіді на гістаміноблокатори (рис. 1).
Брадикінінова природа набряку при САН є одним із провідних діагностичних критеріїв, які дозволяють відрізнити останній від гістамінергічного чи алергічного набряку за рахунок відсутності відповіді на гістаміноблокатори (рис. 1).
У 2000 р. було описано САН із нормальним рівнем С1-інгібітора (Binkley K. E., Davis A., 2000; Bork K. et al., 2000). Незважаючи на прогрес у розумінні патофізіології САН, донедавна спостерігалися значні затримки в установленні діагнозу, а ефективні методи лікування були відсутні (Busse P. J., Christiansen S. C., 2020).
Найважливіша передумова вчасного встановлення діагнозу САН – високий рівень настороженості лікаря. Рецидивуючі напади ангіонабряку з типовими характеристиками (асиметричність, відсутність свербежу, дефігурація набряклої частини тіла, висока щільність набряку) без кропив’янки, тяжкі абдомінальні симптоми (біль і набряк) чи їх поєднання мають змусити лікаря задуматися про ймовірність САН (Busse P. J., Christiansen S. C., 2020).
Одна з найважливіших проблем, асоційованих із САН, – напади набряку гортані (НГ). Хоча НГ становлять лише близько 0,9% усіх нападів, пацієнти із САН є групою ризику їх появи; приблизно в половини з них протягом життя щонайменше один раз відбувається епізод НГ (Zuraw B. L., 2008; Bork K. et al., 2012). Іноді летальний НГ може бути першим проявом САН (Bork K. et al., 2011).
Аналіз даних 123 пацієнтів із САН, проведений K. Bork і співавт. (2003), виявив епізоди НГ у 49,6% пацієнтів (61 хворий, 596 випадків НГ). Середній вік на момент першого епізоду НГ становив 26,2±15,3 року. Близько 80% усіх НГ спостерігалися у віці 11-45 років. Середній інтервал між початком і максимальним розвитком НГ складав 8,3 год. У 342 випадках НГ минув самостійно без лікування, а у 208 випадках загрозливий стан було проліковано за допомогою С1-інгібітора. Отже, основною групою ризику НГ є молоді дорослі та підлітки. Для запобігання фатальних наслідків слід детально інструктувати пацієнтів та їхніх родичів щодо розпізнавання ранніх ознак НГ і необхідних дій у такій ситуації.
Підвищений (порівняно з хворими зі встановленим діагнозом САН) ризик асфіксії та смерті в пацієнтів із САН, яким не встановлено цей діагноз, обґрунтовує доцільність обстеження всіх близьких родичів хворого із САН (Bork K. et al., 2012). Із цією метою рекомендовано застосовувати хромогенний аналіз (за умови доступності) як чутливіший метод або імуноферментний аналіз (Li H. H. et al., 2015). Якщо відомо про наявність мутації, для раннього встановлення діагнозу може застосовуватися геномне секвенування (Pedrosa M. et al., 2016; Farkas H. et al., 2017).
Нерідко пацієнти, в яких спостерігалися випадки необструктивного набряку ротової порожнини, а також лікарі, недостатньо обізнані з перебігом та небезпеками САН, недооцінюють потенційну загрозу (Longhurst H., Cicardi M., 2012). Особливо важливою є вчасна діагностика НГ у дітей у зв’язку з меншим діаметром повітроносних шляхів (Farkas H. et al., 2010).
K. Bork і співавт. (2012) проаналізували дані когорти 728 пацієнтів із САН з дефіцитом С1-інгібітора зі 128 родин щодо причин смерті та, зокрема, фатальних нападів НГ. Останній став причиною смерті в 70 випадках із 214 летальних наслідків у цій когорті. Смертність була вищою серед хворих, котрим не було встановлено діагноз САН. Тривалість життя пацієнтів з недіагностованим САН, які померли від асфіксії унаслідок НГ, була в середньому на 31 рік меншою, ніж тривалість життя хворих із САН, котрі померли від інших причин. Ретельне опитування близьких родичів і лікуючих лікарів дозволило виявити трифазовий перебіг фатальних НГ. Так, І фаза, охарактеризована як стан передзадишки, тривала в середньому 3,7±3,2 год (діапазон 0-11 год), II фаза (фаза задишки) – 41±49 хв (діапазон 2 хв – 4 год), а III фаза (фаза втрати свідомості) – 8,9±5,1 хв (діапазон 2-20 хв). Основними симптомами, пов’язаними з НГ, є задишка та втрата свідомості, а також дисфагія, стридор, зміни голосу, ціаноз, підвищений артеріальний тиск з переходом у гіпотензію. На думку авторів, фази фатального НГ не перекриваються, тобто I фаза розпочинається при появі перших симптомів, II фаза – за появи задишки, а III фаза – в разі втрати свідомості. Оскільки клінічний ефект внутрішньовенного введення С1-інгібітора проявляється через 15-42 хв, лікування необхідно розпочати у I фазі. Однак в разі блискавичного перебігу НГ медикаментозна терапія може не встигнути реалізувати свій ефект, тому доцільним буде застосування ендотрахеальної інтубації або крикотомії. У II фазі зазвичай недостатньо часу для введення С1-інгібітора, а очікувати на результат від введеного у I фазі препарату можна лише за умови повної готовності до крикотомії, оскільки інтубація може бути неуспішною чи потребувати занадто багато часу. III фаза є найкоротшою, тому в цьому періоді може бути застосована лише крикотомія.
Детальну інформацію щодо фатального НГ вдалося отримати щодо 36 пацієнтів. У 20 з них НГ спостерігався вперше. В 11 хворих набряк обличчя передував фатальному НГ, а в 7 – супроводжував його. Середній час між появою набряку обличчя та НГ становив 1,4 дня. Тригером фатального НГ у 8 із 36 пацієнтів була гостра респіраторна інфекція, в 6 – видалення зуба. В інших хворих тригерний чинник встановити не вдалося. Автори підкреслили, що наявність такого небезпечного ускладнення, як НГ, зумовлює необхідність активного виявлення, обстеження та лікування пацієнтів із САН.
Донедавна у світі не існувало схвалених Управлінням із контролю за якістю продуктів харчування та лікарських засобів США (FDA) препаратів для лікування САН, тому терапевтичні підходи обмежувалися підтримувальним лікуванням і спробами захистити дихальні шляхи від НГ. У деяких випадках успішно застосовувалася свіжозаморожена плазма, однак такий підхід асоціюється з ризиком посилення тяжкості нападу (Zuraw B. L., 2008). Протягом останнього десятиліття було схвалено кілька препаратів для застосування за вимогою.
Першим препаратом для прицільної довгострокової профілактичної терапії САН, схваленим FDA у 2008 р. для лікування САН із дефіцитом С1-інгібітора в підлітків і дорослих, став С1-інгібітор плазмового походження для внутрішньовенного введення Сінрайз («Такеда»). Підґрунтям для схвалення стали дослідження, які виявили, що профілактичне застосування препарату Сінрайз приблизно удвічі зменшує кількість нападів (Zuraw B. L. et al., 2010). Після отримання сприятливих результатів дослідження III фази у 2018 р. показання до застосування були розширені із включенням дітей віком >6 років (Aygören-Pürsün E. et al., 2019). Відкриті продовжені дослідження для цих пацієнтів виявили покращення наслідків за умов тривалого застосування препарату Сінрайз, а також його високу безпечність при такому застосуванні (Bernstein J. A. et al., 2014; Zuraw B. L., Kalfus I., 2012).
Існують 3 основні напрями лікування САН: короткострокова профілактика, довгострокова профілактика та лікування нападу (Busse P. J., Christiansen S. C., 2020).
Відповідно до рекомендацій Всесвітньої організації з алергії та Європейської академії алергії та клінічної імунології (2017), для невідкладного лікування нападу САН можуть застосовуватися С1-інгібітор, екалантид або ікатибант (Maurer M. et al., 2018).
K. Bork і S. Barnstedt (2001) проаналізували 517 випадків НГ, що спостерігалися в 42 пацієнтів. 18 пацієнтів (193 епізоди) отримували концентрат С1-інгібітора (500 або 100 МО). Часовий інтервал від введення препарату до припинення прогресування симптомів становив від 10 хв до 4 год (в середньому, 42,2±19,9 хв). Середня тривалість НГ серед пацієнтів, які отримували С1-інгібітор, складала 15,3±9,3 год, а серед хворих, котрі його не отримували,– 100,8±26,2 год. Було зроблено висновок, що С1-інгібітор є високоефективним і швидким методом усунення НГ.
Короткострокова профілактика показана перед медичними (в т. ч. хірургічними) та стоматологічними процедурами, які є відомими тригерами набрякових нападів (Bork K. et al., 2011; Zuraw B. L. et al., 2013). Перевагу слід віддавати С1-інгібітору плазмового походження, призначеному за 1-12 год (в ідеалі – приблизно за 2 год) до процедури. Ікатбант, екалантид і рекомбінантний людський С1-інгібітор для такої цілі не рекомендовані у зв’язку з коротшим періодом напіврозпаду. Даних щодо короткострокової профілактики САН з нормальним рівнем С1-інгібітора надзвичайно мало; ймовірно, доцільним є аналогічний підхід (Busse P. J., Christiansen S. C., 2020).
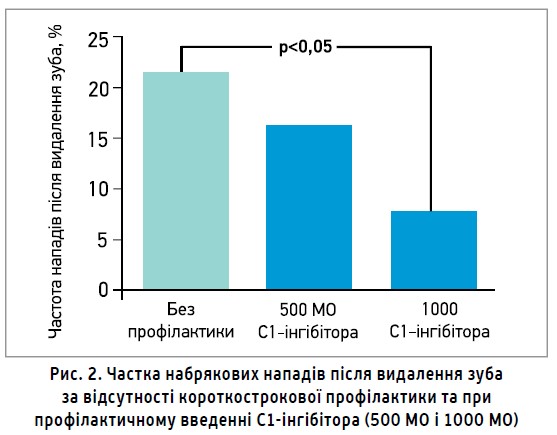 У дослідженні K. Bork і співавт. (2011) було оцінено частоту набрякових нападів після видалення зуба в 171 пацієнта із САН. За відсутності профілактики набряк обличчя або потенційно життєзагрозливий НГ спостерігався в 21,5% пацієнтів, а в разі короткострокової профілактики С1-інгібітором – лише в 12,5%. Середній час між видаленням зуба та розвитком нападу складав 14,3 год; фатальних випадків НГ зафіксовано не було. Автори виявили дозозалежну закономірність: серед пацієнтів, яким було введено 500 МО С1-інгібітора, набряки спостерігалися в 16%, а серед хворих, котрі отримали 1000 МО, – в 7,5% (рис. 2). Цікаво, що тяжкість процедури та попередній анамнез не корелювали з імовірністю появи набряку. Так, двом пацієнтам із САН із зазначеної у дослідженні когорти було видалено всі 32 зуби за один візит до стоматолога, однак жоден із них не зазнав набрякового нападу. Крім того, деякі хворі мали напади після попередніх видалень зубів, але в них не спостерігалися напади при видаленні, включеному до дослідження.
У дослідженні K. Bork і співавт. (2011) було оцінено частоту набрякових нападів після видалення зуба в 171 пацієнта із САН. За відсутності профілактики набряк обличчя або потенційно життєзагрозливий НГ спостерігався в 21,5% пацієнтів, а в разі короткострокової профілактики С1-інгібітором – лише в 12,5%. Середній час між видаленням зуба та розвитком нападу складав 14,3 год; фатальних випадків НГ зафіксовано не було. Автори виявили дозозалежну закономірність: серед пацієнтів, яким було введено 500 МО С1-інгібітора, набряки спостерігалися в 16%, а серед хворих, котрі отримали 1000 МО, – в 7,5% (рис. 2). Цікаво, що тяжкість процедури та попередній анамнез не корелювали з імовірністю появи набряку. Так, двом пацієнтам із САН із зазначеної у дослідженні когорти було видалено всі 32 зуби за один візит до стоматолога, однак жоден із них не зазнав набрякового нападу. Крім того, деякі хворі мали напади після попередніх видалень зубів, але в них не спостерігалися напади при видаленні, включеному до дослідження.
Для довгострокової профілактики в пацієнтів із САН, у т. ч. у вагітних та осіб із САН з нормальним рівнем С1-інгібітора, також успішно застосовуються С1-інгібітор плазмового походження (Сінрайз) (Bork K. et al., 2017; Zuraw B. L. et al., 2010; Garcia J. F.B. et al., 2018). Крім того, можуть призначатися моноклональні інгібіторні антитіла до плазмового калікреїну (ланаделумаб; в Україні не зареєстрований), атенуйовані андрогени (даназол), транексамова кислота (Busse P. J., Christiansen S. C., 2020). Відповідно до рекомендацій Всесвітньої організації з алергії і Європейської академії алергії та клінічної імунології (2017), схема довгострокової профілактики САН має бути індивідуалізованою зі врахуванням активності хвороби, частоти нападів, якості життя пацієнта, доступності медичної допомоги та можливості досягти контролю нападу за допомогою терапії за вимогою. Оскільки ці фактори можуть змінюватися з плином часу, довгострокову профілактику слід переглядати при кожному візиті до лікаря (щонайменше 1 р/рік). Із метою довгострокової профілактики С1-інгібітор плазмового походження слід вводити 2 р/тиж; доза та частота введення також потребують індивідуалізації. Пацієнти, котрі підлягають довгостроковій профілактиці, повинні також мати С1-інгібітор, екалантид або ікатибант для застосування за вимогою (Maurer M. et al., 2018).
Висновки
- САН – рідкісне захворювання, що часто супроводжується затримкою встановлення правильного діагнозу.
- НГ є найнебезпечнішим і потенційно життєзагрозливим проявом САН.
- Повноцінне лікування САН включає усунення гострого нападу, короткострокову та довгострокову профілактику.
- С1-інгібітор плазмового походження Сінрайз («Такеда») – єдиний препарат, що застосовується і для негайного усунення нападу САН, і для профілактики (як короткострокової, так і довгострокової).
Підготувала Лариса Стрільчук
Медична газета «Здоров’я України 21 сторіччя» № 23 (492), 2020 р.
СТАТТІ ЗА ТЕМОЮ Алергія та імунологія
Хронічна кропив’янка (ХК) – це патологія, яка характеризується рецидивними нестійкими висипаннями з/без ангіоневротичного набряку, які виникають мало не щодня впродовж більш як 6 тиж [1]. Розрізняють два варіанти ХК – хронічна індукована кропив’янка (ХІК), або фізична кропив’янка, зумовлена певними фізичними подразниками, такими як тиск, тепло або холод, і більш поширена хронічна спонтанна кропив’янка (ХСК), яка розвивається у 80-90% випадків і характеризується відсутністю відомих екзогенних чинників і причин [2]. На це захворювання страждає від 0,5 до 1% населення світу, переважно особи жіночої статі [3]. Повторні симптоми часто призводять до порушень сну та чинять виражений негативний вплив на якість життя (QoL) [4]. ...
Алергічний риніт (АР) є поширеним запальним захворюванням верхніх дихальних шляхів (ВДШ), особливо серед педіатричних пацієнтів. Ця патологія може знижувати якість життя, погіршувати сон та щоденну продуктивність. Метою наведеного огляду є надання оновленої інформації щодо епідеміології АР та його діагностики, з урахуванням зв’язку з бронхіальною астмою (БА). ...
Поширеність і вплив алергічних захворювань часто недооцінюють [1]. Ключовим фактором алергічної відповіді є імуноглобулін (Ig) Е, присутній на поверхні тучних клітин і базофілів. Взаємодія алергену з IgЕ та його рецепторним комплексом призводить до активації цих клітин і вивільнення речовин, у тому числі гістаміну, які викликають симптоми алергії [2]. Враховуючи ключову роль гістаміну в розвитку алергічних реакцій, при багатьох алергічних станах, включаючи алергічний риніт і кропив’янку, пацієнту призначають антигістамінні препарати [3, 4]....
Алергічний риніт (АР) – дуже поширений патологічний стан, що часто зумовлюється пилком трав і дерев, шерстю тварин, кліщами домашнього пилу та цвіллю. Оцінки його поширеності в різних регіонах Європи та світу дуже різняться [1, 2], але результати епідеміологічних досліджень демонструють, що на нього страждають до 30% дорослих людей і до 40% дітей. Симптоми можуть чинити значний негативний вплив на якість життя пацієнтів, часто заважати сну і сприяти поганій успішності на роботі та в школі. Крім того, АР є відомим фактором ризику розвитку бронхіальної астми; і, навпаки, ця коморбідність значно підвищується [2, 5-7]....




