Сучасні погляди на лікування акромегалії: вплив блокатора рецепторів гормону росту на коморбідні захворювання
У кінці листопада 2020 року відбулося чергове засідання в рамках освітнього проекту «Школа ендокринолога», присвячене актуальним проблемам ендокринології. Робоча програма заходу була дуже насиченою. Однією з обговорюваних тем стали особливості лікування акромегалії, яка належить до рідкісних, так званих орфанних, захворювань, що призводять до скорочення тривалості життя хворих або їх інвалідизації.
Свою доповідь «Акромегалія. Розбір клінічних випадків» лікар-ендокринолог ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), наукова співробітниця відділення загальної ендокринологічної патології Вікторія Миколаївна Клочкова почала з роз’яснення, що таке акромегалія.
Акромегалія – це нейроендокринне захворювання, зумовлене тривалою підвищеною секрецією гормону росту в осіб із завершеним фізіологічним ростом, яке характеризується патологічним диспропорційним періостальним ростом кісток, хрящів, м’яких тканин та порушенням периферичних ендокринних залоз.
У пацієнтів із підозрою на акромегалію спостерігаються зміни зовнішності – збільшення та огрубіння рис обличчя, збільшення розмірів кистей рук і стоп, язика, гірсутизм. Також хворих на акромегалію можуть турбувати гіпергідроз, постійний головний біль, біль у суглобах, зниження працездатності, порушення зору, серйозні зміни з боку серцево-судинної, дихальної, репродуктивної систем, що проявляються підвищеним артеріальним тиском (АТ), розвитком кардіоміопатії та серцево-судинної недостатності, враженням клапанів серця, синдромом обструктивного нічного апное. Хворих із клінічними проявами акромегалії необхідно обстежувати на наявність вузлового зобу, цукрового діабету (ЦД), поліпів (новоутворень) товстої кишки, остеоартритів, гіпогонадизму, гіперпаратиреозу, пухлини підшлункової залози.
У переважній більшості випадків основною причиною акромегалії є хронічна гіперсекреція соматотропного гормону (СТГ) через наявність аденоми гіпофіза. Такі зміни можуть бути зумовлені соматичною точковою мутацією субодиниці α білка G, що викликає симптоми неперервної активації рецептора соматоліберину (СРЛ) і призводить до посиленої проліферації соматотропних клітин і неконтрольованої секреції СТГ. Рідко захворювання викликає СРЛ, що продукується нейроендокринними пухлинами (карциноїдом) бронха, підшлункової залози та шлунково-кишкового тракту. Надлишкова секреція СТГ призводить до збільшення синтезу соматомединів у печінці та периферійних тканинах, в основному інсуліноподібного фактору росту (ІФР-1), який стимулює клітинне ділення в тканинах-мішенях, що проявляється гіпертрофією м’яких тканин і кісток.
На додаток до підвищеного рівня СТГ та ІФР-I сама пухлинна маса може спричиняти стиснення зорового нерву, хіазми, викликати головний біль, гідроцефалію та гіпопітуїтаризм.
Далі Вікторія Миколаївна запропонувала переглянути кілька клінічних випадків із власної практики, щоб краще розібратися в цій нозології.
Клінічний випадок 1
Пацієнтка Р., 27 років, звернулася до клініки зі скаргами на набряк обличчя та рук, надмірну вагу. З анамнезу захворювання стало відомо, що пацієнтка хворіє з 2016 року і на той момент у неї були скарги на головний біль, загальну слабкість, погіршення сну та пам’яті, порушення менструального циклу. Означені скарги турбували хвору протягом останніх п’яти місяців. Із ліків приймала достинекс 0,5 мг по 3 таблетки на тиждень.
На момент огляду лікарем-ендокринологом ріст пацієнтки складав 158 см, її вага була 106 кг, індекс маси тіла (ІМТ) – 42,5 кг/м2, АТ – 110/70 мм рт. ст., частота серцевих скорочень (ЧСС) – 68 уд./хв.
Загальний аналіз крові (ЗАК) і загальний аналіз сечі (ЗАС) та біохімічні показники були в межах норми. На електрокардіограмі (ЕКГ): ритм синусовий, ЧСС 64 уд./хв, нормальне положення електричної осі серця, вольтаж у нормі. Переважає електрична активність лівого шлуночка, незначні зміни в міокарді.
Пацієнтку було обстежено, їй призначено визначення пролактину, тиреотропного гормону (ТТГ), Т4 вільн. – для виключення гіпотиреозу, а також кортизолу у крові, дегідроепіандростерон-сульфату (ДГЕА-С), глікованого гемоглобіну (HbA1c) – для виявлення порушень вуглеводного обміну, рівень глюкози крові складав 3,9 ммоль/л.
Результати лабораторного дослідження:
- Пролактин – 1604,6 ммоль/л.
- ТТГ – 0,96 мкМО/мл (0,27-4,2).
- Т4 вільний – 0,79 нг/дл (0,89-1,76).
- Кортизол у крові – 6,2 мкг/дл (4,30-22,40).
- ДГЕА-С – 523 мкг/дл (65-380).
- HbA1c – 6,6%.
- Глюкоза в плазмі крові – 3,9 ммоль/л.
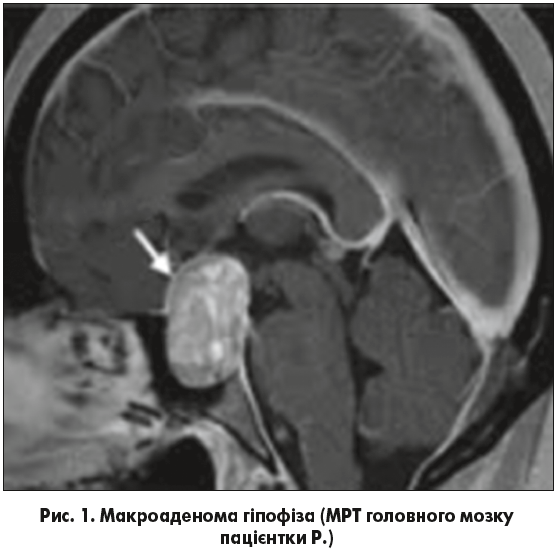
За результатами лабораторних досліджень виявлено, що рівень пролактину значно підвищений, ДГЕА-С підвищений, ТТГ, кортизол – у межах норми, Т4 знижений. Рівень HbA1c – підвищений, що може свідчити про порушення толерантності до глюкози або наявність ЦД. Високий рівень пролактину одразу має навести лікаря на думку, що це пролактинома, і оскільки магнітно-резонансна томографія (МРТ) є методом вибору для візуалізації пухлини гіпофіза, пацієнтці й було призначено МРТ головного мозку. На ньому виявлено макроаденому гіпофіза (рис. 1). Хвора також була оглянута офтальмологом і отоларінгологом, які ніяких значущих відхилень у здоров’ї жінки не виявили.
За результатами огляду, лабораторних та інструментальних досліджень пацієнтці запропоновано хірургічне лікування.
У квітні 2017 року в ДУ «Інститут нейрохірургії ім. акад. А.П. Ромоданова НАМН України» хворій було проведено операцію з мікрохірургічного трансназального транссептального видалення пухлини гіпофіза. Пухлину було досліджено патогістологічно та імуногістохімічно.
Результати досліджень:
- У патогістологічному дослідженні описано, що це хромофобно-еозинофільна макроаденома гіпофіза з дифузним типом росту.
- Результати імуногістохімічного дослідження:
- Кі‑7 експресія позитивна до 2%.
- Growth-Hormone, Human/bGH Ab‑3 (Close GH01/#2 +GH02/#7) – експресія слабопозитивна.
- Adrenocorticotrophic Hormone (ACTG) Ab‑1 – негативна.
- Prolactin (Clone SPM108) – позитивна.
- P53 (Clone Sp5) – експресія негативна.
Висновок: імуногістохімічне дослідження свідчить на користь хромофобно-еозинофільної макроаденоми гіпофіза з пролактиновою і слабо вираженою соматотропною функціональною активністю.
Отже, імуногістохімічне дослідження виявило не тільки функціональну активність пролактину, але й експресію гормону росту (ГР), що є свідченням, що це змішана аденома гіпофіза, яка продукує СТГ і пролактин.
Після хірургічного лікування були повторно проведені лабораторні дослідження.
Результати лабораторних досліджень:
- Пролактин – 0,9 нг/мл (2,8-29,2).
- Т4 вільний – 0,95 нг/дл (0,89-1,76).
- Кортизол у крові – 10,4 мкг/дл (4,30-22,40).
- ДГЕА-С – 296,9 мкг/дл (65-380).
- Соматомедин С – 644,86 нг/мл (116-358).
- СТГ – 0,794 нг/мл (<10).
Після оперативного втручання показники пролактину, кортизолу і ДГЕА-С та тироксину прийшли до норми. Але з огляду на те що імуногістохімічне дослідження виявило порушення з боку ГР, були проведені додаткові дослідження СТГ та соматомедину С і встановлено, що рівень соматомедину С вдвічі перевищував норму.
Лікування пацієнта з акромегалією має на меті досягнення біохімічних рівнів гормонів, для того щоб зменшити ризики смертності, симптоми прояву акромегалії, а також контролювати масу пухлини, функціональні особливості гіпофіза, оскільки було проведено хірургічне втручання.
На момент звернення до лікаря хвора скаржилася на набряки обличчя та рук, надмірну вагу, підвищення АТ, із ліків вона приймала достинекс 0,5 мг тричі на тиждень.
Відповідно до консенсусу з лікування акромегалії, якщо в пацієнта відсутнє значне підвищення ГР, а соматомедин С незначуще підвищений, препаратом першої лінії має бути призначений достинекс протягом 18 тиж; але в разі відсутності відповіді на терапію і недосягнення оптимальних вікових рівнів соматомедину С пацієнту обов’язково пропонують препарати лігандів соматотропних рецепторів.
Клінічний випадок 2
Пацієнт Н., 34 роки, поступив в ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України». Під час огляду лікар відразу звернув увагу на змінені риси обличчя: гіпертрофію і набряк, збільшений ніс, огрубіння рис обличчя і надбрівних дуг, непропорційно великі кисті рук, а також на підвищення АТ до 140/90 мм рт. ст.
З анамнезу хвороби: хворіє з 2016 року. З 2017 року оточуючі почали звертати увагу на зміни зовнішності хворого. У листопаді 2018 року чоловік був направлений на консультацію до ендокринолога. І лише в грудні 2018 року було проведено обстеження.
Загальні дані обстеження хворого:
- Зріст – 177 см, вага – 85 кг.
- АТ – 140/90 мм рт ст.
- ЕКГ: Синусовий регулярний ритм із ЧСС 68 уд./хв. Нормальне положення електричної осі серця. Помірні порушення метаболізму в міокарді.
- Заключення офтальмолога: Очне дно без патології. Поля зору в нормі.
- ЗАК, ЗАС, біохімічний аналіз крові – у межах норми.
- СТГ – 77 нг/мл (до 3).
- ТТГ – у нормі.
Після того як хворого оглянув нейрохірург, пацієнту було зроблено МРТ гіпофіза та призначене лікування.
МРТ головного мозку з внутрішньовенним контрастуванням у лікарні за місцем проживання. Розміри, розташування та форма турецького сідла не змінені, стінки чіткі, рівні. Гіпофіз розташований в типовому місці, звичайної форми, збільшений, розмірами 15/18,5/12,5 мм, права та ліва половини дещо асиметричні (D>S), верхній контур плаский; адено- та нейрогіпофіз без ознак патологічних змін; аденогіпофіз виражено збільшений в об’ємі, однорідного сигналу на всіх ІП, розмірами 11,5/18,5/12,5 мм; після внутрішньовенного введення контрастної речовини аденогіпофіз слабоінтенсивно однорідно підсилюється.
Лійка гіпофіза нормальних розмірів, структури та сигнальних характеристик, розташована серединно, шириною 1,5-2,5 мм.
Хіазма без особливостей. Ділянка гіпоталамуса без видимих ознак патологічних змін. Кавернозні синуси та сифони внутрішніх сонних артерій без особливостей.
Шишкоподібна залоза звичайної форми, розмірів, структури, має чіткі рівні контури. Патологічних змін візуалізованих відділів головного мозку не виявлено.
Заключення: МР-ознаки збільшення розмірів аденогіпофіза (макроаденома гіпофіза?).
Для дообстеження пацієнт був направлений в ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України».
Результати лабораторного дослідження:
- ТТГ – 3,67 мкМО/мл (0,27-4,2).
- СТГ – 60,6 нг/мл (до 3).
- ІФР-1 – 897 нг/мл (57,0-241,0).
- Пролактин – 28,18 нг/мл (4,04-15,2).
Отже, повторне лабораторне обстеження показало стійке підвищення СТГ та ІФР‑1. На МРТ – збільшення розміру гіпофіза та асиметрія правої й лівої половини. МР-ознаки збільшення розміру аденогіпофіза і, імовірно, макроаденома гіпофіза. Все це демонструє класичну клініку акромегалії: макроаденома в гіпофізі, підвищені рівні СТГ та ІФР‑1.
В інституті хворому було проведено рентгенографію легень і виявлено в проекції правого кореня додаткове утворення 70×30 мм однорідної структури. Межі серця розширені, що також часто спостерігається при акромегалії. У заключенні вказано про наявність рентгенологічних ознак новоутворення середнього відділу середостіння.
Рентгенографія легень. Рентгенограма пряма + права бічна проекції. Доза 0,6 мЗв. Легеневі поля без видимих та інфільтративних тіней. Легеневий малюнок помірно посилений у прикорневих відділах за рахунок бронхосудинного компоненту. У проекції правого кореня додаткове утворення округлої форми з чіткими рівними контурами орієнтовними розмірами 70×30 мм, однорідної структури. Межі серця розширені. Контури діафрагми рівні. Синуси вільні.
Заключення: Рентгенологічні ознаки новоутворення середнього відділу середостіння.
Після виявлених змін на рентгенограмі легень пацієнта направили на дообстеження – на комп’ютерну томографію (КТ) органів грудної клітки (ОГК).
КТ з внутрішньовенним контрастним підсиленням. На серії знімків мультизрізової КТ (МЗКТ) легені розправлені. У сегменті S6 правої легені з поширенням на сегмент S10 зазначається додаткове утворення з нерівними контурами, неоднорідної структури, розмірами до 53×54×72 мм, щільністю до +42HU з ознаками накопичення контрастної речовини (КР) + просвіт правого нижньодольового бронху нерівномірно звужений на 2/3 внаслідок інвазії, сегментарний бронх b6 правої легені з ознаками «ампутації», сегментарний бронх b10 нерівномірно звужений з наявністю консолідації паренхіми S10 правої легені. Стінка середньодольового бронху правої легені нерівномірно потовщена (імовірно через інвазію). Утворення має у своїй структурі поодинокі кальцифікати до 2 мм у діаметрі, щільно прилежить до правої головної гілки легеневої артерії, має у своїй структурі сегментарні гілки легеневої артерії справа (не можна виключити інвазії). Інша паренхіма обох легень без вогнищевих змін.
Заключення: МЗКТ ознаки центрального C-r правої легені вказаного поширення.
На КТ ОГК підтверджується, що в сегментах 6 і 10 правої легені дійсно є великі утворення неоднорідної структури, з нерівними контурами, які вже задіють бронхи (є «ампутація» бронхів). У заключенні вказано про можливий центральний рак правої легені вказаного поширення. Після отримання таких результатів пацієнт направлений на консультацію до торакального хірурга.
Після огляду торакальним хірургом встановлено діагноз: Карциноїд проміжного бронха справа? Пацієнту було зроблено ендоскопічне дослідження.
Фібробронхоскопія: справа проміжний бронх у середній третині, обтурований за рахунок компресії по мембрані від рівня другого кільця з інфільтративним ростом на верхівці. Біопсія.
Патогістологічне дослідження (медична лабораторія CSD). Заключення: Ектопічний соматостатин-продукований синдром. Карциноїд правої легені.
Карциноїд правої легені в 5% випадків може призводити до вироблення соматоліберину, який стимулює неконтрольований рівень СТГ.
Пацієнт був направлений на хірургічне лікування, у квітні 2019 року йому було проведено операцію: задньо-бокова торакотомія справа, нижньопластична білобектомія з медіастинальною лімфодисекцією. У лімфовузлах метастази не виявлені. Патогістологічне дослідження підтвердило припущення щодо карциноїду – нейроендокринна пухлина, першого ступеня карциноїд. Через місяць пацієнта було обстежено: СТГ, пролактин – у межах норми, ІФР‑1 підвищений, але не в 4 рази, як до операції, а лише вдвічі.
Результати лабораторних досліджень через місяць після операції:
- СТГ – 2,56 нг/мл (до 3).
- ІФР-1 – 437 нг/мл (57,0-241,0).
- Пролактин – 15,4 нг/мл (4,04-15,2).
Консенсус з акромегалії рекомендує проводити обстеження СТГ та ІФР‑1 в післяопераційному періоді не раніше ніж через 12 тижнів. При обстеженні прооперованого пацієнта через рік усі показники стали до норми, змінився і його зовнішній вигляд: набряк тканин зменшився, а також значно зменшилися кисті руки.
Обстеження на ІФР, СТГ призначають у разі, якщо в пацієнта:
- на МРТ виявлено пухлину гіпофіза, для того щоб виключити акромегалію;
- наявні клінічні ознаки акромегалії;
- наявні асоційовані з акромегалією порушення, зокрема: рівні ІФР-1 у пацієнтів без типових проявів акромегалії, але з наявністю кількох із перелічених нижче асоційованих станів: синдром апное уві сні, ЦД 2 типу, інвалідизуючий артрит, тунельний синдром зап’ястя, гіпергідроз та артеріальна гіпертензія.
Клінічний випадок 3
Пацієнтка М., 40 років, скаржилася на підвищену втомлюваність, поліурію, сухість у роті, відчуття розпирання в голові, сонливість, висипання на шкірі загального характеру, свербіж шкіри тощо. На одному із сайтів в інтернеті вона прочитала, що за наявності подібних симптомів необхідно перевірити рівень ІФР, СТГ та глюкози в плазмі крові, та зробила аналізи.
З анамнезу захворювання: хворіє з 2018 року.
Результати лабораторного дослідження:
- ІФР‑1 – 289 нг/мл (94-267); ІФР‑1 – 280,68 нг/мл (травень 2018 р.).
- СТГ – 3,38 нг/мл.
- HbA1c – 5,1%.
- Глюкоза в плазмі крові – 5,4 ммоль/л.
Як можна побачити з результатів, рівень ІФР‑1 (зроблений двічі) незначно підвищений щодо верхньої межі, при цьому рівні СТГ, HbA1c, глюкози крові – у межах норми. Далі жінка зробила МРТ головного мозку та гіпофіза з внутрішньовенним контрастуванням.
Заключення: МР змін вогнищевого чи дифузного характеру в речовині головного мозку не виявлено. МР ознак наявності новоутворень гіпофіза не виявлено.
Пацієнтку оглянув нейрохірург та рекомендував звернутися до ендокринолога.
На момент огляду та консультації ендокринологом пацієнтки її зріст складав 160 см, вага – 52 кг, АТ – 120/70 мм рт. ст.
ЕКГ: Синусова нормоаритмія, ЧСС 70-80 уд./хв. Нормальне положення електричної осі серця. Помірно виражені дифузні метаболічні зміни міокарда.
Заключення офтальмолога: Міопія середнього ступеня OU.
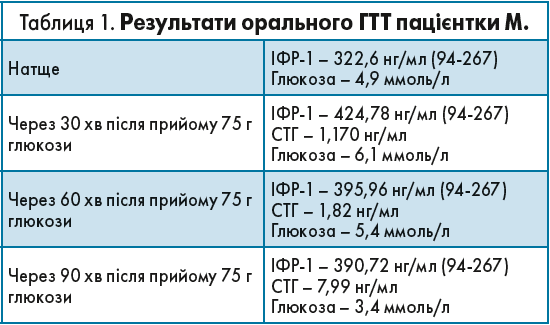
Результати ЗАК, ЗАС та біохімічного аналізу крові також не показали жодних відхилень від норми. Увагу ендокринолога привернуло лише незначне підвищення рівня ІФР‑1. У таких випадках хворим проводять глюкозотолерантний тест (ГТТ), щоб подивитись, як змінюється рівень ГР, ІФР‑1 на тлі гіперглікемії. На початку тестування перевіряють рівень ІФР‑1 та глюкози в плазмі натще (ГПН), потім пацієнт випиває 75 г глюкози, причому паралельно контролюють рівні глюкози, ІФР‑1 та СТГ. Результати ГТТ представлені в таблиці 1.
У консенсусі вказано, що рівень СТГ має знизитись у здорового пацієнта менше ніж на 1 мкг/л на тлі стійкого підвищення глюкози. У нашому випадку ГТТ продемонстрував, що рівень глюкози нормальний, але рівні ІФР‑1 і СТГ підвищилися. Пацієнтці запропоновано дообстеження: КТ органів середостіння, легень та МРТ середостіння, органів шлунково-кишкового тракту, оскільки є ектопічні пухлини, здатні виробляти ІФР‑1 і СТГ, і з часом це може проявитися симптомами акромегалії.
Наприкінці свого виступу Вікторія Миколаївна зазначила, що всі ці клінічні випадки показують, що зовнішній вигляд пацієнта може наводити лікаря на думку, що перед ним класичний приклад хворого на акромегалію. Але в процесі обстеження можна виявити бронхіальний карциноїд (нейроендокринні пухлини), змішані пухлини, будь-які початкові порушення ІФР‑1, які потребують подальшого спостереження. Кожен лікар-ендокринолог має знати, що акромегалія може супроводжуватися змінами в щитоподібній залозі, міокарді, з боку АТ, що в пацієнтів з акромегалією підвищений ризик розвитку раку товстого кишечнику. Безумовно, указана група пацієнтів потребує ретельного обстеження, лікуватися та спостерігатися вони мають в ендокринолога – для того щоб контролювати ці процеси і вчасно виявляти ускладнення.
«Лікування акромегалії: вплив блокатора рецепторів гормону росту на коморбідні захворювання» – такою була тема доповіді віце-президента Асоціації клінічних ендокринологів України, доктора медичних наук, професора Андрія Миколайовича Кваченюка (ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України»).
Професор А.М. Кваченюк звернув увагу на той факт, що більшість усіх ускладнень, смертей та інвалідизацій пацієнтів з акромегалією пов’язані безпосередньо з різними коморбідними захворюваннями – це й церебральні, серцево-судинні катастрофи, і розвиток онкологічної патології товстого кишечнику та інших органів, порушення вуглеводного обміну. Останнім часом основним препаратом в аспекті лікування акромегалії став блокатор рецепторів СТГ, який дає можливість ефективно і швидко впливати на розвиток коморбідних захворювань, зменшення смертності та інвалідизації.
Акромегалія – це анаболічне захворювання, воно впливає практично на всі органи й системи: на розвиток діастолічної дисфункції (2/3 пацієнтів мають дилатацію камер серця); на зміни в суглобах (у 3/4 пацієнтів виявляють артралгії, остеоартрити, остеопорози; неоплазії – практично вчетверо частіше це пухлини товстого кишечнику і щитоподібної залози); у кожного 3-го пацієнта розвивається ЦД, у кожного 2-го – порушення вуглеводного обміну; у 70% пацієнтів наявні цереброваскулярні захворювання, порушення респіраторної функції – нічне апное, рестриктивна легенева недостатність, яка може призвести в деяких випадках до летального результату. Практично єдиний не анаболічний ефект – апластичний: збільшення зростання аденоми (гіпопітуїтаризм). Кожен лікар має пам’ятати, що зі збільшенням аденоми гіпофіза відбувається атрофія, витіснення всіх інших ростків гіпофіза та гіперпролактинемія внаслідок блокади дофамінових пучків і, як наслідок, гіперпродукція гормону пролактину – вважається, що він грає певну роль у патогенезі акромегалії. Це тяжке хронічне нейроендокринне захворювання, ступінь тяжкості якого напряму залежить від наявності в пацієнта коморбідних патологій. Їх вчасне лікування полегшує терапію хворих на акромегалію і знижує рівень смертності та інвалідизації. У цьому лікарю-ендокринологу допоможе препарат пегвісомант. У багатьох випадках блокатор рецепторів СТГ є практично єдиним препаратом вибору.
Як уже згадувалося, акромегалія належить до орфанних захворювань. На жаль, і сьогодні правильний діагноз встановлюють від 5 до 15 років (у середньому через 8 років) після виникнення цього захворювання. Це пов’язано з мультисимптоматикою, тим, що багато скарг, характерних не лише для акромегалії, а й для коморбідних патологій, маскують акромегалію. За протоколом, якщо в пацієнта є такі клінічні симптоми: головний біль, змінене обличчя, виснаження, втома, гіперпролактинемія, надмірне потовиділення, симптом зап’ястного каналу, набряк м’яких тканин, функціональні порушення з боку репродуктивної системи, біль у суглобах, збільшення розмірів і потовщення стопи й долонь, – необхідно перевірити рівень ІФР‑1, щоб виявити акромегалію на більш ранній стадії.
Супутні захворювання призводять до легеневих і респіраторних загострень у 8% пацієнтів; гіпертрофію серця – у 60%, а також – метаболічні порушення, ЦД, шлунково-кишкові розлади, онкологічні патології та інші. Під час огляду пацієнта лікар має звертати увагу на його статуру, риси обличчя: у 95% осіб з аденомою гіпофіза потовщуються лобові кістки черепа, змінюється та збільшується ніс, а також губи, спостерігається макроглосія і збільшення щитоподібної залози. Уважність лікаря до пацієнта допоможе вчасно поставити правильний діагноз і почати відповідне лікування.
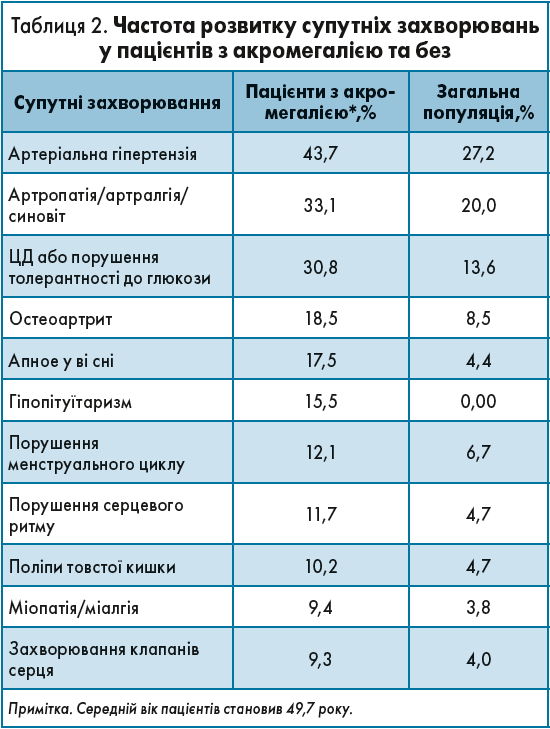
Усі коморбідні патології, які зумовлюють інвалідизацію і летальність, достовірно частіше спостерігаються у хворих на акромегалію, якщо порівняти із загальною популяцією (табл. 2).
Спікер нагадав, що в патогенезі акромегалії ключову роль грає гіперпродукція СТГ, аденома гіпофіза. Основні дії СТГ – глюконеогенез, ліполіз і, найголовніша, – стимуляція синтезу ІФР‑1, який виробляється в основному в печінці, у периферійних тканинах серця, м’язів та нирок. Таким чином, усі подальші анаболічні дії гормону зумовлені ІФР‑1, який діє як паракринним, так і аутокринним методом. Усі анаболічні впливи на всю супутню патологію є ефектом ІФР‑1. При лікуванні акромегалії головним біохімічним маркером контролю та маркером ефективності лікування є ІФР‑1. І саме підвищений рівень ІФР‑1 – основна причина клінічної маніфестації цього захворювання, розвитку супутніх патологій та суттєвого погіршення якості життя пацієнтів.
ІФР‑1 як основний діагностичний маркер акромегалії:
- відповідальний за більшість клінічних проявів акромегалії;
- вміст ІФР‑1 відображає середній рівень СТГ за попередній день;
- рівень ІФР‑1 на відміну від СТГ не піддається коливанням протягом короткого періоду часу внаслідок тривалого періоду «напівжиття»;
- навіть «нормальний» рівень СТГ супроводжується підвищенням концентрації ІФР‑1 при акромегалії.
Механізм дії блокатора рецепторів СТГ препарату пегвісомант
Цей аналог людського СТГ діє як його антагоніст, зв’язуючися з рецепторами гормону росту. Афінність речовини до рецепторів у тисячу разів більша за природний людський СТГ, що зворотно-конкурентно з’єднується й блокує передачу сигналу через рецептор СТГ та продукцію ІФР‑1 – головного анаболічного фактору, який зумовлює тяжкість стану, інвалідизацію та, у деяких випадках, летальність. У результаті прийому цього препарату можуть зникати симптоми та коморбідні захворювання, що вкрай важливо, адже кількість таких хворих останніми роками збільшилась.
Опубліковане в Journal of Endocrinological Investigation дослідження показує, що акромегалія впливає на вуглеводний обмін у 50% пацієнтів, на розвиток ЦД – у 30%, на порушення толерантності до вуглеводів – у майже 24%.
На тлі прийому пегвісоманту знизились:
- рівні ГПН у пацієнтів із ЦД;
- рівні ГПН у пацієнтів без діабету;
- рівні HbA1c;
- рівень інсуліну при оральному ГТТ.
Вплив пегвісоманту асоціюється зі значущим поліпшенням глікемічного контролю і зменшенням дози гіпоглікемічної терапії.
Пегвісомант є лікувальним фактором не лише для пацієнтів з акромегалію, він також зменшує необхідність у гіпоглікемічних препаратах у хворих на ЦД.
У реєстрі хворих на акромегалію ACROSTUDY (Pfizer International Somavert Database) є дані пацієнтів з акромегалією, які отримували препарат Somavert (пегвісомант) у різних варіантах терапії. Це дослідження містить опис клінічної ситуації і терапії 2200 пацієнтів із Німеччини, Франції, Італії, США, Греції та багатьох європейських країн (усі дані зібрано з 2004 року). Випробування порівнювало пацієнтів із супутнім діабетом та без нього.
Нижче наведені вихідні характеристики пацієнтів, включених у німецьку когорту дослідження ACROSTUDY, принаймні з одним контрольним оглядом. Так, згідно зі статистикою обсерваційного дослідження німецької когорти ACROSTUDY:
- 514 пацієнтів з акромегалією отримували лікування пегвісомантом;
- 147 пацієнтів мали супутній ЦД.
Було зроблено висновки:
- Нормалізація ІФР‑1 була значно ефективнішою в осіб без діабету.
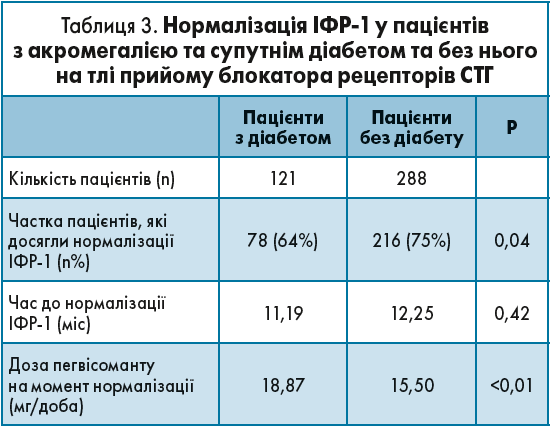
- Менше пацієнтів із діабетом досягали нормалізації ІФР‑1, ніж пацієнти без діабету (64 проти 75%; р=0,04).
- Зниження рівнів HbA1c протягом перших 6 міс (терапії) було значущим тільки в пацієнтів, які отримували монотерапію пегвісомантом (р<0,01) та незалежно від суттєвого зниження рівнів ІФР‑1.
Такими були результати патогенетичного лікування блокатором рецепторів СТГ, який безпосередньо впливає на ускладнення та на супутні захворювання. Важливо підкреслити, що завдяки пегвісоманту лікар може контролювати цукровий обмін у пацієнтів з акромегалією. Незважаючи на те що нормалізація ІФР‑1 була ефективнішою в пацієнтів без ЦД, у хворих на діабет прийом пегвісоманту також сприяв значній нормалізації показників, але це потребувало більш тривалого часу та більш високої дози препарату (табл. 3). Зниження HbA1c відбувалося при монотерапії пегвісомантом незалежно від значущого зниження рівнів ІФР‑1 в обох групах.
Отже, ми можемо зробити висновок, що комбіноване лікування акромегалії, до якого входять аналоги соматостатину, пов’язані з підвищенням рівня глюкози, але монотерапія пегвісомантом дає можливість контролювати порушення цукрового обміну. Більш декомпенсований ЦД потребує більшої дози пегвісоманту. Найнижча доза препарату необхідна пацієнтам з акромегалією, але без діабету, більша – хворим на діабет, але без прийому інсуліну, і найвища доза – хворим на інсулінотерапії, для досягнення максимально ефективного результату. Більшість відомих вчених-ендокринологів вважають, що це може бути пов’язано з великою кількістю печінкових рецепторів до ГР у пацієнтів із ЦД. Таким чином, у пацієнтів з акромегалією в поєднанні з ЦД інший патогенетичний розвиток – збільшення кількості рецепторів до ГР в печінці.
Значуще обтяжують стан хворих на акромегалію кардіоваскулярні катастрофи (понад 54%). Результати дослідження німецьких вчених Берга та співавт. демонструють, що через 12 міс лікування препаратом пегвісомант відсоток пацієнтів з акромегалією з проміжною або високою вірогідністю розвитку ішемічної хвороби серця (ІХС) протягом 10 років знизився з 61,3% до 50%. Середньою дозою лікарського засобу через 12 міс була 16,8 мг/добу. Тобто згідно з цим дослідженням використання пегвісоманту – або в якості монотерапії, або в комбінованому лікуванні – покращує віддалені наслідки серцево-судинних катастроф та ІХС.
Було також опубліковано цікаву роботу щодо впливу пегвісоманту на серцеві аритмії. У статті йшлося про відкрите проспективне дослідження, в якому через 18 міс лікування пегвісомантом у середній дозі 25 мг/добу:
- у 85% пацієнтів нормалізувався рівень ІФР‑1;
- значуще зменшилася маса міокарда лівого шлуночка (р=0,05);
- значуще зменшилася середня, мінімальна і максимальна ЧСС (р=0,03, р=0,05, р=0,05 відповідно);
- зменшилося число випадків порушення провідності з 15% до 7,7%.
Підбиваючи підсумки свого виступу, професор А.М. Кваченюк наголосив на позитивному впливі пегвісоманту на супутні захворювання серцевої та респіраторної системи:
- У пацієнтів із високою резистентністю до аналогів соматостатину тривале лікування (≥18 міс) комбінованою терапією з пегвісомантом індукувало значне зниження серцевої маси (при гіпертрофії міокарду).
- Пегвісомант надав сприятливий вплив на ритмічність діяльності серця, товщину стінки сонних артерій і артеріальний тиск.
- Найчастіше респіраторне ускладнення – синдром обструктивного апное сну, поширеність якого сягає до 80%. Лікування пацієнтів пегвісомантом із цією супутньою патологією покращує їхній стан.
- Досягнення біохімічного контролю, отриманого за допомогою пегвісоманту, повязане із загальним поліпшенням показників апное та зі значним зменшенням розмірів язика.
Крім вищезазначених параметрів німецькі вчені вивчали й скарги хворих на акромегалію – на головний біль, пітливість, біль у суглобах, втомлюваність, набряк м’яких тканин, оніміння кінцівок. Автори згаданого обсерваційного дослідження довели, що використання пегвісоманту супроводжується поліпшенням усіх симптомів, покращанням емоційного стану пацієнтів. При акромегалії задоволеність лікуванням, якість життя і стан депресії корелюють один з одним. У клінічній практиці задоволеність лікуванням може бути поліпшено шляхом тіснішої взаємодії з пацієнтами, і це може сприяти як покращанню якості життя, так і усвідомленому ставленню до свого лікування.
Підготувала Юлія Золотухіна
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 4 (52) 2020 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
21 березня в рамках II Міжнародної школи «Сучасний лікар: від теорії до практики» професор кафедри ендокринології Львівського національного медичного університету ім. Данила Галицького, лікар-ендокринолог вищої категорії, доктор медичних наук Вікторія Олександрівна Сергієнко представила доповідь, присвячену хронічним ускладненням цукрового діабету (ЦД). Зокрема, було акцентовано увагу на причинах розвитку діабетичної полінейропатії (ДП), розглянуто клінічні варіанти цього ускладнення, діагностичні підходи та основні принципи лікування. Пропонуємо огляд цієї доповіді у форматі «запитання – відповідь»....
Останніми десятиліттями в усьому світі спостерігалося значне зростання поширеності цукрового діабету (ЦД), що зумовило серйозні наслідки стосовно якості життя населення, а також спричинило певний тягар для системи охорони здоров’я та економічні витрати [1]. За даними Діабетичного атласу Міжнародної діабетичної федерації (International Diabetes Federation Diabetes Atlas), у 2021 р. ≈537 млн людей мали ЦД і, за прогнозами, до 2045 р. цей показник досягне 783 млн [2]. Значна захворюваність і підвищена смертність асоційовані з пов’язаними із ЦД макросудинними (інфаркт міокарда, інсульт) і мікросудинними (сліпота, ниркова недостатність, ампутації) ускладненнями [3]....
За визначенням Всесвітньої організації охорони здоров’я, цукровий діабет (ЦД) – це група метаболічних розладів, що характеризуються гіперглікемією, яка є наслідком дефектів секреції інсуліну, дії інсуліну або обох цих чинників. За останні 15 років поширеність діабету зросла в усьому світі (Guariguata et al., 2014). Згідно з даними Diabetes Atlas (IDF), глобальна поширеність діабету серед осіб віком 20-79 років становила 10,5% (536,6 млн у 2021 році; очікується, що вона зросте до 12,2% (783,2 млн у 2045 році (Sun et al., 2022). Наразі триває Програма профілактики діабету (ППД), метою якої є визначити, які підходи до зниження інсулінорезистентності (ІР) можуть допомогти в створенні профілактичних заходів ЦД 2 типу (The Diabetes Prevention Program (DPP), 2002). У цьому світлі визначення впливу вітаміну D на розвиток ЦД є актуальним питанням....
Внутрішній біологічний годинник людини тісно та двоспрямовано пов’язаний зі стресовою системою. Критична втрата гармонійного часового порядку на різних рівнях організації може вплинути на фундаментальні властивості нейроендокринної, імунної та вегетативної систем, що спричиняє порушення біоповедінкових адаптаційних механізмів із підвищеною чутливістю до стресу й уразливості. Поєднання декількох хвороб зумовлює двоспрямованість патофізіологічних змін....