Хвороба Грейвса та її наслідки: сучасний стан проблеми
Напередодні весни відбулась онлайн-конференція в рамках науково-освітнього проєкту «Школа ендокринолога». У заході взяли участь провідні вітчизняні фахівці, які у своїх доповідях розповіли про актуальні проблеми й основні сучасні тенденції лікування і діагностики в клінічній ендокринології. За традицією зі вступною промовою звернувся до учасників конференції науковий керівник науково-освітнього проєкту «Школа ендокринолога» – президент Української асоціації клінічних ендокринологів, директор ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України» (м. Київ), академік НАМН України, член-кореспондент НАН України, завідувач кафедри ендокринології Національного університету охорони здоров’я (НУОЗ) України ім. П.Л. Шупика МОЗ України (м. Київ), доктор медичних наук, професор Микола Дмитрович Тронько. Незмінним модератором заходу була керівник відділу клінічної діабетології ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», доктор медичних наук Любов Костянтинівна Соколова.
Ключові слова: аутоімунна офтальмопатія, ендокринна тиреотоксична офтльмопатія, хвороба Грейвса, екзофтальм
Із доповіддю «Аутоімунна офтальмопатія за хвороби Грейвса. Погляд офтальмолога» виступила завідувач Науково-практичного центру офтальмологічних ускладнень у хворих з ендокринною патологією ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», кандидат медичних наук Катерина Миколаївна Тронько.
 Аутоімунна офтальмопатія (АІО), асоційована із хворобою Грейвса (ХГ), – аутоімунне захворювання, патогенетично пов’язане з дифузним токсичним зобом (ДТЗ). Проявляється патологічними змінами в м’яких тканинах орбіти з вторинним залученням ока і характеризується вираженим екзофтальмом і обмеженням рухливості очних яблук.
Аутоімунна офтальмопатія (АІО), асоційована із хворобою Грейвса (ХГ), – аутоімунне захворювання, патогенетично пов’язане з дифузним токсичним зобом (ДТЗ). Проявляється патологічними змінами в м’яких тканинах орбіти з вторинним залученням ока і характеризується вираженим екзофтальмом і обмеженням рухливості очних яблук.
Для визначення ступеня тяжкості ендокринної офтальмопатії лікарі застосовують класифікацію згідно з консенсусом Європейської групи з вивчення офтальмопатії Грейвса (EUGOGO):
- екзофтальмопатія (ЕОП), що загрожує втратою зору (оптична нейропатія і/або пошкодження рогівки), потребує екстреного лікування;
- ЕОП помірної тяжкості характеризується відсутністю ризику втрати зору. У пацієнтів із помірною ЕОП спостерігають ≥1 з таких ознак:
- - ретракція повіки ≥2 мм;
- - помірно виражені зміни м’яких тканин очниці;
- - екзофтальм ≥3 мм вище норми для відповідної статі й раси;
- - непостійна або постійна диплопія.
- легка ЕОП, яка супроводжується незначним погіршенням якості життя і має ≥1 з таких ознак:
- - ретракція повіки <2 мм;
- - незначні зміни м’яких тканин очниці;
- - екзофтальм вище норми для відповідної статі й раси <3 мм;
- - транзиторна диплопія або відсутність диплопії;
- - ураження рогівки з позитивною відповіддю на лікування очними мазями.
Розрізняють АІО в активній і пасивній фазі. В активній фазі оцінка активності ЕОП ґрунтується на класичних ознаках запалення: спонтанний ретробульбарний біль, біль при погляді вгору і вниз, почервоніння повік, ін’єкція кон’юнктиви, набряк повік, хемоз, запалення півмісяцевої складки і слізного м’ясця. Наявність симптому оцінюється в 1 бал, у разі ≥3 балів ЕОП вважається активною. (шкала клінічної активності – CAS). За підозри активної фази лікар має призначити додаткові обстеження:
- візометрію;
- тонометрію за Маклаковим;
- обстеження орбітального статусу (зокрема, екзофтальмометрію, визначення обсягу рухів ока, ширини очної щілини та ін.);
- біомікроскопію;
- офтальмоскопію (обстеження очного дна);
- комп’ютерну периметрію (уточнення поля зору);
- дослідження колірного зору (за таблицями Рабкіна);
- комп’ютерну томографію (КТ) орбіт в двох проєкціях з обов’язковою денситометрією м’яких тканин;
- ультразвукове В-сканування;
- у разі виявлення ознак оптичної нейропатії – оптичну когерентну томографію диска зорового нерва (ДЗН) і макулярної ділянки, а також імпульсну доплерографію для оцінки кровотоку в судинах ока й орбіти.
Клінічний випадок
13.02.2018.
Офтальмологічне обстеження хворої К., 73 роки:
Vis OD = 0,3 н/к (не коригує).
Vis OS = 0,1 н/к.
Внутрішньоочний тиск (BOT) OD = 17 мм рт. ст.
BOT OS = 19 мм рт. ст.
Екзофтальмометрія (EOМ) OD = 26 мм
EOМ OS = 24 мм
Хвора скаржиться на сльозотечу, світлобоязнь, різі, печіння в очах, відчуття «піску» та стороннього тіла, в них, тиск на очі, болі в очних яблуках та обмеження їх руху в усіх напрямках.
Результати попереднього огляду хворої офтальмологом за симптомами:
- Грефе – відставання верхньої повіки від краю райдужки при русі очного яблука вниз – «+».
- Кохера – відставання очного яблука від верхньої повіки при погляді вгору, через що між верхньою повікою і райдужкою спостерігається ділянка склери – «+».
- Краузе – посилений блиск очей – «+».
- Дальрімпля – широке розкриття очних щілин, «здивований погляд» – «+».
- Розенбаха – дрібне й швидке тремтіння опущених або злегка зімкнутих повік – «+».
- Штельвага – рідкісні й неповні мигальні рухи в поєднанні з ретракцією верхньої повіки – «+».
- Мебіуса – порушення конвергенції – «+».
Також під час огляду:
- Повіки набряклі, визначається гіперемія, набряк кон’юнктиви, ін’єкція судин склер.
- Рогівка OU: ознаки дегенерації епітелію, зниження рогівкових рефлексів.
- Кришталик: OD – інтраокулярна лінза, задня капсула кришталика частково мутна, OS – повне помутніння кришталика.
- Очне дно: OD під флером – ДЗН блідно-рожевий, межі чіткі, артерії і вени звужені, звивисті, OS – не офтальмоскопується.
Діагноз: Ендокринна тиреотоксична офтальмопатія тяжкого ступеня, активна фаза OU. Кератопатія OU. Артифакія OD. Вторинна катаракта OD. Зріла катаракта OS.
Пацієнтці рекомендовано:
- Ультразвукове дослідження (УЗД) орбіт.
- Пульс-терапія.
- Солкосерил 20% (очний гель) – закладати за нижню повіку тричі на добу в обидва ока.
- Окомістин – по 1 краплі 4 рази на добу.
- Тіотриазолін 1% (очні краплі) – по 1 краплі 4 рази на добу.
Через 6 днів (19.02) стан хворої погіршився. Було встановлено діагноз: Ендокринна тиреотоксична офтальмопатія тяжкого ступеня, активна фаза OU. Кератопатія OU. Бактеріальний кератит OU. Артифакія OD. Вторинна катаракта OD. Зріла катаракта OS.
Рекомендовано:
1. Флоксал 0,3% (очна мазь) – закладати за нижню повіку тричі на добу в обидва ока.
2. Тобрекс 0,3% (очні краплі) – по 1 краплі 4 рази на добу.
3. Окомістин 0,01% (очні краплі) – по 1 краплі 4 рази на добу.
4. Солкосерил 20% (очний гель) – закладати за нижню повіку тричі на добу в обидва ока.
22.02.2018.
Діагноз не змінився, але після початку лікування ерозії рогівки зменшилися, і було рекомендовано зменшити антибактеріальну терапію:
- Флоксал 0,3% (очна мазь) – закладати за нижню повіку двічі на добу в обидва ока.
- Тобрекс 0,3% (очні краплі) – по 1 краплі тричі на добу.
- Солкосерил 20% (очний гель) – закладати за нижню повіку тричі на добу в обидва ока.
- Хіло-комод форте (очні краплі) – 5-6 разів на добу.
Хворим із пошкодженням рогівки рекомендовано часте використання очних мазей (без консервантів), зволожувачів та інші тимчасові заходи до загоєння рогівки (Солкосерил, Корнерегель, Тіотриазолін, Хіло-комод форте). У разі перфорації/виразки рогівки і бактеріального кератиту до терапії додають антибактеріальні препарати і вирішують питання щодо екстреної кератопластики (тобраміцин, ципрофлоксацин, офлоксацин, моксифлоксацин). За умови стабілізації процесу необхідно продовжити лікування, спрямоване на поліпшення змикання повік, для запобігання пошкодженню рогівки.
Дуже важливе значення в лікуванні ЕОП має пульс-терапія. Відносні протипоказання до її призначення:
- задня субкапсулярна катаракта;
- підвищення внутрішньоочного тиску (глаукома);
- вторинна грибкова або вірусна очна інфекція, очні прояви простого герпесу;
- язва і перфорація рогівки;
- тромбоз центральної вени сітківки;
- проліферативна діабетична ретинопатія.
Перед пульс-терапією хворим необхідно призначити сльозозамінники (Хіло-комод форте, Відісік, Корнерегель, Офтагель). При неповному змиканні повік доцільне застосування мазей на ніч для захисту рогівки, антисептиків (Окомістин, Офтальмодек), для компенсації підвищення внутрішньоочного тиску (глаукома) – бета-адреноблокатори, інгібітори карбоангідрази.
Два місяці потому під час повторного огляду пацієнтки було виявлено:
- зменшення активності й тяжкості захворювання;
- зменшення екзофтальму на 2 мм;
- збільшення рухливості ока більш як на 8 градусів у будь-якому напрямку;
- збільшення гостроти зору більш як на 1/10.
При вираженому екзофтальмі для декомпресії орбіти, корекції косокоості рекомендують реконструктивну хірургію (кісткову чи жирову) – операцію на леваторі (при ретракції верхньої повіки) та блефаропластику. Реконструктивна хірургія косоокості й повік при неактивній ЕОП ефективніша. Реконструктивну депресію орбіти треба виконувати в пацієнтів з еутиреозом і неактивною (принаймі впродовж 6 міс) ЕОП.
Основні показання для декомпресії орбіти:
- підтверджена під час КТ або магнітно-резонансної томографії (МРТ) компресійна нейропатія зорового нерва, що проявляється вираженим погіршенням зору;
- компресійна нейропатія зорового нерва, яка зберігається після медикаментозного і променевого лікування;
- загроза підвивиху з орбіти очного яблука або значне пошкодження рогівки внаслідок надзвичайно вираженого екзофтальму;
- із косметичних міркувань – зокрема, для корекції екзофтальму і косоокості через фіброз окорухових м’язів.
Тему ХГ продовжила у своєму виступі старший науковий співробітник НУОЗ України ім. П.Л. Шупика, ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», кандидат медичних наук Оксана Ярославівна Самсон.  Вона докладно освітила аспекти алгоритму ведення хворих на ХГ згідно з оновленими європейським протоколом 2018 року від Європейської тиреоїдної асоціації (European Thyroid Association – ETA) – Guidelines for the Management of Graves’ hyperthyroidism (ЕТА 2018) і американським 2016 року від Американської тиреоїдної асоціації (American Thyroid Association – АТА) – Guidelines for the Diagnosis and Management of Hyperthyroidismand other causes of Thyrotoxicos (АТА 2016).
Вона докладно освітила аспекти алгоритму ведення хворих на ХГ згідно з оновленими європейським протоколом 2018 року від Європейської тиреоїдної асоціації (European Thyroid Association – ETA) – Guidelines for the Management of Graves’ hyperthyroidism (ЕТА 2018) і американським 2016 року від Американської тиреоїдної асоціації (American Thyroid Association – АТА) – Guidelines for the Diagnosis and Management of Hyperthyroidismand other causes of Thyrotoxicos (АТА 2016).
ХГ – системне аутоімунне захворювання, яке розвивається в результаті продукції стимулюючих антитіл до рецепторів тиреотропного гормону (АТ до рТТГ) і клінічно проявляється ураженням щитоподібної залози (ЩЗ) з розвитком тиреотоксикозу в поєднанні з екстратиреоїдною патологією (ЕОП, претібіальна мікседема).
За останніми епідеміологічними даними, ХГ є найпоширенішою причиною гіпертиреозу в йод-забезпечених географічних районах із частотою 20-30 випадків на 100 тис населення щороку. Поширеність ХГ в популяції становить 1-1,5%, частіше – у жінок. Приблизно в 3% жінок і в 0,5% чоловіків упродовж життя розвивається ХГ. Пік захворюваності припадає на пацієнтів віком 30-60 років, зі збільшенням захворюваності в афроамериканців.
Етіологія ХГ
Це мультифакторне захворювання, у разі якого генетичні особливості імунного реагування реалізуються під впливом факторів довкілля. В європейському протоколі подані основні чинники розвитку ХГ:
- асоціація з гаплотипами головного комплексу гістосумісності HLA-DR3 і HLA-DR4. Наявність Т-лімфоцитарного антигену‑4; протеїн-тирозинфосфатази, безрецепторного типу 22; основного фактору транскрипції 2 з лейциновою застібкою та CD40. Приблизно в 30% пацієнтів із ХГ в сімейному анамнезі є родичі, які також страждають на ХГ або тиреоїдит Хашимото;
- погана екологія, куріння, надмірне споживання йоду з їжею, стрес, вагітність;
- застосування пероральної контрацепції (чоловіча стать запобігає розвитку ХГ).
Патогенез ХГ
Як було вже зазначено, причиною ХГ є циркулюючі аутоантитіла, які стимулюють рТТГ, що, своєю чергою, призводить до гіпертиреозу і зобу. АТ до рТТГ переважно є ізотипом IgG1 і зв’язуються з розривним епітопом у багатому на лейцин позаклітинному домені ТТГ-рецептора за участю інсуліноподібного фактора росту, тип 1 (ІФР‑1). Інфільтруючі імунні клітини – В- і Т-лімфоцити та антиген-презентуючі клітини – продукують інтерлейкіни (ІЛ) ІЛ‑1, -6 та -12; інтерферон-γ (ІНФ-γ); фактор некрозу пухлини-α (ФНП-α); ліганд CD40 та інші цитокіни, які активують і підтримують запалення в тироцитах.
Антитиреоїдні препарати (АТП) можуть послаблювати синтез гормонів ЩЗ та експресію внутрішньотиреоїдних цитокінів і таким чином модулювати аутоімунний процес.
Гормони ЩЗ впливають майже на кожну тканину і систему організму. Вони підвищують термогенез і швидкість базального метаболізму, знижують рівень холестерину в сироватці крові і системний судинний опір.
Найчастіше наслідки підвищення рівня гормонів ЩЗ проявляються в змінах з боку серцево-судинної і нервової систем. Нелікований або частково лікований тиреотоксикоз супроводжується втратою ваги, остеопорозом, фібриляцією передсердь (ФП), емболічними явищами, м’язовою слабкістю, тремором, нервово-психічними симптомами і, рідко, серцево-судинним колапсом і смертю. Є лише помірна кореляція між ступенем підвищення рівня гормонів ЩЗ і клінічними ознаками й симптомами.
Для встановлення правильного діагнозу необхідно провести високочутливий метод визначення ТТГ (функціональна чутливість не менше 0,01 мОд/л). За умови зниженого рівня ТТГ визначають рівні вільних Т4 і Т3: якщо хоча б один із них підвищений, діагностують маніфестний тиреотоксикоз, якщо обидва в нормі – субклінічний тиреотоксикоз. Також рекомендується визначити АТ до рТТГ (стимулюючі; імуноаналіз ІІ, ІІІ генерації). На УЗД ЩЗ у 80% випадків виявляють дифузне збільшення ЩЗ, зниження ехогенності, посилення кровотоку. Провести сцинтиграфію ЩЗ рекомендують за наявності вузлів у ЩЗ разом із гіпертиреозом і до терапії радіоактивним йодом (131I).
Лікування ХГ
Згідно з настановами АТА 2016 лікар у разі виявлення в пацієнта ХГ має рекомендувати якнайшвидше припинити курити і запропонувати долучитися до програми відмови від цієї шкідливої звички. Оскільки як активне, так і пасивне куріння збільшує ризик розвитку офтальмопатії, треба виявляти пацієнтів, які зазнають впливу пасивного куріння, та роз’яснювати його негативний вплив на здоров’я.
Першою лінією лікування ХГ є АТП, передусім у популяції пацієнтів молодого віку і для короткочасного лікування перед терапією 131I або тиреоїдектомією: тіонаміди – пропілтіоурацил, карбімазол і його активний метаболіт – метимазол. Усі вони пригнічують функцію тиреопероксидази, зменшуючи окислення й організацію йодиду, пригнічують зв’язування йодтиронінів, зменшують синтез тригліцеридів (ТГ).
Початкова доза метимазолу зазвичай становить10-30 мг 1 раз на добу залежно від тяжкості гіпертиреозу (карбімазолу – у дозі 15-40 мг/добу). Пропілтіоурацил вводять у дозі 100 мг кожні 8 годин. Початкову дозу АТП поступово зменшують (режим титрування), відповідно до поліпшення стану хворого й зниження рівнів вільних Т4 і Т3, кожні 3-4 тижні. Рівень ТГ залишається пригніченим упродовж кількох місяців і тому не вважається чутливим показником ранньої відповіді на лікування.
Добові підтримувальні дози АТП у режимі титрування становлять: 2,5-10 мг – метимазол і 50-100 мг – пропілтіоурацил. Оптимальна тривалість терапії АТП для режиму титрування – 12-18 міс (максимальна ремісія 50-55%). Рекомендується визначати рівень АТ до рТТГ до припинення терапії, нормальні рівні вказують на більший шанс ремісії. Пацієнти з постійно високим рівнем АТ до рТТГ через 12-18 міс можуть продовжувати терапію метимазолом (контроль ще через 12 міс) або вибрати 131I чи тиреоїдектомію.
Згідно з рекомендаціями АТА 2016 у США на початку терапії тиреостатиками застосовують початкові дози 10-30 мг на добу до відновлення еутиреоїдного стану, підтримувальна доза зазвичай становить 5-10 мг на добу. Щодо початкової дози метимазолу, АТА 2016 пропонує починати: з 5-10 мг, якщо рівень вільного Т4 вище верхньої межі норми в 1-1,5 раза; із 10-20 мг – якщо в 1,5-2 рази та з 30-40 мг – якщо у 2-3 рази.
Вищі дози АТП іноді вводять безперервно і поєднують із L-тироксином у дозах, які дають можливість підтримувати еутиреоїдний стан залози (схема «блокуй і заміщай»). Однак цей підхід рекомендують як крайній захід.
Пропонують також використовувати йодид калію (КІ) як сприятливу допоміжну терапію. Рандомізоване контрольоване дослідження описувало введення 38 мг КІ разом із 15 мг метимазолу щодня, що сприяло кращому контролю гіпертиреозу та меншій кількості побічних реакцій проти 30 мг метимазолу.
На тлі терапії тиреостатиками можуть виникнути побічні ефекти.
1. Незначні:
- шкірні висипання – 4-6%;
- артралгії, міалгії – 1-5%;
- гастроінтестинальні прояви – 1-5%.
2. Значні:
- поліартрит – 1-2%;
- системний васкуліт, артеріїт – рідко;
- агранулоцитоз – рідко;
- гепатит – 0,1-0,2% (пропілтіоурацил);
- холестаз – рідко (метимазол, карбімазол).
У разі появи серйозних побічних ефектів лікар має скасувати застосування АТП і якомога швидше компенсувати стан пацієнта такими препаратами, як бета-адреноблокатори, КІ, глюкокортикоїди, холестирамін.
Субклінічний гіпертиреоз Грейвса
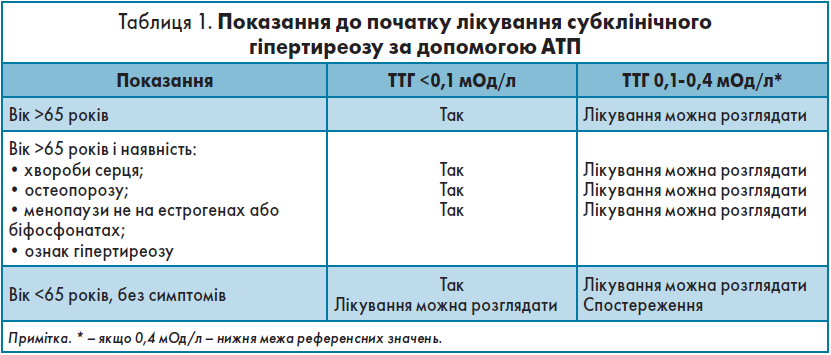
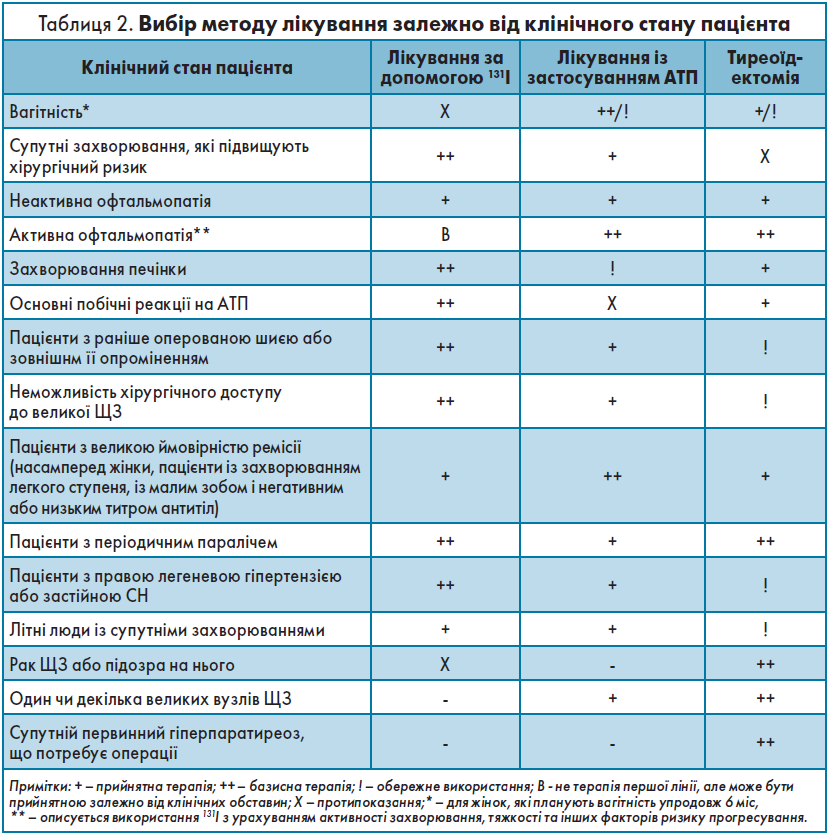
Субклінічний гіпертиреоз асоціюється з підвищеним ризиком смертності від ішемічної хвороби серця (ІХС), ФП, серцевої недостатності (СН), із переломами та надмірною смертністю в пацієнтів із рівнем ТТГ у сироватці крові ﹤0,1 мОд/л. Наявність АТ до рТТГ вказує на субклінічний перебіг ХГ, і швидкість прогресування цього стану до явного гіпертиреозу становить 30% упродовж наступних 3 років. Для запобігання цьому необхідно вчасно розпочати застосовувати АТП (табл. 1), узгоджуючи вибір методів лікування з клінічним станом хворого (табл. 2).
Після тиреоїдектомії пацієнту скасовують прийом АТП і β-адреноблокаторів, а замість них призначають левотироксин (L-T4) у добовій дозі з урахуванням маси тіла пацієнта (1,6 мкг/кг). Літні пацієнти потребують меншої дози, а також визначення рівня ТТГ через 6-8 тиж після операції, рівня кальцію (переважно іонізованого) і паратгормону, а також, за необхідності, призначення препаратів кальцію і вітаміну D (АТА 2016).
Протипоказаннями до лікування пацієнта 131І є вагітність, лактація, планування вагітності впродовж 4-6 міс, рак ЩЗ чи підозра на нього, неможливість дотримання вказівок стосовно радіаційної безпеки.
Разова доза 131І зазвичай становить 10-15 мКі (370-55 МБк). Спостереження впродовж перших 1-2 міс після терапії 131І має охоплювати контроль рівнів вільного Т4, загального Т3 і ТТГ.
Гормональний моніторинг треба продовжувати з інтервалом 4-6 тиж впродовж 6 міс або доти, доки в пацієнта не виникне гіпотиреоз. Тоді призначають замісну терапію тиреоїдними гормонами.
Досьогодні більшість членів робочої групи використовують мінімальну початкову дозу преднізолону 30 мг на добу і зменшують її впродовж 6-8 тижнів для зниження ризику розвитку офтальмопатіі.
Підготувала Юлія Золотухіна
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 1 (53) 2021 р.
СТАТТІ ЗА ТЕМОЮ Ендокринологія
За визначенням Всесвітньої організації охорони здоров’я, цукровий діабет (ЦД) – це група метаболічних розладів, що характеризуються гіперглікемією, яка є наслідком дефектів секреції інсуліну, дії інсуліну або обох цих чинників. За останні 15 років поширеність діабету зросла в усьому світі (Guariguata et al., 2014). Згідно з даними Diabetes Atlas (IDF), глобальна поширеність діабету серед осіб віком 20-79 років становила 10,5% (536,6 млн у 2021 році; очікується, що вона зросте до 12,2% (783,2 млн у 2045 році (Sun et al., 2022). Наразі триває Програма профілактики діабету (ППД), метою якої є визначити, які підходи до зниження інсулінорезистентності (ІР) можуть допомогти в створенні профілактичних заходів ЦД 2 типу (The Diabetes Prevention Program (DPP), 2002). У цьому світлі визначення впливу вітаміну D на розвиток ЦД є актуальним питанням....
Внутрішній біологічний годинник людини тісно та двоспрямовано пов’язаний зі стресовою системою. Критична втрата гармонійного часового порядку на різних рівнях організації може вплинути на фундаментальні властивості нейроендокринної, імунної та вегетативної систем, що спричиняє порушення біоповедінкових адаптаційних механізмів із підвищеною чутливістю до стресу й уразливості. Поєднання декількох хвороб зумовлює двоспрямованість патофізіологічних змін....
Метформін – протидіабетичний препарат першої лінії, який пригнічує глюконеогенез у печінці і в такий спосіб знижує рівні глюкози в крові. Крім того, він знижує ризик кардіоваскулярних подій, чинить нефропротекторний ефект і здатен подовжувати тривалість життя. Завдяки цим властивостям метформін нині розглядають як мультифункціональний препарат і дедалі частіше застосовують для лікування та профілактики різноманітних захворювань....
Сучасне лікування хворих на цукровий діабет (ЦД) 2 типу включає зміну способу життя і медикаментозну терапію для контролю глікемії та профілактики ускладнень. Проте дослідження показують, що на практиці небагато хворих досягають контролю захворювання (частково через погану прихильність до лікування). Частка пацієнтів, які дотримуються протидіабетичної терапії, коливається від 33 до 93% (упродовж 6-24 міс) [1, 2]....