Терапевтичний потенціал синбіотика при антибактеріальній терапії респіраторних інфекцій
 Антибіотики є однією з найширше застосовуваних груп лікарських препаратів, які використовуються в різних галузях медицини та складають до 70% від обсягу призначень ліків [1, 2]. Водночас слід розуміти, що антибіотики – важливий компонент у лікуванні багатьох захворювань, але він може зумовлювати тяжкі побічні ефекти [3-6].
Антибіотики є однією з найширше застосовуваних груп лікарських препаратів, які використовуються в різних галузях медицини та складають до 70% від обсягу призначень ліків [1, 2]. Водночас слід розуміти, що антибіотики – важливий компонент у лікуванні багатьох захворювань, але він може зумовлювати тяжкі побічні ефекти [3-6].
Відповідно до результатів численних досліджень визначено, що ця група лікарських препаратів використовується найбільш нераціонально [3-10]. За даними Всесвітньої організації охорони здоров’я, до 75% антибіотиків використовуються з порушенням настанов інструкції щодо їхнього застосування; це сприяє збільшенню частоти побічних і токсичних реакцій, зростанню бактеріальної резистентності, подовженню часу перебування на лікарняному [11-12], що стає причиною призначення лікарських засобів для усунення ятрогенних наслідків неправильного обрання та нераціонального застосування антибактеріальних препаратів (пребіотики, пробіотики, синбіотики, симбіотики) [3, 6, 13-18].
Серед побічних реакцій при застосуванні лікарських засобів найчастіше зустрічаються ефекти, зумовлені їхніми фармакологічними властивостями під час використання в терапевтичній дозі [11-12]. Так, у прямій залежності від фармакологічних властивостей антибіотиків знаходиться розвиток дисбіозу. В результаті антибактеріальної терапії порушуються нормальні екологічні умови існування природної мікрофлори організму, що часто спричиняє порушення з боку шлунково-кишкового тракту (ШКТ): болі в животі, нудоту, закрепи, діарею тощо. Найчастіше пацієнти скаржаться на дискомфорт у животі та діарею [3, 6, 14, 17, 18]. Частота розвитку антибіотик-асоційованої діареї (ААД), за даними різних авторів, є різною та може досягати 40% [19-22]. Симптоми ААД можуть варіювати від легких і самовиліковних проявів діареї до тяжкого варіанту псевдомембранозного коліту, спричиненого C. difficile. Серед універсальних засобів боротьби з ААД залишаються пробіотики, пребіотики та їхні комбінації [16, 19, 21].
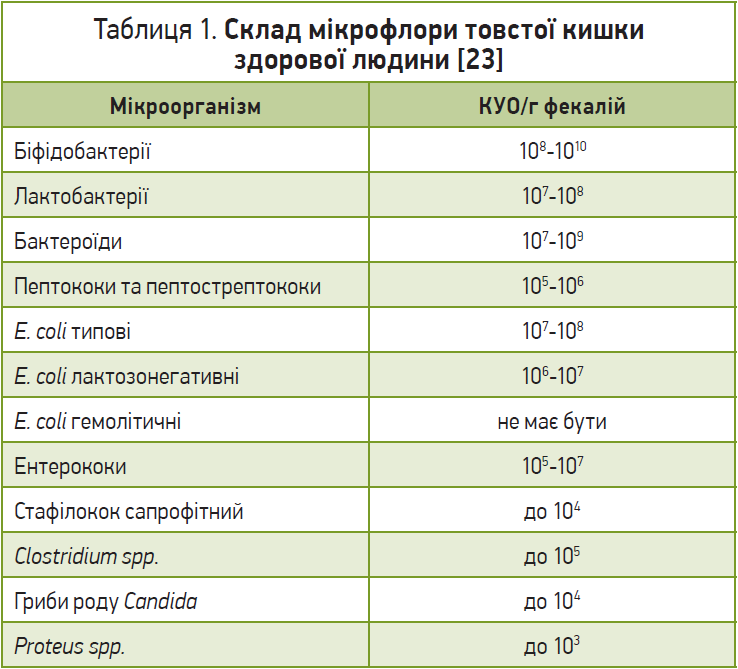
На сьогодні відомо декілька механізмів дії пробіотиків, що дозволяють пояснити їхні ефекти в лікуванні ААД. Так, продемонстровано, що призначення пробіотиків супроводжується зменшенням колонізації ШКТ патогенними мікроорганізмами. Низка пробіотиків у процесі свого росту продукують кислоти, що знижують рН кишкового вмісту та пригнічують розмноження частки патогенів, зокрема гемолітичної E. coli. Крім того, низка штамів пробіотиків прямо продукує антимікробні сполуки. Важливою є також здатність пробіотиків брати участь в усіх метаболічних процесах, стимуляції активності ферментних систем, регуляції процесів перетравлення їжі. Особливо корисна імуномодулювальна дія пробіотиків, спрямована на гармонізацію всіх гомеостатичних систем. Найвираженіші ефекти пробіотиків розповсюджуються на мікробіоценоз кишечнику (табл. 1) [13-15, 17-19, 21].
Пребіотики – неперетравлювані харчові інгредієнти, котрі в незмінному вигляді досягають товстої кишки, де вибірково стимулюють ріст і життєдіяльність корисних біфідо- та лактобактерій.
Що стосується використання пребіотиків з метою профілактики розвитку ААД, то схожих клінічних досліджень проведено значно менше. В одному з останніх авторитетних систематичних оглядів Кокранівської спільноти лише наявна інформація про ефекти використання пребіотиків у дітей з харчовою алергією й атопічним дерматитом. Однак за допомогою низки раніше опублікованих робіт продемонстровано, що різні олігосахариди (галакто-, фруктоолігосахариди) можуть сприяти зростанню нормальної кишкової флори [17, 18].
Синбіотики – препарати, які містять одночасно пробіотик і відповідний цьому виду бактерій пребіотик, що забезпечує їхній синергізм; при цьому синбіотичний продукт демонструє як пребіотичні, так і пробіотичні ефекти [16, 17]. Недостатнє вивчення ефективності синбіотичної терапії у хворих з ААД і малочисельність досліджень цього питання стали приводами для проведення нами випробування, метою якого була оцінка клініко-лабораторної ефективності призначення синбіотика (дієтичної добавки Біфітен Нео) хворим з респіраторною патологією, котрі приймали антибіотики, для профілактики розвитку ААД.
Матеріали та методи
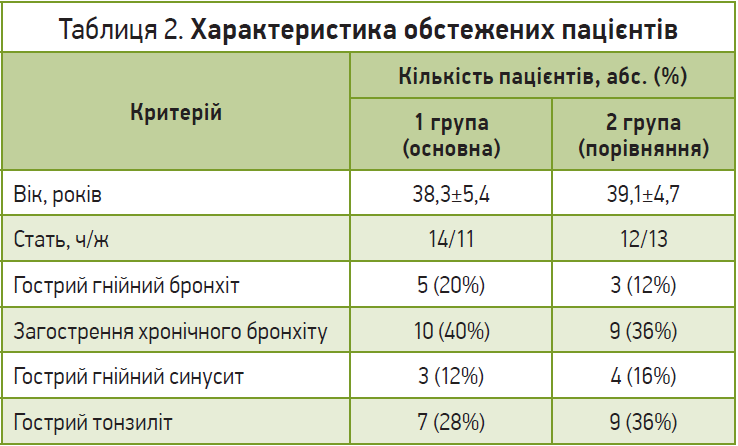
До випробування було залучено 50 хворих з бактеріальною респіраторною патологією (гострий гнійний бронхіт, загострення хронічного бронхіту, гострий синусит, гострий тонзиліт) віком від 25 до 50 років, які отримували антибіотикотерапію (препарати амінопеніцилінового ряду до 10 днів).
Критерії виключення з дослідження: вагітність, період лактації та годування грудьми, наявність інфекційного захворювання чи стану, за якого необхідний тривалий прийом антибіотика, онкологічні захворювання, інші респіраторні захворювання, терапія антибіотиками впродовж останніх 6 міс, наявність в анамнезі інформації про реакції гіперчутливості до досліджуваних препаратів або їхніх складових, тяжкі порушення стану органів дихання, що потребують госпіталізації, потреба в кисневій терапії, тяжкі захворювання серцево-судинної системи, ШКТ, печінки, нирок, цукровий діабет, психічні розлади. Від усіх пацієнтів отримано інформовану згоду на участь у дослідженні. Рандомізацією у співвідношенні 1:1 хворих розподілили на групи: 1 група (25 осіб) з першого дня антибіотикотерапії вживала синбіотик Біфітен Нео (по 2 капсули 1 р/добу протягом 10 днів), 2 група (25 осіб) отримувала тільки антибактеріальну терапію. Під час дослідження пацієнти не приймали інші про-, пре- та синбіотики.
Комплексне клінічне та лабораторне обстеження пацієнтів проводилося до початку терапії, а також після закінчення курсу лікування. Під час першого та останнього відвідувань збирали анамнез, проводили оцінку поточного загального стану пацієнта, виявляли скарги, здійснювали фізикальне обстеження, забір крові для проведення загальноклінічного, біохімічного й імунологічного аналізів. Дослідження фагоцитарної активності гранулоцитарних нейтрофілів передбачало визначення фагоцитарного індексу як кількості нейтрофілів, що брали участь у процесі фагоцитозу (у відсотках від загальної кількості гранулоцитарних нейтрофілів крові), а також фагоцитарного числа як середньої кількості мікробних клітин, поглинених однією фагоцитуючою клітиною (в умовних одиницях), оцінку окислювально-відновлювальної активності нейтрофілів (НСТ‑тест) та активності внутрішньоклітинних ферментних систем гранулоцитарних нейтрофілів (СЦК). Також пацієнтам проводили бактеріологічне дослідження кишкової мікрофлори. Показником стану біоценозу кишечнику був уміст нормальної та умовно-патогенної флори, виражений у десятковому логарифмі колонієутворювальних одиниць (КУО/г).
Критерії ефективності застосування Біфітен Нео: позитивна динаміка клінічних симптомів з боку ШКТ або відсутність таких, відсутність розвитку ААД, позитивна динаміка бактеріологічного дослідження випорожнень й імунологічних показників крові.
Результати й обговорення
Характеристику пацієнтів з урахуванням статі, віку та розподілу нозологій, за якими вони отримували антибактеріальну терапію, наведено в таблиці 2.
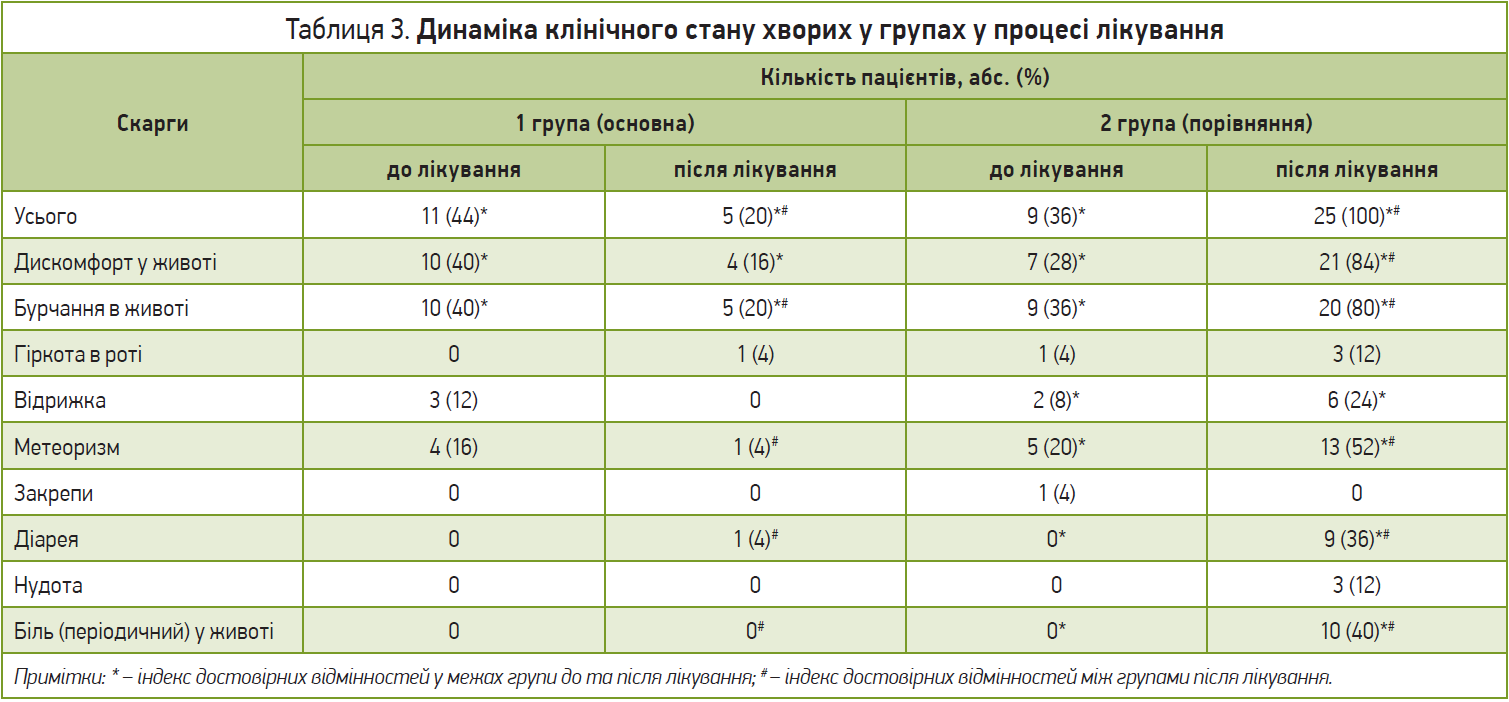
У майже 40% хворих в обох групах до початку лікування виявлено диспепсичний (гіркота в роті, відрижка) й інтестинальний (дискомфорт, бурчання в животі, метеоризм, схильність до закрепів) синдроми. Частоту наявності скарг, що відображають клінічні прояви кишкової диспепсії, а також динаміку клінічного стану хворих в групах у процесі лікування, наведено в таблиці 3.
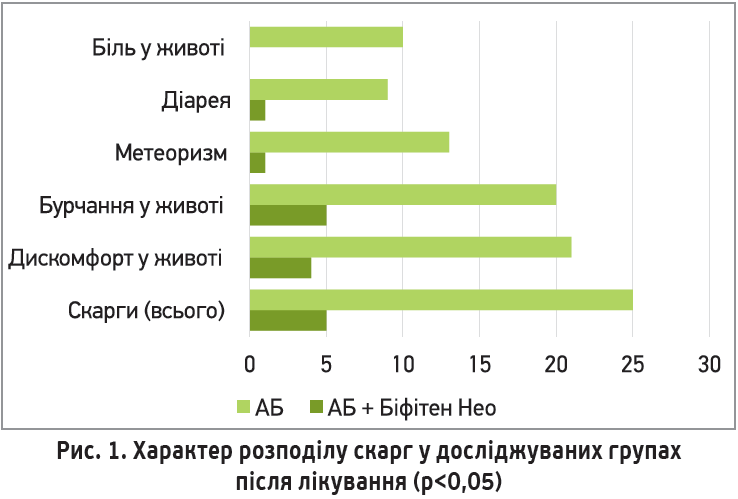
У результаті проведеного лікування серед пацієнтів, які отримували синбіотик, спостерігалося достовірне зниження загальної кількості скарг у 2,2 разу порівняно з початком терапії, зокрема, зменшення кількості випадків відчуття дискомфорту та бурчання в животі у 2,5 та 2 рази відповідно (p<0,05). Усі пацієнти, які не отримували синбіотик у процесі лікування, мали скарги з боку ШКТ після курсу антибіотикотерапії: у них спостерігалося достовірне збільшення скарг на дискомфорт і бурчання в животі та метеоризм (p<0,05). 36% пацієнтів групи порівняння мали ознаки ААД (у групі втручання – 4%); 40% – больові відчуття в животі, чого не було визначено в групі Біфітену Нео (p<0,05) (рис. 1).
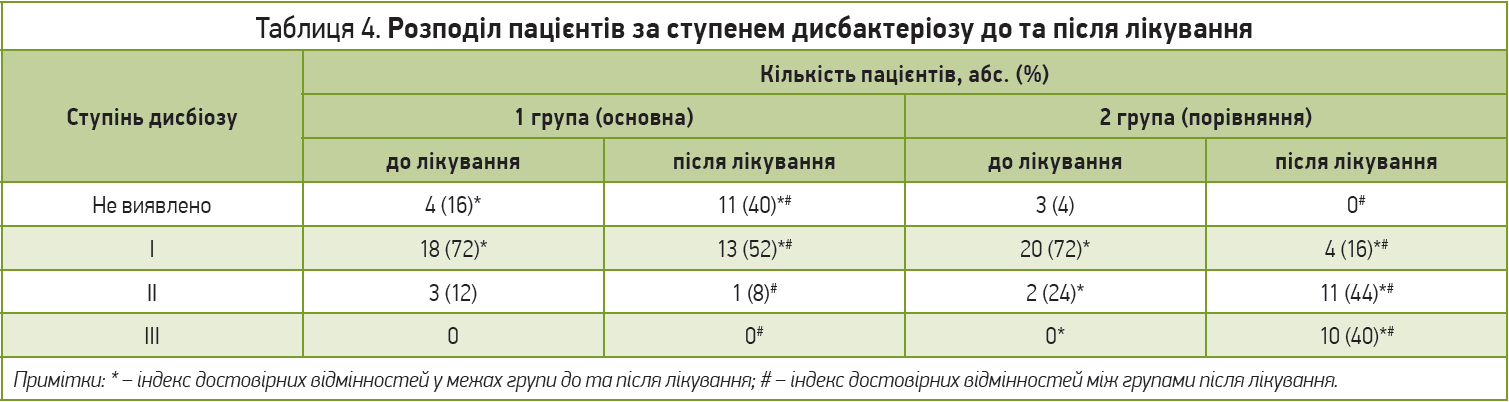
Серед усіх обстежених пацієнтів виявлені порушення мікробіоценозу кишечнику до лікування: в 76% випадків визначено I ступінь дисбактеріозу, в 10% випадків – II ступінь дисбактеріозу. Хворих з III ступенем дисбіотичних порушень виявлено не було. Після лікування дисбіотичні порушення серед усіх пацієнтів були розподілені так: І ступінь – 34%, II ступінь – 24%, ІІІ ступінь – 20%. Розподіл хворих за ступенем дисбіотичних порушень у групах обстеження до лікування та після проведеної терапії наведено в таблиці 4.
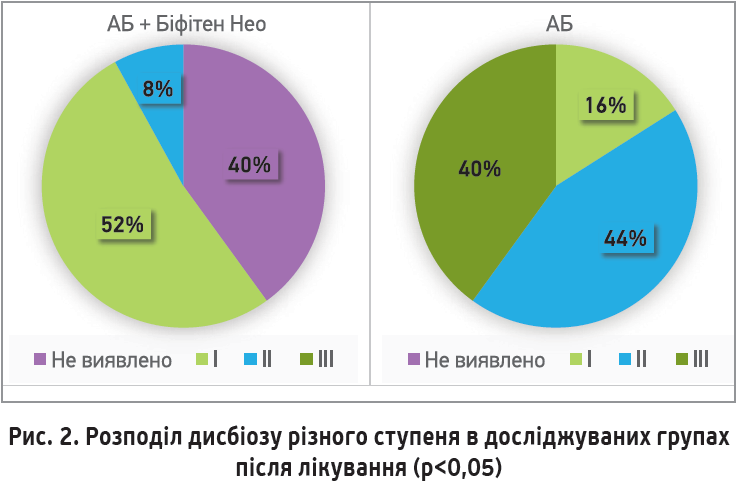
У більшості пацієнтів основної групи в результаті проведеного лікування стан мікробіоценозу кишечнику нормалізувався або відбулося зменшення ступеня дисбіозу. Після лікування в 1-й групі залишалися 14 осіб з дисбіотичними порушеннями: в 13 пацієнтів зберігалися розлади I ступеня, в 1 хворого – порушення II ступеня. В 2-й групі після лікування всі пацієнти мали дисбіотичні розлади, причому кількість дисбіозу І ступеня була в 3,25 разу нижчою, ніж в основній групі; 10 (40%) хворих мали III ступінь порушення біоценозу (рис. 2).
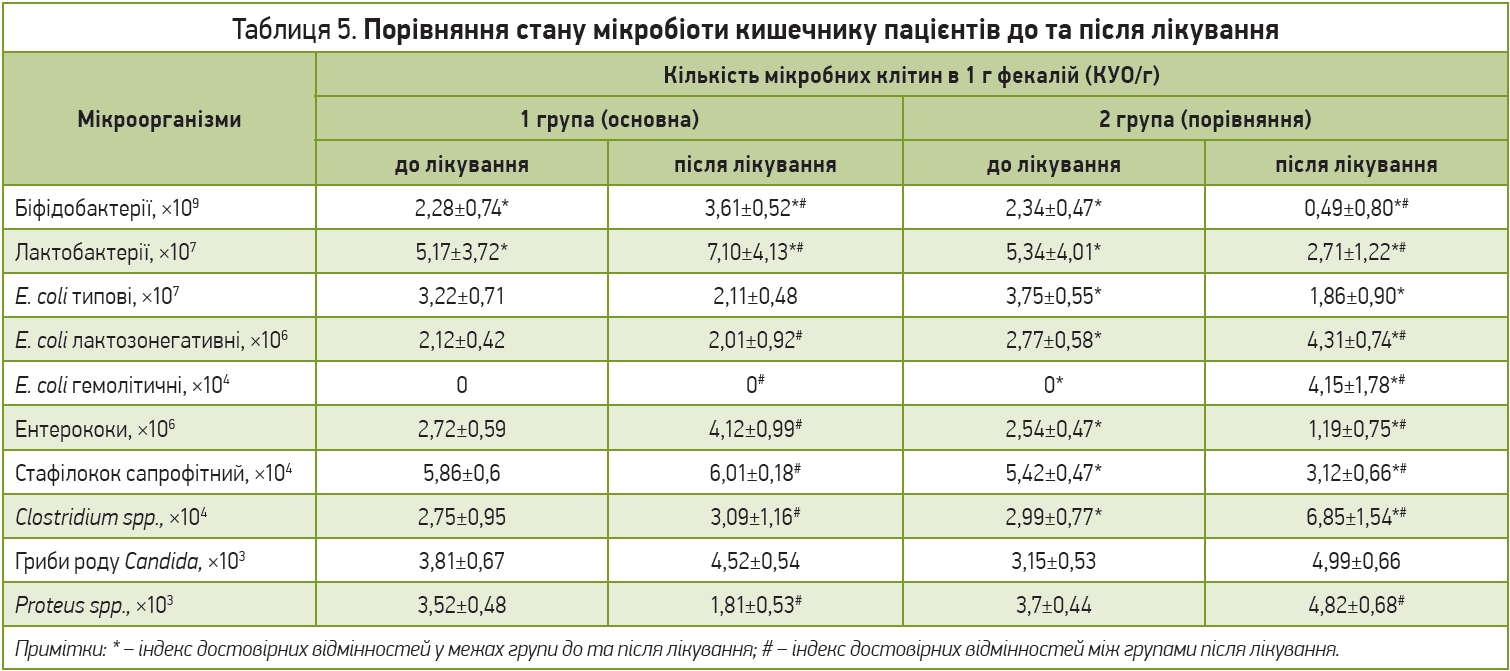
Вивчення стану мікробіоти кишечнику в обстежених осіб продемонструвало відсутність у них виражених дисбіотичних порушень до початку антибактеріальної терапії. Не було значного дефіциту біфідофлори, лактобактерій і порушення співвідношення з групою умовно-патогенних мікробів (табл. 5).
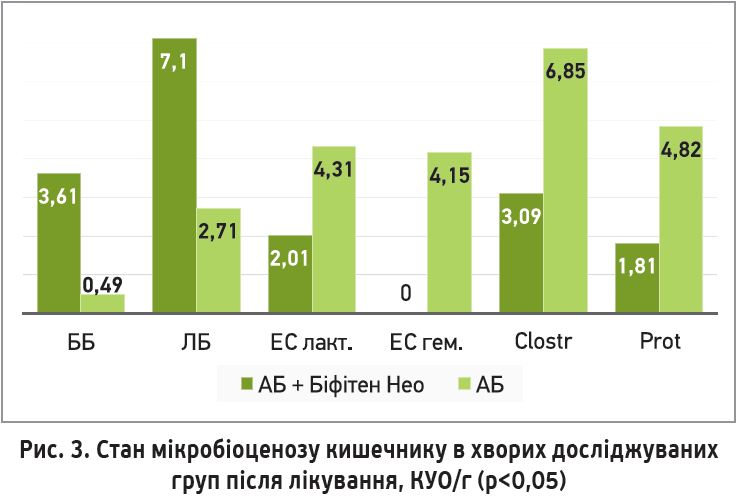
Аналіз отриманих результатів продемонстрував, що в пацієнтів основної групи, незважаючи на отримувану антибіотикотерапію, спостерігалося статистично значиме зростання біфідо- та лактобактерій; своєю чергою, не відбулося нарощування кількості умовно-патогенної мікрофлори. Крім того, пацієнтів основної групи, які не мали порушень біоценозу, було в 2,75 разу більше, ніж перед початком терапії (рис. 3).
Порівняння показників мікробіоценозу кишечнику пацієнтів досліджуваних груп продемонструвало, що вміст біфідо- та лактобактерій, а також сапрофітного стафілокока й ентерококів після лікування в основній групі значимо перевищував такі показники в групі порівняння (р<0,05); це свідчить про ефективне відновлення нормофлори при вживанні синбіотика. Натомість у групі порівняння спостерігалося значне зниження біфідо- та лактобактерій як щодо основної групи, так і щодо стану мікробіому до лікування (p<0,05). Якісний склад мікроорганізмів кишечнику в цій групі змінився в бік переважання умовно-патогенних мікроорганізмів; порівняно з основною групою відбулося достовірне зростання кишкової палички зі зміненими ферментативними властивостями (E. coli лактозонегативні), Clostridium spp. і Proteus spp. (p<0,05). Негативними ознаками серед пацієнтів групи порівняння була поява в калі гемолітичного штаму E. сoli та значне зниження рівнів ентерококів і сапрофітного стафілокока порівняно з основною групою (p<0,05).
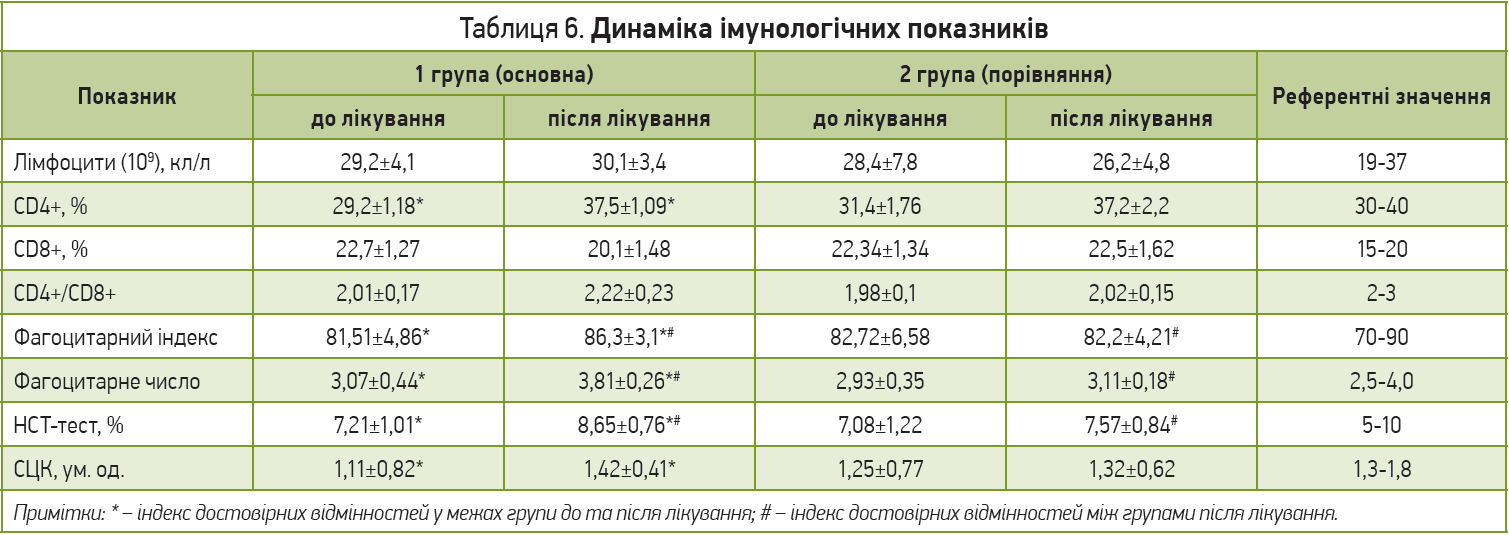
Особливе місце займають можливості синбіотиків впливати на імунологічне відновлення організму за допомогою таких фізіологічних процесів, як підвищення функціональної здатності фагоцитуючих клітин і цитостатичної активності макрофагів, стимуляція асоційованої з кишечником лімфоїдної тканини і вплив на імунокомпетентні Т- і В‑клітини [24-30]. Саме тому одне із завдань нашого дослідження – оцінка клітинної ланки імунної системи до та після лікування (табл. 6).
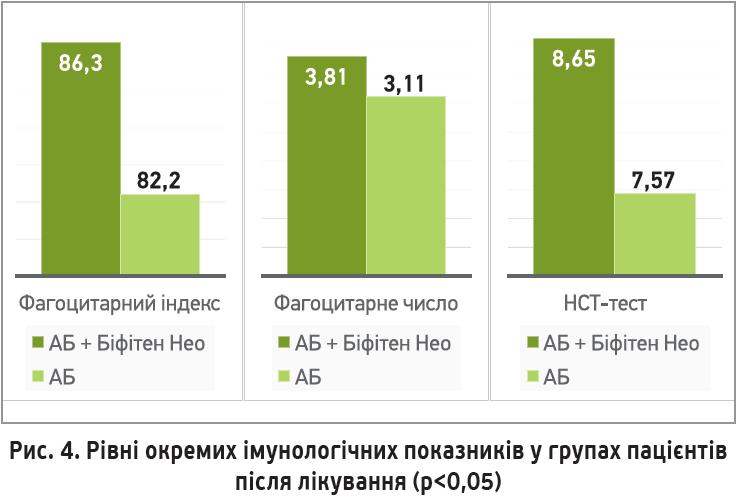
У динаміці після лікування в основній групі спостерігали достовірне збільшення кількості нейтрофілів, що вступили у фагоцитоз, а також достовірне підвищення здатності фагоцитів поглинати і перетравлювати бактерії, що свідчило про більш високу їхню функціональну активність, однак цифри за цими показниками були в референтних межах. Схожа тенденція прослідковувалася і щодо окисно-відновлювальної та ферментативної СЦК: група пацієнтів, яка приймала синбіотик, мала достовірне збільшення відновлювальної здатності порівняно з початковим показником і групою порівняння після терапії (рис. 4). У групі пацієнтів, котрі не отримували Біфітен Нео, спостерігали зниження фагоцитарного індексу та незначне підвищення фагоцитарного числа, що свідчило про погіршення здатності нейтрофілів до фагоцитозу.
Під час аналізу показників клітинного імунітету в групі втручання (група Біфітену Нео) було виявлено наростання відносного вмісту Т‑хелперів, окрім того, відбулася нормалізація кількості цитотоксичних Т‑лімфоцитів (CD8+), проте їхній уміст все одно не перевищував референтних значень. Ці зміни показників імунного статусу свідчили про те, що продовжується активація клітинної ланки імунної системи для забезпечення протиінфекційного імунітету. В цій групі відбувалося зменшення підвищеної кількості В‑клітин, тоді як у контрольній групі вона дещо зростала. Це могло свідчити про те, що при вживанні комплексу Біфітен Нео не відбувалося подальшої стимуляції утворення В‑лімфоцитів у відповідь на розвиток кишкової інфекції. Імунорегуляторний індекс залишався в межах референтних значень, проте зростав, що також свідчило про тенденцію до нормалізації реакцій імунної системи.
Отже, отримані результати свідчать про те, що застосування синбіотика Біфітен Нео в комплексній терапії пацієнтів, котрі отримували антибактеріальну терапію препаратами амінопеніцилінового ряду, супроводжувалося вираженішою редукцією клінічних симптомів, ефективнішим відновленням мікрофлори кишечнику та нормалізацією функцій клітинної ланки імунної системи.
Виявлений нами виражений клінічний ефект синбіотика Біфітен Нео зумовлений тим, що до його складу входять ліофілізовані пробіотичні бактерії 11 штамів у кількості не менше 5,0×109 КУО (Lactobacillus rhamnosus, Lactobacillus casei, Lactobacillus plantarum, Lactococcus lactis, Bifidobacterium longum, Bifidobacterium bifidum, Streptococcus thermophilus, Bifidobacterium lactis, Lactobacillus acidophilus, Lactobacillus salivarius, Lactobacillus bulgaricus) і пребіотичний компонент – олігофруктоза. Унікальна запатентована технологія покриття капсул ProTarget® захищає вміст капсули від впливу низького рівня рН шлункового соку, руйнівного впливу травних ферментів і солей жовчних кислот, а також забезпечує надходження безпосередньо в кишечник живих бактерій, здатних адаптуватися і зберігати високу біологічну активність саме в кишечнику.
Важлива особливість Біфітену Нео полягає в тому, що він є синбіотиком – комбінацією пробіотиків і пребіотиків, які взаємно підсилюють дію один одного на фізіологічні функції та процеси обміну речовин в організмі людини. Пробіотики, потрапляючи до кишечнику, нормалізують мікробний баланс, пригнічуючи патогенні мікроорганізми та відновлюючи якісний і кількісний склад мікрофлори. На жаль, через досить нетривалий проміжок часу вони гинуть; склад мікрофлори знову змінюється на гірший, а патогенні мікроорганізми розмножуються, руйнуючи нормальну мікрофлору. Саме тому в синбіотику, крім пробіотиків, містяться пребіотики, які є живильним середовищем, енергетичним ресурсом і одночасно засобом захисту пробіотиків від зовнішнього середовища, що збільшує тривалість їхнього життя й активність. Завдяки пребіотикам корисні бактерії (пробіотики), що входять до складу дієтичної добавки Біфітен Нео, забезпечені харчуванням, що допомагає їм розмножуватися й нормалізувати баланс мікрофлори кишечнику.
Висновки
Призначення антибактеріальної терапії спричиняло депресію біфідо- та лактофлори, трансформацію ферментативних властивостей кишкової палички та помірне підвищення частоти асоціацій умовно-патогенної флори.
Включення дієтичної добавки Біфітен Нео в дозі 2 капсули 1 р/добу під час їжі протягом 10 днів із 1-го дня прийому антибіотика в комплексі лікувальних заходів у хворих, які отримували антибактеріальну терапію щодо бактеріальної респіраторної патології, сприяло зменшенню клінічної симптоматики, збереженню сталого рівня мікробіоти кишечнику, зменшенню кількості умовно-патогенної мікрофлори, зниженню ймовірності розвитку ААД і нормалізації імунного статусу.
Отримані результати дозволяють рекомендувати включення синбіотика Біфітен Нео до комплексної терапії бактеріальних респіраторних захворювань із метою профілактики ААД і стабілізації кишкової мікрофлори.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 8 (501), 2021 р.
СТАТТІ ЗА ТЕМОЮ Гастроентерологія
Метаболічноасоційована жирова хвороба печінки (МАЖХП) є однією з найактуальніших проблем сучасної гепатології та внутрішньої медицини в цілому. Стрімке зростання поширеності ожиріння та цукрового діабету (ЦД) 2 типу в популяції призвело до істотного збільшення кількості хворих на МАЖХП, яка охоплює спектр патологічних станів від неускладненого стеатозу до алкогольної хвороби печінки та цирозу, що розвиваються на тлі надлишкового нагромадження ліпідів у гепатоцитах. ...
Інфекція Helicobacter pylori (H. pylori) офіційно визнана інфекційним захворюванням і включена до Міжнародної класифікації хвороб (МКХ) 11-го перегляду, тому рекомендовано лікувати всіх інфікованих пацієнтів. Проте, зважаючи на широкий спектр клінічних проявів, пов’язаних із гастритом, викликаним H. pylori, лишаються специфічні проблеми, які потребують регулярного перегляду для оптимізації лікування. ...
Відтворення майбутнього здорової нації – один з найважливіших сенсів існування теперішнього покоління. День боротьби з ожирінням нагадує нам про поширеність цього проблемного явища і важливість попередження його наслідків. Ожиріння може мати вплив на різні аспекти здоров'я, включаючи репродуктивне....
Вивчення клініко-патогенетичних особливостей поєднаного перебігу остеоартрозу (ОА) у хворих із метаболічними розладами, які характеризують перебіг метаболічного синдрому (МС), зокрема цукровим діабетом (ЦД) 2 типу, ожирінням (ОЖ), артеріальною гіпертензією (АГ), є актуальним, оскільки це пов’язано з неухильним збільшенням розповсюдженості цього захворювання, недостатньою ефективністю лікування, особливо за коморбідності з іншими захворюваннями, які патогенетично пов’язані з порушеннями метаболічних процесів. ...