Порушення серцевого ритму в практиці сімейного лікаря та лікаря-терапевта. Коли, кого і як лікувати?
 Пацієнти, котрі мають порушення серцевого ритму (ПСР), посідають особливе місце в практиці як сімейного лікаря, так і лікарів-терапевтів, а також кардіологів: по-перше, останнім часом спостерігається суттєве збільшення кількості таких хворих, по-друге, обрання оптимальної стратегії лікування цього контингенту – нелегка справа. Не лише аритмія, а й використання антиаритмічних препаратів (ААП) може спричинити небезпечні наслідки.
Пацієнти, котрі мають порушення серцевого ритму (ПСР), посідають особливе місце в практиці як сімейного лікаря, так і лікарів-терапевтів, а також кардіологів: по-перше, останнім часом спостерігається суттєве збільшення кількості таких хворих, по-друге, обрання оптимальної стратегії лікування цього контингенту – нелегка справа. Не лише аритмія, а й використання антиаритмічних препаратів (ААП) може спричинити небезпечні наслідки.
З доповіддю, присвяченою клініці, діагностиці ПСР і сучасним підходам до лікування, 3 червня в рамках науково-практичної конференції «Роль сімейного лікаря в діагностиці та лікуванні розповсюджених захворювань серцево-судинної системи» виступила професор кафедри пропедевтики внутрішньої медицини Вінницького національного медичного університету ім. М. І. Пирогова, доктор медичних наук Леся Вікторівна Распутіна.
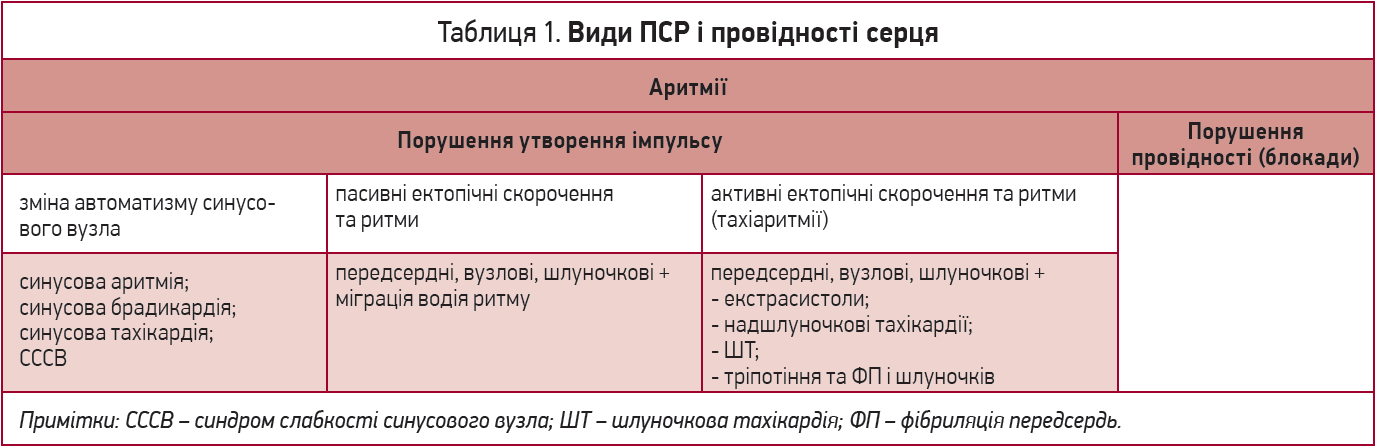
Аритмія – серцевий ритм, що відрізняється від нормального синусового ритму частотою, регулярністю та джерелом, а також порушенням зв’язку чи послідовності між активацією передсердь і шлуночків. Основні види ПСР і провідності серця наведено в таблиці 1.
До найчастіших ПСР, що зустрічаються в практиці сімейного лікаря, належать синусова аритмія, шлуночкові екстрасистоли та ФП.
З огляду на ситуацію з COVID‑19 слід детально зупинитися на особливостях ведення пацієнтів із ПСР, а також розглянути т. зв. невідповідну синусову тахікардію. Цей стан характеризується синусовим ритмом на електрокардіограмі (ЕКГ), збільшенням частоти серцевих скорочень (ЧСС) >100 уд./хв у стані спокою або під час незначного фізичного навантаження. Наразі невідповідну синусову тахікардію вважають діагнозом виключення. Такий стан часто реєструється в осіб з гіпоксемією, пацієнтів, які перенесли гостру респіраторну вірусну інфекцію або COVID‑19 (ESC, 2020). Прозапальні цитокіни здатні впливати на функцію іонних каналів міокарда та підтримувати тахіаритмію (в т. ч. синусову тахікардію). Крім того, до механізмів її виникнення належать підвищений автоматизм синусового вузла, вегетативна дисрегуляція тощо.
Згідно з рекомендаціями ESC (Guidance for the Diagnosis and Management of CV Disease during the COVID‑19 Pandemic, 2020), під час лікування невідповідної синусової тахікардії насамперед варто вплинути на зворотну причину (клас I, рівень С); зокрема, йдеться про гіпоксемію. Симптомним пацієнтам потрібно призначити івабрадин у монотерапії чи в комбінації з β-блокатором (клас IIa, рівень С) або β-блокатори (клас IIa, рівень С), адже β-блокатори при COVID‑19 зменшують надмірну активацію симпатичної нервової системи, перешкоджають потраплянню вірусу до клітин, послаблюють цитокіновий шторм, запобігають появі аритмій. Що стосується поєднаного використання β-блокаторів та івабрадину, то необхідно нагадати, що така комбінація не може призначатися стартово, а також потребує постійних контролю і корекції терапії.
Ще одна цікава клінічна нозологія – синдром постуральної ортостатичної тахікардії, що являє собою підвищення ЧСС на ≥30 уд./хв при вертикалізації у дорослих пацієнтів (≥40 уд./хв в осіб віком 12-19 років) щонайменше протягом 10 хв за відсутності ортостатичної гіпотензії. Терапевтична тактика передбачає регулярні фізичні навантаження (клас IIa, рівень В); добовий об’єм споживання рідини складає ≤2-3 л, солі – 10-12 г (клас IIb, рівень C); застосування мідодрину, низьких доз неселективних β-блокаторів (клас IIb, рівень В); також можна розглянути використання івабрадину (клас IIb, рівень C).
Серед аритмій, що, ймовірно, є причиною раптової серцевої смерті, частка ШТ становить 62%. Шлуночкові аритмії мають різне прогностичне значення (Bigger J. T., 1993) і розподіляються на:
- безпечні (доброякісні) – шлуночкові екстрасистоли (рідкісні, часті, політопні, парні), а також короткі епізоди ШТ за відсутності кардіальної патології, що не зумовлюють порушення гемодинаміки. Прогноз є сприятливим (зіставним з таким у здоровій популяції), показань для ААП немає;
- небезпечні для життя (злоякісні) – епізоди ШТ, що зумовлюють порушення гемодинаміки чи фібриляції шлуночків. Такі аритмії зазвичай спостерігаються в хворих з вираженим структурним ураженням серця (ішемічна хвороба серця (ІХС), застійна серцева недостатність (СН), кардіоміопатії, вади серця) і порушенням скоротливості лівого шлуночка, потребують лікування;
- потенційно небезпечні (потенційно злоякісні) – часті, політопні, парні шлуночкові екстрасистоли, короткі епізоди ШТ у хворих зі структурними ураженнями серця (ІХС, застійна СН, кардіоміопатії, вади серця), що не спричиняють під час порушення ритму виражених змін гемодинаміки, в багатьох пацієнтів потребують лікування.
Тактика в разі шлуночкових екстрасистол має базуватися на визначенні таких показників: поєднання зі структурним захворюванням серця; частота виникнення екстрасистол і наявність / відсутність групових екстрасистол або супутніх пароксизмів тахіаритмії; клінічні симптоми, пов’язані з аритмією.
! Стани, що вважаються показанням для призначення ААП:
- прогресуючий перебіг захворювання серця та збільшення кількості шлуночкових екстрасистол;
- часті, політопні, парні, групові та ранні («R на Т») шлуночкові екстрасистоли, що загрожують пароксизмальною ШТ і ФП;
- алоритмія (бі-, три-, квадригемінія), короткі «пробіжки» ШТ, що супроводжуються ознаками СН;
- шлуночкова екстрасистолія на тлі захворювань, котрі супроводжуються збільшенням ризику небезпечних для життя аритмій (пролапс мітрального клапана, синдром подовженого інтервалу QT тощо);
- виникнення чи збільшення частоти шлуночкових екстрасистол під час нападів стенокардії або гострого інфаркту міокарда;
- збереження шлуночкових екстрасистол після припинення нападу тахікардії / фібриляції шлуночків;
- екстрасистоли на тлі аномальних шляхів проведення (синдром Вольфа – Паркінсона – Уайта).
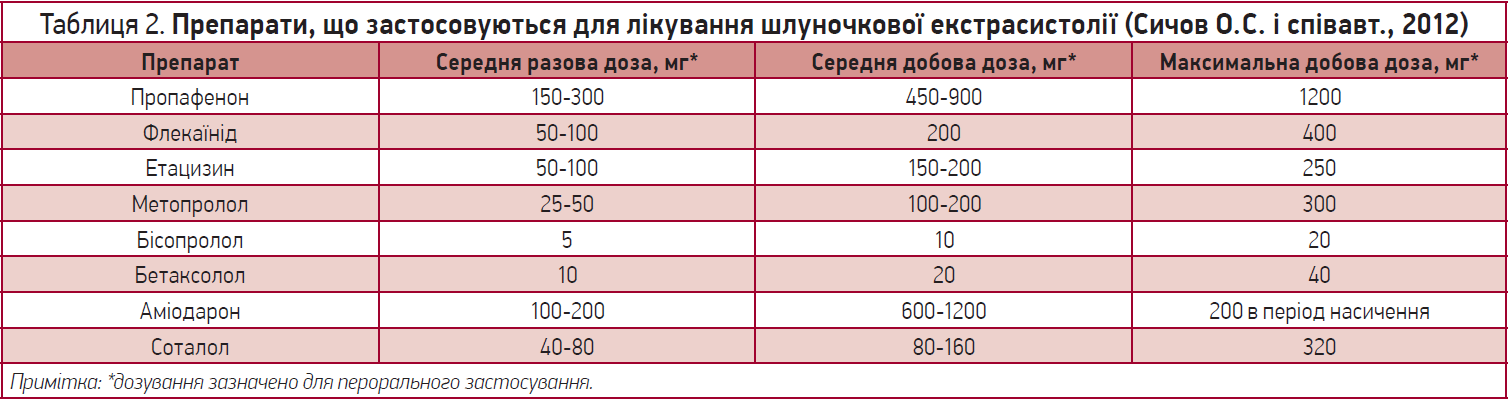
Необхідні корекція факторів ризику та лікування основного захворювання. Варто підкреслити, що доброякісні шлуночкові екстрасистоли не потребують лікування. Основними антиаритмічними засобами для лікування шлуночкових порушень ритму вважаються β-адреноблокатори, ААП I (пропафенон, флекаїнід тощо) та III класів (аміодарон).
Перелік деяких ААП, що часто використовуються, а також їхні дозування продемонстровано в таблиці 2.
Ефективність терапії ААП оцінюють за декількома критеріями: зменшення кількості поодиноких екстрасистол на >75%, а парних екстрасистол та екстрасистол за типами «R на Т» – на >90%; якщо екстрасистоли є поліморфними, скорочення їхніх морфологічних типів щонайбільше до 2; зникнення епізодів ШТ.
Ще одна патологія, з якою доводиться мати справу сімейному лікарю, – ФП. Перед клініцистом досить часто постає таке запитання: чи припустиме лікування пацієнта із ФП в амбулаторних умовах? Стабільна гемодинаміка, відомий діагноз основного захворювання, верифіковані види ПСР і супутня патологія – лише в разі дотримання цих вимог пацієнт може розглядатися як кандидат на амбулаторне лікування.
Згідно з рекомендаціями ESC (2020), в діагностиці ФП ключове значення належить верифікації аритмії. Аритмію, що має характерні для ФП ознаки та зберігається досить довго (щоб зареєструвати ЕКГ у 12 відведеннях або із тривалістю запису >30 с), слід розцінювати як ФП.
Наступний крок – описати ФП за схемою 4S-AF:
- ступінь тяжкості фібриляції – Sb (тривалість, спонтанне припинення);
- ступінь ризику інсульту – St (зокрема, з використанням шкали CHA2DS-VASc);
- ступінь тяжкості аритмічного субстрату – Su (вік, коморбідність, збільшення передсердь / фіброз);
- ступінь тяжкості симптому – Sy (наприклад, за шкалою симптомів EHRA).
Діагностичний алгоритм на амбулаторному етапі: збір анамнезу, ЕКГ у 12 відведеннях (протягом 30 с зафіксовано ФП), ехокардіографія (I, С).
Систематичний скринінг здійснюється в хворих віком >75 років, осіб з підвищеним ризиком інсульту (IIb), пацієнтів із транзиторною ішемічною атакою, гострим порушенням мозкового кровообігу – холтерівське моніторування ЕКГ протягом 72 г (I, В). Позаплановий скринінг – у пацієнтів віком >65 років (оцінка пульсу, ЕКГ, застосування будь-яких пристроїв).
Симптоми ФП оцінюють за шкалою EHRA, де клас 1 – відсутність симптомів; клас 2а – легкі симптоми, що не порушують звичайної щоденної активності; клас 2b – помірні симптоми, які не порушують звичайної щоденної активності, але турбують пацієнта; клас 3 – тяжкі симптоми, котрі супроводжуються ускладненням звичайної щоденної активності; клас 4 – інвалідизуючі симптоми, які її унеможливлюють.
При призначенні терапії ФП рекомендується дотримуватися стратегії АВС (ESC/EACTS, 2020). Перша літера (А) символізує важливість антикоагулянтної терапії для запобігання інсульту (anticoagulation / avoid stroke). Необхідно запропонувати пацієнтам профілактику інсульту, якщо показник за шкалою CHA2DS2-VASc ≥1 у чоловіків і ≥2 у жінок: призначити нові оральні антикоагулянти чи антагоністи вітаміну К (АВК) із добре керованим часом перебування в терапевтичному діапазоні. Друга літера акроніма (В) означає покращення контролю симптомів (better symptom control). Лікар повинен оцінити симптоми, якість життя й уподобання пацієнта, оптимізувати контроль показників і розглянути оптимальну стратегію контролю серцевого ритму (кардіоверсія, ААП або абляція). Третій компонент (С) нагадує про супутні захворювання й управління факторами ризику кардіоваскулярної патології (comorbidities / cardiovascular risk factor management).
Антикоагулянтна терапія показана, якщо показник за шкалою CHA2DS2-VASc ≥2 балів у чоловіків або ≥3 балів у жінок. Коли в пацієнтів-чоловіків значення за CHA2DS2-VASc становить 1 бал, а в пацієнток-жінок – 2 бали, також можна розглядати застосування оральних антикоагулянтів; коли показник дорівнює 0, антитромбоцитарні препарати не призначаються. За наявності штучного клапана серця, мітрального стенозу чи антифосфоліпідного синдрому препарати вибору – АВК (варфарин); в усіх інших випадках рекомендується розглядати як терапію першої лінії нові оральні антикоагулянти.
Розглянемо одні з найдискутабельніших питань: яка стратегія в пацієнтів із ФП (контроль синусового ритму або ЧСС), чи забезпечує вона кращі результати?
Проаналізуємо дані останніх наукових спостережень, зокрема дослідження EAST-AFNET‑4 (n=2789), в якому брали участь пацієнти з високим ризиком тромбоемболічних ускладнень (3-4 бали за CHA2DS2-VASc); 40% осіб мали перший епізод ФП (Kirchhof P., Camm A. J. et al., 2020). У рамках 5-річного спостереження науковці виявили, що в пацієнтів, щодо яких застосовувалася стратегія контролю ритму (ААП або абляція), ризик серйозних кардіоваскулярних подій (включно зі смертю та інсультом) був нижчим порівняно з таким у групі контролю ЧСС. Уже через рік частота несприятливих кардіоваскулярних подій відчутно зростала в популяції хворих, у яких контролювали ЧСС.
Отже, в останніх рекомендаціях ESC (Hindricks G., Potpara T. et al., 2020) зазначено, що слід довготривало контролювати синусовий ритм за допомогою електричної кардіоверсії (у гемодинамічно нестабільних хворих), медикаментозної кардіоверсії (у гемодинамічно стабільних пацієнтів) та інтервенційних методів (катетерна абляція).
Під час обрання стратегії лікування ФП слід ураховувати наявність структурних змін і коморбідності. Якщо в хворого відсутні чи спостерігаються мінімальні ознаки структурної патології серця, варто розглянути призначення дронедарону (I, A), флекаїніду (I, A), пропафенону (I, A), соталолу (IIb, A); в разі рецидиву ФП необхідно обговорити питання щодо катетерної абляції. У хворих з ІХС, СН зі збереженою фракцією викиду (ФВ), тяжкою вадою серця краще використовувати аміодарон (I, A), дронедарон (I, A), соталол (IIb, A); в разі рецидиву ФП варто запропонувати катетерну абляцію. В пацієнтів із СН зі зниженою ФВ препаратом вибору є аміодарон (I, A); в разі рецидиву ФП розглядається катетерна абляція.
Для контролю ритму в рекомендаціях ESС (Hindricks G., Potpara T. et al., 2020) запропоновано декілька ААП. Аміодарон підходить для довготривалого контролю ритму всім хворим на ФП. У пацієнтів зі структурними змінами серця та СН молекула аміодарону є першою лінією терапії. Однак з огляду на його позасерцеву токсичність науковці радять за можливості обирати інші ААП, особливо пацієнтам без структурних змін серця та СН.
Дронедарон рекомендований для довготривалого контролю ритму хворим на ФП із нормальною або незначно погіршеною (але стабільною) функцією лівого шлуночка чи СН зі збереженою ФВ, ішемією або патологією клапанів.
Флекаїнід або пропафенон радять застосовувати в хворих з нормальною функцією лівого шлуночка без структурних уражень серця, в т. ч. без значної його гіпертрофії, а також ішемії міокарда.
Лікування ААП не рекомендовано хворим з постійною ФП для контролю ЧСС і пацієнтам з істотними порушеннями провідності, якщо не встановлений водій ритму для запобігання брадикардії.
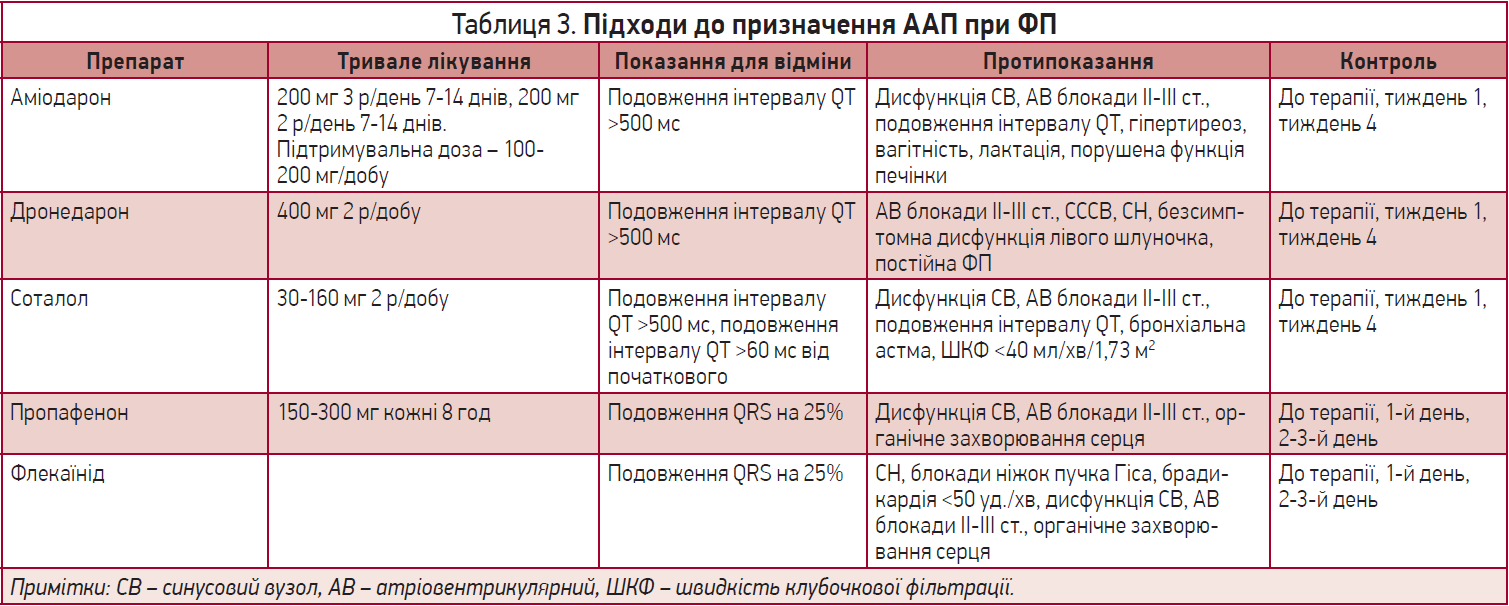
Підходи до використання ААП у пацієнтів із ФП, згідно з даними адаптованої настанови з лікування ФП (2016), наведено в таблиці 3.
Обов’язковим є ЕКГ-контроль! Подовження інтервалу QT >500 мс на тлі прийому аміодарону, дронедарону чи соталолу – показання для відміни препарату. При лікуванні пропафеноном і флекаїнідом потрібно орієнтуватися на QRS: у разі подовження на 25% слід припинити терапію.
Водночас варто розглянути питання наступності та тривалості застосування ААП. Дослідники під керівництвом О. С. Сичова (2009) оцінили ефективність оригінального аміодарону (Кордарон®) у підтриманні синусового ритму в пацієнтів віком 35-65 років з персистуючою ФП й ознаками СН I-II ст., тривалістю пароксизму ФП >2, але <15 діб. Виявилося, що в 56% хворих в амбулаторних умовах відбулася корекція терапії – необґрунтоване скасування антиаритмічної терапії або заміна аміодарону на інший ААП, при цьому середня тривалість збереження синусового ритму була найбільшою в разі застосування саме аміодарону (1,7±0,3 року) та достовірно вищою порівняно з такою в групі використання інших ААП (0,7±0,28 року) та групі відміни ААП (0,15±0,06 року). Серед хворих, які продовжили приймати аміодарон (Кордарон®) протягом року після відновлення синусового ритму, не з’явилося жодного пароксизму ФП.
Частота переходу ФП у постійну форму протягом 2 років складала:
- 64% – у пацієнтів, які не приймали ААП;
- 50% – серед хворих, яким Кордарон® замінили на інший ААП;
- 0% – у групі застосування Кордарону.
Ведення хворих із ПСР потребує ретельного обстеження й оцінки ризиків. Призначення ААП має бути виваженим рішенням з урахуванням виду аритмії, факторів ризику, супутніх захворювань та обов’язково підкріплюватися адекватним контролем синусового ритму за допомогою ААП, які продемонстрували високу ефективність, зокрема аміодарону (Кордарон®).
Підготувала Олександра Марченко
Медична газета «Здоров’я України 21 сторіччя» № 15 (508), 2021 р.
СТАТТІ ЗА ТЕМОЮ Кардіологія
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Торакалгія – симптом, пов’язаний із захворюваннями хребта. Проте біль у грудній клітці може зустрічатися за багатьох інших захворювань, тому лікарям загальної практики важливо проводити ретельну диференційну діагностику цього патологічного стану та своєчасно визначати, в яких випадках торакалгії необхідна консультація невролога. В березні відбувся семінар «Академія сімейного лікаря. Біль у грудній клітці. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста». Слово мала завідувачка кафедри неврології Харківського національного медичного університету, доктор медичних наук, професор Олена Леонідівна Товажнянська з доповіддю «Торакалгія. Коли потрібен невролог»....
Рівень ліпопротеїну (a) >50 мг/дл спостерігається в ≈20-25% населення і пов’язаний із підвищеним ризиком серцево-судинних захворювань (ССЗ) [1]. Ліпопротеїн (a) задіяний в атерогенезі та судинному запаленні, а також може відігравати певну роль у тромбозі через антифібринолітичну дію і взаємодію із тромбоцитами [2, 3]. Дієта та фізична активність не впливають на рівень ліпопротеїну (a); специфічної терапії для його зниження також не існує. Підвищений ризик ССЗ, пов’язаний з ліпопротеїном (а), залишається навіть у пацієнтів, які приймають статини [4]. Саме тому існує критична потреба в терапії для зниження цього ризику, особливо в первинній профілактиці. ...
Запалення відіграє важливу роль у розвитку багатьох хронічних захворювань, зокрема атеросклерозу. Нещодавно було встановлено, що гіперурикемія спричиняє запалення ендотеліальних клітин судин, ендотеліальну дисфункцію та, зрештою, атеросклероз. Експериментальна робота Mizuno та співавт. (2019), у якій було продемонстровано здатність фебуксостату пригнічувати запальні цитокіни, привернула увагу дослідників до протизапальних ефектів уратзнижувальних препаратів. Кількість лейкоцитів – надійний маркер запалення, пов’язаний із різними кардіоваскулярними захворюваннями, як-от ішемічна хвороба серця; у багатьох попередніх дослідженнях його використовували для оцінки протизапального ефекту терапевтичного втручання. Мета нового аналізу дослідження PRIZE – вивчити вплив фебуксостату на кількість лейкоцитів у пацієнтів із безсимптомною гіперурикемією....