Мультимодальное обезболивание при тотальном эндопротезировании коленного сустава
Несмотря на лучшее понимание механизмов развития и внедрение новых стратегий лечения,
в настоящее время все продолжаются поиски оптимального решения проблемы послеоперационной боли после тотального эндопротезирования коленного сустава (ТЭКС). Это хирургическое вмешательство обычно ассоциируется с умеренной или интенсивной послеоперационной болью в связи с богатой иннервацией коленного сустава бедренным, запирательным и седалищным нервами. Послеоперационная боль замедляет восстановление, продлевает госпитализацию, увеличивает дискомфорт пациента и риск послеоперационных осложнений. Неспособность обеспечить адекватное обезболивание препятствует активной физиотерапии и реабилитации.
Периферическая блокада одного или нескольких крупных нервов, иннервирующих нижнюю конечность, может обеспечить эффективное обезболивание в ортопедической хирургии. Продленная периферическая блокада нерва еще более эффективна, чем одномоментная блокада, с точки зрения послеоперационной аналгезии и обеспечения удовлетворенности пациентов обезболиванием с небольшим количеством побочных эффектов и быстрым функциональным восстановлением. Для того чтобы минимизировать моторный блок в послеоперационном периоде, но при этом сохранить контроль боли, применяют низкие концентрации длительно действующих анестетиков, например ропивакаина. Проведенные ранее исследования подтвердили, что по эффективности продленная блокада бедренного нерва после ТЭКС эквивалентна продленной эпидуральной анестезии и продленной блокаде поясничного сплетения, но с меньшим количеством побочных эффектов. Однако боль в подколенной ямке часто требует дополнительных методов аналгезии.
Внутривенное введение ингибиторов циклооксигеназы-2 (ЦОГ-2) могло бы обеспечить в этих случаях дополнительное облегчение боли. Аналгетический эффект парекоксиба при хирургических вмешательствах хорошо изучен. Согласно данным клинических испытаний ощутимый обезболивающий эффект парекоксиба наступает в диапазоне от 7 до 13 минут с достижением клинически значимой аналгезии в течение 23-39 мин и пика действия через 2 ч после внутривенного введения 40 мг препарата.
Данное исследование проведено с целью изучения аналгезирующего и опиоидсберегающего эффекта внутривенного парекоксиба при сочетании с продленной блокадой бедренного нерва после ТЭКС.
Материалы и методы
Двойное слепое рандомизированное исследование было проведено на базе университетской клиники в Великобритании. В исследование включено 90 пациентов, которым была выполнена ТЭКС с применением спинальной анестезии. После оперативного вмешательства выполняли продленную блокаду бедренного нерва с использованием ропивакаина (болюс 20 мл 0,75% раствора с последующим введением 0,2% раствора 10 мл/ч).
Участники были рандомизированы в 2 группы: 45 пациентов в группе D получали парекоксиб внутривенно в дополнение к блокаде бедренного нерва; 45 пациентам в группе Р внутривенно вводили плацебо (0,9% NaCl) вместо парекоксиба.
Критериями исключения из исследования были: возраст меньше 40 лет или больше 80 лет, оценка статуса по шкале ASA>III, ожирение (>140 кг), аллергия на местные анестетики, зависимость от опиоидов в анамнезе, противопоказания к проведению спинальной анестезии или блокады бедренного нерва (коагулопатия, локальная инфекция, ранее существовавшие неврологические нарушения, отказ пациента), противопоказания к применению парекоксиба, тяжелая печеночная или почечная недостаточность (уровень креатинина сыворотки крови ≥1,7 мг/дл), инсулинзависимый сахарный диабет, сердечная недостаточность II-III функционального класса по классификации NYНА, стенокардия, ишемическая болезнь сердца, заболевания желудочно кишечного тракта, в том числе язвенные поражения, побочные эффекты парекоксиба.
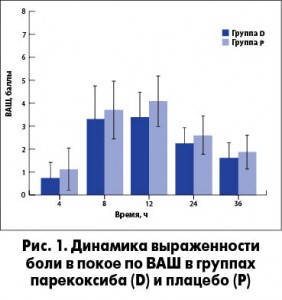
До выполнения непрерывной блокады бедренного нерва у всех пациентов выполнена оценка выраженности боли с помощью 10 см визуальной аналоговой шкалы (ВАШ): 0 – нет боли, 10 – максимально вообразимая боль. Оценку выраженности боли в состоянии покоя по ВАШ проводили через различные промежутки времени, в том числе через 4, 8, 12, 24 и 36 ч. Боль оценивали как в покое, так и при сгибании коленного сустава до 60 градусов.
Измерение артериального давления, частоты пульса, насыщения крови кислородом и оценку по числовой рейтинговой шкале (NRS) проводили каждые 15 минут во время операции, через 15 минут после введения парекоксиба, а затем через 4, 8, 12, 24 и 36 ч после хирургического вмешательства.
Если указанное обезболивание расценивалось как недостаточное (оценка по ВАШ >5), мог применяться морфин с помощью инфузомата в формате контролируемой пациентом аналгезии.
Побочные эффекты также оценивали в указанные промежутки времени, спрашивая пациентов о наличии каких-либо нежелательных симптомов.
Результаты
В общей сложности 90 пациентов были рандомизированы в группы плацебо (n=45) и парекоксиба (n=45). Ни один из пациентов не был исключен из исследования. По данным физикальных характеристик исследуемые группы были сопоставимы. Большинство составляли женщины (83,3%). Статистически различий между группами по пери- и послеоперационным гемодинамическим показателям, выполненным оперативным вмешательствам (на правом или левом коленном суставе), продолжительности анестезии во время операции не выявлено.
Парекоксиб продемонстрировал большую эффективность в сравнении с плацебо при сочетании с продленной блокадой бедренного нерва после ТЭКС (рис. 1). Показатели выраженности боли в состоянии покоя по ВАШ были статистически значимо ниже у пациентов в группе парекоксиба в сравнении с группой плацебо (р=0,007) через 4 ч (р=0,044), 12 ч (р=0,001) и 24 ч (р=0,012).
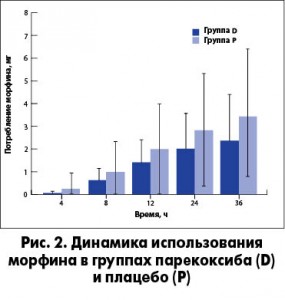
Пациенты, получавшие парекоксиб, нуждались в меньшем количестве морфина во всех временных точках в сравнении с пациентами в группе плацебо (рис. 2) с пограничной статистической значимостью (р=0,054). В целом все пациенты, которым выполнялась продленная блокада бедренного нерва, независимо от группы лечения использовали низкие дозы морфина. Частота осложнений, связанных с применением морфина, была сопоставимой в обеих группах. В целом такие побочные эффекты отмечены у 6/90 (6,67%) пациентов, получавших морфин, в том числе головокружение (n=1), сонливость (n=1) и зуд (n=4).
Обсуждение
Установлено, что мультимодальная аналгезия может уменьшать потребность в опиатах и выраженность боли, повышать степень удовлетворенности пациентов лечением и ускорять восстановление. Этим термином называют применение комбинации различных аналгетиков, часто с разными путями введения и в разные моменты времени периоперационного периода для обеспечения лучшей аналгезии при меньшем риске побочных эффектов.
По мнению Venditolli и др. (2006), продленная блокада периферических нервов и интратекальное введение низких доз опиоидов являются основой мультимодальной аналгезии при ТЭКС. Однако чрезмерное использование опиоидов может быть связано с рядом осложнений, включающих депрессию, гемодинамическую нестабильность, тошноту, рвоту, длительную седацию, угнетение дыхания, паралитическую непроходимость кишечника и др. Кроме того, опиоиды не могут быть идеальным выбором для пациентов, нуждающихся в физической реабилитации из-за чрезмерного седативного эффекта, который может ей препятствовать. Селективные ингибиторы ЦОГ-2 обладают доказанной аналгетической эффективностью в послеоперационном периоде, а их опиоидсберегающий эффект может привести к значительному сокращению нежелательных явлений, связанных с приемом наркотических аналгетиков.
В данном исследовании была изучена мультимодальная схема периоперационного обезболивания при ТЭКС с использованием продленной блокады бедренного нерва 0,2% раствором ропивакаина и внутривенного парекоксиба, а также при необходимости морфина в виде контролируемой пациентом аналгезии. Такая комбинация обеспечила оптимизацию контроля боли и достижение целей терапии с использованием меньшего количества наркотического аналгетика и более низкой частотой нежелательных явлений, а также улучшение реабилитации, увеличение объема движений и уменьшение выраженности боли при мобилизации, повышение связанного со здоровьем качества жизни и удовлетворенности пациентов лечением.
В ходе исследования значительно более высокие показатели выраженности боли по ВАШ отмечались в группе плацебо в сравнении с группой парекоксиба через 4, 12 и 24 часа. По мнению авторов, это стало результатом того, что больные в группе плацебо старались сильно не повышать дозу морфина (как уже было отмечено, он применялся в формате контролируемой пациентом аналгезии), чтобы минимизировать связанные с ним побочные эффекты. Вероятно, по этой же причине разница между группами по использованию наркотического аналгетика имела пограничную статистическую значимость.
Парекоксиб стал первым ингибитором ЦОГ-2 для парентерального введения (внутривенного или внутримышечного), который обеспечивает потенциальные преимущества в сравнении с пероральными препаратами в пери- и послеоперационном периоде. На сегодня он считается единственным селективным ингибитором ЦОГ-2 для парентерального введения с убедительной доказательной базой. Так, в ряде исследований была доказана его эффективность в лечении послеоперационной боли при различных хирургических вмешательствах без увеличения риска геморрагических или желудочно-кишечных осложнений.
В настоящем исследовании не было зафиксировано повышения риска кровотечений, тромбоэмболий, желудочно-кишечных и сердечно-сосудистых нежелательных явлений при применении парекоксиба в сравнении с плацебо. Кроме того, не было отмечено влияния на ремоделирование костной ткани и кровопотерю, что оценивали по уровню гемоглобина, потребности в гемотрансфузии, данным рентгенологического исследования и скорости восстановления пациентов. Эти наблюдения подтверждают безопасность использования парекоксиба у пациентов после проведенного ТЭКС.
Вывод
Согласно результатам данного исследования, внутривенный парекоксиб в сочетании с продленной блокадой бедренного нерва обеспечивает улучшение контроля боли и сокращение применения наркотических аналгетиков у пациентов после ТЭКС.
Перевод с англ. Натальи Мищенко
Подготовлено по материалам статьи:
D.G. Sarridou, G. Chalmouki, M. Braoudaki et al. Intravenous Parecoxib and Continuous Femoral Block for Postoperative Analgesia after Total Knee Arthroplasty. A Randomized, Double-Blind, Prospective Trial. Pain Physician 2015; 18: 267-276
Напечатано при поддержке Представительства «Файзер Эйч.Си.Пи. Корпорейшн» в Украине
WUKDYN0216027
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...