Профилактика и лечение гнойных осложнений cтернотомий
В последние десятилетия в связи с внедрением в повседневную практику новых медицинских технологий, широким развитием кардиоторакальной хирургии резко возросло количество операций на органах средостения. Наиболее распространенным хирургическим доступом, с помощью которого можно широко открыть все отделы сердца, оперировать на магистральных сосудах, трахее, свободно манипулировать и производить исследования во время операции, в настоящее время является срединная стернотомия.
По данным мировой литературы, послеоперационные осложнения после срединной стернотомии – несостоятельность швов грудины, острый медиастинит и остеомиелит грудины и ребер – составляют 0,4-6,0% (А.А. Вишневский и соавт., 1999; D.H. Song et al., 2004; O.F. Dogan et al., 2005; R. Sharma et al., 2005; V.A. Olbrecht et al., 2006; S. Franco et al., 2009). При этом в группе риска, которая составляет от 12 до 20%, летальность при развитии послеоперационного медиастинита достигает 14-47% (S. Franco et аl., 2009). Инфицирование мягких тканей и костных компонентов грудной стенки характеризуется местным гнойным воспалением, склонным к распространению, хроническому течению и частым рецидивам, что приводит к инвалидизации больных (Ю.Г. Боженков, 1990; В.В. Грубник и соавт., 1997; Л.А. Блатун и соавт., 1998).
Осложнения со стороны стернотомных ран и инфекция средостения в структуре послеоперационных осложнений занимают 0,5-5,0% случаев. Наиболее грозным среди этих осложнений является стерномедиастинит, частота его составляет 5% от общего числа оперативных вмешательств, а летальность достигает 70%. По данным J. Ochsner (1986) и C. Serry (1990), осложнения после стернотомий – следствие прежде всего технических ошибок, а лечение таких осложнений необходимо начинать в максимально ранние сроки, чтобы предотвратить распространение инфекции на грудину и органы средостения.
Раневые осложнения после полной срединной стернотомии варьируют от стерильного расхождения краев раны до гнойного медиастинита. В своей практике мы используем классификацию по El Oakley & John E. Wright (1996), которая основывается на сроках манифестации осложнения, наличии факторов риска и неэффективных попыток хирургического лечения (табл. 1).
Некоторые авторы подразделяют инфекционные осложнения со стороны стернотомной раны (SWI, sternal wound infection) на две группы: поверхностные SWI с поражением лишь кожи и подкожно-жировой клетчатки и глубокие SWI с развитием остеомиелита грудины в сочетании с инфицированием ретростернального пространства или без него (A.S. Omran, A. Karimi, S.H. Ahmadi et al., 2007). В свою очередь, А.А. Вишневский, С.С. Рудаков и Н.О. Миланов с соавт. (2005) полагают, что термин «послеоперационный стерномедиастинит» является собирательным, так как инфицирование грудины почти всегда сопровождается поражением ребер, хрящей, мышц грудной стенки, ключиц, переднего средостения.
Стерномедиастинит – это инфекционное осложнение, возникающее после рассечения грудины, с вовлечением в инфекционный процесс костной ткани грудины, тканей средостения, с/без вовлечения в процесс поверхностных мягких тканей, с/без наличия стабильности грудины (Инфекция в хирургии, № 2, 2009. А.А. Вишневский и соавторы; Complications of midlaine sternothomy F. Robiscek, section 5, Pearson’s thoracic & esofageal surgery, 2008).
Несостоятельность шва грудины после срединной стернотомии в сочетании с присоединившейся инфекцией расценивается как стерномедиастинит (СМ), поскольку составляющими раны являются органы и клетчатка средостения, а также грудная кость, ребра и мягкие ткани передней грудной стенки. В отдельных случаях, когда пациенты не получают должного объема хирургического лечения, болезнь принимает рецидивирующий и затяжной характер (С.В. Софроний,1992).
Основной целью данной работы являются определение объема диагностических мероприятий с целью раннего выявления осложнений у пациентов после срединной стернотомии, для предотвращения развития глубоких осложнений и генерализации процесса, а также выбор оптимальной хирургической и лечебной тактики для оптимизации сроков лечения и реабилитации на основании литературных данных и собственного опыта.
Исследования проводились на базе ГУ «Институт общей и неотложной хирургии им. В.Т. Зайцева НАМН Украины», основываясь на 10-летнем опыте лечения больных с осложнениями после срединной стернотомии. Всего за этот период пролечено 1980 пациентов, оперированных с использованием стернотомного доступа. Следует отметить, что 196 (9,9%) была выполнена рестернотомия по поводу ранних послеоперационных осложнений. Поверхностные SWI с поражением лишь кожи и подкожно-жировой клетчатки диагностированы у 119 (6%) больных, СМ диагностирован в 3 наблюдениях (0,15%).
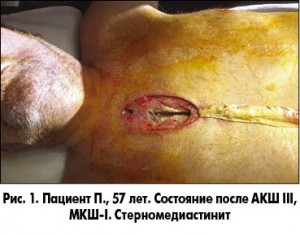
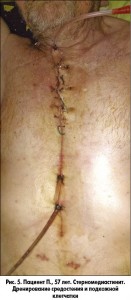
В настоящей работе мы хотели бы более подробно остановиться на наиболее грозном осложнении срединных стернотомий – СМ (рис. 1).
Мы считаем, что оценка факторов риска – залог минимизации осложнений. Развитие осложнений после срединного трансстернального доступа многие авторы описывают у пациентов, входящих на предоперационном этапе в так называемую группу риска [12, 18, 19]. Факторы риска возможного развития осложнений после срединной стернотомии делятся на дооперационные, интраоперационные и послеоперационные.
Дооперационными «факторами риска» являются хронические нарушения обмена веществ (ожирение, сахарный диабет), обострения хронических заболеваний легких (ХОБЛ, астма), нарушения работы выделительной системы (хроническая почечная недостаточность), снижение иммунологической реактивности организма, длительный прием лекарственных препаратов, снижающих свертываемость крови, прием стероидных гормонов, препаратов комплексного лечения гипертонической болезни [4, 12, 25].
Интраоперационными «факторами риска» являются значительная кровопотеря [9, 18, 24, 25], продолжительность операции, время искусственного кровообращения (ИК) [12], компрессия (ишемия) в зоне операционной раны. Выделяют риск развития воспалительного процесса при наличии гематом [16, 21, 22], по существу являющихся инкубатором для бактерий. Кроме того, среди причин осложнений в литературе есть указания на использование медицинского воска, вызывающего образование гранулем в области шва грудины [2, 15, 21, 23, 24].
Послеоперационными «факторами риска» являются нестабильность грудины, ишемия сосудов грудины, прорезывание швов грудины, кровотечение, рестернотомии, продолжительная искусственная вентиляция легких, непрямой массаж сердца, низкий сердечный выброс, респираторный дистресс-синдром, иммунодепрессия, неправильное ведение больного в послеоперационном периоде, декомпенсация хронических заболеваний (одному из наблюдаемых нами пациентов выполнялся непрямой массаж сердца) [5, 11, 19, 20].
В соответствии с этим мероприятия по профилактике развития осложнений должны проводиться на всех этапах лечения.
Предоперационная профилактика включает:
- Санацию очагов хронической инфекции (осмотр ЛОР-врача, стоматолога, офтальмолога, уролога, гинеколога, общего хирурга).
- Компенсацию сопутствующих соматических заболеваний (сахарный диабет, ожирение, ХОБЛ, астма, хронический бронхит, системные заболевания и т.д.).
- Соблюдение правил личной гигиены пациентом: комплекс гигиенических мероприятий (душ, смена постельного и нательного белья, гигиена полости носа и рта, бритье операционного поля в предоперационной).
- Разъяснительную беседу с больным о поведении (режиме) в послеоперационном периоде.
- Антибиотикопрофилактику в предоперационном периоде: цефазолин 2 г внутривенно или амоксициллин/клавуланат 1,2 г внутривенно, или цефуроксим 1,5 г внутривенно. При аллергической реакции на пенициллины – клиндамицин 0,9 г внутривенно (в стационарах с редко встречающимся MRSA) или ванкомицин 15 мг/кг внутривенно (в стационарах с часто встречающимся MRSA). Антибактериальный препарат вводится однократно за 30-40 минут до разреза («Справочник по антимикробной терапии» Р.С. Козлов, А.В. Дехнич, 2013).
- Анестезиологические мероприятия: обработка поля перед установкой катетеров осуществляется трехкратно с применением хлоргексидина 2% на спиртовой основе; не использовать йодсодержащие растворы и их заменители («Элиминация стернальной инфекции в кардиохирургии» П.Р. Фогт, Г.Г. Хубулава, 2012).
Интраоперационная профилактика должна включать:
1. Антибиотикопрофилактику – повторное введение дозы антимикробного средства при длительности операции больше двух периодов полувыведения препарата, выбранного для профилактики.
2. Хирургические мероприятия:
- тщательная обработка операционного поля;
- рассечение мягких тканей, включая надкостницу, скальпелем;
- технически симметрично выполненная стернотомия;
- скелетирование внутренних грудных артерий;
- промывание раны и полости перикарда теплым стерильным физиологическим раствором;
- раздельное дренирование перикарда и ретростернального пространства;
- исключение применения воска для гемостаза грудины;
- стабилизация грудины 6-8 восьмиобразными швами;
- ушивание фасциально-мышечного слоя отдельными швами (подкожная клетчатка не ушивается);
- ушивание кожи внутрикожным швом мононитью на режущей игле.
3. OFF-pump хирургия (по возможности).
Профилактика в послеоперационном периоде включает:
- раннюю активизацию больных;
- ношение торакального корсета;
- компенсацию сопутствующей патологии;
- продолжающийся диагностический поиск соматической патологии у больных, оперированных ургентно;
- своевременность удаления дренажей, электродов, катетеров – удаление дренажей при условии, что количество отделяемого по ним не превышает 100 мл за сутки;
- контроль водно-электролитного баланса;
- уход за раной (обработка, своевременная смена повязок, «снятие
- швов»);
- соблюдение пациентом лечебно-охранительного режима («Элиминация стернальной инфекции в кардиохирургии» П.Р. Фогт, Г.Г. Хубулава, 2012).
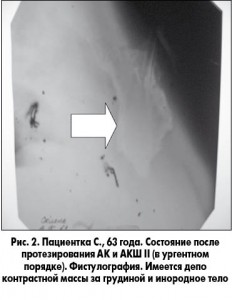
Диагностика осложнений основывается в первую очередь на выявлении клинических симптомов, характерных для раннего расхождения шва грудины. Во время первичного осмотра осуществляется забор раневого отделяемого для идентификации микрофлоры и определения ее чувствительности к антибиотикам. В дальнейшем выполняют ЭКГ, Эхо-КГ, ФВД, обзорную рентгенографию органов грудной клетки (в 2 проекциях) и фистулографию – при наличии свищей (рис. 2). Лабораторные методы диагностики включают клинический и биохимический анализы крови, коагулограмму, определение уровня С-реактивного белка, прокальцитониновый тест (по показаниям). Обязательным считаем ультразвуковое исследование раны, которое помогает определить локализацию и форму патологического очага в грудной стенке, выявить наличие и расположение жидкостного компонента – гематом, абсцессов.
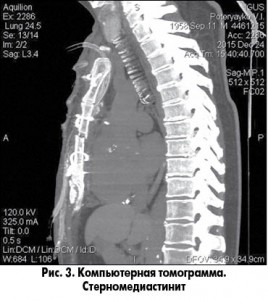
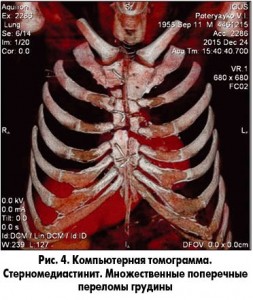
Наиболее информативным из методов диагностики является мультиспиральная компьютерная томография (МСКТ) грудной клетки. Данное исследование легко переносится больными и является высокоинформативной методикой в диагностике инфекционно-воспалительных заболеваний грудины и ребер (рис. 3, 4). Мы отмечаем необходимость проведения компьютерной томографии не только до операции, но и после нее, с целью контроля состояния костных структур раны, оценки радикальности выполненной резекции, отсутствия гематом. Так как инфекционно-воспалительные заболевания склонны к рецидивированию, КТ обоснованно применять также в отдаленные сроки послеоперационного периода [5, 9, 11].
Большое значение при определении тактики лечения имеет диагностика бактериальной флоры. Большинство пациентов с данной патологией при микробиологическом исследовании раневого содержимого имеют госпитальную флору, резистентную ко многим антибактериальным препаратам. В качестве микробного агента наиболее часто выступают золотистый и эпидермальный стафилококки, синегнойная и кишечная палочки [23]. Зачастую в ране не один, а ассоциация штаммов. Среди грибковой флоры при остеомиелите чаще всего встречаются грибы рода Candida [6, 9]. Грибы рода Aspergillus fumigatus дают высокий риск развития сепсиса. Инфекция, развившаяся на фоне анаэробной флоры, имеет особенно тяжелое течение и сопровождается выраженными признаками интоксикации [10, 16].
Лечение больного с СМ должно быть комплексным и мультидисциплинарным.
Основной метод лечения воспалительных заболеваний грудной стенки – этапный хирургический [4, 5, 13, 21, 26].
На первом этапе производится хирургическая обработка раны с ревизией и удалением наложенных ранее швов и резекцией некротических участков как костных структур, так и мягких тканей. Во время операции из вскрытых очагов некроза, гнойных затеков производится забор материала на исследование микрофлоры и чувствительность к антибактериальным препаратам (рис. 5).
Одной из главных особенностей операции является хирургическая обработка раны с удалением инфицированных тканей блоком, в пределах здоровых, так как высокая инфицированность раны не позволяет произвести более экономную резекцию. Все попытки местной обработки раны и сохранение даже небольших костных фрагментов деструкции приводят к развитию рецидива заболевания.
- При хондрите – полностью удалять хрящ и ткани реберно-грудинного сустава вместе с фрагментом костной части ребра.
- При поражении медиальной трети реберного хряща – резецировать 2-3 см костной части.
- При поражении латеральной трети хряща – резецировать не менее 5 см костной части.
- При остеомиелите ребра – ребро резецировать в пределах не менее 2-3 см от границы воспаленной надкостницы.
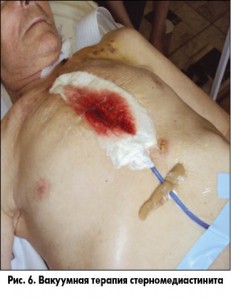
Второй этап хирургического лечения СМ необходимо по возможности осуществлять методом вакуумной аспирационной терапии (рис. 6) либо традиционными перевязками с применением мазей. При наличии технических возможностей предпочтение необходимо отдавать методу вакуумной аспирационной терапии.
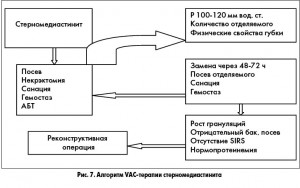
Алгоритм лечения с применением вакуумной терапии представлен на рисунке 7.
Особенностями метода вакуумной терапии при медиастините являются:
- мобилизация ретростернального пространства (переднего средостения) латерально на 3-4 см от краев резецированных костных фрагментов;
- применение неадгезивных перевязочных сетчатых материалов на дно раны (миокард, магистральные сосуды, шунты);
- обязательное укладывание губки в переднее средостение на ширину мобилизованного пространства с целью исключения контакта костных фрагментов со структурами сердца;
- дренаж, установленный через контраппертуру, не должен контактировать с периметром раны.
Местное лечение «мазевым методом» осуществляется в зависимости от фазы раневого процесса.
В клинике института в случаях развития осложнений стернотомий в комплексе лечения широко применяется методика наружного СВЧ-облучения ран.
«Стартовая» антибиотикотерапия (до получения результатов посевов, с учетом наиболее частых возбудителей) – эртапенем 1 г 1 раз в сутки или пиперациллин/тазобактам 4,5 г 4 раза в сутки; при высокой вероятности MRSA (10-15%) – лечение дополняется введением ванкомицина, линезолида или тейкопланина. При высокой вероятности ESBL-продуцентов используются карбапенемы или тигециклин («Справочник по антимикробной терапии» Р.С. Козлов, А.В. Дехнич, 2013).
Дальнейшая коррекция антибактериальной терапии должна проводиться согласно результатам посевов и чувствительности к антибиотикам. Проводимое местное лечение претерпевает изменения согласно результатам микробиологического исследования раневого отделяемого, получаемого во время каждой перевязки при использовании вакуумной терапии или 1 раз в 3 дня при использовании мазевого метода. Следует отметить, что у пролеченных в клинике пациентов с СМ в одном случае назначался Мепенам в монотерапии, в одном наблюдении Мепенам комбинировали с Линезолидином и в одном наблюдении – с Глитейком. Во всех случаях констатировали положительный клинический и бактериологический эффекты, смены режима антибактериальной терапии не потребовалось.
На третьем этапе лечения выполняются операции с целью ликвидации дефекта передней грудной стенки (пластический этап).
Критерии возможности перехода к третьему этапу лечения:
- «чистая рана» – полное отсутствие микробных тел в ране или их минимальное количество (1,00 Е + 0,1 КОЕ/мл);
- II фаза раневого процесса (регенерация и пролиферация);
- отсутствие синдрома системной воспалительной реакции (клинически и лабораторно);
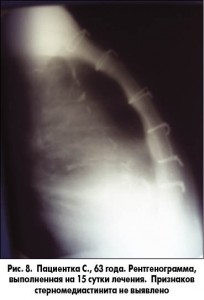
- клинически, лабораторно и инструментально подтвержденное удовлетворительное состояние пациента (рис. 8).
В настоящее время используются следующие варианты реконструктивных операций:
- Реостеосинтез грудины с применением рутинного шва грудины стальной лигатурой или с применением современных имплантов и фиксирующих систем: ZipFix, монофиламентной нити, имплантов из металла с памятью формы и др.
- Пластика мышечным лоскутом. Возможно использование большой и малой грудных мышц, прямой мышцы живота, широчайшей мышцы спины.
- Пластика прядью большого сальника. При избыточном объеме сальника возможно выполнение частичной резекции пряди для создания трансплантата необходимой величины.
Таким образом, проанализировав данные литературы и собственный опыт лечения больных с осложнениями после стернотомий, мы выделили следующие ключевые моменты:
- при установлении диагноза «послеоперационный медиастинит» хирургическое лечение должно быть выполнено в максимально ранние сроки;
- оперативное вмешательство должно выполняться после устранения коагулопатии;
- хирургическая обработка раны должна выполняться в условиях адекватного обезболивания;
- из раны необходимо полностью удалять нефиксированные отломки ребер и грудины;
- при проведении вакуумного лечения раны сердце перед укладкой губки должно быть отграничено неадгезивным сетчатым перевязочным материалом;
- реконструктивная операция должна выполняться только при условии достижения всех необходимых критериев.
Пациенты, перенесшие реостеосинтез грудины либо резекционно-пластические операции на грудине, должны соблюдать строгие ограничения физической нагрузки в течение 6 месяцев. Медикаментозная терапия заключается в лечении сопутствующих заболеваний согласно рекомендациям смежных специалистов.
Литература
- Билалов И.В. Клинико-анатомическое обоснование срединной стернотомии и профилактика ее осложнений //Автореф. к.м.н., Казань – 1996.
- Вишневский А.А., Оганесян А.К., Головтеев В.В. и др. Хирургическое лечение хронического остеомиелита грудины // Груд. хирургия. – 1989. – № 6. – С. 46-51.
- Вишневский А.А., Рудаков С.С., Миланов О.Н. // Хирургия грудной стенки. – Москва: ВИДАР, 2005. – С. 301.
- Гетьман В.Г. Причины, хирургическое лечение и профилактика хондрита и остеомиелита ребер и грудины // Груд. и сердечно-сосудистая хирургия. 1991. – № 5. С. 52-55.
- Гостищев В.К. Оперативная гнойная хирургия. – Москва: Медицина. – 1991. – С. 415
- Грубник В.В., Шипулин П.П., Прохода С.А., Кравченко В.М. Хирургическое лечение гнойного хондрита и остеомиелита ребер и грудины // Груд. и сердечно-сосудистая хирургия. – 1997. – № 4. – С. 39-43.
- Кремлев Н.И. Клинико-анатомическая характеристика чрездвухплеврального доступа и органам переднего средостения и некоторые вопросы заживления операционной раны. Автореф. к.м.н., Новосибирск – 1963.
- Ладутько И.М., Лобко П.И., Савченко А.Н., Фимкович М.Е. Консолидация грудины и осложнения стернальных ран после продольной срединной стернотомии. Здравоохранение Беларуси, 1994, 6, С. 6-10.
- Морозов И.А., Сек Н.Н., Панков Е.Я. Морфологическое обоснование участков и техники получения костного мозга из грудины // Арх. анатомии, гистологии и эмбриологии. 1973, С. 103-107.
- Сафроний С.В. Диагностика и лечение послеоперационного остеомиелита грудины // Автореф. дис. д-ра мед. наук: М., – 1990. – С. 52.
- Breyer R.N., Mills S.A., Cordel A.R. A prospective study of sternal wound complications // Ann. Thorac. Surg. – 1984. – Vol. 37. – № 5. – P. 412-416.
- Dogan O.F., Demircin M., Duman U., Ozsoy F., Acaroglu E. The use of suture anchor for sternal nonunion as a new approach (Demicin-Dogan technique) // Heart. Surg Forum. – 2005. – 8(5): Р. 64-90.
- Fabiani J.N., Beres J., Aubert P.W. Treatment des sternites et sterno-chondrites apres chirurgie cardiaque // Ann. Thorac. Cardio-vascul. – 1976. – Vol. 15. – № 4. – P. 297-304.
- Franco Sergio, Ana M. Herrera, Mauricio Atehortua, Luis Velez, Juan Botero, Juan S. Jaramillo, Juan F. Velez and Hugo Fernandez. Use of steel bands in sternotomy closure: implications in high-risk cardiac surgical population // Interact CardioVasc Thorac Surg. 2009; 8: 200-205.
- Graeber G.M., Cohen D.J., Patrick Dr. et al. Rib fracture healing in experimental flail chest // J. Trauma Vol. 25: 903, 1985. 14.
- He G.W., Acuff T.E., Ryan W.H. Risk factors for operative mortality and sternal wound infection in bilateral internal mammary artery grafting // J. Thorac. Cardiovasc. Surj. – 1994. – Vol. 107. – № 1 – P. 196-202.
- Majure J.A., Albin R.E., Arganese T.R. Reconstruction of the infected median sternotomy wound // Ann. Thorac. Surg. – 1986. – Vol. 42. – № 7 – P. 777-778.
- Martin R.D. The management of infected median sternotomy wounds // Ann. Plast. Surg. – 1989. – Vol. 22. – № 3. – P. 243-251.
- Olbrecht V.A., Barreiro C.J., Bonde P.N., Willians J.A., Baumgartner W.A., Gott V.L., Conte J.V. Clinical outcomes of noninfectious sternal dehiscence after median sternotomy // Ann Thorac Surg. – 2006. – Sep; 82(3): 902-7.
- Ottino G., Rocca D., Costa P. Major sternal wound infection after open-heart Surgery: A Multivariate analysis of risk factors in 2579 consecutive operative procedures // Ann. Thorac. Surg. – 1987. – Vol. 44. – № 2. – P. 173-179.
- Pairolero P.S., Arnold C.L. Management of recalcitrant median sternotomy wound // J. Cardiovasc. Surg. – 1984. – Vol. 88. – № 3. – P. 357-364.
- Sharma R., Puri D., Panigrahi B.P., Virdi I.S. A modified parasternal wire technique for prevention and treatment of sternal dehiscence // Ann Thorac Surg. – 2004. – Jan; 77(1): 210-312.
- Serry C., Bleck P.C., Hunter J.A. Sternal wound complication: Management and results // J. Thorac. Cardiovasc. Surg. – 1980. – Vol. 80. – № 6. – P. 861-866.
- Scullu E.N. Comparison between antibiotic irrigation and mobilization of pectoral muscle flaps in treatment of deep sternal infection // J. Cardiovasc. Surg. – 1985. – Vol. 90. – № 4. – P. 523-531.
- Song D.H., Lohman R.F., Renucci J.D., Jeevanandam V., Raman J. Primary sternal plating in high-risk patients mediastinitis // Eur. J. Cardiothorac Surg. – 2004. – Aug; 26(2): 367-372.
- Stoney W.S., Alford W.C., Frist K.A. Median sternotomy dechiscence // Ann. Thorac. Surg. – 1978. – Vol. 26. – № 5. – P. 421-426.
- Sudmann B., Bang G., Sudmann E. Histologically verified bone wax (beeswax) granuloma after sternotomy 17 of 18 autopsy cases // Patology. – 2006; Apr. 38(2), 134-141.
СТАТТІ ЗА ТЕМОЮ Хірургія, ортопедія та анестезіологія
Дисфагія є поширеним явищем у пацієнтів відділення інтенсивної терапії (ВІТ), але вона часто залишається недостатньо розпізнаною та неконтрольованою, незважаючи на те що пов’язана з небезпечними для життя ускладненнями, тривалим перебуванням у ВІТ та госпіталізацією. Запропонований у статті експертний висновок щодо діагностики й лікування дисфагії розроблений на основі доказових клінічних рекомендацій та думок лікарів-практиків. Автори рекомендують прийняти ці клінічні алгоритми для надання стандартизованої та високоякісної допомоги, яка передбачає своєчасний систематичний скринінг, оцінку та лікування дисфагії в екстубованих пацієнтів і пацієнтів із трахеостомою у ВІТ. ...
Больовий синдром при хронічних ранах є рутинним явищем хірургічної практики. Рана вважається такою, що тривало не загоюється, якщо, незважаючи на відповідну терапію та достатній термін лікування (4-6 міс), відсутні або практично відсутні ознаки загоєння. Неопіоїдні та опіоїдні анальгетики є основними препаратами, що застосовуються для лікування больового синдрому при ранах. На науково-практичній конференції «Міждисциплінарний підхід у лікуванні коморбідних хірургічних пацієнтів», що відбулася наприкінці 2023 року, тему менеджменту хронічної ранової хвороби представив у доповіді «Контроль болю в хірургії ран та трофічних дефектів м’яких тканин різної етіології» завідувач кафедри хірургії та судинної хірургії Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Сергій Іванович Саволюк. Ключові слова: ранова хвороба, трофічна виразка, ВАК-терапія, больовий синдром, нестероїдні протизапальні препарати, Дексалгін®....
Актуальність проблеми переломів на сьогодні не залишає сумнівів, зокрема в контексті старіння населення та поширеності остеопорозу. Кальцій та вітамін D, виконуючи ключову роль у формуванні та підтриманні щільності кісткової тканини, є необхідними елементами для успішної профілактики переломів, особливо у вразливих груп населення. Також важливим є достатній рівень кальцію та вітаміну D в організмі для оптимального зрощення переломів і посттравматичної зміни кісток. У цьому контексті велике значення має вибір конкретного комплексу Са + D із позицій ефективності, безпеки та високого комплаєнсу. Ключові слова: остеопороз, крихкість кісток, кальцій, вітамін D, профілактика переломів. ...
З установленням центральних венозних катетерів (ЦВК) пов’язані різноманітні ускладнення, включаючи ті, що зумовлені безпосередньо введенням і/або доступом, через який уводиться катетер, а також віддалені (>1 тижня) ускладнення, такі як дисфункція катетера, стеноз або тромбоз центральної вени та розвиток інфекції. Кількість і тяжкість ускладнень зростають зі збільшенням розміру катетера, кількості використовуваних катетерів та часу їх перебування в організмі. У статті наведено огляд сучасних даних щодо ускладнень, пов’язаних із ЦВК, а також стратегії їх профілактики та лікування. Ключові слова: центральний венозний катетер, ускладнення, пункція артерії, пневмоторакс, тромбоз центральної вени, інфекції кровотоку, дисфункція катетера. ...