Особливості ведення пацієнтів із постковідним синдромом: у фокусі – патогенетична терапія
Згідно з результатами спостереження за перебігом COVID‑19 установлено, що коронавірусна інфекція не минає безслідно та часто супроводжується розвитком т. зв. постковідного синдрому (Long COVID). Безперечним є також і факт підсилення тяжкості функціональних та морфологічних розладів, що існували до початку COVID‑19, тому в хворих після гострої фази відзначаються ознаки загострення хронічних захворювань. Уже сьогодні ми маємо негативні прогнози щодо зростання частоти хронічних нейропсихічних розладів у найближчому майбутньому, асоційованих із впливом COVID‑19 на центральну нервову та імунну системи. Хоча протягом 2 років життя в умовах пандемії знання фахівців щодо терапії COVID‑19 суттєво поглибилися, питання щодо швидкого й ефективного відновлення порушених функцій через тривалий час після перенесеної хвороби стало новим викликом для медичної спільноти.
 Ускладнення, що розвиваються після гострої фази коронавірусної інфекції, залежить від поширеності та тяжкості вірусних уражень у різних типах клітин і органах. Хворі, котрі перенесли COVID‑19, найчастіше повідомляють про розвиток загального нездужання, дифузної міалгії, підвищену втомлюваність, депресивні симптоми, порушення сну, мігренеподібний головний біль, що часто є рефрактерним до традиційних аналгетиків.
Ускладнення, що розвиваються після гострої фази коронавірусної інфекції, залежить від поширеності та тяжкості вірусних уражень у різних типах клітин і органах. Хворі, котрі перенесли COVID‑19, найчастіше повідомляють про розвиток загального нездужання, дифузної міалгії, підвищену втомлюваність, депресивні симптоми, порушення сну, мігренеподібний головний біль, що часто є рефрактерним до традиційних аналгетиків.
За даними P. Pozo-Rosich і співавт. (2020), через 6 тиж після перенесеної гострої коронавірусної інфекції ≈38% пацієнтів продовжують страждати на хронічний головний біль. Про клінічно значиму депресію та тривожність повідомляли ≈30-40% хворих, які мали тяжкий перебіг COVID‑19 (Rogers J. et al., 2020).
За даними J. Seessle та співавт. (2021), тільки 23% пацієнтів повністю повертаються до нормального рівня здоров’я через 12 місяців після перенесеної COVID‑19. До групи ризику щодо психологічних / психічних розладів після COVID‑19 належать:
- пацієнти з тяжким перебігом COVID‑19 з ураженням нервової системи, в т.ч. із порушенням мозкового кровотоку (мікротромбози та васкуліти);
- люди похилого віку зі зниженими адаптаційними можливостями (самотні, без соціальної підтримки);
- жінки (як тривожніші й емоційно нестабільні);
- тривожні та депресивні особистості, особи, котрі мають в анамнезі афективні розлади;
- хворі, в яких ще до виникнення COVID‑19 діагностувалися хронічні соматичні порушення, що впливали на центральну нервову систему;
- неодружені / розлучені особи віком до 40 років;
- особи з алко- та/або наркозалежністю;
- медичний персонал (особливо працівники із синдромом професійного вигорання).
Ураження центральної нервової системи при COVID‑19 пов’язують з опосередкованим ушкодженням нервової тканини внаслідок ендотеліїту та системного запалення (цитокіновий шторм). Розвиток т. зв. SARS-CoV‑2-асоційованого ендотеліїту – результат специфічного вірусного впливу на ендотелій судин із мішенню у вигляді рецепторів ангіотензинперетворювального ферменту 2 типу (АПФ‑2). З огляду на гіпотезу про наявність тропності вірусу SARS-CoV‑2 до ендотелію, який вважається найбільш дифузно представленим ендокринним органом у тілі людини, незаперечним є той факт, що саме цей вірус здатен спричиняти ендотеліальну дисфункцію, зміщення гомеостазу в бік гіперкоагуляції, імунні реакції з формуванням цитокінового шторму й утворенням каскаду факторів гіперзапалення. Патофізіологічно такі стани характеризуються вазоконстрикційними змінами, що супроводжуються гіпоксією, ішемією та гострим набряком.
Патоморфологічні зміни проявляються венозною й артеріальною мікроангіопатією, мікротромбозами, дифузним ендотеліїтом та іншими SARS-CoV‑2-асоційованими судинними порушеннями із запальним компонентом. Постковідні ускладнення характеризуються формуванням хронічної тромботичної мікроангіопатії зі стійкими проявами оксидативного стресу та дефіцитом синтезу оксиду азоту (NO) ендотеліоцитами в судинній стінці (Bermejo-Martin J.F. et al., 2020).
Інший ушкоджувальний фактор нервової системи – синдром вивільнення цитокінів, або цитокіновий шторм. Такий стан супроводжується різким збільшенням активних форм кисню, що зумовлює окислювальне ушкодження ліпідів клітинних мембран, підвищення судинної проникності, розвиток набряку та гіпоксії. Ураження ендотелію судин унаслідок гіперімунної реакції (ушкодження цитокінами та вільними радикалами) спричиняє розвиток системного фонового «тліючого» запалення в постковідний період. Ендотеліальна дисфункція та хронічне запалення супроводжуються гіперкоагуляцією, підвищенням рівня фібриногену, зниженням процесів фібринолізу й антикоагуляції, що, своєю чергою, зумовлює тромбоутворення.
Цитокіни, що виділяються при периферичному запаленні, можуть збільшувати проникність гематоенцефалічного бар’єра, відкриваючи в такий спосіб вірусу шлях для проникнення до мозку. Після потрапляння до центральної нервової системи SARS-CoV‑2 може інфікувати астроцити й мікроглію, а також активувати каскад реакцій нейрозапалення та нейродегенерації.
З огляду на ті зміни, які спричиняє вірус SARS-CoV‑2 (дисфункція ендотелію та порушення синтезу NO, системне запалення і оксидативний стрес, стимуляція тромбоутворення), можна легко визначитися з обранням лікарських засобів, здатних впливати на вищезазначені ланки патогенезу.
Потужну антиоксидантну та протизапальну дію чинить едаравон, що являє собою низькомолекулярну ліпофільну сполуку, швидко нейтралізує вільні радикали, гальмує перекисне окиснення ліпідів, захищаючи клітини від руйнування, активує ферменти антиоксидантного захисту. Препарат здатен пригнічувати продукцію низки медіаторів запалення (фактора некрозу пухлини, IL‑1, IL‑6), а також зменшувати проникність ендотеліоцитів мікроциркулярного русла (Kikuchi K. et al., 2012). Сьогодні едаравон внесений до японських настанов і рекомендований у схемах терапії пацієнтів із гострим респіраторним дистрес-синдромом у відділеннях інтенсивної терапії.
На вітчизняному фармацевтичному ринку едаравон представлений препаратом Ксаврон®.
Дисфункція ендотелію та зниження продукції NO в результаті його посиленого руйнування під дією вільних радикалів і зменшення доступності попередника NO (L-аргініну) зумовлює переважання дії вазоконстрикторів і посилення адгезії тромбоцитів. Це призводить до погіршення кровопостачання тканин, посилення гіпоксії та розвитку метаболічних порушень на клітинному рівні. Саме тому екзогенне надходження L-аргініну як субстрату для синтезу NO є патогенетично обґрунтованим для зменшення проявів ендотеліальної дисфункції в постковідний період.
Також важливе значення має застосування речовин, що покращують енергетичне забезпечення клітини.
Вирішити ці завдання можна за рахунок застосування препарту Тіворель®, який є унікальною комбінацією L-карнітину та L-аргініну. Основна роль L-карнітину в організмі людини – участь в енергетичному обміні, а саме перенесення ацильних груп жирних кислот усередину мітохондрій, де вони піддаються β-окисленню. L-карнітин також регулює концентрацію коензиму А, впливаючи на різні процеси, в тому числі цикл Кребса й окислення амінокислот.
Механізмами зменшення ішемії під дією L-карнітину є запобігання накопиченню довголанцюгових молекул ацил-кoензиму A, які сприяють виробітці вільних радикалів пошкодженими мітохондріями, відновлення оксидативних уражень фосфоліпідів клітинних мембран (Wang Z. Y. et al., 2018).
Амінокислота L-аргінін є основним субстратом для синтезу судинного NO. Численні дослідження демонструють сприятливий вплив L-аргініну на продукцію NO та функцію ендотелію. Також відомо, що NO чинить антитромботичну дію, яка реалізується через пригнічення агрегації тромбоцитів та їх адгезії до ендотелію. Окрім того, NO має імуномодулювальні, антиоксидантні та протизапальні властивості, регулює апоптоз тощо.
Для зменшення проявів ішемії та покриття внутрішньоклітинного енергодефіциту, профілактики розвитку метаболічних розладів (кетоацидозу голодування й діабетичного кетоацидозу) доцільно використовувати препарати на основі ксилітолу, зокрема Ксилат®. Ксилітол являє собою 5-атомний спирт, який при парентеральному введенні швидко включається в пентозофосфатний цикл метаболізму клітини, підвищує інтенсивність гліколізу, посилює утворення піровиноградної кислоти, котра сприяє окисленню ацетилкоензиму А в циклі Кребса. Ксилітол стабілізує внутрішньоклітинні енергетичні процеси та підвищує енергетичну ефективність метаболізму, проявляє виражену антикетогенну дію.
Ретельний аналіз наявних літературних джерел надає підстави рекомендувати комбінацію препаратів Ксаврон® (вплив на системне запалення), Тіворель® (нормалізація функції ендотелію та покращення енергозабезпечення міокарда) та Ксилат® (покриття внутрішньоклітинного енергодефіциту, профілактика метаболічних розладів).
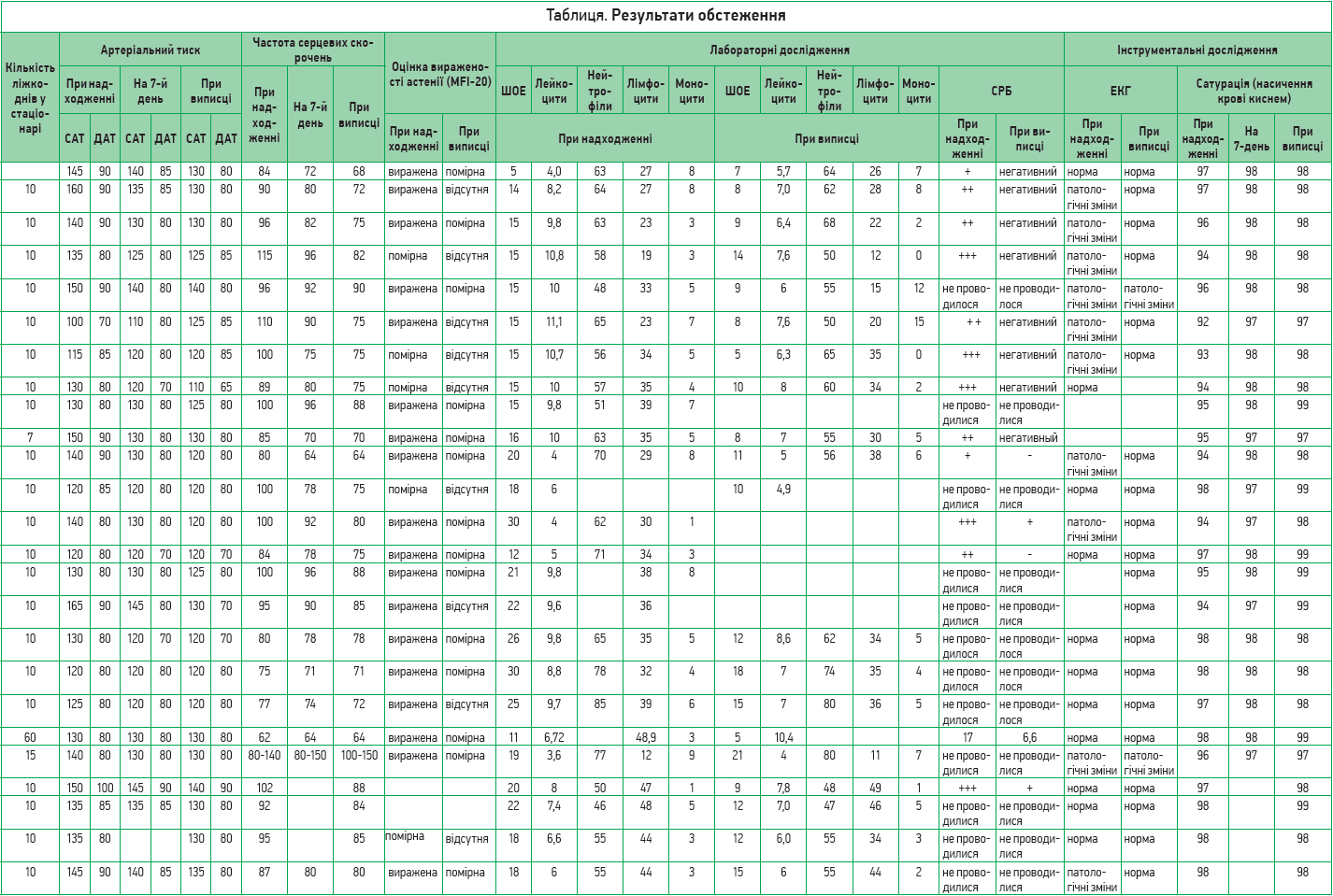
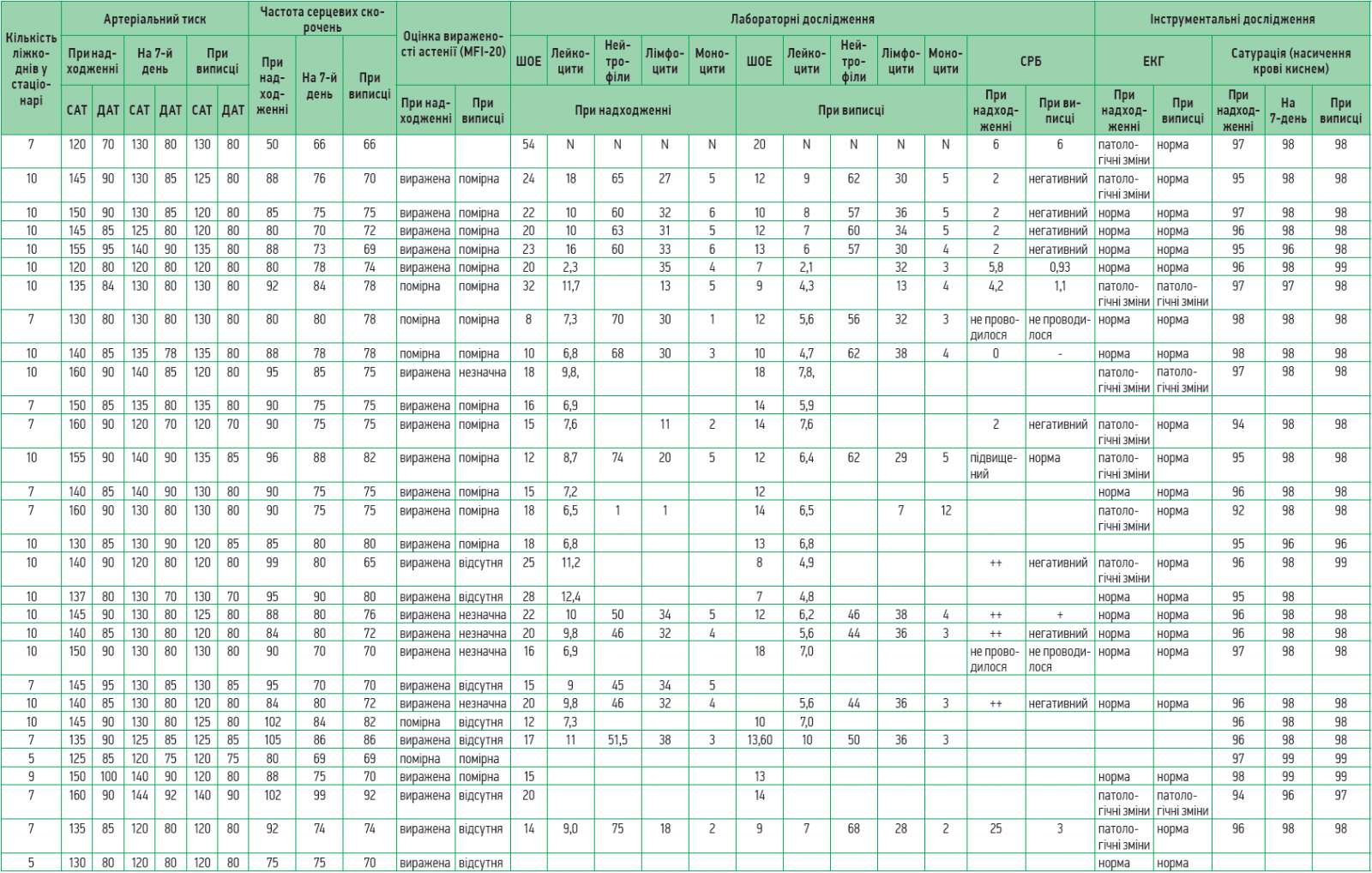
Для прослідковування динаміки перебігу постковідного синдрому на тлі запропонованого патогенетичного лікування було проведено обстеження 60 лікарів, котрі перенесли гостру фазу COVID‑19, але в подальшому були госпіталізовані в зв’язку з вираженими порушеннями функціонування та неможливістю повернутися до повсякденної діяльності.
Найпоширенішими скаргами були загальна слабкість, астенія, апатія, задишка при незначному фізичному навантаженні та стані спокою, зниження фізичної витривалості, швидка втомлюваність, емоційна лабільність, порушення сну, підвищена тривожність, головний біль, відчуття туману в голові, запаморочення, зниження когнітивної функції, порушення концентрації уваги, болі в серці, підвищення артеріального тиску, відчуття оніміння ніг, болі в ногах.
Додатково до стандартної терапії пацієнти отримували Ксаврон® – по 30 мг 2 р/день (препарат розчиняли в 100 мл 0,9% розчину NaCl і вводили протягом 30 хв зі швидкістю 40 крапель/хв), Тіворель® – по 100 мл 1 р/день (30 крапель/хв), Ксилат® – по 200 мл (5-6 мл/кг) 1 р/день упродовж 60 хв (швидкість – 40 крапель/хв).
Слід зазначити, що на сьогодні немає офіційно зареєстрованих тестів чи опитувальників, які надавали б змогу оцінити тяжкість постковідного астенічного синдрому. Саме тому для оцінки стану пацієнтів і спостереження за регресуванням постковідних проявів використовували шкалу вираженості астенії MFI‑20, зміну показників лабораторних досліджень у часі.
У перший день надходження до медичного закладу, а також перед випискою виконували ЕКГ, вимірювання артеріального тиску, проводили загальний та розгорнутий аналіз крові, оцінку вираженості астенії за MFI‑20, визначення сатурації крові. В переважній більшості випадків тривалість госпіталізації становила 10 днів (табл.).
Аналіз наведених у таблиці даних продемонстрував швидке зменшення астенічних проявів і нормалізацію маркерів системного запалення (С-реактивний білок) та лейкоцитарної формули.
Показовим є клінічний випадок ураження периферичних нервів із частковою втратою рухової активності після перенесеної COVID‑19.
Клінічний випадок
Хвора С., 64 роки. Звернулася зі скаргами на слабкість у кінцівках, більше виражену в ногах порушення ходи, самостійна хода та хода з підтримкою не можливі, сильний біль у гомілках, що сильно погіршує самопочуття, біль знімається тільки 300 мг прегабаліну на добу, набряки нижніх кінцівок.
Анамнез захворювання: в червні 2021 року захворіла на COVID‑19, лікувалася в реанімаційному відділенні, весь час була в лежачому положенні. Коли мала змогу вставати, відчувала слабкість у кінцівках. Після виписки з інфекційного відділення повторно звернулася по медичну допомогу у зв’язку з вираженою слабкістю нижніх кінцівок і труднощами при ходьбі. 27.07.2021 пацієнтку було госпіталізовано.
Анамнез життя: туберкульоз, гепатит А, венеричні захворювання, епілептичні напади заперечує. Алергологічний анамнез не обтяжений. Спадковий анамнез не обтяжений.
Об’єктивно: загальний стан середньої тяжкості. Лімфатичні вузли: не збільшені. Шкіра та слизові чисті. Дихання везикулярне, 15/хв, хрипи відсутні. Живіт м’який, безболісний. АТ 120/80 мм рт. ст., ЧСС 71/хв.
Неврологічний статус: свідомість збережена. Орієнтація не порушена, критика не знижена. Мова збережена. Менінгеальні симптоми негативні. Черепно-мозкові нерви: очні щілини, зіниці D=S. Ністагму, диплопії немає. Обличчя симетричне. Язик по середній лінії. Ковтання, фонація збережені. М’язова сила: з верхніх кінцівок знижена справа до 46, зліва – до 36. Сила м’язів нижніх кінцівок до 2 балів. Нормотонус. Сухожильні рефлекси з верхніх і нижніх кінцівок симетричні, знижені. Хода порушена. Координація: пальце-носову виконує незадовільно. В позі Ромберга не стоїть. Чутливість не порушена. Патологічні рефлекси: симптом Бабінського не викликається. Вегетативна нервова система: без патології.
Загальний аналіз крові (27.07.2021): еритроцити 4,49×1012/л, гемоглобін 138 г/л, тромбоцити 165×109/л, лейкоцити 15,26×109/л, нейтрофіли 78,6%, лімфоцити 16,1%, моноцити 5,2%, еозинофіли 0%, базофіли 0,1%.
Біохімічний аналіз крові (27.07.2021): загальний білірубін 9,2 мкмоль/л, АЛТ 197 Од/л, АСТ 41,5 Од/л, креатинін 39 мкмоль/л, холестерин 4,14 ммоль/л, тригліцериди 1,75 ммоль/л, глюкоза 8,88 ммоль/л. Тиреотропний гормон (27.07.2021): 1,32 мОд/л.
Попередній діагноз: синдром Гієна-Барре?
План лікування: протинабрякова, протизапальна, судинна, нейропротекторна терапія, Ксаврон, Тіворель®, Ксилат®.
29.07.21. Скарги на відсутність рухів у нижніх кінцівках, слабкість у них.
Електронейроміографія (29.07.21). Було проведено обстеження сенсорних і моторних волокон n. peroneus, n. tibialis, дослідження F-хвиль. Висновок: ознаки вираженої аксонально-демієнізуючої полінейропатії нижніх кінцівок.
Загальний аналіз крові (30.07.2021): еритроцити 3,96×1012/л, гемоглобін 126 г/л, тромбоцити 147×109/л, лейкоцити 14,9×109/л, нейтрофіли 89,8%, лімфоцити 6,5%, моноцити 3,6%, еозинофіли 0%, базофіли 0,1%.
11.10.21 після проведеного курсу медикаментозного та реабілітаційного лікування. Скарги на відчуття оніміння в дистальних відділах кінцівок, більше справа, незначну слабкість у стопах. У неврологічному статусі – хода відновилася, пацієнтка ходить самостійно без підтримки, незначний парез згиначів обох стоп, більше правої. Сухожильні рефлекси нижніх кінцівок: колінний рефлекс знижений справа; аліловий рефлекс знижений з обох сторін. Гіпестезії нижніх кінцівок за поліневротичним типом.
Електронейроміографія (11.10.21). Обстежені наступні нерви: n. peroneus, n. tibialis, n. peroneus superficialis, n. suralis, проведено дослідження F-хвиль. Висновок: ЕНМГ-ознаки сенсомоторної аксонально-демієнізуючої полінейропатії нижніх кінцівок. Порівняно з даними ЕНМГ від 29.07.21 позитивна динаміка відповіді по правому та лівому m. аbductor hallucis, поява з обох сторін F-хвиль. Двобічна відсутність Н-рефлексів свідчить про відсутність замикання нервової дуги на рівні сегментів S1-S2 спинного мозку.
Рекомендовано: ЕНМГ контроль у динаміці після зниження периферичних набряків нижніх кінцівок.
Отже, постковідний синдром є частим ускладненням перебігу гострого COVID‑19, що потребує адекватної терапії. З цією метою доцільно застосовувати патогенетичний підхід, спрямований на корекцію найвираженіших порушень, обумовлених впливом вірусу SARS-CoV‑2. Інфузійне введення препаратів Ксаврон®, Тіворель® і Ксилат® продемонструвало швидке відновлення загального стану, фізичної активності пацієнтів, зменшення проявів астенії (зниження показника суб’єктивної оцінки астенії MFI‑20), нормалізацію сну.
Запропонована схема лікування добре переносилася хворими. Ускладнень і побічних ефектів при проведенні інфузійної терапії не спостерігалося.
Медична газета «Здоров’я України 21 сторіччя» № 1 (518), 2022 р.
СТАТТІ ЗА ТЕМОЮ Терапія та сімейна медицина
Реімбурсація – це повне або часткове відшкодування аптечним закладам вартості лікарських засобів або медичних виробів, що були відпущені пацієнту на підставі рецепта, за рахунок коштів програми державних гарантій медичного обслуговування населення. Серед громадськості програма реімбурсації відома як програма «Доступні ліки». Вона робить для українців лікування хронічних захворювань доступнішим....
Тіамін (вітамін В1) – важливий вітамін, який відіграє вирішальну роль в енергетичному обміні та метаболічних процесах організму загалом. Він необхідний для функціонування нервової системи, серця і м’язів. Дефіцит тіаміну (ДТ) спричиняє різноманітні розлади, зумовлені ураженням нервів периферичної та центральної нервової системи (ЦНС). Для компенсації ДТ розроблено попередники тіаміну з високою біодоступністю, представником яких є бенфотіамін. Пропонуємо до вашої уваги огляд досліджень щодо корисних терапевтичних ефектів тіаміну та бенфотіаміну, продемонстрованих у доклінічних і клінічних дослідженнях....
Актуальність проблеми порушень моторної функції шлунково-кишкового тракту (ШКТ) за останні десятиліття значно зросла, що пов’язано з великою поширеністю в світі та в Україні цієї патології. Удосконалення фармакотерапії порушень моторики ШКТ та широке впровадження сучасних лікарських засобів у клінічну практику є на сьогодні важливим завданням внутрішньої медицини....
Дисліпідемія та атеросклеротичні серцево-судинні захворювання (АСССЗ) є провідною причиною передчасної смерті в усьому світі (Bianconi V. et al., 2021). Гіперхолестеринемія – третій за поширеністю (після артеріальної гіпертензії та дієтологічних порушень) фактор кардіоваскулярного ризику в світі (Roth G.A. et al., 2020), а в низці європейських країн і, зокрема, в Польщі вона посідає перше місце. Актуальні дані свідчать, що 70% дорослого населення Польщі страждають на гіперхолестеринемію (Banach M. et al., 2023). Загалом дані Польщі як сусідньої східноєвропейської країни можна екстраполювати і на Україну....