Гепатоцелюлярна карцинома: епідеміологія, діагностика, лікування
 Гепатоцелюлярна карцинома (ГЦК) є однією з найчастіших причин смерті від злоякісних новоутворень. За кілька останніх десятиліть досягнуто значного прогресу у вивченні епідеміології, факторів ризику та молекулярного профайлу ГЦК. Оновлено підходи до профілактики, скринінгу, діагностики та лікування цієї патології, завдяки чому знижено смертність у багатьох країнах із високим рівнем захворюваності на ГЦК. Проте захворюваність і смертність продовжують зростати у всьому світі, у більшості випадків діагноз ГЦК встановлюють на пізніх стадіях [1].
Гепатоцелюлярна карцинома (ГЦК) є однією з найчастіших причин смерті від злоякісних новоутворень. За кілька останніх десятиліть досягнуто значного прогресу у вивченні епідеміології, факторів ризику та молекулярного профайлу ГЦК. Оновлено підходи до профілактики, скринінгу, діагностики та лікування цієї патології, завдяки чому знижено смертність у багатьох країнах із високим рівнем захворюваності на ГЦК. Проте захворюваність і смертність продовжують зростати у всьому світі, у більшості випадків діагноз ГЦК встановлюють на пізніх стадіях [1].
У цьому огляді висвітлені переваги та загальні перспективи впровадження сучасних підходів, які можуть вплинути на загальне зниження навантаження ГЦК на суспільство у найближчі кілька десятиліть.
Епідеміологія
ГЦК становить близько 80% від усіх злоякісних новоутворень печінки [2] та є однією з найпоширеніших причин смерті від онкологічних захворювань [1]. У 2020 році у світі було діагностовано 905 700 випадків ГЦК, а 830 200 осіб померли від цього захворювання (рис. 1, 2) [1].
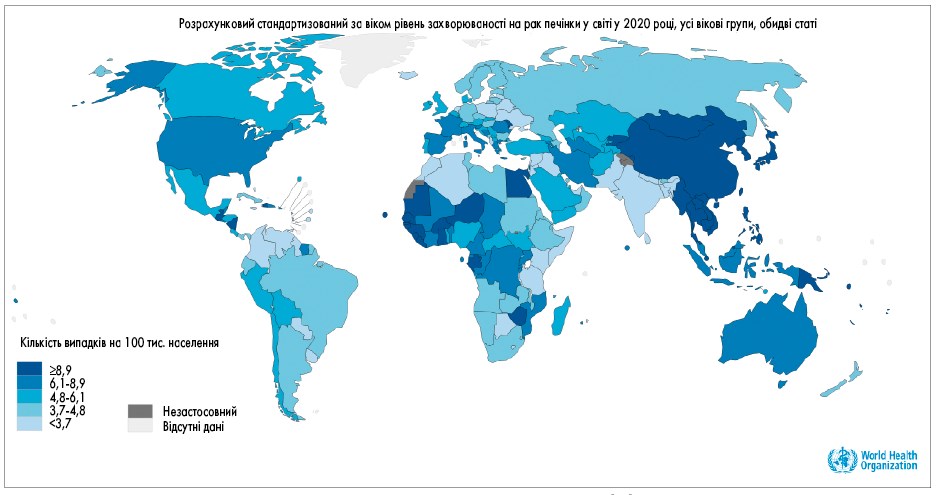 Рис. 1. Захворюваність на ГЦК за даними GLOBOCAN [88]
Рис. 1. Захворюваність на ГЦК за даними GLOBOCAN [88]
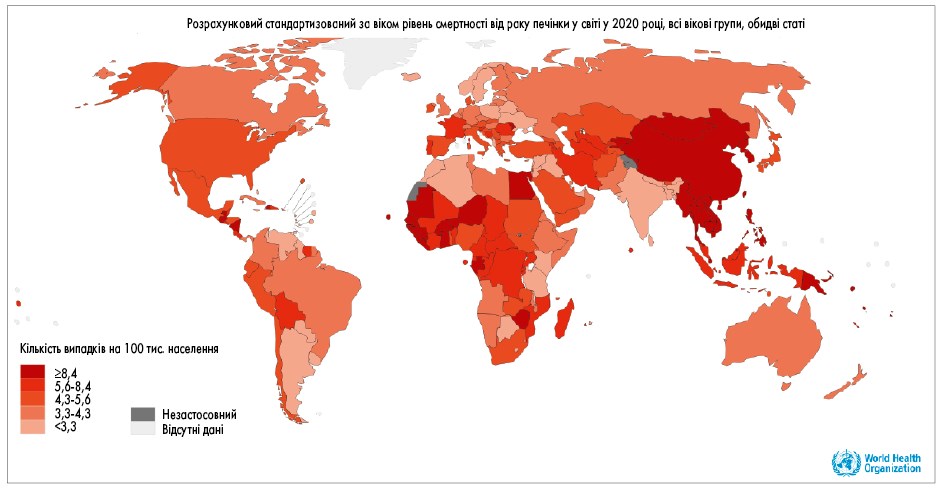 Рис. 2. Смертність від ГЦК за даними GLOBOCAN [88]
Рис. 2. Смертність від ГЦК за даними GLOBOCAN [88]
Істотна варіабельність захворюваності на ГЦК та смертності від неї залежно від географічного регіону спричинена різницею впливу екологічних та інфекційних факторів ризику, доступності медичної інформованості та допомоги, а також можливості виявлення захворювання на ранній стадії. Майже 85% випадків ГЦК припадає на країни із низьким і середнім рівнем доходу, зокрема Східної Азії та Південної Африки [3, 4]. Проте тенденцію до значного зростання захворюваності на ГЦК спостерігають у країнах Європейського Союзу і США.
За даними Mohammadian та співавт. [5], в Україні діагностують 1700 нових випадків ГЦК щороку, смертність від цієї патології становить більше 2200 на рік.
На відміну від багатьох інших злоякісних захворювань, частота яких поступово знижується, кількість випадків ГЦК у світі зростає [1]. Після раку легені ГЦК посідає друге місце серед злоякісних новоутворень, що активно знижують тривалість життя за аналітичний період 2005-2015 роки, а саме на 4,6% [3, 4]. Відповідно до стандартизованого за віком показника захворюваності (ASIRs), існує глобальна тенденція до повільного зниження захворюваності на ГЦК із кінця 1990-х років, проте загальна кількість випадків продовжує збільшуватися паралельно із глобальним зростанням середньої тривалості життя [6].
Якби вікова структура населення у 2015 році була такою, як у 2005-му, кількість випадків ГЦК складала б на 8% менше у 2015 році, ніж у 2005-му. Частота виникнення ГЦК у США підвищилася від 2 до 3 разів за останні 3 десятиліття, що насамперед пов’язано із поширенням вірусного гепатиту С (ВГС) у когорті народжених у 1945-1965 роках, а також із прогресуючою кількістю випадків жирової трансформації печінки, викликаної ожирінням, в останні два десятиліття [6].
Вік виникнення ГЦК варіює у різних частинах світу. У Японії, Північній Америці та європейських країнах медіана захворюваності відповідає 60 рокам та старше на відміну від країн Азії й Африки, де ГЦК діагностують у віковому проміжку від 30 до 60 років [7]. У досліджені BRIDGE за участю 18 031 пацієнта з ГЦК із 14 країн встановили середній вік виникнення хвороби: в Японії – 69 років, у Європі – 65, Північній Америці – 62 роки, тоді як у Південній Кореї ГЦК діагностували переважно в 59 років, а в Китаї – у 52 роки [7]. Достовірних даних щодо населення Африки недостатньо, але результати територіального дослідження, опубліковані у 2015 році, показали, що ГЦК у Центральній Африці діагностують у значно молодшому віці. Згідно з аналізом даних 1552 пацієнтів із 14 медичних центрів у 7 африканських країнах середній вік діагностики ГЦК становив 45 років.
Для ГЦК, спричиненої вірусом гепатиту В, середній вік виявлення пухлини складає 32,5-37,6 року [8]. Ранній вік виникнення ГЦК характерний не лише для пацієнтів із Центральної Африки, а зафіксований при аналізі даних 59 907 пацієнтів зі США за 2000-2012 рр. Дуже ранній вік (<40 років) формування ГЦК максимально асоційований із фактом народження у Західній Африці (скориговане співвідношення ризиків – ССР – 16,3; 95% довірчий інтервал – ДІ – 9,2-27,9; p<0,01), Центральній/Південній/інших частинах Африки (ССР 11,0; 95% ДІ 4,5-23,7; p<0,01), Океанії (ССР 4,9; 95% ДІ 2,9-8,0; p<0,01), Східній Африці (ССР 3,5; 95% ДІ 1,5-6,8; p<0,01) [9]. Важливо, що країни Західної Африки з наймолодшим віком виникнення ГЦК мають населення близько 384 млн – майже 30% населення континенту.
Загальна виживаність пацієнтів із ГЦК варіює досить значно в різних частинах світу [7, 10]: у Тайвані та Японії набагато більша, ніж у Центральній Африці, де медіана виживаності складає всього 2,5 міс. Це свідчить про недостатність як програм раннього виявлення, так і доступності ефективного лікування [7, 10]. Тайвань і Японія мають найкращі результати лікування пацієнтів із ГЦК, у цих країнах існує розвинена система виявлення груп ризику та їх регулярне обстеження, що включає дослідження онкомаркерів (альфа-фетопротеїн – АФП, АФП-L3, дез-гамма-карбоксипротромбін – DCP) та якісне ультразвукове дослідження печінки для визначення ранніх вогнищевих змін [11]. Отже, >70% випадків ГЦК, виявлених у різних медичних центрах у цих країнах, підлягають радикальному лікуванню. Прогноз у пацієнтів з ГЦК у Південній Кореї, Китаї або Північній Америці чи Європі не такий хороший, як у Тайвані або Японії, адже >60% первинних пацієнтів мають поширені пухлини [7]. Серед країн Африки найвища загальна виживаність спостерігається у пацієнтів із ГЦК у Єгипті. Це пов’язано із меншою частотою пізньої діагностики в Єгипті – 69% порівняно з 95% в інших африканських країнах (p<0,01).
Фактори ризику
Вірусний гепатит В, С та цироз печінки
Хронічний вірусний гепатит В (ВГВ) та С (ВГС) спричиняють розвиток 80% ГЦК у світі [3, 12]. Хронічна інфекція вірусу гепатиту В є провідною причиною виникнення ГЦК у країнах Східної Азії та більшості африканських країн, за винятком Північної Африки, де серед причин ГЦК превалює ВГС [7, 8]. На сьогодні близько 257 млн населення світу має хронічний ВГВ. Ця хвороба є і буде причиною 20 млн смертей між 2015 та 2030 роками, у тому числі від гострої або хронічної форм ВГВ, що призведе до цирозу печінки та ГЦК, 5 млн смертей будуть спричинені безпосередньо ГЦК [13]. Близько 57 млн осіб прогнозовано матимуть хронічний ВГС, у 10-20% із них розвинуться тяжкі ускладнення, такі як цироз печінки із декомпенсованою печінковою недостатністю та ГЦК [6, 14]. Вірус гепатиту С – основний етіологічний чинник ГЦК у Північній Америці, Європі, Японії, деяких країнах Центральної Азії, включаючи Монголію, північно-африканські країни та країни Середнього Сходу, частково Єгипет [7, 10].
В Україні інфекції, викликані вірусами гепатиту B і С, є одними з ключових проблем системи охорони здоров’я. За даними CDA foundation, серед дорослого населення кількість інфікованих вірусом гепатиту B у 2020 році становила 531 000, а вірусом гепатиту С – 1 342 000 [15]; захворюваність вища серед чоловіків та осіб літнього віку. Основне занепокоєння викликає частка пацієнтів, які отримали специфічне противірусне лікування, – менше 1% на рік. Поширеність ВГС і ВГВ є вищою серед груп ризику, таких як споживачі ін’єкційних наркотиків (HBsAg 8,5% і анти-HCV 56,3%) [16] або інфіковані вірусом імунодефіциту людини (ВІЛ) [17, 18].
У більшості випадків, зокрема в високорозвинених країнах, ГЦК асоційована із цирозом печінки через затяжний хронічний гепатит після інфікування вірусами гепатиту В або С. Загалом частота розвитку ГЦК на рік складає 2-5% серед пацієнтів із цирозом печінки, що був викликаний вірусами гепатиту В або С [19]. Однак ГЦК, асоційована із ВГВ, часто виникає і при відсутності цирозу печінки, що складає 30-50% випадків у ендемічних осередках, таких як Східна Азія та більшість країн Африки [10]. На противагу у когортних дослідженнях у США, де зараження вірусом гепатиту B не є ендемічним, понад 90% пацієнтів із ГЦК на фоні ВГВ мали цироз печінки [20]. Різниця у типі передачі вірусу гепатиту B, початку й перебігу інфекції та впливах навколишнього середовища можуть пояснити вищу частоту ГЦК у пацієнтів із ВГВ без цирозу у районах, ендемічних щодо ВГВ.
Стеатогепатит і діабет
Стеатогепатит, або неалкогольна жирова хвороба печінки (НАЖХП), є одним із найпоширеніших захворювань печінки та основним фактором ризику виникнення ГЦК у розвинених країнах [21, 22]. Від 10 до 20% випадків ГЦК у США спричинені НАЖХП [23, 24]. У великих популяційних дослідженнях не було доведено достовірного зв’язку між НАЖХП і ГЦК, проте відмічено зростання ризику виникнення ГЦК у 2,6 разу у пацієнтів з НАЖХП порівняно з загальною популяцією. Цукровий діабет та/або ожиріння також є значними факторами ризику розвитку НАЖХП, яка згодом призводить до ГЦК у 37% первинних пацієнтів у США. Виникнення ГЦК здебільшого пов’язане із хронічною хворобою печінки в анамнезі. НАЖХП-асоційовані ГЦК частіше, ніж ГЦК, спричинені вірусними гепатитами, розвиваються у пацієнтів літнього віку, тому варто на це зважати при інтерпретації досліджень із включенням осіб старших 65 років У цій групі може переважати кількість ГЦК, спричинених НАЖХП. НАЖХП-асоційована ГЦК також може виникати при відсутності цирозу печінки [23, 25]. Популяційне дослідження, проведене у Міннесоті, у яке було включено 93 пацієнти, показало, що 27% пацієнтів із НАЖХП-асоційованою ГЦК не мали цирозу печінки. В іншому дослідженні (Veterans Health Administration study), куди було включено 1500 пацієнтів із ГЦК, встановили, що пацієнти із НАЖХП-асоційованою ГЦК мали 5-кратно вищий ризик виникнення ГЦК без цирозу печінки порівняно із ГЦК, спричиненою ВГС [26].
Цукровий діабет підвищує ймовірність розвитку ГЦК в 2-3 рази [19, 27, 28]. Інсулінорезистентність і подальша продукція активних форм кисню сприяють запальним змінам у паренхімі печінки та запускають механізми канцерогенезу [29-31]. В одному із досліджень було припущено: цукровий діабет підвищує ризик розвитку ГЦК у пацієнтів із цирозом печінки, що потребує подальшого вивчення [19, 28].
Вживання алкогольних напоїв
Алкогольний цироз печінки є другою найпоширенішою причиною виникнення ГЦК у пацієнтів у США та Європі [7]. Метааналіз 19 досліджень (n=5,650), проведений Світовим фондом дослідження раку, показав статистично значуще зростання ризику ГЦК на 4% за кожні 10 г алкоголю, вжиті за добу [32]. Однак абсолютний ризик розвитку ГЦК у пацієнтів із цирозом печінки, спричиненим вживанням алкогольних напоїв, виявився нижчим, ніж у пацієнтів із вірус-індукованим цирозом [33, 34]. У національному популяційному дослідженні у Данії було виявлено, що кумулятивний 5-річний ризик виникнення ГЦК становить 1,0% (95% ДІ 0,8-1,3%) серед усіх жителів Данії, яким було вперше встановлено діагноз цироз печінки, спричинений алкоголем, з 1993 до 2005 року (n=8482) [34]. За результатами популяційного дослідження 3106 пацієнтів із цирозом печінки у Сполученому Королівстві з 1987 до 2006 року хворі на алкогольний цироз печінки мали вдвічі нижчий ризик виникнення ГЦК, ніж пацієнти з цирозом, спричиненим хронічною вірусною інфекцією [34]. Ретроспективне когортне дослідження в 450 пацієнтів із алкогольним цирозом печінки виявило, що старший вік (≥55 років) і тромбоцитопенія як ускладнення цирозу (кількість тромбоцитів <125 000 на мм3) можуть бути незалежними факторами підвищеного ризику розвитку ГЦК [35].
Афлатоксин та аристохолієва кислота
Афлатоксин є мікотоксином із сильним гепатоканцерогенним ефектом, що уражає багато зернових та олійних культур [36]. Афлатоксинове ураження рослин значно поширене у ареалах із високим рівнем захворюваності на ГЦК. Наприклад, >90% загального населення деяких країн Західної Африки уражені афлатоксином через неналежну обробку зерна після збирання, на відміну від мінімального ураження у західних країнах [37]. Провідне значення у печінковому канцерогенезі має афлатоксин В1 (AFB1), що продукується Aspergillus sp. Афлатоксинове навантаження вважається основною причиною раннього початку ГЦК серед населення багатьох країн Субсахарської Африки [12, 36, 38]. AFB1 переважно спричиняє мутацію кодону 249 у гені-супресорі пухлинного росту TP53 (АГГ на АГТ), викликаючи заміну аргініну серином (R249S), що рідко спостерігається при інших злоякісних пухлинах [37]. Зміну R249S виявляють у 50-90% мутацій гена TP53 у регіонах із високим рівнем контакту з афлатоксином і на 6% рідше у пацієнтів зі США [37, 40].
Підтверджено можливу взаємодію між ВГВ та афлатоксином, що підвищує ризик виникнення ГЦК [41]. Хронічна інфекція вірусу гепатиту В може запустити шлях метаболізму неактивного AFB1 у мутагенний AFB1-9,9-епоксид цитохромом P459s. Некроз гепатоцитів і регенерація при хронічному ВГВ також підвищують імовірність AFB1-індукованої мутації TP53. Крім того, репарація вирізання ядра клітин, що в нормі відповідає за видалення частин ДНК AFB1, пригнічується онкогенним протеїном вірусу гепатиту В [42].
Аристохолієва кислота (АК) – мутагенний компонент, наявний у рослині, відомій як Aristolichia, або Asarum (дикий китайський імбир, хвилівник), що росте у дикій природі [43]. Рослини, які містять АК, використовували у традиційній китайській фітотерапії протягом століть. У сучасних дослідженнях із застосуванням методу секвенування показано, що значний відсоток ГЦК у пацієнтів з Азії, зокрема Китаю, Тайваню, В’єтнаму та Південної Азії, має вищий рівень мутацій, викликаних контактом із АК [44, 45]. Тринуклеотидний контекст, характерний для контакту з АК, включає значний пік у 5’-ЦТГ3’ (5’-ЦТГ3’ у комплементарному ланцюзі) [45]. У великому дослідженні гістопрепаратів 1400 пацієнтів із різних регіонів виявлено АК-«підпис» у 78% ГЦК жителів Тайваню, 47% – Китаю, 29% – з Південної Азії, 13% – Південної Кореї, 2,7% – Японії, 4,8% – Північної Америки та 1,7% – країн Європи [45]. В одному дослідженні з випадковими зразками ГЦК 200 000 пацієнтів з Тайваню з 1997 до 2003 року показано, що близько 1/3 з них мали контакт із АК [46]. Дозозалежне співвідношення між контактом із АК та ризиком виникнення ГЦК також було доведено у пацієнтів з Тайваню [47].
Інші причини цирозу печінки
Решта хронічних хвороб печінки, таких як патологія жовчних проток, генетичні або метаболічні розлади, можуть призводити до цирозу печінки і згодом до виникнення ГЦК. Але пропорція цих причин у генезі ГЦК у світі становить від <5 до 10% [12].
Протективні фактори
Кава, статини, метформін та аспірин показали свою протективну дію проти розвитку ГЦК за даними багатьох ретроспективних досліджень [48-51]. Хоча жоден з цих постулатів не був доведений у великих рандомізованих дослідженнях, вживання кави зараз рекомендоване Європейською асоціацією з вивчення печінки (EASL) у клінічних практичних рекомендаціях щодо ГЦК [52].
Фармакологічна супресія вірусу гепатиту В або активності вірусу гепатиту С високоефективними противірусними препаратами знижує ризик виникнення ГЦК на 50-80% [53-56].
Ефект спрямованого противірусного лікування (СПЛ) ВГС став предметом широких дискусій після отримання даних щодо підвищення ризику рецидиву ГЦК у пацієнтів, яким провели СПЛ після завершення радикального лікування ранніх стадій ГЦК, у чотирьох ретроспективних дослідженнях у госпіталях Іспанії [57]. В італійському ретроспективному дослідженні у когортах, що включали 59 пацієнтів з ГЦК, отримано схожі результати [58]. Результати іншого ретроспективного дослідження підтвердили незначну тенденцію до збільшення ризику рецидиву ГЦК після трансплантації печінки у 5 (28%) з 18 пацієнтів, що отримали противірусну терапію з приводу ВГС, порівняно з 6 (10%) з 63 пацієнтів, які не отримували противірусного лікування [59]. У невеликому одноцентровому дослідженні в США виявлено високу частоту виникнення ГЦК після противірусного лікування в пацієнтів із цирозом печінки, спричиненим ВГС [60]. Однак у низці досліджень отримано негативний результат у спробі довести зв’язок СПЛ із рецидивом ГЦК [61-63]. Дані ретроспективного багатоцентрового дослідження, опубліковані у 2019 році, за участю 793 пацієнтів з ВГС-асоційованою ГЦК, 38% з яких отримували СПЛ, з урахуванням додаткових варіантів, не підтвердили зв’язку між віддаленими результатами лікування ГЦК і СПЛ (відносний ризик – ВР – 0,90; 95% ДІ 0,80-1,16) [63]. Загалом можливість підвищення ризику рецидиву ГЦК комплексом противірусної терапії не була підтверджена у багатоцентрових дослідженнях, але подальші дослідження мають бути проведені для точної відповіді на запитання, чи є зв’язок між противірусною терапією і ризиком рецидиву ГЦК. Хоча асоціація між СПЛ і ризиком рецидиву ГЦК після радикального лікування залишається не точною, успішне противірусне лікування однозначно знижує ризик появи ГЦК de novo [56].
Молекулярні особливості канцерогенезу ГЦК
Інтегративні дослідження з секвенування комбінованого екзону, аналізу транскриптонів і ретельна генетична характеристика ГЦК дали змогу виявити гетерогенність пухлин на гістомолекулярному рівні, різниця в молекулярних особливостях відповідала клінічним даним [65-67]. Один валідований аналіз ідентифікував шість сталих підгруп ГЦК, визначених як G1-G6, що були пов’язані специфічними генетичними та клінічними характеристиками [68, 69]. Мутації у промоутері TERT (виявляли у 44-65% пацієнтів із ГЦК, відповідає за регуляцію транскрипції каталітичної субодиниці теломерази), CTNNB1 (визначали у 27-40%, кодує бета-катенін, протоонкоген у сигнальному шляху WNT) та TP53 (описаний у 21-31%, головний регулятор клітинного циклу) були найчастішими [65, 70]. Специфічна клінічна картина ГЦК може відповідати конкретній генетичній альтерації [70]. Наприклад, промоутер TERT та мутація TP53 пов’язані зі зниженням виживаності [65, 68], трансдуктор інтерлейкін-6 янус-кінази та активатор транскрипції шляху активації без TERT, CTNNB1 або альтерації шляху TP53 супроводжують ГЦК, що виникає на фоні стеатогепатиту. Описані інтегровані аналізи підкреслюють молекулярне різноманіття ГЦК, відмінності етіології та механізмів канцерогенезу [70]. Загалом близько 1/4 ГЦК мають молекулярні або генетичні альтерації, на які потенційно спрямована дія затверджених лікарських препаратів, підвищуючи інтерес до використання молекулярних «підписів» у розробці таргетних терапевтичних засобів [66, 71]. Дослідження, у яких проспективно характеризується ГЦК методом секвенування наступного покоління у пацієнтів, що отримали системну терапію, починають показувати взаємодію між альтерацією, різними внутрішньоклітинними сигнальними шляхами та рівнем контролю захворювання у відповідь на специфічні класи системної терапії. Наприклад, у пацієнтів із ГЦК, яких лікували інгібіторами імунних мішеней, активація мутацій у сигнальному шляху Wnt/бета-кетаніну була пов’язана з нижчим контролем захворювання та рівнем виживаності [71].
Профілактика та спостереження
Профілактика хронічного вірусного гепатиту B та C
Первинна профілактика – важливий і, можливо, єдиний реалістичний підхід для зменшення тягаря ГЦК у країнах із низьким економічним розвитком, де вірусний гепатит є ендемічним, а ресурси для лікування вірусного гепатиту та ГЦК обмежені.
В ендемічних районах ВГВ переважно передається з інфікованою кров’ю, часто вертикально (від матері до дитини внутрішньоутробно або під час пологів), а також горизонтально (від старших членів сім’ї до дітей) [12]. У популяційному дослідженні в Тайвані показано, що захворюваність на ГЦК була в 4 рази вищою в когорті невакцинованих від ВГВ, ніж у вакцинованих [72]. У дослідженні використовували дані з двох тайванських систем реєстру про пацієнтів 6-26 років із діагнозом ГЦК за 1983-2011 роки. Із 1509 пацієнтів 1343 були народжені до та 166 після початку програми вакцинації проти ВГВ [72]. Відносний ризик розвитку ГЦК у пацієнтів вікових груп 6-9, 10-14, 15-19 та 20-26 років, які були вакциновані, порівняно з тими, хто не був вакцинований, становив 0,26 (95% ДІ 0,17-0,40), 0,34 (95% ДІ 0,25-0,48), 0,37 (95% ДІ 0,25-0,51) і 0,42 (95% ДІ 0,32-0,56) відповідно [72]. Хоча неонатальна вакцинація від ВГВ доступна і рекомендована в більшості країн, охоплення щепленнями становить лише 40-70% у найбільших і найнаселеніших африканських країнах із високим рівнем захворюваності на ГЦК, що забезпечує чітке вікно можливостей для покращення профілактики [73]. Крім того, доведено, що противірусне лікування вагітних, які мають високе вірусне навантаження ВГВ у третьому триместрі, знижує ризик передачі вірусу від матері до дитини. Проте дані про механізми вертикальної передачі вірусу ще потребують детального вивчення.
Вакцинація новонароджених в Україні за даними Всесвітньої організації охорони здоров’я (ВООЗ) має стійку тенденцію до зниження з 99% у 2004 р. до 49% у 2018 році [74]. Особливу увагу також слід зосередити на тенденції значного, майже у 2 рази, зниження кількості щеплень новонароджених проти гепатиту В за останні 10 років (рис. 3).
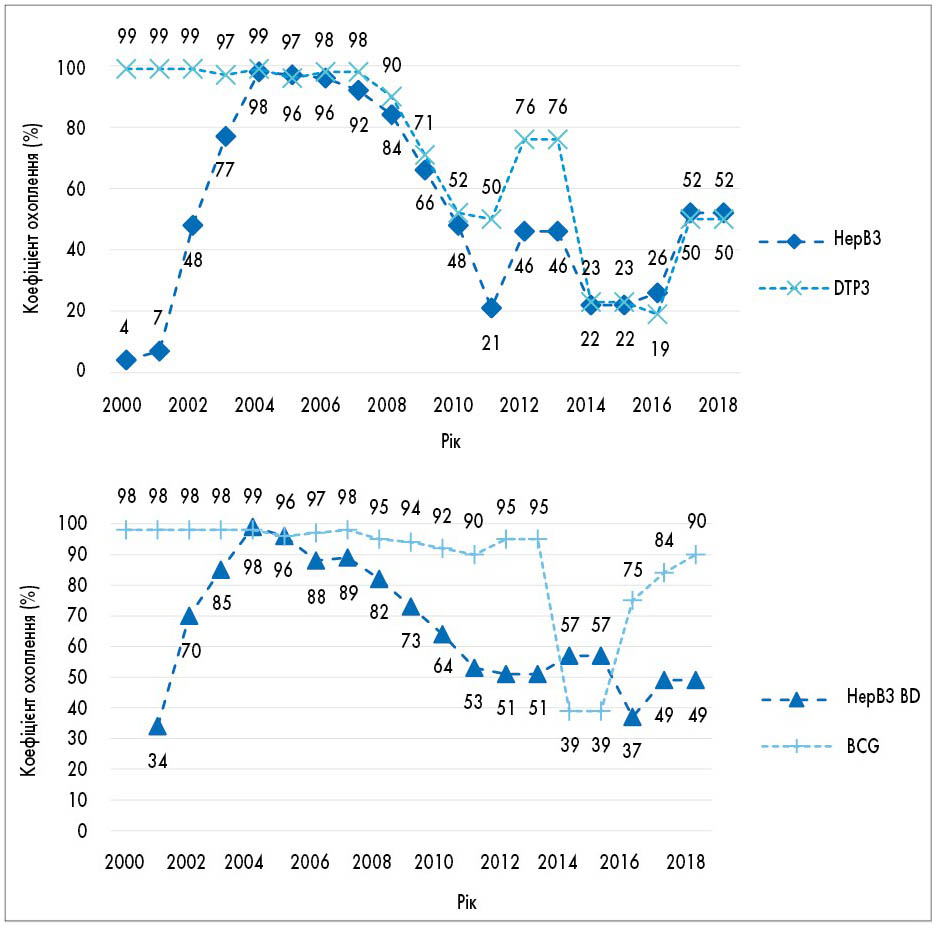 Рис. 3. Тенденції вакцинацій проти вірусного гепатиту В в Україні за останні 20 років за даними Дитячого фонду ООН (UNICEF) 2019 р. [74]
Рис. 3. Тенденції вакцинацій проти вірусного гепатиту В в Україні за останні 20 років за даними Дитячого фонду ООН (UNICEF) 2019 р. [74]
HepB3 – мінімум 3 дози вакцини проти гепатиту В; DTP3 – щеплення проти дифтерії, правця, кашлюку; HepB BD – вакцинація після народження (24 год); BCG – вакцинація БЦЖ.
Профілактика ВГС шляхом вакцинації наразі неможлива, але мінімізація передачі вірусного гепатиту через скринінг компонентів крові перед трансфузією, використання одноразових голок та інших витратних матеріалів, а також стерилізація хірургічних і стоматологічних інструментів є ефективними стратегіями зменшення ризику ятрогенної передачі ВГВ і ВГС [12].
Скринінг ВГС у США на сьогодні рекомендований для когорти високого ризику, народжених між 1945 та 1965 роками [77]. У той час як популяційний скринінг на ВГВ і ВГС та забезпечення противірусним лікуванням інфікованих осіб у високоендемічних районах наразі відсутні, реалізація стратегії всесвітньої елімінації хронічного вірусного гепатиту до 2030 року може істотно полегшити тягар захворювання на ГЦК [54, 55, 78, 79].
Підтримка здорового способу життя
Підтримка здорового способу життя й уникнення факторів ризику ГЦК є додатковими стратегіями її профілактики. Уникнення частого вживання алкоголю та гіперкалорійної дієти, що призводить до ожиріння й метаболічного синдрому, сприяє зменшенню ушкоджень печінки, пов’язаних з ожирінням, цирозом і, як наслідок, ГЦК [80]. Куріння – встановлений фактор ризику ГЦК: об’єднані дані 14 проспективних досліджень у США показали, що ризик серед осіб, які кинули курити >30 років тому, був майже еквівалентним такому в когорті осіб, котрі ніколи не курили (ВР 1,09; 95% ДІ 0,74-1,61) відповідно, відмова від куріння знижує вірогідність розвитку ГЦК [81].
Мінімізація впливу афлатоксину, що потрапляє в продукти харчування, – вирішальний крок для зменшення навантаження від ГЦК у районах із високою захворюваністю. У метааналізі 19 досліджень показано популяційний ризик розвитку ГЦК, пов’язаного з афлатоксином, що становив 17% та додатково збільшувався в інфікованих вірусом гепатиту В (21-23%) порівняно із неінфікованими (8-9%) [82]. У дослідженнях, включених в метааналіз, проводили визначення аддуктів AFB1-альбуміну, метаболітів афлатоксину в сечі, аддуктів AFB1-ДНК та анамнезу харчування (арахісове масло та споживання кукурудзи як сурогати афлатоксину). У 2014 році робоча група Міжнародного агентства з дослідження раку оцінила ефективність різних стратегій втручання для зменшення впливу афлатоксину на людину [36]. Ці заходи включали відбір генетично стійкого насіння, покращення післязбиральної обробки, первинну профілактику за допомогою ентеросорбентів, що «уловлюють» мікотоксини, та можливості хіміопрофілактики. Комплекс процедур після збору врожаю, зокрема, може сприяти помітному зниженню рівня біомаркерів забруднення афлатоксинами в осіб, які беруть участь у цих заходах [83, 84].
Скринінг
Скринінг є стратегією вторинної профілактики для зменшення тягаря ГЦК шляхом раннього виявлення пухлини та відповідного раннього лікування. Скринінг на ГЦК показаний пацієнтам із цирозом печінки або хронічною інфекцією ВГВ з ознаками високого ризику. Такі програми рекомендовані у країнах Азії чоловікам-носіям вірусу гепатиту В віком старше 40 років, жінкам-носіям вірусу гепатиту В віком понад 50 років, носіям вірусу гепатиту В із сімейним анамнезом ГЦК, а в країнах Африки – темношкірим особам із хронічним ВГВ. За рекомендаціями EASL, скринінг на ГЦК показаний пацієнтам із хронічним ВГВ і додатковими факторами ризику відповідно до класифікації PAGE-B, що включають вік, стать і кількість тромбоцитів [85]. Критерії скринінгу були розроблені для прогнозування 5-річного ризику розвитку ГЦК у білих пацієнтів, які отримували ентекавір або тенофовір при хронічному ВГВ. У метааналізі 47 досліджень, що сумарно включали 15 158 пацієнтів, показано ефективність скринінгу ГЦК у покращенні загальної виживаності через виявлення пухлин на ранній або дуже ранній стадії, коли пацієнти мають можливість потенційно ефективного лікування [52, 85]. Хоча переваги скринінгу визнані клінічною спільнотою та комітетами з написання рекомендацій, Національний інститут раку США наголошує на відсутності високоякісних рандомізованих досліджень із доведенням ефективності скринінгу у зниженні смертності від ГЦК [87]. Проте наявні певні складності до проведення великих рандомізованих досліджень щодо скринінгу ГЦК: при отриманні інформованої згоди пацієнти віддають перевагу нагляду [89].
Ультразвукове дослідження (УЗД) печінки – стандартний метод скринінгу ГЦК, схвалений Американською асоціацією з вивчення хвороб печінки (AASLD), EASL та Азіатсько-Тихоокеанською асоціацією з вивчення хвороб печінки (APASL) [52, 85, 90]. Оптимальний інтервал скринінгу має складати 6 міс на підставі даних досліджень про середній час подвоєння розмірів вогнища ГЦК (3-9 міс). Інтервал спостережень 6 міс так само ефективний, як 3-4-місячний, і більш ефективний, ніж 12-місячний [91, 92].
Серед онкомаркерів визначення рівня АФП у сироватці крові зазвичай використовується як доповнення до УЗД печінки, хоча рекомендації щодо АФП як тесту для спостереження за ГЦК залишаються відносними через його низьку чутливість (40-60%) і специфічність (80-90%) при пороговому рівні 20 нг/мл [93]. У дослідженні за участю 1597 пацієнтів із цирозом печінки з Тайваню показано, що вимірювання рівня АФП додатково до стандартного УЗД істотно покращує чутливість скринінгу без значної втрати специфічності. Чутливість УЗД досягає 92,0%, а специфічність 74,2%, тоді як комбінація УЗД і АФП підвищує чутливість до 99,2%, але дещо знижує специфічність – 68,3% – ранньої діагностики ГЦК [93]. У великому популяційному дослідженні за участю 1487 носіїв поверхневого антигену гепатиту В (HBsAg) – місцевих жителів Аляски показано, що скринінг за допомогою лише рівня АФП може виявити більшість ГЦК на резектабельній стадії та значно подовжити тривалість життя. Відповідно АФП може бути ефективним методом скринінгу ГЦК у випадках, коли УЗД не є широко доступним через обмежені ресурси [94]. У багатоцентровому ретроспективному дослідженні в США продемонстровано ефективність скринінгу шляхом вимірювання АФП у пацієнтів з цирозом печінки і вірусним гепатитом при рівні аланінамінотрансферази в межах фізіологічної норми [95]. У загальнонаціональному дослідженні реєстру у справах ветеранів у США підтверджено, що використання АФП для виявлення ГЦК є кращим у пацієнтів із низьким рівнем аланінамінотрансферази в сироватці крові, який відповідав низькому рівню запальних процесів у печінці [96]. Оцінка тенденції до зміни рівня АФП або його стандартного відхилення може підвищити ефективність і розширити показання до ширшого застосування АФП у скринінгу ГЦК [97].
Інші онкомаркери, такі як АФП-L3 і DCP, використовували для спостереження за ГЦК в Японії [98, 99]. Також було запропоновано шкалу GALAD, яка розраховується на основі статі, віку, вмісту АФП-L3, АФП і DCP і зарекомендувала себе як високоточна методика раннього виявлення ГЦК [100, 101]. У 2018 р. у багатоцентровому дослідженні біомаркерів показано, що GALAD є кращою за УЗД для раннього виявлення ГЦК [102]. Це дослідження включало загалом 111 пацієнтів із ГЦК і 180 контрольних пацієнтів із цирозом печінки або ВГВ. При пороговому рівні 0,76 показник GALAD мав чутливість 91% і специфічність 85%. Ефективність оцінки GALAD слід додатково вивчати в проспективних дослідженнях біомаркерів у порівнянні або в поєднанні з візуалізаційними тестами, зокрема і з оцінкою її економічної ефективності [102]. Шкала GALAD може бути корисною, оскільки її можна легко розрахувати на основі демографічних даних пацієнта і вимірювання онкомаркерів крові з використанням невеликого об’єму периферичної крові. Якщо витрати на тест-системи будуть зменшені, шкала GALAD стане ефективним методом спостереження в країнах з низькими ресурсами, де не вистачає ультразвукового обладнання та кваліфікованих спеціалістів.
Завдяки розвитку молекулярних технологій і геноміки було показано, що циркулюючі біомаркери раку в матеріалах рідинної біопсії, такі як мікро-РНК, специфічні пептиди, ідентифіковані протеомікою, мутації ДНК і диференціально метильовані ділянки, можуть використовуватися для спостереження та раннього виявлення ГЦК [103-107]. Проте ці показники ще не застосовувалися в клінічній практиці.
Хоча переваги скринінгу ГЦК були широко доведені, необхідна оптимізація заходів для запобігання гіпердіагностиці. Наприклад, у пацієнтів із цирозом печінки і значною печінковою недостатністю (клас С за шкалою Чайлда – П’ю) скринінгові процедури рекомендовані лише на листі очікування трансплантації печінки, оскільки при відсутності можливості трансплантації прогнозована тривалість життя є дуже короткою через високий ризик смерті від наростання печінкової недостатності [52]. Заходи для виявлення ранніх стадій ГЦК у цій групі пацієнтів є надмірною діагностикою, що може призвести до зайвих обстежень, надмірного лікування, збільшення витрат, несприятливих фізичних наслідків і психологічної шкоди без позитивного впливу на тривалість чи якість життя [108, 109].
Діагностика та стадіювання
Неінвазивна рентгенологічна діагностика
Традиційно діагноз ГЦК встановлюють на основі цитологічного або гістологічного дослідження матеріалу біопсії пухлини. Завдяки прогресу в розумінні рентгенологічних особливостей, специфічних для ГЦК, при фазовій судинній перфузії контрастної речовини під час візуалізації поперечних зрізів, отриманих на комп’ютерній і магнітно-резонансній томографії, тепер можна встановити точний діагноз ГЦК у пацієнтів із цирозом печінки, які перебувають під наглядом, без біопсії. У рекомендаціях AASLD та EASL йдеться, що діагноз ГЦК може бути встановлений рентгенологічно, якщо в печінці виявлено нову пухлину розміром ≥1 см, яка демонструє артеріальне гіперпідсилення та венозне «вимивання» в циротичній печінці, за допомогою багатофазної контрастної комп’ютерної або магнітно-резонансної томографії [52, 85].
У 2011 році було представлено систему узагальнених даних зображень печінки (LI-RADS Liver Imaging Reporting and Data System) для стандартизації звітності та збору даних комп’ютерної і магнітно-резонансної томографії у пацієнтів із ГЦК [110]. За LI-RADS нові ураження печінки класифікують на п’ять типів на основі розміру, ступеня інтервалу росту та характеру контрастного підсилення пухлини [111]. Варто зауважити, що ураження з низьким класом LI-RADS 1-2 також надалі слід ретельно контролювати, оскільки система має низьку специфічність для прогнозування доброякісних новоутворень.
Стадіювання
Більшість систем стадіювання ГЦК була розроблена з метою прогнозування подальшого перебігу хвороби, але деякі також пропонують алгоритми лікування [112]. Класифікація ГЦК Барселонської клініки з лікування раку печінки (BCLC) є найчастіше використовуваною стандартною системою визначення стадії ГЦК і єдиною, яка була проспективно підтверджена в дослідженнях. BCLC розподіляє ГЦК на п’ять стадій і надає прогноз щодо середньої тривалості життя й алгоритм вибору методу лікування відповідно до стадії (рис. 4) [113, 114]. Один з недоліків класифікації BCLC – значна неоднорідність пухлинного навантаження, печінкової недостатності та прогнозу у групах із проміжною (BCLC В) або поширеною (BCLC C) стадією. Кілька дослідників прагнули удосконалити систему BCLC шляхом виділення проміжних етапів стадії B BCLC. Італійська група раку печінки (Italian Liver Cancer Group) запропонувала підкласифікацію BCLC стадії B на основі шкали Чайлда – П’ю та поширення пухлини (в межах або за межами 7 критеріїв) [115]. Японські дослідники запропонували подальшу підкласифікацію BCLC стадії B на основі рівня білірубіну та альбуміну, що є показниками тяжкості печінкової недостатності [117, 118]. Цей підхід ще не набув широкого застосування в рутинній клінічній практиці, тому необхідна подальша проспективна перевірка в клінічних дослідженнях.
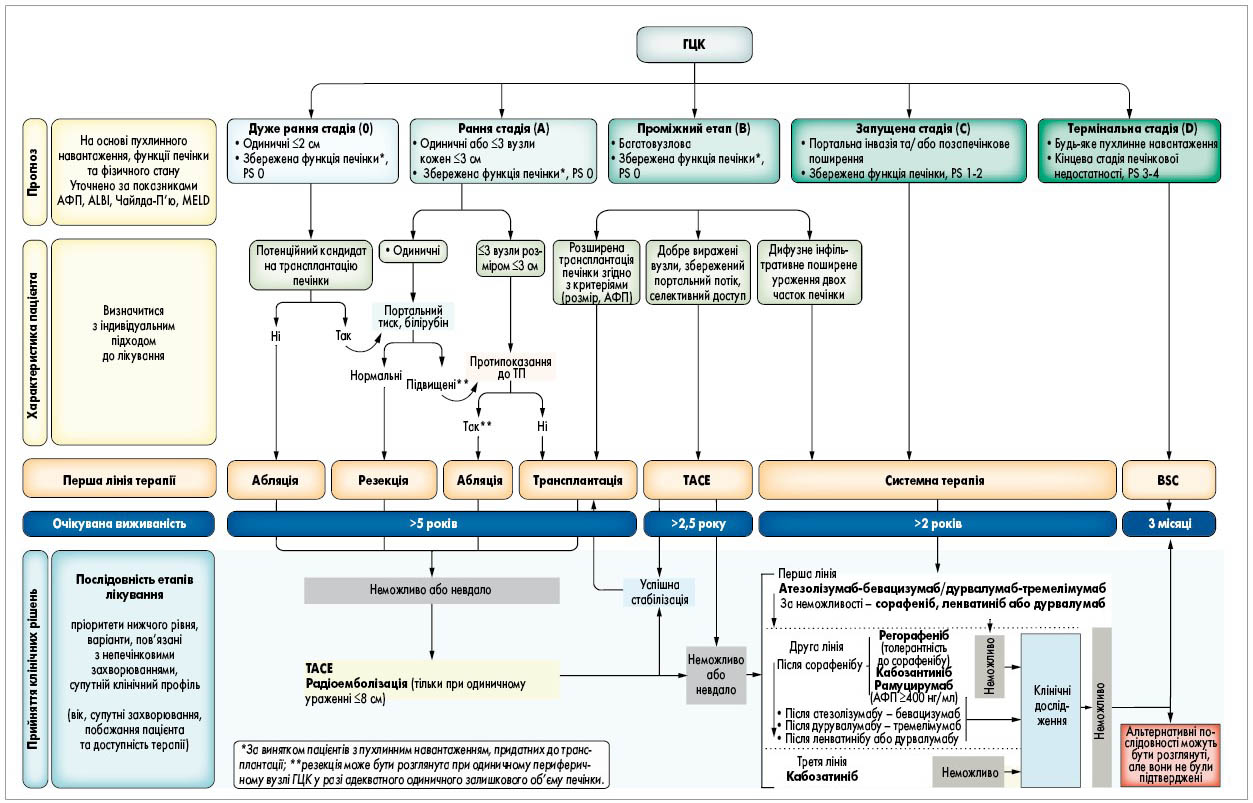 Рис. 4. Стаюдівання та лікування за системою BCLC (оновлено у 2022 році)
Рис. 4. Стаюдівання та лікування за системою BCLC (оновлено у 2022 році)
ALBI – альбумін-білірубін; BSC – найкраща підтримуюча терапія; ECOG-PS – загальний стан пацієнта за критеріями Об’єднаної східної онкологічної групи; TП – трансплантація печінки; MELD – модель кінцевої стадії захворювання печінки.
Гонконзька система визначення стадії раку печінки (HKLC) також надає рекомендації щодо лікування додатково до прогностичної класифікації [119]. За HKLC у пацієнтів із ГЦК виділяють п’ять стадій із дев’ятьма підстадіями, вони мають різний середній час виживання на основі розміру пухлини, наявності судинної інвазії, класу за Чайлдом – П’ю й оцінкою за шкалою ECOG. У кількох дослідженнях показано, що завдяки HKLC можна точно розподілити пацієнтів з ГЦК на різні прогностичні групи [112, 120, 121]. Найважливішим аспектом HKLC є розширення критеріїв потенційної терапії для пацієнтів, класифікованих як такі, що мають проміжну стадію ГЦК відповідно до системи BCLC. Загалом ефективність HKLC є багатообіцяючою, але необхідна подальша перевірка в проспективних дослідженнях.
Щоб звести до мінімуму суб’єктивність моделей виживаності, була запропонована шкала MESIAH для амбулаторних пацієнтів із ГЦК [112, 116, 122]. Ця шкала включає вік, кількість пухлинних вогнищ, розмір найбільшого вогнища, судинну інвазію, наявність метастазів і рівні сироваткового альбуміну й АФП додатково до оцінки MELD (модель для кінцевої стадії захворювання печінки). Шкала оцінки MESIAH для визначення ступеня печінкової недостатності використовує критерії MELD, а не шкалу Чайлда – П’ю, яка може бути дещо суб’єктивною при оцінці печінкової енцефалопатії чи ступеня асциту. Модель MESIAH продемонструвала більший дискримінант показника статистики – 0,77 порівняно із BCLC – 0,71 (p<0,01). Модель була додатково перевірена в азіатських і європейських когортах [121-123]. Оцінка MESIAH дає змогу визначити лише прогноз, але не рекомендації щодо лікування.
Як і модель MESIAH, система визначення стадії BALAD, яка базується на рівнях п’яти сироваткових маркерів (білірубін, альбумін, АФП-L3, АФП і DCP), виявилася ефективною в прогнозуванні перебігу хвороби [100, 124]. Рівень білірубіну й альбуміну відображає тяжкість печінкової недостатності, а АФП-L3, АФП і DCP характеризує пухлинне навантаження та агресивність онкозахворювання [100].
Загалом стадіювання ГЦК за BCLC наразі є найчастіше використовуваною стандартною системою, єдиною, що має надійну проспективну валідацію, незважаючи на кілька обмежень, описаних вище. Тому її регулярно застосовують як основний стратифікуючий фактор у клінічних дослідженнях [125].
Лікування
Лікування ГЦК передбачає складний процес прийняття рішень, враховуючи не лише стадію та супутні захворювання пацієнта, а й тяжкість печінкової недостатності, оскільки більшість методів терапії ГЦК можуть загострити первинну патологію печінки. Доступність варіантів лікування дуже різниться між медичними центрами в різних країнах з різним рівнем досвіду та ресурсами. Лікування ГЦК потребує мультидисциплінарного підходу для досягнення найкращого результату [126].
Резекція печінки. Хірургічне видалення є рекомендованим варіантом у пацієнтів з резектабельною ГЦК за відсутності клінічно значущої портальної гіпертензії. Остання визначається як градієнт печінкового венозного тиску ≥10 мм рт. ст./мм3 та пов’язана із клінічно значущою спленомегалією [127-129]. Порівняно обмежувальні критерії BCLC для рекомендації та призначення лікування були оскаржені. Результати багаторегіонального когортного дослідження за участю 8656 пацієнтів із ГЦК показали, що у хворих, які не були ідеальними кандидатами для операції за класифікацією BCLC, хірургічна резекція асоціювалася з вищою виживаністю, ніж емболізація (ВР 1,4; 95% ДІ 1,3-1,6; p<0,001) [130] або інше місцеве чи системне лікування (ВР 1,8; 95% ДІ 1,4-2,3; p<0,001). Подібним чином за даними багатоцентрового дослідження в Кореї резекція печінки значно подовжує тривалість життя порівняно з нехірургічним лікуванням у пацієнтів із резектабельною ГЦК стадії B за BCLC [131]. Хірургічну резекцію, яка потенційно може бути застосована в усіх умовах, слід розглядати для вибраних осіб із проміжною або поширеною стадією ГЦК (рис. 5).
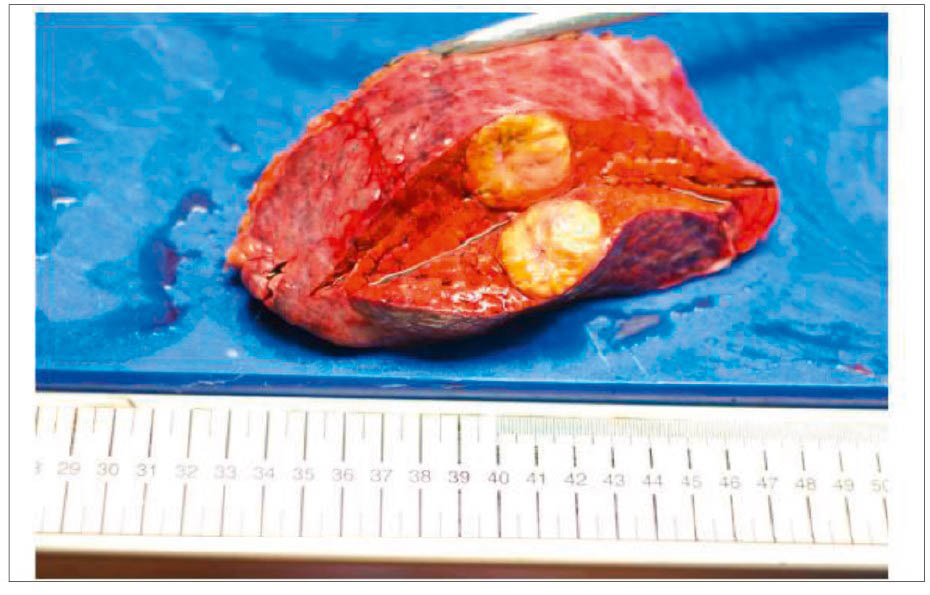 Рис. 5. Хірургічний препарат після лапароскопічної анатомічної резекції печінки в Національному інституті раку: другий сегмент печінки із ГЦК, що розвинулася на фоні цирозу, спричиненого ВГС
Рис. 5. Хірургічний препарат після лапароскопічної анатомічної резекції печінки в Національному інституті раку: другий сегмент печінки із ГЦК, що розвинулася на фоні цирозу, спричиненого ВГС
Хірургічна резекція є потенційно лікувальним методом, але майже у 70% пацієнтів згодом діагностують прогресування хвороби [132]. Одним із важливих моментів операції є отримання гістопатологічного зразка, який може допомогти у прогнозуванні ризику прогресування ГЦК [133]. Група BCLC запропонувала та підтвердила ефективність стратегії «рятівної трансплантації» після резекції печінки у пацієнтів із післяопераційним гістопатологічним «набором даних» високого ризику, що включає мікросудинне поширення пухлини та/або наявність сателітних мікрометастазів [122, 134]. У країнах із обмеженими ресурсами паліативне хірургічне втручання може бути методом вибору для пацієнтів із вираженими симптомами та відносно збереженою функцією печінки. Паліативне втручання має потенціал істотно поліпшити симптоми, покращити якість життя та подовжити медіану тривалості життя [135-137].
Трансплантація. Трансплантація печінки (ТП) є радикальним варіантом лікування ГЦК, оскільки дозволяє видалити як пухлину, так і хворий орган, що має обмежену функціональну здатність і потенціал до розвитку додаткових метахронних ГЦК у полі циротичної тканини, схильної до канцерогенезу. Оскільки захворюваність на ГЦК зростає, ця хвороба стала основним показанням до ТП у США [138]. ТП – оптимальний метод лікування ранньої стадії ГЦК при наявності значної печінкової недостатності, що унеможливлює резекцію органа. Міланські критерії показань до ТП (одне утворення <5 см або два-три утворення <3 см кожне) були вперше встановлені більше двох десятиліть тому для визначення оптимального пухлинного навантаження. При цьому трансплантація печінки може забезпечити хороші віддалені результати, зазвичай 5-річна загальна виживаність перевищує 70% [139]. Розширені критерії до трансплантації були запропоновані, щоб надати можливість проведення ТП за межами Міланських критеріїв пацієнтам із менш агресивною біологією пухлини, при неможливості використати інші методи лікування [140-142].
Серед розширених показань до ТП критерії Каліфорнійського університету в Сан-Франциско (одне вогнище до 6,5 см або до трьох вогнищ, найбільше з яких ≤4,5 см, із сумою діаметрів ≤8 см) отримали найбільше визнання та показали відмінні результати після трансплантації. Щоб стати кандидатами на ТП, пацієнти, які відповідають критеріям Каліфорнійського університету, мають отримувати місцеву або локальну терапію для зниження стадії ГЦК до відповідності Міланським критеріям [142-144]. У разі успішного зменшення стадії пухлини шляхом попереднього лікування прогноз сприятливий, такі пацієнти мають відмінні віддалені результати ТП [145, 146]. У ретроспективному багатоцентровому дослідженні показано, що із 187 пацієнтів із ГЦК, які брали участь у протоколі зниження стадії в трьох трансплантаційних центрах в Каліфорнії, ТП була виконана після успішного зниження стадії у 58% осіб, а їх подальша 5-річна виживаність становила 80% [146].
Абляція. Черезшкірна локальна абляція є потенційно радикальним методом лікування пацієнтів із ранньою стадією ГЦК (рис. 6) [147]. Двома найчастіше використовуваними методами є радіочастотна та мікрохвильова абляція (рис. 7). Найбільш вивчена техніка – радіочастотна абляція – може бути використана у багатьох випадках і є методом вибору при пухлинах розміром <2 см.
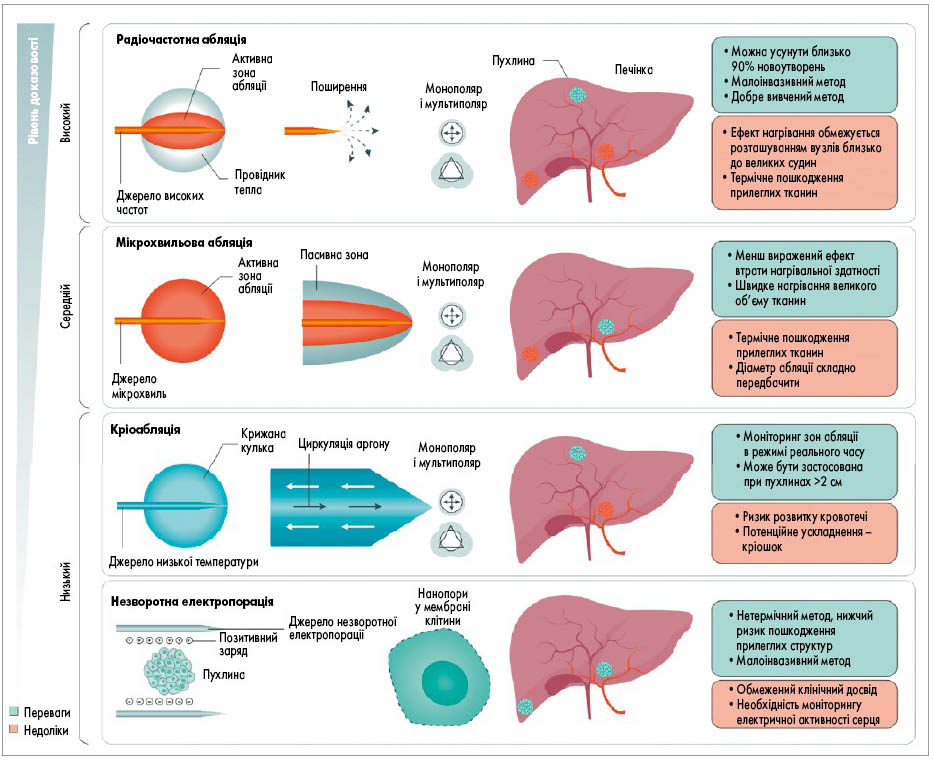 Рис. 6. Методики черезшкірної абляції для лікування ГЦК. Транскутанні техніки абляції для ГЦК показані відповідно до рівня доказовості, як описано у рекомендаціях EASL
Рис. 6. Методики черезшкірної абляції для лікування ГЦК. Транскутанні техніки абляції для ГЦК показані відповідно до рівня доказовості, як описано у рекомендаціях EASL
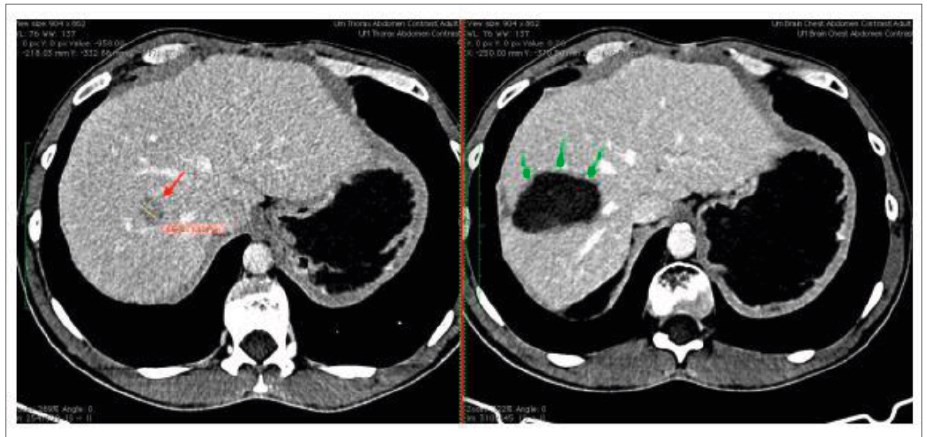 Рис. 7. Комп’ютерна томографія пацієнта із ГЦК 8-го сегмента печінки: ліворуч пухлина відмічена червоною стрілкою; праворуч – через 3 міс після радіочастотної абляції в Національному інституті раку (зона абляції, що виникла на місці пухлини, відмічена зеленими стрілками)
Рис. 7. Комп’ютерна томографія пацієнта із ГЦК 8-го сегмента печінки: ліворуч пухлина відмічена червоною стрілкою; праворуч – через 3 міс після радіочастотної абляції в Національному інституті раку (зона абляції, що виникла на місці пухлини, відмічена зеленими стрілками)
Мікрохвильова абляція набуває все більшої поширеності [148]. Обидва підходи індукують некроз пухлини шляхом доставки високої температури безпосередньо у вогнище ГЦК. Але мікрохвильова абляція має деякі переваги перед радіочастотною завдяки вищій термічній ефективності через інший механізм генерації тепла. Мікрохвильова абляція менш сприйнятлива до ефекту тепловідведення від великих судин, прилеглих до пухлини, більш ефективна для абляції пухлин розміром 3-4 см і потребує меншого часу, ніж радіочастотна абляція [149-151]. У рандомізованому контрольованому сліпому дослідженні ІІ фази у чотирьох університетських центрах Франції та Швейцарії порівнювали ефективність мікрохвильової абляції (n=76) з радіочастотною (n=76) у пацієнтів із ГЦК за наявності до трьох вогнищ розміром 4 см або менше, які не підлягали операції. Через 2 роки виявлено локальне прогресування у шести (6%) із 98 вогнищ у групі мікрохвильової абляції та 12 (12%) із 104 у групі радіочастотної абляції (ВР 1,6; 95% ДІ 0,7-3,9; p=0,27). Хоча швидкість локального прогресування була нижчою при мікрохвильовій абляції, вона не досягла статистичної значущості, ймовірно, через недосконалий дизайн дослідження [152].
У минулому як техніку хімічної абляції часто використовували черезшкірне введення етанолу в вогнища ГЦК, цей метод все ще широко застосовується в умовах обмежених ресурсів [12]. Ін’єкція етанолу може бути кращим методом лікування, коли пухлинний вузол прилягає до великих внутрішньопечінкових судин або жовчних проток, щоб уникнути теплового ураження цих структур радіочастотною або мікрохвильовою енергією. Крім того, було показано, що кріоабляція є такою ж ефективною, як і радіочастотна абляція, і її використовують за наявності обладнання [153-155]. Локальну абляцію зазвичай застосовують у пацієнтів, які не є кандидатами на ТП або хірургічну резекцію через супутні захворювання чи печінкову недостатність. Локальну абляцію також можна використовувати як проміжну терапію в пацієнтів, що очікують на ТП [156]. Найкращий підхід до лікування невеликих пухлин, які підходять як для резекції, так і для локальної абляції, викликає суперечки. На підставі даних метааналізу трьох рандомізованих контрольованих досліджень (РКД) у найновіших публікаціях AASLD при резектабельній ГЦК у дорослих пацієнтів із цирозом печінки і печінковою недостатністю не вище класу А за шкалою Чайлда – П’ю рекомендується проводити резекцію, а не абляцію [157-160].
Трансартеріальна емболізація та променева терапія. TACE є ефективним варіантом лікування пацієнтів із ГЦК проміжної стадії. TACE включає два основних протипухлинних механізми: внутрішньоартеріальну інфузію цитотоксичних хіміотерапевтичних засобів і доставку емболів в артерію, що живить пухлину, викликаючи ішемічний некроз пухлини. Найпоширенішими препаратами, які використовуються під час звичайної ТАСЕ, є доксорубіцин, епірубіцин або цисплатин [161]. ТАСЕ – найчастіше використовуваний локорегіонарний метод лікування у пацієнтів з ГЦК, які очікують на ТП, щоб запобігти прогресуванню пухлини.
Трансартеріальна емболізація (ТАЕ) спрямована на обструкцію артеріального кровопостачання пухлини. Вона спричиняє ішемію, тоді як ТАСЕ передбачає вивільнення протипухлинних агентів перед блокуванням артерій, що кровопостачають пухлину. Існує два способи виконання ТАСЕ: традиційна ТАСЕ, в якій до пухлини з ліпіодолом доставляють цитостатики, а потім емболізують артеріальну судину, і TACE кулькою, що виділяє препарат (DEB-TACE), у якій доставляються мікросфери, що містять доксорубіцин, досягаючи стійкої дії препарату з подальшою емболізацією.
У РКД, проведених у Європі та Азії, показано, що TACE покращує загальну виживаність у пацієнтів з неоперабельною ГЦК [162, 163]. Додаткове використання хіміотерапевтичних агентів у TACE порівняно з TAE було оскаржене, оскільки є деякі докази того, що більша частина протипухлинного ефекту досягається за допомогою TACE через ішемію, спричинену оклюзією судин пухлини. В РКД, що включало 101 пацієнта (51 отримував TAE, 50 – доксорубіцинові мікросфери у TACE), не виявлено різниці у відповіді на лікування, виживаності без прогресування, загальній виживаності або побічних ефектах TACE між групами. Це свідчить про відсутність додаткової користі від хіміотерапії в TACE [164]. У цьому РКД медіана тривалості життя в обох групах становила лише 21 міс, що було менше, ніж очікувалося, оскільки в інших дослідженнях медіана тривалості життя після застосування TACE досягала 30-40 міс [114, 165].
Виживаність пацієнтів після ТАСЕ залежить від поширення пухлини та ступеня печінкової недостатності і є варіабельною у різних країнах. У проспективному дослідженні за участю 173 пацієнтів із ГЦК із Греції, які не підходили під критерії радикального лікування, медіана тривалості життя після TACE з використанням мікросфер зі спеціальним покриттям, наповнених доксорубіцином, дорівнювала 43 міс. Загальна 5-річна виживаність становила 23% у пацієнтів із печінковою недостатністю класу А за Чайлдом – П’ю, 13% – класу В (p=0,03) [165]. Схематично методи внутрішньоартеріальної емболізації зображено на рисунку 8 [147].
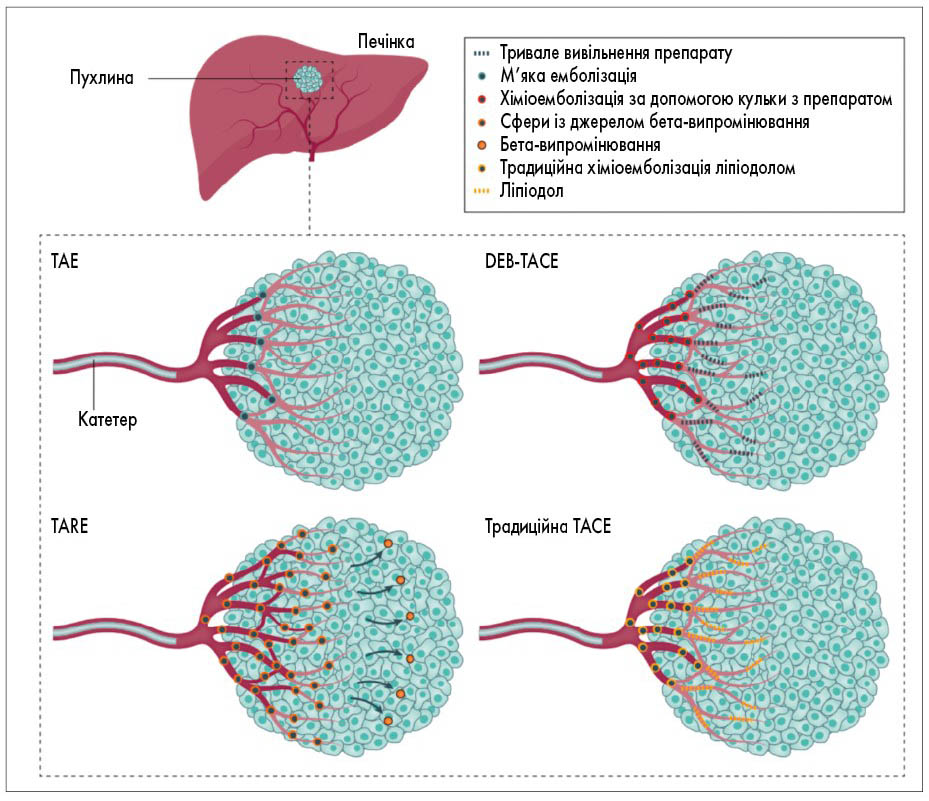 Рис. 8. Методи внутрішньоартеріальної терапії
Рис. 8. Методи внутрішньоартеріальної терапії
Оскільки докази відсутності користі від хіміотерапевтичного засобу при ТАСЕ порівняно з ТАЕ отримані в одноцентровому дослідженні з невеликою кількістю учасників, необхідні подальші РКД для можливої зміни клінічних рекомендацій. З огляду на багатообіцяючу ефективність і схвалення 20 нових системних методів лікування пізніх стадій ГЦК, потенціал для використання цих нових методів замість стандартних хіміотерапевтичних засобів для ТАСЕ також потребує подальшого вивчення.
Трансартеріальна радіоемболізація (TARE) є ще одним методом ефективної локорегіонарної первинної терапії неоперабельної ГЦК, а також зниження стадії перед ТП або проведення лобарної абляції (променевої лобектомії). Остання викликає компенсаторну гіпертрофію нелікованої, неураженої частини печінки та полегшує подальшу хірургічну резекцію. TARE – це форма внутрішньопухлинної брахітерапії, що передбачає доставку радіоактивних мікросфер, наповнених β-випромінюючим ізотопом ітрієм-90, в артерії, які живлять ГЦК, потенційно досягаючи доз опромінення, вищих за ті, які можна отримати за допомогою зовнішнього опромінення. На відміну від TACE, TARE має мінімальний ефект емболії у басейні печінкової артерії, отже, може бути використана у пацієнтів із тромбозом або інвазією ворітної вени [166]. Ефективність та безпека TARE були ретельно оцінені протягом останнього десятиліття [167-172]. У метааналізі даних 284 пацієнтів після ТАCЕ і 269 після ТАRЕ не виявлено статистично значущої різниці щодо виживаності між групами (ВР 1,06; 95% ДІ 0,81-1,46; p=0,57) [171]. Пацієнти групи TACE відмічали більш виражений больовий синдром після лікування, ніж ті, що отримували TARE (ВР 0,51; 95% ДІ 0,36-0,72; p<0,01), але меншу суб’єктивну втому (ВР 1,68; 95% ДІ 1,08-2,62; p<0,01) [171]. TARE була запропонована як варіант лікування пацієнтів з місцево-поширеною ГЦК. У РКД з Європи та Азіатсько-Тихоокеанського регіону оцінювали безпеку й ефективність TARE порівняно з медикаментозною терапією сорафенібом у пацієнтів з місцево-поширеною ГЦК. У жодному з досліджень не продемонстровано переваги TARE щодо загальної тривалості життя порівняно з сорафенібом [173, 174]. Проте аналіз національної бази США 2021 року показав, що застосування TARE асоційоване із покращенням загальної виживаності у пацієнтів із місцево-поширеною ГЦК порівняно з системною терапією [175]. Але дані було зібрано з різних центрів, тому вони неоднорідні. Більше того, на момент проведення цього аналізу опубліковано дані дослідження IMbrave150 із застосування імунотерапії у комбінації з таргетною терапією, у якому було показано значне покращення загальної виживаності, що не враховано в аналізі [176].
Стереотаксична променева терапія та протонно-променева терапія також забезпечували певну ефективність в лікуванні ГЦК. Перші результати виявились еквівалентними ефективності TACE на фоні зниження профілю побічних ефектів [177-184]. Однак високоякісних даних щодо віддалених результатів стереотаксичної променевої та протонно-променевої терапії недостатньо, тому необхідні додаткові дослідження для визначення оптимального вибору локальної терапії ГЦК.
Системна медикаментозна терапія. Революційні зміни відбулися в сфері системної терапії ГЦК за останні декілька років. Пацієнти із поширеними (BCLC C) або проміжними (BCLC B) стадіями ГЦК після прогресування на тлі локорегіонарної терапії мають бути оцінені на предмет призначення системної терапії [185, 186]. На сьогодні Управління з контролю якості харчових продуктів і лікарських препаратів США (FDA) схвалило та ввело у національні та міжнародні рекомендації шість препаратів для лікування ГЦК, чим у 2016 році поставило крапку у майже десятиріччі неуспішних досліджень III фази [185-191]
Перша лінія лікування
Атезолізумаб + бевацизумаб (IMbrave150). До революційного дослідження IMbrave 150 сорафеніб був стандартом лікування поширеної ГЦК більше 10 років. У дослідженні IMbrave 150 було доведено, що атезолізумаб і бевацизумаб забезпечують значне збільшення загальної виживаності порівняно з сорафенібом як першою лінією терапії [192]. Атезолізумаб є повністю гуманізованим препаратом, моноклональним антитілом проти ліганду програмованої клітинної смерті 1 (PD-L1), а бевацизумаб – інгібітором ангіогенезу, що блокує зв’язування фактора росту судинного ендотелію А. У цьому дослідженні III фази взяв участь 501 нелікований пацієнт із нерезектабельною ГЦК. Рандомізація відбувалась у співвідношенні 2:1 у групи атезолізумаб (1200 мг) + бевацизумаб (15 мг/кг маси тіла) через кожні 3 тижні або сорафенібу (400 мг) перорально двічі на день. Кінцевими точками були загальна виживаність (ЗВ) і виживаність без прогресування (ВБП) згідно з Критеріями оцінки відповіді при солідних пухлинах, версія 1.1 (RECIST 1.1). Комбінація атезолізумаб + бевацизумаб продемонструвала статистично значуще покращення як ЗВ через 12,0 міс – 67,2% (95% ДІ 61,3-73,1) проти 54,6% (95% ДІ 45,2-64,0), так і ВБП – 6,8 міс (95% ДІ 5,7-8,3) проти 4,3 міс (95% ДІ 4,0-5,6) у групі сорафенібу. Частота об’єктивної відповіді (ORR) була подвоєна в групі комбінованого лікування порівняно з сорафенібом. Несприятливі події 3 або 4 ступеня тяжкості спостерігалися у 38% учасників групи атезолізумаб + бевацизумаб, найпоширенішою була гіпертензія, за якою слідували протеїнурія та втома. Кровотеча є відомим побічним ефектом прийому бевацизумабу, і пацієнти в цьому дослідженні повинні були пройти езофагогастроскопію для оцінки наявності варикозно розширених вен стравоходу та їх лікування за 6 міс до включення. Позитивні результати цього дослідження сприяли схваленню FDA комбінації атезолізумаб + бевацизумаб як першої лінії терапії при нерезектабельній або метастатичній ГЦК у 2020 році.
Альтернативні препарати першої лінії
Сорафеніб (дослідження SHARP) – низькомолекулярний інгібітор мультикінази, який діє на рецептори судинного ендотеліального фактора росту VEGFR1, VEGFR2 і VEGFR3, рецептор тромбоцитарного фактора росту-β (PDGFRβ) і кінази сімейства Raf (переважно C-Raf, а не B-Raf). Сорафеніб був першим препаратом, схваленим для першої лінії системного лікування в пацієнтів із пізньою стадією ГЦК, і першим протоколом системного лікування, що продемонстрував подовження тривалості життя пацієнтів у РКД III фази. Збільшення медіани загальної тривалості життя склало 2-3 міс (10,7 міс у групі сорафенібу проти 7,9 міс у групі плацебо в дослідженні SHARP і 6,5 міс у групі сорафенібу проти 4,2 міс у групі плацебо в Азіатсько-Тихоокеанському дослідженні). В РКД III фази визначено неефективність сорафенібу як допоміжного (ад’ювантного) лікування після радикальної операції (дослідження STORM) або додаткового лікування з TACE (дослідження SPACE) [193-196].
Ленватиніб (дослідження REFLECT). До 2018 року проведено багато безуспішних досліджень, доки не було схвалено ленватиніб – інгібітор мультикінази, спрямований на VEGFR1-3, рецептори фактора росту фібробластів FGFR1-4, PDGFRα, RET і KIT. У дослідженні III фази пероральний ленватиніб виявився не менш ефективним, ніж сорафеніб (середня ЗВ 13,6 проти 12,3 міс). Однак використання ленватинібу сприяло статистично значущому збільшенню ВБП (7,3 проти 3,6 міс) і часу до прогресування захворювання (7,4 проти 3,7 міс). Крім того, у групі ленватинібу спостерігалася краща якість життя та краща толерантність. Найпоширенішими побічними ефектами, пов’язаними із застосуванням ленватинібу, були гіпертензія, діарея та зменшення маси тіла [197].
Друга лінія терапії
Регорафеніб (дослідження RESORCE) – ще один інгібітор тирозинкінази, перший препарат другої лінії, який продемонстрував переваги щодо виживаності пацієнтів із прогресуванням захворювання на тлі лікування сорафенібом, і був схвалений як друга лінія терапії ГЦК у 2017 році [198]. Пацієнти в групі регорафенібу мали подовжену середню ЗВ (10,6 порівняно з 7,8 міс у групі плацебо). Крім того, використання регорафенібу після прогресування на тлі прийому сорафенібу забезпечувало медіану виживаності 21 міс від початку терапії сорафенібом [195].
Кабозантиніб (дослідження CELESTIAL). У 2018 році у дослідженні III фази CELESTIAL підтверджено ефективність препарату кабозантиніб (інгібітор тирозинкінази, включаючи рецептори MET, AXL і VEGF) у подовженні медіани тривалості життя порівняно з плацебо у пацієнтів із поширеною ГЦК, які раніше отримували сорафеніб. Загалом у 707 пацієнтів, рандомізованих у співвідношенні 2:1 для прийому кабозантинібу чи плацебо, середня ЗВ становила 10,2 міс для кабозантинібу та 8,0 міс для плацебо (ВР 0,76; 95% ДІ 0,63-0,92; p=0,005). Побічні ефекти 3 або 4 ступеня виникли у 68% пацієнтів у групі кабозантинібу та 36% у групі плацебо. При аналізі підгруп коефіцієнт ризику смерті становив 0,69 у пацієнтів з ГЦК, інфікованих вірусом гепатиту В, і 1,11 – вірусом гепатиту С, що свідчить про можливість модифікації ефекту кабозантинібу відповідно до наявного попереднього типу вірусного гепатиту. Виявлено ефективність кабозантинібу як другої лінії терапії, особливо у пацієнтів з ВГВ. Цей аспект потребує додаткових досліджень [199].
Рамуцирумаб (дослідження REACH-2). У 2019 були отримані дані щодо ефективності антиангіогенного антагоніста VEGFR-2 рамуцирумабу у подовженні загальної тривалості життя в пацієнтів при прогресуванні ГЦК, що супроводжувалося підвищенням рівня АФП у сироватці крові ≥400 нг/мл [200]. Рамуцирумаб блокує активацію VEGFR-2 шляхом порушення зв’язування лігандів рецептора VEGF VEGFA, VEGFC і VEGFD. Рамуцирумаб є першим препаратом для системного лікування ГЦК на основі біомаркерів і має потенціал вибору для другої лінії терапії в підгрупі пацієнтів із підвищеним АФП ≥400 нг/мл. Це було перше успішне клінічне дослідження щодо цього препарату, у подальших мають розглянути можливість визначення окремих груп пацієнтів із відповідною біологією пухлини, щоб максималізувати ефективність лікування в майбутніх дослідженнях. Рамуцирумаб був схвалений FDA у травні 2019 року як монотерапія для лікування ГЦК у пацієнтів, які раніше отримували сорафеніб і мають рівень АФП ≥400 нг/мл [201].
Ніволумаб (дослідження CheckMate 040 та 459) і пембролізумаб (дослідження KEYNOTE-224 та -240). Ніволумаб – людське моноклональне антитіло до імуноглобуліну G4, яке порушує передачу сигналів імунної контрольної точки PD-1. Ніволумаб став першим схваленим імунопрепаратом для лікування ГЦК з ORR 20% і медіаною виживаності 16 міс, а також прийнятним профілем безпеки у пацієнтів із прогресуванням захворювання або непереносимістю сорафенібу. Він також показав обнадійливі результати у пацієнтів, які раніше не отримували лікування [202]. Результати не залежали від експресії PD-L1. На жаль, у дослідженні III фази, у якому порівнювали ніволумаб із сорафенібом як першу лінію терапії при прогресуючій ГЦК, отримано негативні результати щодо первинної кінцевої точки ЗВ, хоча ніволумаб мав сприятливіший профіль безпеки (CheckMate 459). Пембролізумаб, інше антитіло до PD-1, показав обнадійливі результати у дослідженні II фази (KEYNOTE-224), що сприяло його прискореному схваленню FDA як другої лінії терапії. Однак у наступному дослідженні III фази пембролізумаб не забезпечив статистично значущого покращення ЗВ або ВБП відповідно до заздалегідь заданих критеріїв протоколу (KEYNOTE-240) [203].
Дурвалумаб + тремілімумаб (дослідження HIMALAYA). Дурвалумаб – людське високоафінне моноклональне антитіло до імуноглобуліну G1 каппа, що селективно блокує взаємодію PD-L1 з PD-1. Тремілімумаб – антитіло імуноглобуліну G2 до цитотоксичного Т-лімфоцитасоційованого антигену 4 (CTLA4). У червні 2022 року було опубліковано результати дослідження HIMALAYA, у якому показано достовірно вищу ефективність комбінації препаратів тремілімумаб (1 введення 300 мг) та дурвалумаб (1500 мг через кожні 4 тижні) порівняно із монотерапією дурвалумабом (1500 мг через кожні 4 тижні) та монотерапією сорафенібом (400 мг щоденно). Всього було включено 1171 пацієнта, медіана ЗВ склала 16,43 міс (95% ДІ 14,16-19,58) у групі дурвалумаб + тремілімумаб, 16,56 міс (95% ДІ 14,06-19,12) у групі монотерапії дурвалумабом та 13,77 міс (95% ДІ 12,25-16,13) у групі сорафенібу. 36-місячна ЗВ становила 30,7; 24,7 і 20,2% відповідно. Медіана ВБП не дуже відрізнялася між групами [204]. У жовтні 2022 року FDA схвалило цю комбінацію для лікування пацієнтів із нерезектабельною або метастатичною ГЦК [205].
Лікування ГЦК в умовах різних фінансових спроможностей
Лікування ГЦК можливе навіть у країнах із проміжними або недостатніми ресурсами. Однак не всі види терапії ГЦК є однаково економічно ефективними та гарантовано впливовими на подовження тривалості життя без урахування можливостей країни фінансово забезпечити повний діагностично-лікувальний комплекс. При ГЦК на ранніх стадіях найефективнішими є потенційно радикальні методи лікування: абляція, резекція або ТП. При ГЦК проміжної стадії слід запропонувати локальне лікування, таке як TACE, TAE або TARE. Ці методи сучасного лікування потребують відповідного обладнання і кваліфікованих спеціалістів, тому сорафеніб може бути альтернативою в країнах з обмеженими ресурсами. У разі пізніх стадій ГЦК застосування інгібіторів тирозинкінази або імунотерапії є єдиним можливим протипухлинним лікуванням. Тому зменшення вартості ліків критично важливе, особливо для країн з обмеженими ресурсами. Пацієнтам із термінальною стадією ГЦК слід забезпечити найкраще паліативне лікування [206].
Глобальні стратегії запобігання розвитку, діагностики та лікування ГЦК
Щоб зменшити тягар ГЦК у світі, необхідно інтенсивно впливати на чотири основні напрями: запобігання інфікуванню вірусами гепатиту В та С; лікування хронічних ВГВ, ВГC та інших хронічних захворювань печінки; зменшення впливу дієтичних і метаболічних факторів ризику; покращення раннього виявлення та лікування ГЦК. Точні оцінки ефекту конкретних заходів відсутні, але слід враховувати, що жоден із цих напрямів сам по собі не буде достатнім для значного зниження кількості смертей від ГЦК. Ці заходи необхідно об’єднати в організований і структурований план дій для реального шансу врівноважити зростання частоти ГЦК внаслідок збільшення чи старіння населення. Нижче наведено структуру глобальних рекомендацій, враховуючи досягнутий на сьогодні прогрес, а також нові дії, які здаються необхідними та можливими на основі останніх досягнень у профілактиці та лікуванні ГЦК. Ця система включає первинну профілактику, в тому числі охоплення вакцинацією проти ВГВ, контроль хронічного вірусного гепатиту за допомогою противірусного лікування та зменшення факторів ризику, пов’язаних із середовищем і способом життя, вторинну профілактику, включаючи раннє виявлення ГЦК за допомогою програм епіднагляду, і третинну профілактику через універсальний доступ до найвідповідніших методів лікування з урахуванням ресурсів країни.
Рекомендації щодо глобального зниження тягаря ГЦК
1. Досягнення достатнього рівня вакцинації проти ВГВ:
- розгортання програм неонатальної вакцинації проти ВГВ;
- моніторинг довгострокового захисту (ефективності вакцини);
- вивчення взаємодії з іншими інфекціями;
- оцінка користі введення імуноглобуліну проти ВГВ вагітним для запобігання передачі вірусу від матері до дитини;
- інформування та навчання населення, вирішення питань про зміну сприйняття вакцинації.
2. Контроль захворювань, пов’язаних із ВГС та ВГВ:
- впровадження скринінгу на ВГС і ВГВ в осіб групи високого ризику;
- забезпечення універсального доступу до фармакологічного лікування ВГС та ВГВ.
3. Зниження ризиків з боку навколишнього середовища та способу життя:
- сприяння вирощуванню замінних культур із меншим ризиком забруднення афлатоксином;
- впровадження суворішого контролю за рівнем забруднення афлатоксинами;
- сприяння здоровому харчуванню та фізичним вправам для профілактики метаболічного синдрому й НАЖХП;
- сприяння відмові від вживання алкогольних напоїв і куріння;
- контроль впливу канцерогенів і токсинів у навколишньому середовищі та на робочому місці.
4. Покращення раннього виявлення, стадіювання та лікування:
- розроблення загальнонаціональних програм виявлення ГЦК в осіб із груп ризику;
- розроблення та впровадження покращених стратегій раннього виявлення ГЦК за допомогою неінвазивних засобів: біомаркерів та радіологічної діагностики;
- підвищення уваги до необхідності раннього виявлення в умовах країн із недостатніми ресурсами, де ГЦК часто розвивається рано без попереднього цирозу печінки;
- сприяння універсальному доступу до найкращих варіантів лікування, незалежно від контексту ресурсів, включаючи доступ до цільової терапії та імунотерапії;
- підвищення обізнаності про захворювання печінки, підтримка пацієнтів і їхніх сімей та доступ до паліативного лікування [207].
На сьогодні лише вакцинація немовлят проти ВГВ була впроваджена як структурована всесвітня програма і як частина Розширеної програми імунізації з використанням мультивалентних вакцин, що зазвичай вводяться з 6-8-го тижня після народження. Насамперед це сталося завдяки зусиллям ВООЗ, UNICEF і Альянсу вакцин, державно-приватного глобального партнерства у галузі охорони здоров’я, заснованого Фондом Білла та Мелінди Гейтс із спільною метою покращення доступу до вакцин дітей, які живуть у найбідніших країнах світу, у співпраці з місцевими національними системами охорони здоров’я. Проте охоплення населення Розширеною програмою імунізації залишається на рівні <75% приблизно в 1/3 цих країн, особливо в країнах з обмеженими медичними ресурсами. Таким чином, незважаючи на великі очікування на загальну вакцинацію проти ВГВ, кількість смертей від ГЦК продовжуватиме зростати в наступні десятиліття, якщо не буде покращено охоплення населення вакцинацією та вжито інші заходи профілактики (зокрема, відсутність зусиль щодо запобігання передачі інфекції від матері до дитини шляхом щеплення проти ВГВ новонароджених протягом перших 24 год життя, а також шляхом виявлення та лікування ВГВ у антигенпозитивних вагітних, які, найімовірніше, передають інфекцію немовлятам) [74]. Додатково до вакцинації скринінг на ВГВ і ВГС у групах високого ризику та загальний доступ до фармакологічного лікування хронічних ВГВ і ВГС можуть значно зменшити глобальний тягар ГЦК.
Для активного зниження впливу афлатоксину потрібен багаторівневий план дій, але пасивне зменшення відбуватиметься спонтанно через диверсифікацію дієти, оскільки багато країн з низькими ресурсами змінюють статус доходу із низького на середній [207]. Однак очікується, що економічне зростання та диверсифікація дієти спричинять багато змін, які можуть призвести до збільшення захворюваності на ГЦК. Перехід до західних гіперкалорійних дієт і малорухливого способу життя, що відбувається в багатьох традиційно слаборозвинених регіонах, спричиняє швидке зростання ожиріння населення із подальшим виникненням метаболічного синдрому та діабету [208]. Це у свою чергу збільшує поширеність факторів ризику раку печінки як у носіїв ВГВ, так і у тих, хто не є носіями, включаючи осіб, у яких носійства вдалося уникнути завдяки неонатальній вакцинації [80]. Моніторинг описаних тенденцій буде важливим для розрізнення позитивних і негативних наслідків змін, пов’язаних із розвитком. Таким чином, стримування епідемії ГЦК вимагатиме ретельного та раціонального управління глобальними екосистемами, беручи до уваги економічне зростання, зміни в сільськогосподарській практиці і харчовій поведінці та зменшення ендемічних захворювань, таких як вірусний гепатит, ожиріння, модифікація способу життя та факторів ризику, таких як вживання алкогольних напоїв і куріння.
Доступ до діагностики, лікування та паліативної допомоги різко обмежений у країнах із низькими економічними ресурсами в більшості ендемічних зон ГЦК. Однак глобальна траєкторія захворювань печінки вказує на те, що існує хороше вікно можливостей для скринінгу, раннього виявлення та раннього лікування ГЦК [209]. Високотехнологічні методи лікування, такі як трансплантація печінки або локальне лікування за допомогою ТАСЕ, часто недоступні в країнах із низьким або середнім рівнем ресурсів. Таким чином, мають бути забезпечені найкращі альтернативні методи лікування відповідно до стадії ГЦК. Обнадійливі результати досліджень інгібіторів кіназ та імунних контрольних точок за останні кілька років, ймовірно, сприятимуть розширенню доступу та зниженню вартості системної терапії поширених форм ГЦК у світі. Для всіх описаних методів діагностики та лікування ГЦК вирішальне значення має можливість доступу до них пацієнтів із груп ризику. Одним із напрямів розвитку лікування може бути впровадження процедур місцевої абляції та хірургічної резекції, для яких можна знайти порівняно недорогі рішення, що також включають навчання з гепатобіліарної хірургії, анестезії та періопераційного догляду [210].
Всі аспекти зусиль, спрямованих на зменшення тягаря ГЦК у світі, вимагають вжиття термінових просвітницьких заходів на місцевому, урядовому та регіональному рівнях. Основні напрями включають розроблення та впровадження ефективних програм скринінгу та епіднагляду, а також покращення доступу до недорогих діагностичних і терапевтичних засобів. Крім того, необхідно сприяти впровадженню трансформаційних нових технологій, включаючи eHealth або мобільні додатки сфери охорони здоров’я, нові недорогі платформи пристроїв для покращення скринінгу на вірусні гепатити та нові технології для епіднагляду за ГЦК, включаючи молекулярні аналізи, технології на основі пристрою для УЗД або інших форм візуалізації печінки, наприклад, визначення неоангіогенезу.
Зростання національних, регіональних і глобальних мереж, спрямованих на боротьбу з епідемією вірусного гепатиту та ГЦК, стало однією з найважливіших подій за останні 10 років. Ці мережі стимулювали розроблення нових рекомендацій ВООЗ щодо ВГВ і ВГС, прийняття резолюцій, що визнають хронічний вірусний гепатит основною причиною захворюваності та смертності у світі на Всесвітній асамблеї охорони здоров’я, а також додавання до глобальних цілей сталого розвитку усунення вірусного гепатиту в усьому світі [211]. Робота цих мереж, які об’єдналися у Всесвітній альянс з гепатиту, підсумована на Всесвітньому саміті з гепатиту у 2015 та 2017 роках. Ці зустрічі зібрали ключові зацікавлені сторони та зумовили розроблення планів дій для глобальної ліквідації вірусних гепатитів до 2030 року [13].
Особливістю описаних вище ініціатив, що відрізняє їх від зусиль із боротьби з ВІЛ-інфекцією в світі, є визнання факту, що заходи з ліквідації вірусного гепатиту мають включати зміцнення інфраструктури системи охорони здоров’я в країнах із низьким і середнім рівнем доходу, де проживає більшість інфікованих [213]. Запуск Глобального фонду з ліквідації вірусного гепатиту в листопаді 2017 року є ключовим кроком і зобов’язанням глобального філантропічного сектору мобілізації ресурсів для досягнення описаних цілей.
Список літератури знаходиться в редакції.
Тематичний номер «Онкологія. Гематологія. Хіміотерапія» № 2 (81) 2023 р.
СТАТТІ ЗА ТЕМОЮ Онкологія та гематологія
Гостра лімфобластна лейкемія (ГЛЛ) є найпоширенішим онкогематологічним захворюванням у дітей і складає значну частку серед лейкемій у дорослих. Незважаючи на значні успіхи в лікуванні ГЛЛ у дітей, де рівень виліковності сягає 90%, результати терапії у дорослих залишаються незадовільними. У рамках науково-практичної конференції з міжнародною участю «Діагностика та лікування гематологічних захворювань: підведення підсумків 2023 року» (15-16 грудня 2023 року) проведено секцію, присвячену ГЛЛ....
Хронічна лімфоцитарна лейкемія (ХЛЛ) залишається актуальною проблемою сучасної онкогематології. Незважаючи на певні досягнення в терапії, ХЛЛ є невиліковним захворюванням. Стандартна хіміотерапія не забезпечує стійкої відповіді, а трансплантація гемопоетичних стовбурових клітин можлива лише для окремої когорти пацієнтів. Тому пошук нових підходів до терапії ХЛЛ, зокрема таргетної, є нагальним завданням. ...
Гепатоцелюлярна карцинома (ГЦК) – злоякісне новоутворення в печінці, що розвивається з гепатоцитів. Рання діагностика і початок лікування пацієнтів із ГЦК запобігає виникненню тяжких ускладнень і покращує якість життя пацієнтів. Медична допомога пацієнтам із ГЦК потребує міждисциплінарної співпраці та інтегрованого ведення хворих мультидисциплінарною командою фахівців, яка займається або спеціалізується на злоякісних новоутвореннях печінки. Саме цьому сприятимуть положення Стандарту медичної допомоги «Гепатоцелюлярна карцинома»....
Традиційно січень є місяцем обізнаності про рак шийки матки (РШМ) – однієї з найпоширеніших патологій у структурі онкогінекологічних захворювань. Протягом цього місяця світ забарвлюється в палітру бірюзового та білого з метою привернення уваги громадськості до проблеми РШМ. ...




