ТЕЛА: сучасні стандарти діагностики та лікування
Сучасні діагностична та лікувальна стратегії ведення пацієнтів із тромбоемболією легеневої артерії (ТЕЛА) ґрунтуються на першочерговому розмежуванні хворих високого та невисокого ризику. У пацієнтів із високим ризиком летального наслідку в результаті ТЕЛА (за наявності шоку або артеріальної гіпотензії) протягом першої години потрібно виконати екстрену комп’ютерну томографію (КТ) органів грудної клітки для візуалізації тромбу в системі легеневої артерії (за неможливості – негайне ультразвукове дослідження серця для виявлення ознак гострого перевантаження правого шлуночка – ПШ), після чого в разі позитивного результату слід проводити специфічне лікування ТЕЛА за допомогою тромболізису (при ураженні середніх і дрібних гілок) та емболектомію (при ураженні великих гілок легеневої артерії).
За підозри на ТЕЛА із невисоким ризиком летального наслідку (у разі відсутності шоку та артеріальної гіпотензії) проводиться клінічна оцінка вірогідності ТЕЛА (Женевська шкала, шкала Wells). За встановлення високої ймовірності досліджується рівень D-димеру, у разі позитивного результату необхідна візуалізація тромбу за допомогою мультиспіральної КТ і подальше призначення антикоагулянтної терапії. Якщо діагностичні дослідження можуть потребувати більше часу, ніж 1 год, з моменту першої клінічної підозри на легеневу емболію, призначається антикоагулянтна терапія в середніх терапевтичних дозах.
Терапевтичні стратегії ведення пацієнтів з ТЕЛА
1. Підтверджена ТЕЛА високого ризику. За відсутності абсолютних протипоказань проводиться тромболітична терапія (ТЛТ), за абсолютних протипоказань або у випадку неефективності ТЛТ – хірургічна емболектомія, у разі неможливості її виконання – катетерна емболектомія.
2. Підтверджена ТЕЛА невисокого ризику. У випадку низького ризику препаратами вибору є низькомолекулярні гепарини (НМГ) або фондапаринукс, в разі помірного ризику – ТЛТ (особливо без ризику кровотечі). Пацієнти з ТЕЛА низького ризику можуть бути виписані додому за умові амбулаторного спостереження та лікування антагоністами вітаміну К (варфарином). Терапія НМГ, фондапаринуксом або НФГ повинна бути розпочата якнайшвидше і продовжуватися протягом не менш ніж 5 днів. Усім іншим пацієнтам протягом 24 год від встановлення діагнозу повинен бути призначений антагоніст вітаміну К (варфарин) під контролем міжнародного нормалізованого відношення (МНВ). Терапію препаратом слід проводити протягом 3 міс, після чого можна розглянути питання про відміну антикоагулянтної терапії або про її продовження.
Підтримка гемодинаміки та дихання. Гостра правошлуночкова недостатність, що призводить до низького серцевого викиду, є основною причиною смерті хворих із ТЕЛА високого ризику. Метою лікування цієї категорії пацієнтів є підтримка гемодинаміки та дихання. Добутамін та/або дофамін збільшують серцевий індекс, але можуть посилити вентиляційно-перфузійну невідповідність внаслідок збільшення відтоку крові від обтурованих судин до необтурованих. Норадреналін використовується у випадках ТЕЛА з низьким артеріальним тиском – АТ (внутрішньовенно крапельно 1-2 мл 0,2% розчину норадреналіну гідротартрату в 400 мл 5% розчину глюкози). Адреналін має позитивний інотропний ефект, не зумовлює системної вазодилатації, є ефективним у хворих із шоком. Адреналін використовується в інфузії в дозах 0,05-0,5 мкг/кг/хв. Гіпоксемія коригується інгаляцією кисню через носові катетери.
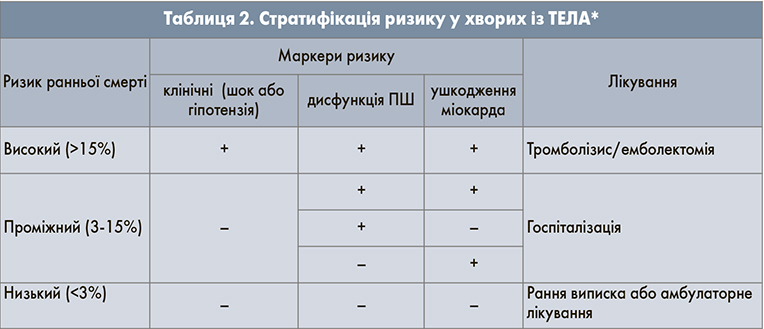
Тромболізис. ТЛТ – лікування першої лінії у хворих із ТЕЛА високого ризику, кардіогенним шоком та/або стійкою артеріальною гіпотензією; сприяє швидкому усуненню обструкції легеневої артерії та позитивному гемодинамічному ефекту. ТЛТ не слід використовувати у хворих із ТЕЛА низького ризику. Найкращий ефект спостерігається, коли лікування розпочинається у перші 48 год від виникнення симптомів, але його терапевтична цінність зберігається при призначенні протягом 6-14 діб з моменту появи порушень. У пацієнтів із підозрою на ТЕЛА здійснюють первинну стратифікацію ризику ранньої (у стаціонарі або протягом 30 днів) смерті від ТЕЛА та оцінюють клінічну вірогідність ТЕЛА. Для вибору тактики лікування необхідно провести стратифікацію ризику у хворих, при цьому слід оцінювати маркери, що визначають ризик смерті від ТЕЛА: дисфункції ПШ, маркери ушкодження міокарда (табл. 1).
Оцінка первинної стратифікації ризику є обов’язковою для ідентифікації пацієнтів із високим ризиком та проведення їм специфічних діагностики та лікування (табл. 2).
ТЛТ – лікування першої лінії у хворих із ТЕЛА високого ризику. Мета її проведення – максимально швидке відновлення прохідності оклюзованої легеневої артерії, зменшення легеневої гіпертензії та постнавантаження на ПШ.
Показання до проведення тромболізису:
- масивні ТЕЛА з артеріальною гіпотензією (систолічний АТ ≥90 мм рт. ст. чи зниження АТ на ≤40 мм рт. ст. протягом 15 хв, яке не викликане аритміями, гіповолемією, сепсисом та іншими причинами);
- масивні ТЕЛА із шоком;
- субмасивні ТЕЛА з симптомами гострої правошлуночкової недостатності за наявності перфузійного дефіциту ≥30% за даними сцинтиграфії чи підвищення тиску в легеневій артерії >60 мм рт. ст. (питання вирішується індивідуально).
Схеми ТЛТ у разі ТЕЛА наведено у таблиці 3. Важливо, що пацієнтам із ТЕЛА без ознак перевантаження правих відділів серця тромболізис не показаний.
Починають ТЛТ у перші 3-7 діб (якомога раніше) і проводять протягом 48-72 год під контролем ангіопульмонографії. У разі досягнення лізису тромбу продовжувати ТЛТ потрібно ще протягом 24-48 год. Лабораторний контроль у разі проведення ТЛТ включає визначення концентрації фібриногену в плазмі крові, а також тромбінового часу. У випадку закінчення ТЛТ призначається гепарин. Ефективність ТЛТ оцінюється за клінічними даними (зменшення задишки, тахікардії, ціанозу), за електрокардіографічними показниками (регрес ознак перевантаження правих відділів серця), за результатами повторної сцинтиграфії або ангіопульмонографії. Абсолютні протипоказання до проведення тромболізису – внутрішня кровотеча, що продовжується, та інтракраніальні крововиливи протягом останнього місяця. Відносні протипоказання до проведення тромболізису включають великі хірургічні втручання або внутрішню кровотечу упродовж останніх 10 днів; біопсію органа чи артерії; травму, що сталася протягом останніх 15 днів; нейрохірургічні та офтальмологічні операції протягом останніх 2 міс; геморагічний інсульт в анамнезі; неконтрольовану артеріальну гіпертензію; діабетичну ретинопатію; геморагічні діатези будь-якого ґенезу; вагітність; менструацію; інфекційний ендокардит; пухлинний процес будь-якої локалізації. Тромболізис не проводиться пацієнтам із масивними ТЕЛА за наявності абсолютних протипоказань і хворим із масивними і субмасивними ТЕЛА, якщо вони мають гемодинамічні порушення серця та/або легень, зумовлені супутніми захворюваннями. У цьому випадку основним методом лікування є встановлення кава-фільтрів.
Показання до встановлення кава-фільтра в разі ТЕЛА:
- епізод венозної тромбоемболії (ВТЕ) за наявності абсолютних протипоказань до призначення антитромботичних препаратів (хірургічне втручання, геморагічний інсульт, кровотеча, що продовжується, та ін.);
- масивна легенева емболія з ризиком рецидиву, що зберігається;
- тромбоемболії з високою ймовірністю летального наслідку;
- рецидив тромбоемболії на тлі адекватної антикоагулянтної терапії;
- високий ризик ТЕЛА (у хворих із легеневим серцем, рецидивуючими тромбоемболіями в анамнезі, онкозахворюваннями, травмами таза);
- пацієнтам після легеневої емболектомії.
Легенева емболектомія виконується у хворих з ТЕЛА високого ризику за наявності протипоказань до ТЛТ або у разі неадекватного ефекту тромболізису, при відкритому овальному вікні та внутрішньосерцевих тромбах. Метод має обмежене місце в лікуванні ТЕЛА внаслідок високого (20-50%) ризику летальності на операційному столі. Основна мета проведення емболектомії – запобігання летального наслідку. Протипоказання до проведення емболектомії – супутні захворювання з несприятливим прогнозом (злоякісні пухлини з віддаленими метастазами, виражена серцева недостатність, що пов’язана з хронічною патологією), за яких ризик операції не є виправданим, а також рецидивуюча тромбоемболія без ангіографічних ознак оклюзії великих гілок легеневої артерії, систолічний тиск в легеневій артерії >70 мм рт. ст. Похилий вік хворих не є абсолютним протипоказанням до виконання емболектомії. Черезшкірна катетерна емболектомія та фрагментація розглядається як альтернативний метод реперфузії у пацієнтів з ТЕЛА високого ризику за наявності абсолютних протипоказань до ТЛТ або за її неефективності. Під час лікування антикоагулянтами слід забезпечити контроль системи гемостазу, зокрема таких показників, як активований частковий тромбопластиновий час (АЧТЧ), МНВ та час згортання крові. Показник АЧТЧ (норма 28-38 с) дозволяє оцінити внутрішній (фактори VIII, IX, XI, XII) і загальний (фактори I, II, V, X) шляхи згортання крові; він застосовується для моніторингу терапії гепарином. Швидкість внутрішньовенного введення гепарину, дозу та частоту підшкірних ін’єкцій регулюють таким чином, щоб забезпечити збільшення АЧТЧ у 1,5-2,5 рази від вихідного значення. Індекс АЧТЧ – відношення між часом появи згустку в досліджуваній та контрольній плазмах. У разі гепаринотерапії слід досягати значення індексу АЧТЧ 1,5-2,5. Показник МНВ застосовують замість визначення протромбінового часу. Рекомендується використовувати саме МНВ, оскільки цей показник враховує відношення стандартизованої активності тромбопластину до значення тромбопластину, що використовується в даній лабораторії. У більшості випадків у разі лікування непрямими антикоагулянтами достатньо досягти збільшення МНВ у межах від 2,0 до 3,0, що відповідає зростанню протромбінового часу в 1,3-1,5 рази порівняно з вихідним значенням. МНВ розраховується за формулою:
МНВ = (ПЧ хворого : ПЧ стандартної плазми хворого)МІЧ,
де ПЧ – протромбіновий час, МІЧ – міжнародний індекс чутливості, який показує співвідношення активності тканинного фактора тварин зі стандартом тканинного фактора людини (зазначається виробником препарату). Час згортання крові – один із найдоступніших показників, який дає загальне уявлення про стан системи згортання крові. Класичним способом визначення часу згортання нестабілізованої крові вважається метод Лі-Уайта, який оцінює швидкість утворення згустку венозної крові у 2 (а в класичному варіанті – в 3) пробірках на водяній бані за температури 37 °С. Час згортання крові збільшується у разі зниження числа або порушення функції тромбоцитів (зокрема на фоні застосування антиагрегантів і антикоагулянтів). Препарати, що використовуються для стартової терапії пацієнтів із підтвердженою ТЕЛА, перераховані в таблиці 4.
Стартова антикоагулянтна терапія (АКТ). Метою невідкладної АКТ є попередження летального наслідку та рецидивів ТЕЛА. Лікування необхідно розпочинати у хворих із підозрою на ТЕЛА. Швидку антикоагуляцію забезпечують внутрішньовенна інфузія нефракціонованого гепарину (НФГ), підшкірне введення НМГ або фондапаринукса (табл. 5).
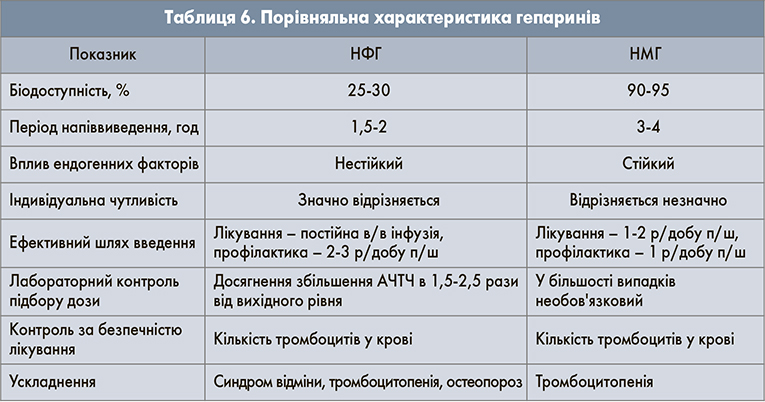
Лікування НФГ починають з внутрішньовенного болюсного введення у дозі 80 Од/кг з подальшою інфузією зі швидкістю 18 Од/(кг/год) з урахуванням АЧТЧ. Останній показник необхідно визначати кожні 4-6 год після введення болюсу, далі через 3 год після кожної зміни дози або 1 р/добу за умови досягнення цільової терапевтичної дози. Внутрішньовенний НФГ є препаратом вибору у пацієнтів із важким порушенням функції нирок, оскільки він не елімінується нирками. Застосування фондапаринуксу не потребує лабораторного контролю та не викликає гепариніндуковану тромбоцитопенію. АКТ з використанням НФГ, НМГ або фондапаринукса слід продовжувати протягом як мінімум 5 діб. За наявності злоякісної пухлини рекомендовано використовувати дальтепарин у дозі 200 Од/кг 1 р/добу. На сьогодні частіше застосовуються НМГ. До переваг їх використання можна віднести здатність на більш високому рівні гальмувати згортання крові та зменшувати утворення тромбіну, високу біодоступність (100%), тривалий період напіввиведення (у 2-4 рази перевищує такий НФГ), відсутність необхідності підбору дози залежно від АЧТЧ, можливість підшкірного введення та пролонгованість дії, рівномірний передбачуваний м’який терапевтичний ефект, можливість призначення 1-2 р/добу, а також застосування безпосередньо в перед- і післяопераційний період (табл. 6).
Протипоказання до лікування гепаринами:
- геморагічні діатези будь-якої етіології;
- важка артеріальна гіпертензія;
- виразкова хвороба або пухлина шлунково-кишкового тракту;
- варикозне розширення вен стравоходу;
- важка печінкова або ниркова недостатність;
- високий ризик розвитку кровотечі;
- інфекційний ендокардит;
- ретинопатія;
- тромбоцитопенія (<100 тис./мкл);
- оперативні втручання на головному мозку, хребті;
- гіперчутливість до гепарину.
Місце непрямих оральних антикоагулянтів в лікуванні ТЕЛА Мета призначення непрямих антикоагулянтів у разі ТЕЛА – запобігання виникненню тромбів і подальшому збільшенню їх розмірів, зменшення ризику розвитку тромбоемболій. Застосовують 2 групи препаратів – похідні індандіону (феніндіон) та кумарину (варфарин, аценокумарол; табл. 7). Непрямі антикоагулянти блокують α-карбоксилювання глутамінових залишків протромбіну, факторів VII, IX, X та ендогенного антикоагулянтного білка С, що призводить до утворення їх неактивних молекул. Цей процес пов’язаний з дезактивацією вітаміну К, який нівелює ефекти непрямих антикоагулянтів
Варфарин – непрямий антикоагулянт групи кумарину, антагоніст вітаміну К, порушує функцію залежних від вітаміну К білків (факторів II, VII, IX, X, білків С та S). Антагоністи вітаміну К (варфарин) необхідно призначати в 1-шу або 2-гу добу після призначення гепарину та відмінити гепарин, коли МНВ досягне значення 2,0-3,0 протягом 2 діб. Лікування варфарином розпочинають з дози 5 або 7,5 мг/добу. У пацієнтів до 60 років без інших важких захворювань варфарин можна використовувати у стартовій дозі 10 мг/добу, а у хворих похилого віку краще починати з 5 мг/добу. У подальшому дози слід підбирати таким чином, щоб МНВ підтримувалось на рівні 2,5 (у межах 2,0-3,0).
Основними показаннями до застосування є профілактика та лікування тромбозу глибоких (ТГВ) та проксимальних вен, мозкових судин, ТЕЛА, вродженої тромбофілії (особливо в разі дефіциту білків С та S), профілактика ускладнень при імплантації штучних клапанів або судин, миготлива аритмія, тріпотіння передсердь, набуті вади серця, а також вторинна профілактика інфаркту міокарда. Контроль лікування проводиться шляхом визначення протромбінового часу та МНВ. У більшості випадків достатньо досягти збільшення МНВ від 2,0 до 3,0, що відповідає підвищенню протромбінового часу в 1,3-1,5 рази порівняно з вихідним значенням. Протромбіновий час або МНВ визначають до початку лікування, на 2-й та 3-й день терапії, далі (за відсутності суттєвих коливань цього показника) – 1 раз на тиждень. Підтримувальна доза зазвичай становить 2-2,5 мг/добу. Доза вважається підібраною правильно, якщо МНВ знаходиться в терапевтичному інтервалі протягом 2 днів поспіль. Варфарин призначається на тлі лікування гепарином за 2-3 доби до його відміни.
Переваги варфарину:
- найбільша доказова база з усіх непрямих антикоагулянтів;
- рекомендації Європейського товариства кардіологів (ESC) з діагностики та лікування гострої легеневої емболії (2008) та ведення пацієнтів із фібриляцією передсердь (2010);
- рекомендації Європейської організації по боротьбі з інсультом (ESO, 2008), Американської асоціації інсульту (ASA, 2008) з ведення пацієнтів з ішемічним інсультом;
- висока біодоступність;
- мінімальна токсичність;
- висока передбачуваність терапевтичного ефекту.
Недоліки варфарину:
- вузьке терапевтичне вікно (МНВ 2,0-3,0) – необхідні постійний лабораторний контроль згортання крові та коригування дози;
- залежність ефекту варфарину від характеру харчування, обміну речовин;
- взаємодія препарату з іншими лікарськими засобами (можлива зміна антикоагулянтного ефекту);
- початок дії – на 4-5-ту добу;
- відсутність антидотів до варфарину (препаратів вітаміну К1, зокрема фітоменадіону) на українському фармацевтичному ринку.
Основним ускладненням терапії непрямими антикоагулянтами є розвиток кровотеч, ризик яких суттєво зростає у разі МНВ >5,0-6,0.
Нові оральні антикоагулянти
Лікування варфарином та іншими інгібіторами вітаміну К асоціюється з низкою обмежень, включаючи вузький терапевтичний інтервал, зміну реакції залежно від дози, повільний початок та кінець дії, можливу взаємодію з іншими лікарськими препаратами та їжею. Тому у пацієнтів, які отримують терапію інгібіторами вітаміну К, необхідний регулярний моніторинг МНВ (терапевтичне вікно 2,0-3,0, при цьому час перебування в терапевтичному вікні повинен бути >60%) і регулярна корекція дози для забезпечення необхідного рівня антикоагуляції. Інші традиційні антикоагулянти, у тому числі НМГ та НФГ, а також фондапаринукс натрію, потребують внутрішньовенного або підшкірного введення, що обмежує їх використання для тривалої терапії ТЕЛА в амбулаторних умовах. Попередня терапія ТЕЛА передбачала обов’язкове використання 2 рівнів і 2 препаратів – прямих і непрямих антикоагулянтів. Так, протягом перших 5-7 діб проводилася парентеральна терапія НМГ або НФГ (під контролем показника часу згортання крові за Лі-Уайтом – норма 4-9 хв), після чого призначався антагоніст вітаміну К (варфарин) тривало під контролем МНВ (у межах 2,0-3,0). Завдяки впровадженню нових сучасних пероральних антикоагулянтів з’явилася можливість перейти на монотерапію, призначаючи препарати у формі таблеток з першого дня як для лікування, так і з метою профілактики ТЕЛА. Ця група препаратів має низку переваг порівняно з варфарином, зокрема швидкі початок і закінчення дії, порівняно невеликий потенціал лікарських взаємодій, а також можливість застосування фіксованої дози препарату. Альтернативою варфарину стали нові пероральні антикоагулянти: дабігатран, ривароксабан, апіксабан (табл. 8).
Ривароксабан – селективний інгібітор фактора Ха. Інгібування фактора Ха дає можливість ефективно блокувати посилене утворення тромбіну та його дію на згортання крові й тромбоцити, але не впливає на рівень фактора ІІ в крові. Ривароксабан є найбільш перспективним з нових пероральних антикоагулянтів для лікування ТЕЛА, вважається реальною альтернативою варфарину у пацієнтів з варіабельним МНВ та у хворих, у яких контроль МНВ неможливий. Препарат дозволений для лікування та профілактики ТЕЛА у Європі (ЕМА), США (FDA) та Канаді (НС). Тактика призначення ривароксабану з метою лікування та профілактики ТЕЛА і ТГВ наведена в таблиці 9.
Дабігатрану етексилат – попередник дабігатрану – потужний конкурентний прямий інгібітор тромбіну для перорального застосування (табл. 10).
Широкий терапевтичний інтервал дає можливість використовувати його у фіксованій дозі без потреби контролю показників коагуляції. Нещодавно препарат був схвалений у США, країнах ЄС та в Україні для розширеного лікування гострої ВТЕ після парентеральної антикоагулянтної терапії з метою профілактики рецидиву ВТЕ (табл. 11).
| Медична газета «Здоров’я України» № 24 (373), грудень 2015 p. |
СТАТТІ ЗА ТЕМОЮ
Як відомо, кальцій бере участь у низці життєво важливих функцій. Хоча більшість досліджень добавок кальцію фокусувалися переважно на стані кісткової тканини та профілактиці остеопорозу, сприятливий вплив цього мінералу є значно ширшим і включає протидію артеріальній гіпертензії (передусім у осіб молодого віку, вагітних та потомства матерів, які приймали достатню кількість кальцію під час вагітності), профілактику колоректальних аденом, зниження вмісту холестерину тощо (Cormick G., Belizan J.M., 2019)....
Після десятиліть, а часом і запеклих суперечок про переваги та недоліки застосування глюкокортикоїдів (ГК) досягнута певна конвергенція. Сучасні рекомендації лікування таких захворювань, як ревматоїдний артрит (РА), ревматична поліміалгія (РПМ) та васкуліт великих судин відображають поточний стан консенсусу терапії ГК. Однак залишаються відкритими питання щодо можливості тривалого лікування дуже низькими дозами ГК у пацієнтів із РА, а також успішності пошуку інноваційних ГК (лігандів ГК-рецепторів) із покращеним співвідношенням користь/ризик....
Серед препаратів, які мають велику доказову базу щодо лікування пацієнтів із захворюваннями дихальних шляхів з алергічним компонентом, особливий інтерес становлять антагоністи лейкотрієнових рецепторів (АЛТР). Ці препарати мають хорошу переносимість у дорослих та дітей, а також, на відміну від інгаляційних кортикостероїдів (ІКС), характеризуються високим комплаєнсом, тому посідають чільне місце в лікуванні пацієнтів із респіраторною патологією. У лютому відбувся міждисциплінарний конгрес із міжнародною участю «Життя без алергії International» за участю провідних вітчизняних міжнародних експертів. Слово мав президент Асоціації алергологів України, професор кафедри фтизіатрії та пульмонології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук Сергій Вікторович Зайков із доповіддю «Місце АЛТР у лікуванні пацієнтів із респіраторною патологією». ...
Розбір клінічного випадку...