Терапевтическое применение комбинации цитиколина и пирацетама
Фиксированная комбинация цитиколина и пирацетама в таблетках присутствует на рынках многих стран. Цитиколин улучшает память и другие когнитивные функции у пациентов с хроническими цереброваскулярными заболеваниями и сосудистой деменцией, а также у лиц с возраст-зависимым дефицитом памяти. Пирацетам поддерживает когнитивные функции, замедляет старение мозга, усиливает мозговой кровоток и увеличивает поступление кислорода к нейронам. Перечисленные эффекты находят применение при лечении болезни Альцгеймера, для стимулирования восстановительных процессов у больных, перенесших инсульт, а также при других состояниях, сопровождающихся повреждением и ишемией нервной ткани. Пирацетам и цитиколин осуществляют поддержку когнитивных функций, не оказывая стимулирующего влияния на периферическую нервную систему. Существуют данные о синергичном взаимодействии этих молекул. Так, пирацетам сглаживает фазу депрессии, которая следует за фазой активации при использовании цитиколина. Цитиколин смягчает побочный эффект в виде головной боли, иногда возникающий при приеме пирацетама. В данном обзоре приводится обоснование комбинированной терапии цитиколином и пирацетамом с точки зрения их физиологических эффектов и фармакологических свойств.
Введение
Цитиколин был открыт в 1955 году Кеннеди и коллегами и впервые синтезирован в 1956 году. На протяжении десятилетий препарат интенсивно изучался в Европе, Японии и США и в настоящее время за- регистрирован во многих странах как лекарственное средство для терапии неврологических заболеваний, а в США – как пищевая добавка, хотя и не входит в официальные фармакопеи. Цитиколин – естественный метаболит холина – витамин В4 , который обнаруживается во всех клетках организма. В исследованиях доказано положительное влияние цитиколина на здоровье мозга. Он поддерживает функции центральной нервной системы (ЦНС) и даже противостоит некоторым повреждающим воздействиям, накапливающимся в течение жизни в стареющем мозге. Цитиколин является прекурсором для синтеза компонентов клеточных мембран и таким образом играет жизненно важную роль в их обновлении и защите от повреждений. Кроме того, цитиколин поддерживает процессы образования энергии в нейронах, участвует в синтезе нейромедиаторов (в частности, ацетилхолина) и проведении нервных импульсов – всего, что необходимо для реализации различных функций мозга: памяти, мышления, при- нятия решений, двигательных актов и др. (R. Jambou et al., 2009).
Пирацетам был разработан в 1967 году и стал первым представителем нового класса лекарственных средств – ноотропов. В клинических исследованиях изучен при лечении пациентов с эпилепсией, деменцией, черепно-мозговыми травмами (ЧМТ) и другими неврологическими проблемами. Включен в официальные фармакопеи Великобритании и Европы.
Структура и свойства молекул
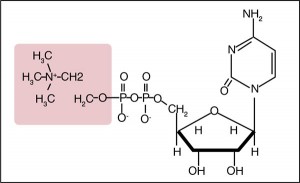
Цитиколин (цитидин-5’-дифосфохолин, или ЦДФ-холин) по химической структуре является нуклеотидом, скомпонованным из рибозы, пирофосфата, цитозина и холина (рис. 1). Молекула организована в две составные части: цитидин и холин, соединенные дифосфатным мостиком. Это водорастворимое вещество с биодоступностью 90%. После перорального приема подвергается гидролизу в тонкой кишке и всасывается как холин и цитидин. После абсорбции холин и цитидин рефосфорилируются, и цитиколин заново синтезируется из цитидин-трифосфата (ЦТФ) и холина монофосфата при помощи фермента ЦТФ-фосфохолинцитидилтрансферазы (R.J. Wurtman, 1992; K.J. D’Orlando, B.W. Sandage Jr., 1995; A.M. Rao et al., 1999).
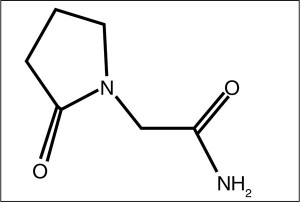
Пирацетам – водорастворимая молекула, содержащая пирролидоновое кольцо, производное гамма-аминомасляной кислоты (ГАМК), которая является основным тормозным медиатором в ЦНС. Химическое название – 2-оксо-1-пирролидин-ацетамид, брутто-формула C6H10N2 O2 (рис. 2).
Пирацетам не проявляет аффинности к большинству важных рецепторов – адренергических α1 и α2, а также β, серотониновых, дофаминовых, аденозиновых, мю-опиатных, ГАМК-эргических, хотя сообщалось о его свойствах модулятора некоторых центральных нейротрансмиттеров, таких как ацетил-холин и глутамат (R.J. Wurtman, 1986). Рацетамы, к группе которых относится пирацетам, являются положительными аллостерическими модуляторами АМРА- рецепторов в ЦНС. АМРА-рецептор (рецептор α-амино-3-гидрокси-5-метил-4-изоксазолпропионовой кислоты) – ионотропный рецептор глутамата, который передает быстрые возбуждающие сигналы в синапсах нервной системы. Присоединение положительных модуляторов АМРА-рецептора, таких как пирацетам, к лиганд-связывающему домену ионного канала приводит к повышению энергии перехода рецептора в ненапряженное состояние после связы- вания с агонистом. Таким образом, модуляторы предотвращают десенситизацию рецептора. Интересно, что другие «усилители» когнитивных функций, которые находятся в разработке, также являются положительными аллостерическими модуляторами АМРА-рецептора. Кроме того, рацетамы активируют глутаматные рецепторы, расположенные совместно с холинергическими рецепторами, что усиливает передачу в последних. В результате рацетамы повышают емкость памяти так, как это делают ингибиторы ацетилхолинестеразы (W.E. Muller et al., 1999). Этот механизм также объясняет, почему ноотропный потенциал рацетамов максимально раскрывается при приеме одновременно с предшественниками холина или ацетилхолина, такими как цитиколин (M. Grau et al., 1987).
Биохимия
Подобно витаминам группы В холин является триметилированным азотистым основанием и участвует в трех важных метаболических путях: 1) синтез фосфолипидов; 2) синтез ацетилхолина; 3) окисление до бетаина, который служит донором метильных групп. Образование цитиколина из холина является лимитированным по скорости этапом в синтезе фосфатидилхолина – ключевого компонента клеточных мембран (R.J. Wurtman et al., 1992). Цитидин – основной компонент РНК, подвергается цитоплазматической конверсии в ЦТФ. В метаболическом пути цитиколина холин фосфорилируется под действием фермента холинкиназы с образованием фосфорилхолина, который, в свою очередь, соединяется с ЦТФ, образуя цитиколин (K.J. D’Orlando, B.W. Sandage Jr., 1995). Затем цитиколин объединяется с диацилглицеролом, образуя фосфатидилхолин. Экзогенный цитиколин, гидролизованный в кишечнике и усвоенный в виде холина и цитидина, включается в различные биосинтетические реакции, использующие цитиколин в качестве промежуточного звена. Таким образом, цитиколин, принятый в форме препарата, поддерживает резервы эндогенного холина и ингибирует распад мембранных фосфолипидов (A.M. Rao, J.F. Hatcher, R.J. Dempsey, 1999).
Рацетамы действуют скорее как усилители уже существующей нейрональной активности (что сопровождается также повышением утилизации глюкозы), чем проявляют собственные нейротрансмиттерные эффекты. Это соотносится с их очень низкой токсичностью и отсутствием серьезных побочных эффектов (K. Winnicka et al., 2005). Пирацетам взаимодействует со специфическими и участками ионных каналов (например, АМРА) на мембранах всех возбудимых клеток, вызывая потенциацию их электрической активности. Увеличивается поступление в клетку кальция через потенциал-зависимые кальциевые каналы не L-типа, ограничивается вход ионов калия, возможно, пирацетам также взаимодействует с молекулами ионных транспортеров.
Фармакокинетика
Фармакокинетические исследования с участием здоровых взрослых добровольцев показали, что перорально принятая доза цитиколина быстро всасывается, менее 1% выводится с калом. Концентрация в плазме крови носит двухфазный характер: наблюдаются два пика – через 1 и 24 ч после приема дозы. Цитиколин метаболизируется в кишечной стенке и в печени. При гидролизе препарата в стенке тонкой кишки образуются холин и цитидин. После абсорбции эти молекулы разносятся кровью по всем тканям организма и включаются в различные биосинтетические реакции, а также проникают через гематоэнцефалический барьер в ЦНС, где ресинтезируются в цитиколин (R.J. Wurtman, 1986). Цитиколин выводится преимущественно через легкие и почки, в две фазы, соответствующих двухфазной кривой концентрации в плазме крови. За первым пиком концентрации следует резкое снижение, которое затем замедляется в последующие 4-10 ч. После второго, 24-часового пика резкое падение концентрации подобным образом переходит в замедленную фазу выведения. Периоды полувыведения равны 56 ч через легкие и 71 ч – с мочой (K.J. D’Orlando, B.W. Sandage Jr., 1995).
Пирацетам быстро и почти полностью всасывается после перорального приема. Пиковая концентрация в плазме достигается через 1,5 ч; период полувыведения равен 5 ч (B. Jordaan et al., 1996). Пирацетам легко проникает через гематоэнцефалический барьер, не метаболизируется с образованием каких-либо производных молекул, а выводится в неизмененном виде. Для него характерны возраст-зависимые особенности фармакокинетики. У лиц молодого возраста Сmax пирацетама после перорального приема в дозе 1600 мг натощак составляет 27,6±1,3 мкг/мл в течение Тmax 0,90±0,15 ч. У пожилых лиц, по данным одного и того же исследования, эти показатели составили 32,2±3,6 мкг/мл и 0,86±0,14 ч соответственно. Площадь под 24-часовой кривой концентрации в плазме крови (AUC) равна 145 и 188 мкг/мин/мл у молодых и пожилых пациентов соответственно. Увеличение AUC с возрастом происходит в результате замедленного почечного клиренса. Почти весь пирацетам, принятый перорально, выводится из организма посредством клубочковой фильтрации в почках (M.M. Paula-Barbosa et al., 1991).
Механизмы действия
Цитиколин оказывает активирующее влияние на ЦНС посредством следующих механизмов.
А. Активация синтеза фосфолипидов: доказательства того, что цитиколин является предшественником фосфатидилхолина, получены в исследованиях на животных (E. De la Morena, 1991).
Б. Восстановление нейрональных мембран. Цитиколин изучался в качестве терапии для пациентов с инсультом, и, по результатам исследований, было выделено три основных эффекта: 1) репарация мембран посредством усиленного синтеза фосфатидилхолина; 2) восстановление поврежденных холинергических нейронов через потенциацию продукции ацетилхолина; 3) противодействие накоплению свободных жирных кислот в месте повреждения нервной ткани (A. Nitta et al., 1994).
В. Ограничение депонирования бета-амилоида – нейротоксичного белка, играющего центральную роль в патофизиологии болезни Альцгеймера (I. Lopez et al., 1986; A. Nitta et al., 1997).
Г. Влияние на нейротрансмиттеры. Доказано, что цитиколин стимулирует высвобождение норадреналина в коре головного мозга и гипоталамусе, допамина – в полосатом теле (стриатуме), серотонина и ацетилхолина – в коре, стриатуме и гипоталамусе.
Пирацетам осуществляет поддержку когнитивных функций, не являясь седативным средством или стимулятором. Считается, что этот эффект связан с положительной аллостерической модуляцией АМРА-рецепторов и, возможно, с влиянием на ионный транспорт. При этом пирацетам не проявляет агонистических или ингибирующих свойств в отношении других рецепторов, задействованных в регуляции синаптической передачи в ЦНС, и этим объясняются его низкая токсичность и высокая безопасность. Также сообщалось об усилении кровотока и повышении потребления кислорода разными отделами мозга, но это является скорее результатом увеличения функциональной активности соответствующих нейронных сетей, чем первичным эффектом пирацетама. Кроме того, пирацетам улучшает функционирование холинергических систем мозга посредством модуляции ацетил-холиновых рецепторов, задействованных в процессах памяти. Пирацетам также может влиять на N-метил-D-аспартатные (NMDA) рецепторы глутамата, которые участвуют в процессах обучения и памяти. Влияние на нейротрансмиссию пирацетам может осуществлять посредством модуляции ионных каналов (натриевых, калиевых). Пирацетам стимулирует синтез цитохрома b5, который является частью механизма транспорта электронов в ми- тохондриях, а также повышает проницаемость мембран митохондрий для некоторых промежуточных продуктов цикла Кребса. Наконец, пирацетам облегчает коммуникацию между полушариями мозга и усиливает активность мозолистого тела.
Применение комбинации цитиколина и пирацетама в лечении неврологических заболеваний
Пользу от комбинации цитиколина и пирацетама могут получить в первую очередь пациенты с когнитивными нарушениями разного происхождения, в том числе с возраст-зависимым ухудшением памяти в результате нормального старения мозга. К неврологическим показаниям относятся болезни Паркинсона и Альцгеймера, инсульт и закрытая ЧМТ.
Оба компонента легко проникают в цереброспинальную жидкость и нервную ткань через гематоэнцефалический барьер. Цитиколин и пирацетам представляют собой научно обоснованные «нутриенты» для нормальной работы мозга, обеспечения межнейронных коммуникаций, необходимых для процессов памяти, обучения, контроля поведения и двигательных функций. Мозг состоит из 100 миллиардов взаимосвязанных нейронов, обменивающихся миллиардами импульсов ежесекундно. Поэтому не удивительно, что мозг является самым зависимым от поступления нутриентов органом. Потеря памяти не является неизбежной. Многие верят в то, что ухудшение памяти – это результат нормального старения. Однако широко известны примеры людей, которые в преклонном возрасте остаются когнитивно сохранными и не уступают молодым по четкости мышления и успешности выполнения различных заданий. Существуют убедительные и воспроизводимые доказательства того, что люди, уделяющие внимание здоровому питанию и ведущие активный образ жизни, не дающий мозгу «простаивать», обычно остаются в хорошей физической и ментальной форме до глубокой старости. Прием нутриентов, специфически усиливающих и поддерживающих когнитивные процессы, дополнительно повышает шансы на активную старость без дефицита памяти и других функций.
Цитиколин является натуральным компонентом для синтеза фосфатидилхолина – основного составляющего массы серого вещества мозга. Это нетоксичная молекула, естественный метаболит человеческого организма. Его нутритивное значение для мозга заключается в стимуляции синтеза важнейшего нейромедиатора ацетилхолина и поддержке пула фосфолипидов нейрональных мембран. При лечении инсульта, последствий нейротравмы, сосудистой деменции, болезни Паркинсона и болезни Альцгеймера цитиколин предотвращает потерю памяти, расстройства поведения, дефицит концентрации, бдительности, способности к обучению, облегчает симптомы головной боли, головокружения и тиннитуса (звона в ушах). Согласно данным ряда исследований доза 500 мг в сутки является оптимальной, но возможно и повышение до 2000 мг в сутки.
Пирацетам применяется при лечении дегенеративной неврологической патологии (болезни Альцгеймера, сенильной деменции), вазоспастических нарушений, инсульта и последствий ишемии в виде неврологического дефицита (в том числе диспраксии, дисграфии), аддикций, депрессии и тревоги, а также при закрытой ЧМТ. Обычно назначается в дозах от 4,8 до 9,6 г, разделенных на три приема в течение суток с интервалами 8 ч.
Заключение
Коррекция нарушений памяти и других когнитивных функций является важнейшей составляющей комплексного лечения неврологических заболеваний, ассоциированных со старением мозга, острыми и хроническими сосудистыми нарушениями, поскольку именно эти функции определяют человека как личность и необходимы для вовлечения в дальнейшие процессы реабилитации и социализации. Разные препараты изучались в качестве средств профилактики и терапии когнитивных нарушений. Однако наиболее перспективным представляется применение безопасных естественных метаболитов мозга, таких как цитиколин (прекурсор фосфолипидов) и пирацетам (циклическое производное ГАМК). Комбинация на основе цитиколина и пирацетама является обоснованной с точки зрения фармакологических свойств, биохимической роли и физиологической совместимости ее компонентов. Синергичные эффекты комбинации находят применение при лечении сосудистой и нейродегенеративной патологии – постинсультного неврологического дефицита, сосудистой деменции, болезней Альцгеймера и Паркинсона и при других состояниях, сопровождающихся повреждением и ишемией нервной ткани.
Asian Journal of Biomedical and Pharmaceutical Sciences.
2012; 2 (12): 15-20.
Сокращенный перевод с англ. Дмитрия Молчанова
СТАТТІ ЗА ТЕМОЮ Неврологія
Проблема когнітивних розладів є однією з найважливіших у сучасній клінічній медицині. Це зумовлено не тільки збільшенням частки людей старшого віку серед населення, а й посиленням ролі стресу та інших патогенетичних чинників. У березні відбувся семінар «Академія сімейного лікаря. Біль в грудній клітині. Алгоритм дій сімейного лікаря та перенаправлення до профільного спеціаліста», у якому прийняли участь провідні вітчизняні науковці і фахівці різних галузей. У рамках заходу професор кафедри військової терапії Української військово-медичної академії Міністерства оборони України, кандидат медичних наук Мар’яна Миколаївна Селюк представила доповідь «Війна та когнітивні порушення. Причина чи наслідок? Як вирішити проблему?». Подаємо огляд цієї доповіді у форматі «запитання – відповідь»....
Хоча нестероїдні протизапальні препарати (НПЗП) мають численні серйозні побічні ефекти, вони належать до найчастіше застосовуваних препаратів у всьому світі (McGettigan P., Henry D., 2013). Через часте застосування побічні дії НПЗП становлять значну загрозу для громадського здоров’я. Так, уже декілька декад тому було описано підвищення артеріального тиску та ризик загострень серцевої недостатності на тлі прийому цих препаратів (Staessen J. et al., 1983; Cannon P.J., 1986)....
У лютому відбувся медичний форум Ukraine Neuro Global 2024, організований ГО «Українська асоціація медичної освіти» (м. Київ). Під час заходу обговорювалися найактуальніші проблеми сучасної неврології. У рамках форуму відбувся сателітний симпозіум «Актуальні питання фармакотерапії в неврології». Слово мала в.о. завідувача кафедри неврології Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), доктор медичних наук, професор Марина Анатоліївна Тріщинська з доповіддю «Краніоцервікалгії: особливості діагностики та лікування»....
Запаморочення є поширеним та іноді стійким симптомом після струсу мозку чи легкої черепно-мозкової травми (лЧМТ). Терміном «запаморочення» часто описують декілька симптомів, як-от головокружіння (вертиго; ілюзія руху), порушення рівноваги (нестійкість, нестабільність) і, власне, запаморочення (пресинкопальний стан). Запаморочення після струсу мозку є клінічним викликом, оскільки існує багато причин цього розладу, а його ведення залежить від етіології [1-3]. Однією з таких причин є пошкодження периферичної вестибулярної системи (внутрішнього вуха). У разі травм, отриманих під час війни, лЧМТ часто пов’язана з вибуховою дією, яка може пошкоджувати внутрішнє вухо. Лікарям важливо розуміти вестибулярні наслідки вибухової лЧМТ, оскільки ЧМТ є дуже характерною для сучасних війн [4]....