Взаємозв’язок тяжкості хронічної серцевої недостатності зі станом когнітивних функцій у пацієнтів з фібриляцією передсердь

Вивчення впливу порушень серцевого ритму та провідності на когнітивну функцію має особливе значення у кардіоневрології, оскільки саме ці розлади відіграють суттєву роль у розвитку когнітивного дефіциту. Особливу увагу приділяють ролі фібриляції передсердь (ФП), яку діагностують в 1% дорослого населення [14]. Понад 6 мільйонів європейців страждають від цієї аритмії. За попередніми оцінками, впродовж наступних 50 років поширеність ФП зросте у 2 рази. За своєю медико-соціальною значущістю ФП суттєво випереджає інші види кардіальних аритмій, що пов’язано не лише з її поширеністю, а й із тяжкістю зумовлених нею органних ускладнень, асоційованих зі значними моральними та матеріальними витратами.
Розвиток хронічної серцевої недостатності (ХСН), збільшення ризику раптової серцевої смерті, емболічні церебральні ускладнення, погіршення перебігу післяінсультного періоду, стійка інвалідизація – усе це є наслідком втрати синусового ритму [6]. ФП сприяє п’ятиразовому збільшенню ризику інсульту, і один із п’яти інсультів пов’язаний із цією аритмією. Ішемічні інсульти при ФП часто завершуються летальним наслідком, а пацієнти, що вижили, мають вищий відсоток інвалідизації й частіше страждають від рецидивів, аніж пацієнти з іншими причинами інсульту. Разом із тим сама специфіка хвороби (клінічні прояви, наслідки, характер лікування) визначає її істотний вплив на актуальну життєву ситуацію, інтелект та систему особистісних стосунків хворого [1]. ФП вважають чинником, пов’язаним із когнітивними розладами (КР), що розвиваються як унаслідок перенесеного інсульту, так і не пов’язані з ним [9, 15, 17].
За інших рівних умов пацієнти з ФП гірше виконують нейропсихологічні тести на пам’ять, мислення, зорово-просторові функції, ніж особи з нормальним серцевим ритмом. Більше того, наявність ФП пов’язана з частішим розвитком деменції [3]. КР при ФП можна пояснити зниженням серцевого викиду та мозкової перфузії, а також підвищеним ризиком розвитку тромбоемболії. Показано, що навіть транзиторна зупинка кровообігу внаслідок тяжкого порушення ритму спроможна запустити або прискорити патологічні процеси, пов’язані з розвитком хвороби Альцгеймера, зокрема, сприяти відкладанню амілоїда у гіпокампі [3, 18, 19].
Крім того, існує тісний зв’язок між КР та ХСН. Навіть з урахуванням усіх додаткових чинників (вік, артеріальна гіпертензія (АГ), цереброваскулярні захворювання) результати аналізу за короткою шкалою оцінки психічного статусу (MMSE) у пацієнтів із ХСН були в середньому на 1 бал нижче, ніж у літніх осіб із захворюваннями серця без ХСН [13]. У пацієнтів із найбільш тяжкою ХСН, які потребували пересадки серця, різниця за MMSE досягала 2 балів, тоді як після успішної трансплантації зафіксовано істотний регрес КР [8]. Також встановлено, що в тривалій (9-річній) перспективі ХСН асоційована із 80% підвищенням ризику деменції та хвороби Альцгеймера. Про зв’язок між когнітивною дисфункцією та ХСН свідчить той факт, що серед пацієнтів із КР частіше виявляється ХСН, аніж серед когнітивно збережених осіб [16]. Зниження церебральної перфузії при ХСН може бути опосередковане розвитком ураження білої речовини (лейкоенцефалопатії) або атрофією медіальних відділів скроневих часток, які можуть бути особливо чутливими до гіпоксії та гіпоперфузії. В ході недавнього дослідження показано, що саме атрофія медіальних відділів скроневої частки найкраще корелює із КР, тоді як з лейкоенцефалопатією пов’язані вираженість депресії і тривоги [21]. Важливими чинниками, що сприяють ішемічному пошкодженню мозку у пацієнтів з ХСН, можуть бути зниження цереброваскулярної реактивності, нейрогуморальні порушення, тромбоемболія, надмірне зниження рівня артеріального тиску (АТ) у зв’язку із застосуванням гіпотензивних засобів [10].
Найбільш виражена форма дисфункції головного мозку, що розвивається у пацієнтів із тяжкою ХСН, трактується як кардіальна енцефалопатія і проявляється когнітивною дисфункцією з брадифренією, порушенням уваги та інших регуляторних процесів, апатико-абулічним синдромом. При цьому КР зазвичай виявляють, якщо фракція викиду лівого шлуночка (ЛШ) стає <30% [3, 11]. Механізм розвитку когнітивної дисфункції у таких випадках може бути пов’язаний зі зниженням діастолічного спорожнення серця, що призводить до підвищення тиску у венозній системі. Це, у свою чергу, спричиняє затримку рідини в організмі, переповнення інтракраніальних венозних синусів та яремних вен. Унаслідок цього може спостерігатися порушення абсорбції цереброспінальної рідини та її накопичення у субарахноїдальному просторі, мозкових цистернах (зовнішня гідроцефалія) й іноді в мозкових шлуночках (внутрішня гідроцефалія). У свою чергу, це порушує перфузію головного мозку, чому також сприяє зниження серцевого викиду. Додатковим чинником може бути і гіпоксія, спричинена порушенням кровообігу в малому колі [3].
У ході проведених досліджень виявлено, що судинна деменція у хворих із ХСН здебільшого розвивається за типом амнестичного та псевдопаралітичного недоумства [2]. У першому випадку фіксують виражене послаблення пам’яті на поточні події. При другому типі судинної деменції на тлі монотонно доброзичливого настрою КР проявлялися нерізкими мнестичними порушеннями, пов’язаними з помітним зниженням критичних можливостей. Так, спостерігається тенденція до мінімізації тяжкості проявів ХСН. Особливо високий ризик розвитку КР спостерігається при поєднанні ХСН з АГ, при цьому страждають як загальний стан когнітивної сфери, так і окремі когнітивні функції: пам’ять, увага, регуляторні процеси [20].
Результати нейропсихологічного тестування, дослідження церебрального кровотоку у пацієнтів із ХСН на тлі серцево-судинної патології, зокрема ФП, вважаються суперечливими. Подібні розбіжності зумовлені неоднорідністю груп хворих із ФП і ХСН. Необхідно враховувати вік обстежуваних, освіту, стать, етіологію захворювань, вираженість клінічних проявів, тип дисфункції ЛШ, супутні захворювання, проведену терапію. Дослідження когнітивних функцій у хворих із ФП і ХСН утруднено у зв’язку з браком ефективних методик нейропсихологічного тестування, придатних для зазначених груп пацієнтів. Під час досліджень рідко застосовують системний підхід в оцінці когнітивних функцій у цих категорій пацієнтів [7, 12, 22].
Отже, починати вивчення особливостей порушень когнітивних функцій при ХСН на тлі ФП доцільно у пацієнтів молодого та середнього віку, що не мають супутньої патології, яка спроможна значною мірою вплинути на когнітивні функції та показники мозкового кровотоку. Включення в дослідження пацієнтів із ХСН зі зниженою ФВ ЛШ, у яких величина серцевого викиду (СВ) безпосередньо залежить від останньої, дасть змогу з великою ймовірністю підтвердити або спростувати зв’язок величини СВ із параметрами мозкового кровотоку та вираженістю КР. Застосування низки нейропсихологічних методик, що дадуть змогу провести системну оцінку когнітивних функцій, сприятиме виявленню особливостей КР у пацієнтів із ХСН на тлі ФП, а також дасть змогу виявити закономірності їх змін при збільшенні вираженості серцевої недостатності. Отже, вивчення зв’язку ФП у поєднанні з ХСН із когнітивними порушеннями є актуальним і методично можливим.
Мета дослідження – вивчити взаємозв’язок тяжкості ХСН з КР у пацієнтів з ФП.
Матеріали і методи дослідження
Це дослідження базується на результатах обстеження 107 пацієнтів із персистуючою або пароксизмальною формою ФП, які перебували на стаціонарному лікуванні в клініках кардіології та неврології Військово-медичного клінічного центру Західного регіону Міністерства оборони України (м. Львів).
До основної групи було залучено 71 пацієнта віком від 28 до 65 років (середній вік 59,3±5,7 року) із ФП у поєднанні з ХСН І-III функціонального класу (ФК) за NYHA: 56 (78,9%) чоловіків і 15 (21,1%) жінок. У 46 (65,8%) осіб основної групи було встановлено персистуючу форму ФП, у 25 (35,2%) – пароксизмальну форму ФП. У 13 (18,3%) осіб основної групи був I ФК ХСН, у 31 (43,7%) – II ФК ХСН, у 27 (38%) – ІІІ ФК ХСН. У 18 (66,7%) пацієнтів діагностовано ІІА стадію ХСН, у 9 (33,3%) пацієнтів – ІІБ стадію ХСН. Коронарогенну ХСН мали 43 (60,6%) обстежених, некоронарогенну (внаслідок перенесеного міокардиту або дилатаційної кардіоміопатії) – 28 (39,4%) пацієнтів. Інфаркт міокарда в анамнезі мали 18 (25,4%) хворих. У 43 (60,1%) учасників ХСН в анамнезі була гіпертонічна хвороба (ГХ), в 63 (88,7%) – ішемічна хвороба серця (ІХС).
Контрольну групу становили 36 осіб із персистуючою або пароксизмальною формою ФП без ХСН, які не мали критеріїв виключення, встановлених для хворих на ХСН. У контрольній групі було 25 (69,4%) чоловіків і 11 (30,6%) жінок у віці від 30 до 65 років (середній вік 58,2±6,8 року).
У дослідження не включали хворих, у яких фіксували гострий коронарний синдром та оперативні втручання в умовах загальної анестезії протягом попередніх 6 міс; гемодинамічно значущі вади серця (крім відносної мітральної та трикуспідальної недостатності); цукровий діабет у стадії декомпенсації, ознаки дисфункції щитоподібної залози; гостре порушення мозкового кровообігу, органічні захворювання головного мозку в анамнезі; онкологічні захворювання, які на той час потребували лікування; ниркову недостатність (креатинін крові >250 мкмоль/л); ознаки печінкової недостатності (підвищення аланінамінотрансферази, аспартатамінотрансферази, білірубіну більш ніж у 2,5 раза від верхньої межі норми); алкоголізм і наркоманію в анамнезі; черепно-мозкову травму середнього й тяжкого ступеня в анамнезі; наявність в анамнезі іншого захворювання, яке, на думку дослідника, здатне значною мірою вплинути на когнітивні функції і мозкову гемодинаміку; прийом лікарських препаратів, спроможних вплинути на когнітивні функції, за винятком засобів, що входять до стандартної терапії ХСН.
Вибір критеріїв виключення пояснюється також необхідністю максимально виключити всі можливі захворювання і стани, здатні бути самостійною причиною пошкодження головного мозку. Виключати з цієї причини АГ недоцільно, оскільки АГ, як і ІХС, – одна з найбільш частих причин розвитку ХСН. За даними літературних джерел, поширеність АГ серед населення, що за віком відповідає досліджуваній групі, сягає 62%, а серед хворих на ІХС – 70% [4, 5]. Отже, досліджувані нами групи є – наскільки це можливо – й однорідними, й представницькими.
Окрім загальноклінічного обстеження виконували електрокардіографію, стандартну ехокардіографію, ультразвукове дослідження судин голови та шиї. До групи показників, що характеризують тяжкість ХСН, були зараховані ФВ ЛШ, ФК за NYHA, кінцево-діастолічний і кінцево-систолічний розміри лівого передсердя.
Усі обстежувані пройшли розширене нейропсихологічне тестування з якісною та кількісною оцінкою отриманих результатів. Застосовували коротку шкалу оцінки психічного статусу (КШОПС), батарею лобної дисфункції (БЛД), шкалу деменції Маттіса (ШДМ), тест малювання годинника, тест вербальних асоціацій, бостонський тест називання, запам’ятовування та відтворення 12 слів за методикою Гробера і Бушке, дослідження зорової пам’яті, складного гнозиса (тест «недомальовані предмети»). Для оцінки емоційного статусу пацієнтів використовували опитувальник Бека, шкалу астенічного стану, шкалу для оцінки тривоги Спілбергера [1]. Інтерпретацію результатів тестів проводили за участю психолога.
Статистичну обробку даних здійснювали із використанням програми Statistica 8.0. Для показників, які мають розподіл, що значно відрізняється від нормального, проведено стандартизацію шляхом логарифмування. Порівняння показників нейропсихологічного тестування виконували за допомогою непараметричного критерію Манна-Уітні. Кореляційний аналіз здійснювали за методом Спірмена. Показником статистичної значущості при множинних порівняннях був p<0,01, при простому порівнянні однієї величини в двох групах – p<0,05. Показники, що мають наближено нормальний розподіл, представлені у вигляді середнього арифметичного ± стандартне відхилення.
Результати дослідження та їх обговорення
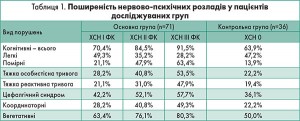
Проведене дослідження продемонструвало, що в обох досліджуваних групах в клінічній картині переважали КР. Достовірно рідше траплялися цефалгічний синдром, розлади координації рухів, тяжка особистісна та реактивна тривога (табл. 1).
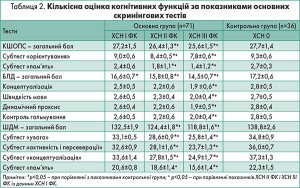
Дані нейропсихологічного дослідження засвідчили, що в пацієнтів із ФП у поєднанні з ХСН ІІІ ФК виявлено більш виражені КР, що проявлялося достовірною (р<0,05) різницею сумарних показників основних нейропсихологічних тестів (КШОПС, БЛД, ШДМ), а також субтестів «пам’ять» і «орієнтування», більшості субтестів БЛД і ШДМ (табл. 2).
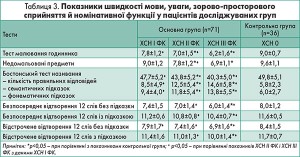
Якісний аналіз нейропсихологічної симптоматики засвідчив, що в основі КР при ФП у поєднанні з ХСН лежать дизрегуляторні механізми й недостатність нейродинамічної складової когнітивної діяльності. Це підтверджується достовірною (р<0,05) різницею від контрольної групи показників уваги, швидкості мови, сумарного бала і показників концептуалізації, динамічного праксиса БЛД, субтесту «концептуалізації» ШДМ.
Наявність КР підтверджувалася достовірною (р<0,05) різницею показників уваги, швидкості мови та пам’яті. Порушення пам’яті при ФП у поєднанні із ХСН характеризувалося головним чином недостатністю вільного відтворення при збереженні відтворення з підказкою.
Порушення пам’яті за результатами тесту «12 слів» спостерігалися у пацієнтів із ХСН І ФК, але значно меншою мірою. У цих пацієнтів семантичні підказки були ефективні, а показник відстроченого відтворення із підказкою достовірно не відрізнявся від контрольних даних. Виражених порушень орієнтування, просторових функцій мови, концептуалізації, номінативної функції мови, а також первинних порушень пам’яті та розладів повсякденної життєвої активності у пацієнтів із ХСН І ФК виявлено не було. Отже, у пацієнтів із ФП у поєднанні з ХСН І ФК спостерігалися порушення нейродинамічної складової когнітивної діяльності, що не досягали за своєю клінічною значущістю виражених КР і не впливали на професійну та соціальну активність.
У пацієнтів із ХСН ІІ-ІІІ ФК порушення пам’яті були більш виражені. Ці учасники відрізнялися від контрольної групи за всіма параметрами тесту Гробера і Бушке, а за показниками відстроченого відтворення (вільного, і що особливо важливо, з підказкою) – і від показників пацієнтів із ХСН І ФК. Також фіксували порушення номінативної функції мови й просторових функцій. Останні найбільш чітко проявлялися під час виконання тесту малювання годинника.
У пацієнтів основної групи частіше спостерігалися симптоми депресії, тривоги й неспецифічний психологічний дистрес; 36,6% учасників цієї групи було складно контролювати свої емоції – вони починали раптово плакати, сміялися без будь-якої причини.
Пацієнти контрольної групи (ХСН 0), у яких були зафіксовані КР, добре усвідомлювали їх: переважна більшість хворих при активному опитуванні повідомляли про погіршення пам’яті та розумової працездатності, скаржилися на головний біль дифузного характеру, запаморочення, поганий сон, дратівливість, зниження пам’яті, періодичне відчуття болю у ділянці серця.
Усупереч сучасним уявленням про часті афективні порушення у пацієнтів із серцево-судинною патологією рівень депресії у хворих основної та контрольної груп був низьким (17,6±1,4 бала і 15,8±1,6 бала відповідно). Проте, як і інші хронічні соматичні хворі, всі пацієнти були високотривожними (особистісна тривожність у пацієнтів основної групи становила 44,8±1,5 бала і 42,3±1,7 бала у хворих контрольної групи). Ситуативна (реактивна) тривога (тобто афективна реакція на події, що відбуваються в даний момент, як-от перебування в стаціонарі, загострення захворювання) була більш виражена в основній групі (47,5±1,5 бала проти 41,2±1,8 бала у контрольній групі; p<0,01), що, швидше за все, може бути відображенням переживань хворих із великими функціональними порушеннями та меншою переносимістю фізичних навантажень. У 45 (63,4%) пацієнтів основної групи виявлено астенію за шкалою астенічного стану.
Зафіксовано достовірне наростання симптомів тривоги у хворих із ХСН у поєднанні з ФП. Встановлено, що ступінь особистісної тривоги зростає у міру підвищення ФК ХСН, а реактивна тривога, залишаючись достовірно вищою у пацієнтів основної групи, серед підгруп із різним ФК ХСН достовірно не відрізнялася.
Сильний і достовірний зв’язок (r=0,87; р<0,05) було встановлено між групою показників, що характеризують ХСН, і результатами когнітивних тестів, причому найбільше значення мали кінцево-систолічний розмір лівого передсердя – з одного боку, і здатність до концентрації уваги – з іншого. За допомогою парного кореляційного аналізу були встановлені негативні зв’язки середньої сили між ФК ХСН і КШОПС і БЛД, позитивні достовірні зв’язки виявили між ФВ ЛШ і тестом малювання годинника та між кінцево-систолічним розміром лівого передсердя і точністю виконання тесту «недомальовані предмети». Отже, чим вищим був ФК ХСН, чим нижчою величина ФВ ЛШ і чим більшими були розміри лівого передсердя, тим гіршими виявилися результати тестів, а тяжкість ХСН у цілому була пов’язана з когнітивними здібностями.
Суттєвого взаємозв’язку між результатами когнітивних тестів і віком, статтю, «стажем» ХСН, наявністю перенесеного інфаркту міокарда у досліджуваних встановлено не було, що, очевидно, зумовлено особливостями відбору хворих: вік не старше 65 років, а також виключення пацієнтів із захворюваннями і станами, здатними самостійно спричинити пошкодження головного мозку. Встановлені взаємозв’язки підтверджують можливість застосування вибраних тестів для оцінки когнітивних функцій головного мозку у хворих із ХСН у поєднанні із персистуючою та пароксизмальною формами ФП.
Висновки
1. Когнітивна дисфункція є найбільш частим неврологічним розладом у пацієнтів із персистуючою або пароксизмальною формою ФП і виявляється у 91,5% хворих із ХСН ІІІ ФК, у 84,5% – із ХСН ІІ ФК, у 70,4% пацієнтів із ХСН І ФК і у 63,9% хворих без ознак ХСН. Когнітивні розлади не досягають ступеня деменції. ФП без ХСН і з ХСН І ФК частіше супроводжується легкими КР (47,2-49,3% випадків), а ХСН ІІ-ІІІ ФК на тлі ФП – помірними КР (47,9-63,4% випадків).
2. У структурі КР переважають зниження концентрації уваги, порушення пам’яті за типом недостатності відтворення й порушення зорово-просторового сприйняття. Результати якісного нейропсихологічного аналізу свідчать про недостатність нейродинаміки як про провідний механізм формування КР, що вказує на патогенетичну роль дисфункції стовбурово-підкіркових структур.
3. КР при персистуючій або пароксизмальній формі ФП супроводжуються емоційно-поведінковими порушеннями, насамперед у вигляді підвищеного рівня тривоги. Збільшення останнього при ХСН на тлі ФП супроводжується одночасним наростанням вираженості КР, що свідчить про наявність причинно-наслідкового зв’язку між когнітивними та емоційно-поведінковими розладами.
4. Серед пацієнтів молодого й середнього віку із ХСН зі зниженою ФВ ЛШ І-III ФК на тлі персистуючої або пароксизмальної форми ФП з метою ранньої діагностики КР слід виконувати розширене нейропсихологічне тестування, що охоплюватиме оцінку уваги, пам’яті, виконавчих функцій, швидкості переробки інформації. Виявлені у пацієнтів із ФП і ХСН когнітивні та афективні розлади можна розглядати як основні мішені додаткового спеціалізованого втручання неврологів та психотерапевтів, спрямованого на індивідуалізацію та підвищення ефективності лікування.
Література
1. Алехин А.Н. Психологические проблемы в аритмологии (на модели фибрилляции предсердий) / А.Н. Алехин, Е.А. Трифонова, Д.С. Лебедев // Вестник аритмологии. – 2011. – № 63. – С. 45-54.
2. Дробижев М.Ю. Когнитивные расстройства в общей медицине / М.Ю. Дробижев, Е.А. Макух, А.И. Дзантиева // Лечащий врач. – 2007. – № 7. – С. 21-23.
3. Левин О.С. Когнитивные нарушения в практике терапевта: заболевания сердечно-сосудистой системы / О.С. Левин // Consilium Medicum. – 2009. – № 11 (2). – С. 55-61.
4. Остроумова О.Д. Влияние Розувастатина на когнитивные функции // О.Д. Остроумова, И.В. Десниццкая // Consilium medicum. – 2007. – № 1 (2). – С. 61-63.
5. Старчина Ю.А. Ранняя диагностика и лечение когнитивных расстройств при артериальной гипертонии: автореф. дис. … канд. мед. наук. – М., 2006. – 16 с.
6. Cуслина З.А. Практическая кардионеврология / З.А. Cуслина, А.В. Фонякин, Л.А. Гераскина, В.В. Машин, Е.С. Трунова, В.В. Машин, М.В. Глебов. – Москва: ИМА-ПРЕСС, 2010. – С. 205-207.
7. Almeida O.P. The mind of a failing heart: a systematic review of the association between congestive heart failure and cognitive functioning / O.P. Almeida, L. Flicker // Intern Med J. – 2001. – Vol. 31 (5). – Р. 290-295.
8. Cacciatore F. Congestive heart failure and cognitive impairment in an older population / F. Cacciatore, P. Abete, N. Ferrara // J. Am. Geriatr. Soc. – 1998. – Vol. 46. – Р. 1343-1348.
9. Elias P.K. Blood pressure-related cognitive decline: does age a make difference? / P.K. Elias, M.F. Elias, M.A. Robbins, M.M. Budge // Hypertension. – 2004. – Vol. 44. – P. 631-636.
10. Georgiadis D. Cerebrovascular reactivity is impaired in patients with cardiac failure / D. Georgiadis, M. Sievert, S. Cencetti // Eur. Heart J. – 2000. – Vol. 21. – Р. 407-413.
11. Gorkin L. Assessment of quality of life as observed from the baseline data of the studies of left ventricular dysfunction (SOLVD) trial quality of life substudy / L. Gorkin, N.K. Norvell, R.S. Rosen // Am. J. Cardiol. – 1993. – Vol. 71. – Р. 1069-1073.
12. Heckman A. Heart failure and cognitive impairment: Challenges and opportunities / A. Heckman, J. Patterson, D. Catherine // Clinical interventions in aging. – 2007. – Vol. 2. – Р. 209-218.
13. Jefferson A. Cardiovascular disease, cognitive decline and dementia. Vascular cognitive impairment in clinical practice / L. Wahlung, T. Erkinjuntti, S. Gauthier // Cambridge, 2009. – Р. 166-177.
14. Kannel W.B. Prevalence, incidence, prognosis and predisposing conditions for atrial fibrillation: population-based estimates / W.B. Kannel, Р.А. Wolf, Е.J. Benjamin // Am. J. Cardiol. – 1998. – Vol. 82 (8A). – P. 2-9.
15. Ott A. Atrial fibrillation and dementia in a population-based study. The Rotterdam Study / А. Ott, М.М. Breteler, М.С. de Bruyne, F. van Harskamp, D.E. Grobbee, А. Hofman // Stroke. – 1997. – Vol. 28 (2). – Р. 316-321.
16. Pullicino P.M. Cognitive Impairment in congestive heart failure / Р.М. Pullicino, J. Hart // Neurology. – 2001. – Vol. 57. – Р. 1945-1946.
17. Sabatini T. Regarding atrial fibrillation and cognitive function in older people / Т. Sabatini, G.B. Frisoni, P. Barbisoni, G. Bellelli, R. Rozzini, M. Trabucchi // J. Am. Geriatr. Soc. – 2000. – Vol. 48. – P. 387-390.
18. Shi J. Hypoperfusion induces overexpression of beta-amyloid precursor protein mRNA in a focal ischemic rodent model / J. Shi, S.H. Yang, L. Stubley // Brain Res. – 2000. – Vol. 853. – Р. 1-4.
19. Sparks D.L. Increased incidence of neurofibrillary tangles (NFT) in non-demented individuals with hypertension / D.L. Sparks, S.W. Scheff, Н. Liu // J. Neurol. Sci. – 1995. – Vol. 131. – Р. 162-169.
20. Trojano L. Cognitive Impairment: a key feature of congestive heart failure in the elderly / L. Trojano, R.A. Incalzi, D. Acaforo // J. Neurol. – 2003. – Vol. 250. – Р. 1456-1463.
21. Vogels R. Neuroimaging and correlates of cognitive function among patients with heart failure / R. Vogels, J. Oosterman, B. Harten // Dement. Geriatr. Cogn. Disord. – 2007. – Vol. 24. – Р. 418-423.
22. Vogels R.L. Profile of cognitive impairment in chronic heart failure / R.L. Vogels, J.M. Oosterman, B. van Harten // Journal of the American geriatrics society. – 2007. – Vol. 11. – Р. 2152-2153.
СТАТТІ ЗА ТЕМОЮ Неврологія
РЕЗОЛЮЦІЯ РАДИ ЕКСПЕРТІВ. 16 грудня 2023 року у м. Києві відбулося засідання дискусійного клубу групи експертів у галузі неврології. Під час зустрічі колеги обмінювалися досвідом, проводили гарячі дискусії щодо ведення важких пацієнтів, нових рекомендацій та спільних пошуків шляхів порятунку. ...
Як відомо, біль у спині ускладнює рух і чинить негативний вплив на якість життя та психічне благополуччя людини. За даними Всесвітньої організації охорони здоров’я (ВООЗ), від болю в нижній частині спини страждають близько 619 млн людей у всьому світі, і за прогнозом, до 2050 року переважно через збільшення чисельності населення та його старіння кількість таких випадків може зрости до 843 млн (WHO, 2020). Попри проведення численних досліджень причини дорсалгій досі лишаються суперечливими, а результат лікування – здебільшого незадовільним....
Полінейропатії – це захворювання всього організму з реалізацією патологічного процесу на рівні периферичної нервової системи як множинного ураження периферичних нервів із порушенням їх функції. Більшість полінейропатій є хронічними станами, що значно порушують якість життя пацієнтів. Це зумовлює актуальність пошуку ефективних підходів до лікування цих захворювань....
Головний біль (ГБ) як один із найчастіших неврологічних розладів є причиною стану, що характеризується порушенням повсякденної життєдіяльності людини. Поширеність цефалгій і значний їх вплив на якість життя свідчать про важливість проблеми діагностування та лікування ГБ. За даними Глобального дослідження тяжкості хвороб, оновленими 2019 р., ГБ посідає третє місце (після інсульту та деменції) серед неврологічних причин за загальним тягарем захворювань (виміряним роками життя з поправкою на інвалідність [DALY]) (WHO, 2014). При цьому лише незначна кількість осіб із ГБ у всьому світі проходять відповідну діагностику та отримують адекватне лікування....