12 березня, 2017
Раціональна антибіотикотерапія гострих респіраторних інфекцій в амбулаторній практиці
Гострі респіраторні інфекції (ГРІ) є одними з найпоширеніших захворювань. Серед причин тимчасової втрати працездатності вони посідають перше місце – навіть у міжепідемічний період на них хворіє 1/6 частина населення світу. В Україні щороку епізоди ГРІ спостерігаються в 10-14 млн осіб, що становить 25-30% загальної та близько 75-90% інфекційної захворюваності. За даними світового фармацевтичного ринку, 2/3 призначень антибактеріальних препаратів (АБП) пов’язані з лікуванням інфекцій дихальних шляхів. З огляду на ризик розвитку побічних реакцій та формування антибактеріальної резистентності мікроорганізмів, раціональність призначення АБП при ГРІ залишається актуальним питанням сучасної медицини.
Найвагомішою причиною появи набутої резистентності є неадекватна антибіотикотерапія (АБТ): призначення не за показаннями; необґрунтований вибір препарату; неправильне дозування; невиправдана тривалість курсу лікування. Безрецептурний продаж АБП у нашій країні також асоціюється з їх надмірним та безвідповідальним застосуванням.
Враховуючи швидкий ріст стійкості мікроорганізмів до АБП, Міжнародне товариство антимікробної хіміотерапії у 2011 р. визначило такі рекомендації для лікарів загальної практики:
- призначати АБП лише за наявності відповідних показань і враховувати, що в разі вірусних інфекцій вони неефективні;
- обирати адекватний АБП;
- враховувати фармакокінетику/фармакодинаміку засобу, призначати найкоротший курс лікування з-поміж можливих;
- сприяти підвищенню комплаєнсу;
- комбінувати АБП тільки в разі необхідності;
- уникати використання АБП низької/сумнівної якості;
- переконувати пацієнтів не застосовувати АБП на власний розсуд;
- дотримуватися практичних рекомендацій, що базуються на даних доказової медицини;
- використовувати можливості мікробіологічної лабораторії;
- зважати на тенденції регіональної антибіотикорезистентності при емпіричному призначенні АБП.
Раціональний підхід лікарів первинної ланки до АБТ при респіраторних інфекціях реалізується використанням різних стратегій лікування АБП:
- відмова від АБП;
- відтермінування використання АБП (застосування антибіотиків дозволяється через певний часовий проміжок, у разі погіршення клінічного стану або за відсутності позитивної динаміки);
- негайне призначення АБП.
Вибір стратегії щодо застосування АБП залежить від оцінки лікарем ризику розвитку ускладнень у разі утримання від АБТ і від очікувань пацієнта щодо призначення АБП. Перевага відкладеного використання порівняно зі стратегією відмови полягає в тому, що воно передбачає призначення антибактеріальних лікарських засобів (виписаний рецепт, розрахована доза та кратність прийому) для незначної кількості пацієнтів, у яких можуть розвинутися ускладнення. Пацієнти, які очікують на призначення АБП, швидше погоджуються з такою стратегією лікування, ніж з повною відмовою від застосування АБП [4]. Згідно з результатами клінічних досліджень, відтерміноване призначення АБП дозволяє знизити частоту їх застосування при зіставному наслідку захворювання та рівню задоволеності пацієнта [16].
Більшість неускладнених ГРІ в дорослих і дітей не потребує призначення АБП, оскільки найчастішим етіологічним чинником цих захворювань є віруси. Показання до проведення АБТ – гострий бактеріальний риносинусит; гострий тонзилофарингіт, викликаний β-гемолітичним стрептококом групи А (БГСА); гострий бронхіт в окремих категоріях пацієнтів; пневмонія.
У структурі бактеріальних збудників позалікарняних респіраторних інфекцій переважають позаклітинні Streptococcus pneumoniae, Haemophilus influenzaе, Moraxella catarrhalis, Staphylococcus spp., Streptococcus spp.; внутрішньоклітинні Mycoplasmа pneumoniae, Chlamydophila pneumoniaе, Legionella pneumophila. Останнім часом обговорюється роль атипових патогенів (M. pneumoniaе, C. pneumoniaе) в етіології не тільки негоспітальної пневмонії, але й інфекцій верхніх дихальних шляхів (ВДШ) та гострого бронхіту [1].
Гострий риносинусит (ГРС) у дорослих визначається як запалення носа та навколоносових пазух і характеризується раптовою появою двох або більше симптомів, один з яких – порушення носового дихання / закладеність носа або виділення з носа (назовні, в носоглотку) ± біль/тиск у ділянці обличчя ± зниження або втрата нюху. Ендоскопічними ознаками риносинуситу є: наявність поліпів носа, слизово-гнійні виділення переважно із середнього носового ходу, набряк слизової оболонки переважно в середньому носовому ході. При ГРС симптоми зберігаються <12 тижнів. Розділяють гострий вірусний риносинусит при тривалості симптомів захворювання <10 днів та гострий поствірусний риносинусит, при якому симптоми посилюються після 5-го дня або зберігаються >10 днів [13].
Основними інфекційними збудниками ГРС є віруси. Збудниками гострого бактеріального риносинуситу (ГБРС) головним чином є S. pneumoniae, H. influenzaе, M. catarrhalis та Staphylococcus aureus.
ГБРС слід запідозрити при наявності не менше трьох з таких ознак:
- виділення з носа (переважно з одного боку) та гнійний секрет у порожнині носа;
- виражена біль у ділянці обличчя (більше з одного боку);
- лихоманка (>38 °C);
- підвищення швидкості осідання еритроцитів та рівня С-реактивного білка);
- «дві хвилі» (посилення симптомів після тимчасового покращення).
АБТ призначається емпірично хворим, які відповідають критеріям для ГБРС, або пацієнтам, у яких спостерігається тяжкий перебіг хвороби.
Препарат першої лінії – амоксицилін/клавуланат. Макроліди як препарати першої лінії розглядаються за підтвердження етіологічної ролі атипової флори у виникненні ГБРС або наявності протипоказань для призначення захищених амінопеніцилінів (алергія на β-лактами або їх нещодавнє застосування).
Препаратами другої лінії є цефалоспорини ІІІ покоління, фторхінолони [5].
Гострий тонзилофарингіт – гостре інфекційне запалення слизової оболонки та лімфатичних структур ротоглотки (мигдалики, лімфоїдні фолікули задньої стінки глотки). Біль у горлі, що супроводжує гострий тонзилофарингіт, є однією з найпоширеніших причин звернення за амбулаторною медичною допомогою. Вибір тактики лікування є відповідальним завданням, оскільки з даною патологією нерідко пов’язане надмірне та необґрунтоване призначення АБТ; разом з тим відмова від АБП у деяких випадках загрожує тяжкими ускладненнями.
Головним бактеріальним збудником гострого тонзилофарингіту є БГСА (Streptococcus pyogenes).
З даним мікроорганізмом пов’язано 5-15% випадків гострих тонзилофарингітів у дорослій популяції та 20-30% – серед дітей [10].
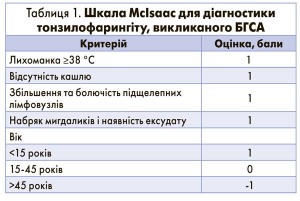 Важливо встановити етіологію (вірусна чи бактеріальна) захворювання. Ключовим інструментом діагностики залишається виділення БГСА в матеріалі з мигдаликів та задньої стінки глотки шляхом бактеріологічного дослідження або використанням експрес-тестів для визначення поверхневого антигена БГСА. За відсутності умов для виконання мікробіологічного дослідження запідозрити наявність БГСА-інфекції й оцінити необхідність призначення АБТ дозволяє використання шкали McIsaac (табл. 1). При кількості балів за цією шкалою від 0 до 1 АБТ не показана, 2 бали – рішення залишається на розсуд лікаря, 3-5 балів – є обов’язковою.
Важливо встановити етіологію (вірусна чи бактеріальна) захворювання. Ключовим інструментом діагностики залишається виділення БГСА в матеріалі з мигдаликів та задньої стінки глотки шляхом бактеріологічного дослідження або використанням експрес-тестів для визначення поверхневого антигена БГСА. За відсутності умов для виконання мікробіологічного дослідження запідозрити наявність БГСА-інфекції й оцінити необхідність призначення АБТ дозволяє використання шкали McIsaac (табл. 1). При кількості балів за цією шкалою від 0 до 1 АБТ не показана, 2 бали – рішення залишається на розсуд лікаря, 3-5 балів – є обов’язковою.
На сьогодні практично єдиним показанням до системної АБТ в імунокомпетентних осіб є тонзилофарингіт, спровокований БГСА. Стартовим препаратом для лікування гострого стрептококового тонзилофарингіту залишається пеніцилін (феноксиметилпеніцилін внутрішньо). Невдачі терапії феноксиметилпеніциліном пов’язані з низькою прихильністю пацієнтів до лікування, продукцією β-лактамаз ко-патогенами, недостатнім проникненням препарату в тканини мигдаликів, внутрішньоклітинною локалізацією збудника. Альтернативним препаратом з меншою кратністю прийому є амоксицилін. При непереносимості β-лактамів доцільно призначати макроліди з вираженою протистрептококовою активністю, здатністю створювати високі тканинні концентрації, хорошою переносимістю.
При рецидивуючому перебігу гострих стрептококових тонзилофарингітів доцільним є призначення захищених амінопеніцилінів, пероральних цефалоспоринів ІІ-ІІІ покоління, 16-членних макролідів або лінкозамідів [2, 10].
Гострий бронхіт – це захворювання, яке розвивається в пацієнта за відсутності хронічного захворювання легень і характеризується кашлем (продуктивним чи непродуктивним), а також іншими скаргами чи симптомами, що вказують на інфекцію нижніх відділів дихальних шляхів – НДШ (відходження мокротиння, задишка, хрипи в легенях, дискомфорт чи біль у грудній клітці) і не мають іншого пояснення (синусит, бронхіальна астма тощо).
Кашель залежно від тривалості розділяють на гострий (до 3 тиж), підгострий (від 3 до 8 тиж) та хронічний
(>8 тиж).
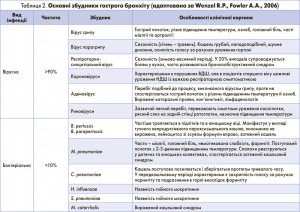 У більшості випадків гострий бронхіт викликається вірусною інфекцією і не потребує застосування АБТ (табл. 2).
У більшості випадків гострий бронхіт викликається вірусною інфекцією і не потребує застосування АБТ (табл. 2).
Бактеріальна флора в етіологічній структурі гострого бронхіту на сьогодні частіше представлена атиповими патогенами (М. pneumoniae, C. pneumoniae), а також B. pertussis, B. parapertussis [1].
Призначення АБП при гострому бронхіті є доцільним у таких клінічних ситуаціях [3]:
- інфікування B. pertussis (контакт із хворим на коклюш, періоди епідемічних спалахів);
- з ймовірним або документованим інфікуванням M. pneumoniae, C. pneumoniae (спалахи в закритих колективах);
- особи похилого віку (>65 років) із супутньою патологією (цукровий діабет, злоякісні новоутворення, хронічна серцева недостатність, неврологічні захворювання);
- пацієнти з тривалістю лихоманки >5 днів, тахікардією >100 уд./хв, задишкою, гнійним мокротинням, локальними вологими хрипами;
- діти дошкільного віку, в яких не досягнуто клінічного покращення упродовж тижня від початку захворювання.
Як АБП першого ряду в даних випадках рекомендовано використовувати макроліди або доксициклін.
Пневмонія – гостре інфекційне захворювання, переважно бактеріальної етіології, яке характеризується
вогнищевим ураженням респіраторних відділів легень та наявністю внутрішньоальвеолярної ексудації. Найбільше практичне значення має поділ пневмонії на негоспітальну (виникає поза стаціонаром або через ≥4 тиж після виписки або діагностована в перші 48 годин від моменту госпіталізації) та госпітальну (нозокоміальну, набуту в лікувальному закладі).
Діагноз негоспітальної пневмонії (НП) встановлюють за наявності у хворого рентгенологічно підтвердженої вогнищевої інфільтрації легеневої тканини та ≥4 з таких клінічних ознак: гострий початок захворювання з підвищенням температури тіла >38 °C; кашель з виділенням мокротиння; фізикальні ознаки (притуплений або тупий перкуторний звук, ослаблене та/або жорстке бронхіальне дихання, фокус дзвінких дрібнопухирцевих хрипів та/або крепітації); лейкоцитоз (<10×109/л) та/або паличкоядерний зсув (>10%). Для встановлення етіології НП виконують бактеріоскопію пофарбованого за методикою Грама мазку мокротиння та його культуральне дослідження, що не є обов’язковим в амбулаторних умовах [6].
Діагностована НП вимагає призначення АБП, ці засоби є основою лікування. АБТ необхідно розпочинати одразу після встановлення діагнозу, особливо в пацієнтів, які потребують госпіталізації. Вибір місця лікування хворого (амбулаторно, у відділенні загального профілю або інтенсивної терапії) повинен визначатисяна підставі індивідуальної оцінки кожного конкретного випадку. Вирішуючи питання про необхідність госпіталізації, важливо не лише оцінювати важкість стану, але й враховувати соціальні фактори [18]. Існує низка клініко-лабораторних шкал (PORT, CURB‑65, CRB‑65), які з врахуванням оцінки прогнозу НП дають рекомендації щодо вибору місця лікування. Найпростішою та доступною для практичного використання є шкала CRB‑65, яка передбачає оцінку таких клінічних параметрів: віку (>65 років); порушень свідомості; частоти дихання (≥30/хв); рівня систолічного (<90 мм рт. ст.) та діастолічного (≤60 мм рт. ст.) артеріального тиску. Враховуючи ймовірність летального наслідку, пацієнтів розподіляють на три групи, які відрізняються за важкістю перебігу захворювання та місцем лікування. В амбулаторних умовах можливе лікування НП легкого перебігу (за відсутності вищевказаних несприятливих прогностичних факторів).
Розподіл пацієнтів із НП на клінічні групи визначає тактику лікування. Виділення груп проводиться з врахуванням наявності супутньої патології (ХОЗЛ, цукровий діабет, застійна серцева недостатність, цереброваскулярні захворювання, дифузні захворювання печінки і нирок з порушенням їх функції, хронічний алкоголізм та ін.), попередньої АБТ (прийом системних антибіотиків упродовж ≥2 послідовних днів за останні 3 міс) та важкості перебігу захворювання.
Для проведення емпіричної АБТ пацієнтам із НП доцільно використовувати антибіотики, які мають: високу
активність щодо основних ймовірних збудників НП; оптимальний профіль безпеки; можливість створювати
високі концентрації в тканинах та біологічних рідинах органів дихання; оптимальне співвідношення вартість/ефективність, зручність у застосуванні, що сприяє дотриманню хворим відповідного режиму лікування.
 В амбулаторних умовах проводять лікування хворих на НП легкого перебігу І та ІІ клінічних груп (табл. 3), пацієнти ІІІ клінічної групи з НП перебігу середньої важкості потребують скерування в терапевтичне (пульмонологічне) відділення, а хворих на НП із важким перебігом IV клінічної групи необхідно госпіталізувати у відділення інтенсивної терапії.
В амбулаторних умовах проводять лікування хворих на НП легкого перебігу І та ІІ клінічних груп (табл. 3), пацієнти ІІІ клінічної групи з НП перебігу середньої важкості потребують скерування в терапевтичне (пульмонологічне) відділення, а хворих на НП із важким перебігом IV клінічної групи необхідно госпіталізувати у відділення інтенсивної терапії.
При підозрі на атипову етіологію захворювання (M. pneumoniaе, С. рneumoniaе) першочерговим є застосування макролідів. Діагностика мікоплазмових та хламідійних пневмоній ґрунтується на виявленні характерних клініко-рентгенологічних даних та підтвердженні за допомогою серологічних реакцій або полімеразної ланцюгової реакції. В етіологічній структурі НП атипові збудники становлять понад 15% [7].
Мікоплазмова пневмонія найчастіше діагностується в дітей (>5 років) та осіб молодого віку (<25 років). Епідеміологічні спалахи характерні для ізольованих груп населення (військовослужбовці, студенти, школярі та ін.), особливо в осінньо-зимовий період. Хламідійна інфекція частіше уражає дорослих, особливо середнього та старшого віку; сезонної закономірності поширення не встановлено. Зазвичай мікоплазмова та хламідійна пневмонії розпочинаються з респіраторного синдрому, який проявляється трахеобронхітом, назофарингітом, ларингітом; супроводжуються субфебрильною температурою тіла, малопродуктивним виснажливим кашлем, мінімальними аускультативними змінами; характеризуються наявністю позалегеневих проявів (шкірних, суглобових, гастроентерологічних, неврологічних та ін.) і нетипових лабораторних показників (відсутність лейкоцитозу і нейтрофільного зсуву в периферичній крові). За допомогою рентгенографії визначаються посилення легеневого рисунку, перибронхіальна або субсегментарна інфільтрація. Для достовірної ідентифікації мікоплазмової та хламідійної пневмоній необхідне проведення серологічних тестів у комплексі з молекулярно-біологічними методами, що вимагає певного часу, є малодоступним і не завжди виправданим. Відсутність клінічного ефекту від стартового призначення β-лактаму при лікуванні НП дозволяє припустити ймовірність атипової етіології захворювання.
Враховуючи спектр антимікробної активності, особливості фармакокінетики, хороший профіль безпеки
макролідів, першочерговими показаннями для їх застосування є підозра на атипову етіологію респіраторної інфекції, непереносимість та неефективність β-лактамних АБП.
За класифікацією макроліди розрізняють залежно від хімічної структури (відповідно до числа атомів вуглецю в макроциклічному лактонному кільці виділяють 14-, 15- і 16-членні макроліди) та походження (природні або напівсинтетичні).
Спіраміцин є природним макролідом, виділеним із Streptomyces ambofaciens. Основу його структури становить лактонне кільце із 16 атомів вуглецю, до якогоприєднано три вуглеводних залишки: форозамін, мікаміноза та мікароза.
Механізм антибактеріальної дії спіраміцину полягає в порушенні синтезу білка в мікробній клітині за рахунок зв’язування з 50S-субодиницею рибосоми. На відміну від 14-членних макролідів (еритроміцин, кларитроміцин) спіраміцин здатний з’єднуватися не з одним, а з трьома доменами 50S-субодиниці, що забезпечує стійкіший зв’язок з рибосомою і тривалий антимікробний ефект [14].
Спіраміцин має широкий спектр дії: є активним щодо грампозитивних коків (Staphylococcus spp., окрім метицилінрезистентних штамів; S. pneumoniae, S. pyogenes, Streptococcus agalactiae, Streptococcus viridans) та паличок (Corynebacterium diphtheriae, Listeria monocytogenes); грамнегативних коків (Neisseria meningitidis, M. catarrhalis) та паличок (B. pertussis, Pasteurella spp., Campylobacter spp., Helicobacter pylori); деяких анаеробів (Propionibacterium acnes, Рерtostreptococcus spp., Peptococcus spp., Bacteroides spp., Prevotella spp., Eubacterium spp., Porphyromonas spp., Clostridium spp., ін.). Особливе значення для клінічної практики має вплив спіраміцину на внутрішньоклітинні патогени – C. psit taci, C. trachomat is, C. pneumoniae, M. pneumoniae, Legionella pneumophila, Ureaplasma urealyticum. Слід відзначити, що спіраміцин проявляє найвищу серед макролідів активність щодо Toxoplasma gondii та Cryptosporidium spp.
Основними механізмами формування резистентності мікроорганізмів до макролідів є модифікація мішені дії (зміна структури бактеріальної рибосоми) та активне виведення АБП з мікробної клітини (ефлюкс). Механізм модифікації мішені зумовлений метилюванням 23S-рибосомальної РНК під дією бактеріальних метилаз – MLSB-тип резистентності. Виникає стійкість бактерій до всіх типів макролідів та лінкозамідів. Спіраміцин та інші 16-членні макроліди мають низький потенціал індукції метилаз, тому при їх застосуванні ймовірність розвитку резистентності, зумовленої цим механізмом, нижча.
Інший механізм резистентності – ефлюкс, зумовлений mef-генами, передусім характерний для стрептококів (БГСА, пневмококів). Суттєво, що виведенню з клітини підлягають тільки 14- і 15-членні макроліди, а 16-членні (зокрема, спіраміцин) зберігають свої ефекти. Таким чином, спіраміцин може проявляти активність щодо грампозитивних коків (стрептококів і пневмококів), стійких до 14- та 15-членних макролідів [8].
Вартий уваги так званий парадокс спіраміцину, феномен невідповідності між помірною мікробіологічною
активністю засобу in vitro та його високою клінічною ефективністю, який зумовлений цілою низкою унікальних особливостей цього АБП [15], а саме:
- здатність створювати високі концентрації у тканинах і зберігати їх на достатньому рівні протягом тривалого часу;
- накопичення у великих кількостях внутрішньоклітинно, що забезпечує бактерицидний ефект щодо внутрішньоклітинних збудників; депонуючись у макрофагах і нейтрофілах, спіраміцин надходить у вогнище запалення; окрім того, він посилює фагоцитарну активність;
- яскраво виражений постантибіотичний ефект (щодо цього спіраміцин має перевагу порівняно з іншими макролідами);
- імуномодулюючий ефект, який полягає в здатності знижувати утворення інтерлейкіну‑2 і стимулювати фагоцитоз.
Перевагою спіраміцину є низький рівень зв’язуванняз білками плазми (15-18%), що дозволяє препарату швидко надходити із судинного русла в тканини. Завдяки високій ліпофільності спіраміцин добре проникає в тканини і середовища [9]. Він здатний накопичуватися в різних відділах респіраторного тракту [11]. Високі концентрації даного препарату (значно вищі за такі в крові) спостерігаються в тканинах ВДШ – мигдаликах, аденоїдах, слизових оболонках придаткових пазух носа, особливо при їх запаленні чи гіперплазії, а також у НДШ – у легеневій тканині (нормальній та ателектазованій), бронхіальному секреті, мокротинні.
Спіраміцин добре проникає в альвеолярні макрофаги і рідину, яка вистилає альвеоли, створюючи високі концентрації.
З підвищенням дози препарату відзначається пропорційне збільшення його внутрішньоклітинних концентрацій. Спіраміцин не підлягає клітинному метаболізму і перебуває в клітинах в активному стані. Описані фармакокінетичні особливості спіраміцину обґрунтовують його високу ефективність при інфекціях дихальних шляхів.
Спіраміцин демонструє високий профіль безпеки.
Даний засіб не володіє прокінетичною активністю, тому значно рідше спричиняє небажані реакції з боку шлунково-кишкового тракту. Ймовірність порушень функції печінки при використанні спіраміцину вкрай низька, оскільки 16-членні макроліди, на відміну від 14-членних, метаболізуються без утворення гепатотоксичних нітрозоалканових сполук [12]. У зв’язку з незначним рівнем метаболізму в печінці спіраміцин не впливає на активність цитохрому Р450, тому ризик лікарських взаємодій, характерний перш за все для 14-членних макролідів, при його використанні мінімальний.
Перевагою спіраміцину є можливість призначення вагітним. В експерименті продемонстровано відсутність у вказаного макроліду тератогенних та ембріотоксичних ефектів. Безпека спіраміцину для плоду підтверджена багаторічним клінічним досвідом його застосування у вагітних з токсоплазмозом.
У клінічній практиці спіраміцин застосовують при лікуванні інфекційних захворювань ВДШ та НДШ, ротової порожнини, шкірних та урогенітальних інфекцій, токсоплазмозу, а також криптоспоридіозу в пацієнтів з імунодефіцитом. Його призначають для профілактики менінгококового менінгіту в осіб, які мали контакт із хворими на менінгіт, та з метою попередження ревматизму в пацієнтів з алергією на β-лактами.
На вітчизняному ринку оригінальний препарат спіраміцину представлений під торговою назвою Роваміцин®. Основною формою випуску є таблетки, вкриті оболонкою, по 1 500 000 і 3 000 000 МО.
Дорослим Роваміцин® п ризначається по 6-9 млн МО 2-3 рази на добу; дітям >6 років – по 1,5-3 млн МО на 10 кг маси тіла на добу на 2-3 прийоми.
При тривалому застосуванні в різних категорій пацієнтів, у тому числі в дітей, вагітних, пацієнтів похилого віку, спіраміцин зарекомендував себе як дієвий та безпечний АБП. Клінічна ефективність і безпека засобу підтверджені численними дослідженнями.
Низка клінічно значущих особливостей препарату Роваміцин®, а саме активність щодо типових та атипових збудників інфекцій дихальних шляхів; низький рівень резистентності; сприятлива фармакокінетика (здатність створювати високі концентрації в тканинах та внутрішньоклітинно, мінімальний ризик лікарських взаємодій); хороший профіль безпеки, дозволяє рекомендувати даний природний макролід для амбулаторного лікування респіраторних інфекцій.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 4 (401), лютий 2017 р.


