26 березня, 2018
Лекарственные повреждения печени

Лекарственные повреждения печени (ЛПП) включают широкий спектр клинико-морфологических нарушений (признаки гепатита, гепатоцеллюлярного некроза, желтуху и другие), возникающих вследствие прогнозируемого или идиосинкразического побочного действия лекарственных средств, а также фитопрепаратов и диетических добавок.
 Парацетамол (ацетаминофен) является наиболее известной потенциальной причиной ЛПП в США [1]. В то же время повреждения печени различной степени тяжести могут вызывать многие фармакологические и фитопрепараты. Сообщения из разных стран мира свидетельствуют о том, что амоксициллина клавуланат является самой распространенной причиной ЛПП [2].
Парацетамол (ацетаминофен) является наиболее известной потенциальной причиной ЛПП в США [1]. В то же время повреждения печени различной степени тяжести могут вызывать многие фармакологические и фитопрепараты. Сообщения из разных стран мира свидетельствуют о том, что амоксициллина клавуланат является самой распространенной причиной ЛПП [2].
Оценка риска развития побочных эффектов является ключевой задачей на этапах доклинических и клинических исследований лекарственных средств. Определение вероятности ЛПП зачастую усложняется вследствие потенциального влияния ряда сопутствующих факторов. Тремя основными направлениями оценки риска являются [3]:
1) причинно-следственная связь – вызывает ли определенный препарат ЛПП?
2) частота ЛПП – у какой доли пациентов отмечаются такие побочные эффекты?
3) тяжесть – клинико-морфологические проявления, варьирующие от транзиторного повышения уровня печеночных трансаминаз до печеночной недостаточности, требующей трансплантации печени.
Эпидемиология ЛПП
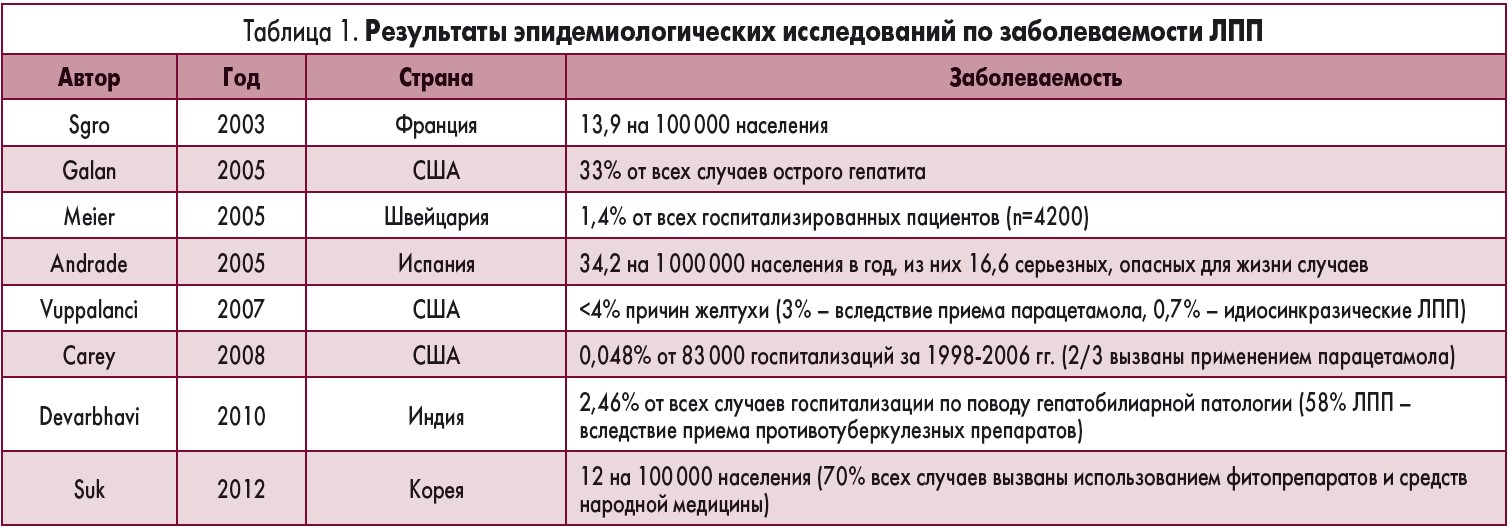
Случаи развития побочных реакций со стороны печени вследствие применения лекарственных средств, фитопрепаратов и диетических добавок тщательно анализируются в разных странах мира. В таблице 1 приведены результаты эпидемиологических исследований, опубликованные в последние годы.
Наиболее фундаментальная система изучения эпидемиологии и прогнозирования ЛПП функционирует в США. Создан многоцентровой проспективный реестр лекарственных повреждений печени – The U.S. Drug Induced Liver Injury Network (DILIN). Выполняется тщательный ретроспективный анализ всех случаев идиосинкразических ЛПП, предположительно связанных с приемом лекарственных средств, фитопрепаратов и диетических добавок [4].
Кроме того, Управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) США создана база информации по известным случаям печеночной токсичности (Liver Toxicity Knowledge Base – LTKB).
Большой объем данных, полученных как в исследованиях in vitro, так и в исследованиях in vivo, позволяет классифицировать 1036 зарегистрированных препаратов с одним действующим веществом на три категории в отношении вероятности ЛПП: высокий риск, низкий риск или отсутствие риска [5].
Представители разных фармакологических групп в качестве причины ЛПП
Распределение долей в структуре причин ЛПП в разных странах мира существенно отличается. Лидирующие позиции занимают те препараты, которые являются наиболее назначаемыми в соответствии с локальными особенностями заболеваемости. В таблице 2 приведены данные, основанные на результатах достаточно масштабных исследований, проведенных в шести странах.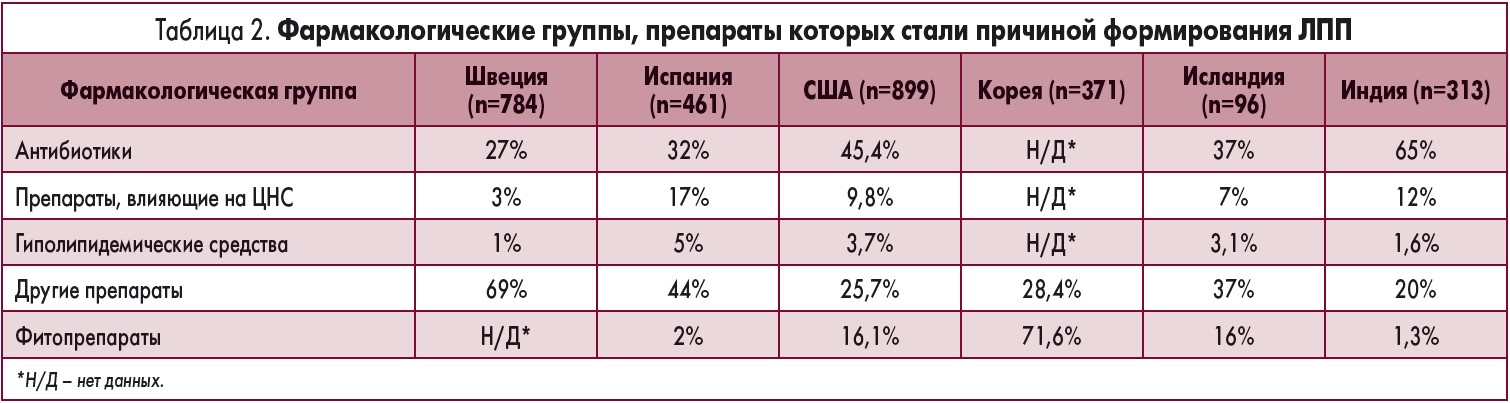
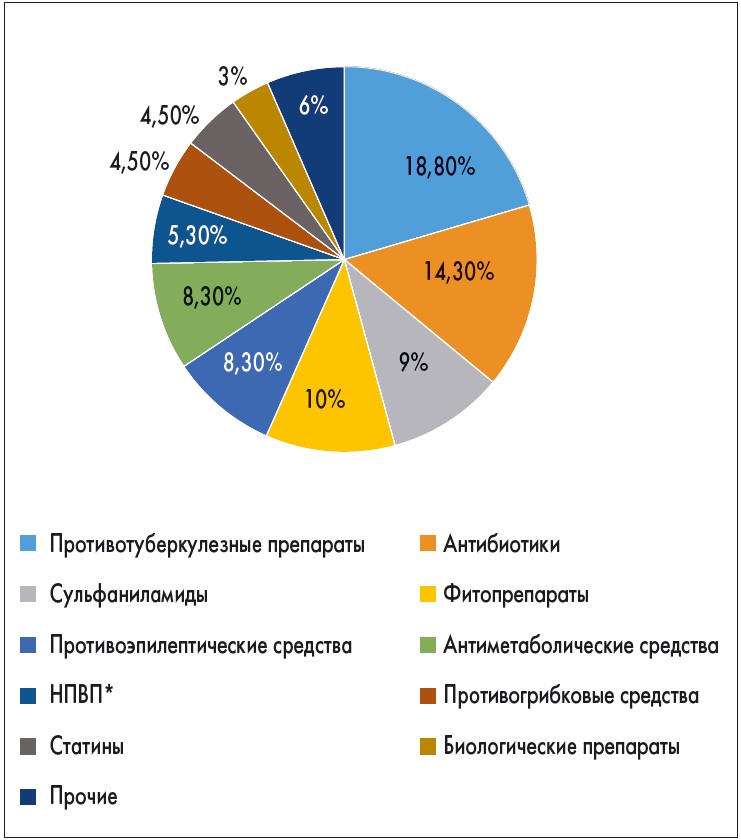
Более подробные данные в отношении структуры причин ЛПП получены в многоцентровом исследовании, включавшем 133 клинических случая в США [6]. Результаты исследования отображены на рисунке 1.
Рис. 1. Частота возникновения ЛПП (n=133) в зависимости от использования препаратов разных фармакологических групп
* Нестероидные противовоспалительные препараты.
В соответствии с данными коллег из США, в структуре причин ЛПП более 1/3 составляет применение противотуберкулезных и антибактериальных препаратов. Обращает внимание существенная доля фитопрепаратов (10%), к назначению которых некоторые специалисты продолжают относиться без должной настороженности. Напротив, прием статинов, психотропных средств и биологических препаратов существенно реже ассоциирован с развитием ЛПП.
ЛПП в структуре побочных реакций на лекарственные средства в Украине
Анализ данных фармакологического надзора в нашей стране за 2016 г. демонстрирует увеличение общего количества сообщений специалистов о случаях побочных реакций вследствие использования вакцин и лекарственных средств. По сравнению с 2015 г. количество таких сообщений увеличилось на 39% – с 18 274 до 25 397 случаев в год [7].
Более 2/3 (68,3%) всех случаев побочных реакций связаны с использованием препаратов семи фармакотерапевтических групп: вакцин (22,1%); антибактериальных препаратов для системного применения (18,5%); противотуберкулезных препаратов (14,5%); противовоспалительных и антиревматических средств (3,9%); противовирусных препаратов для системного применения (3,4%); средств, влияющих на ренин-ангиотензиновую систему (3,3%); кровозаменителей и реперфузионных растворов (2,6%). Остальные группы препаратов обусловливают менее 2% в структуре побочных реакций.
Среди системных проявлений побочных реакций, связанных с использованием лекарственных средств и вакцин, основную долю (70%) составляют изменения кожи и ее придатков (25,6%); общие расстройства (18%); расстройства со стороны желудочно-кишечного тракта (14,9%) и изменения в местах введения препаратов (10,9%).
Расстройства гепатобилиарной системы, которые должны включать ЛПП, составляют только 0,4% от всех случаев побочных реакций. Это достаточно низкий показатель. В то же время аналогичные 0,4% составляет доля ангионевротических отеков.
Результаты анализа сообщений о побочных реакциях, ассоциированных с применением вакцин и лекарственных средств, являются исключительно важными прежде всего для предупреждения аналогичных опасных событий в будущем. Безусловно, следует классифицировать ЛПП по связанным с ними фармакотерапевтическим группам. Кроме того, учитывая статистику зарубежных стран, необходимо включить в перечень объектов фармакологического надзора диетические добавки и фитопрепараты.
Факторы риска развития ЛПП и факторы, влияющие на метаболизм лекарственных средств
Вероятность развития гепатотоксических реакций может зависеть от ряда факторов и повышается при одновременном присутствии нескольких из них. Физиологические особенности организма и наличие острых и хронических сопутствующих заболеваний являются ключевыми детерминантами риска. В таблице 3 приведены основные факторы, повышающие частоту формирования ЛПП при использовании определенных лекарственных средств.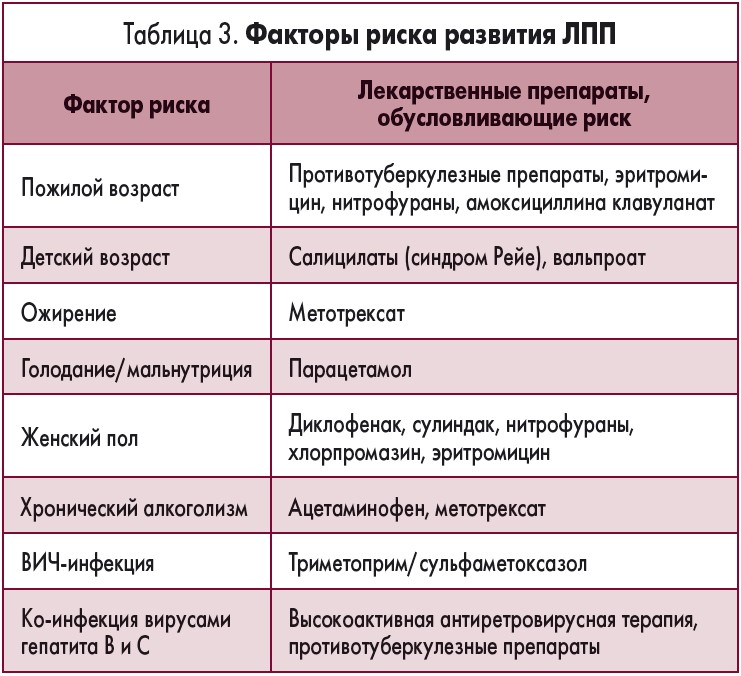
Особенные физиологические состояния (детский возраст, беременность, пожилой возраст), а также метаболические заболевания (кахексия, ожирение, диабет, гипо- и гипертиреоз) могут существенно влиять на метаболизм лекарственных средств, фитопрепаратов и диетических добавок.
В последние десятилетия активно развивается специализированная отрасль генетики – фармакогеномика. Хорошо изучены полиморфизмы генов, кодирующих синтез ферментов системы цитохрома Р450. Установлено, что разные варианты генов CYP2C9/2C19 отвечают за скорость метаболизма таких препаратов, как варфарин и ингибиторы протонной помпы.
В контексте ЛПП большое значение имеет полиморфизм генов, кодирующих глутатион-S-трансферазу, которая отвечает за метаболизм парацетамола (ацетаминофена), и лейкоцитарных генов человека (HLA), кодирующих синтез протеинов системы гистосовместимости и отвечающих за метаболизм ряда антибактериальных препаратов, включая амоксициллина клавуланат.
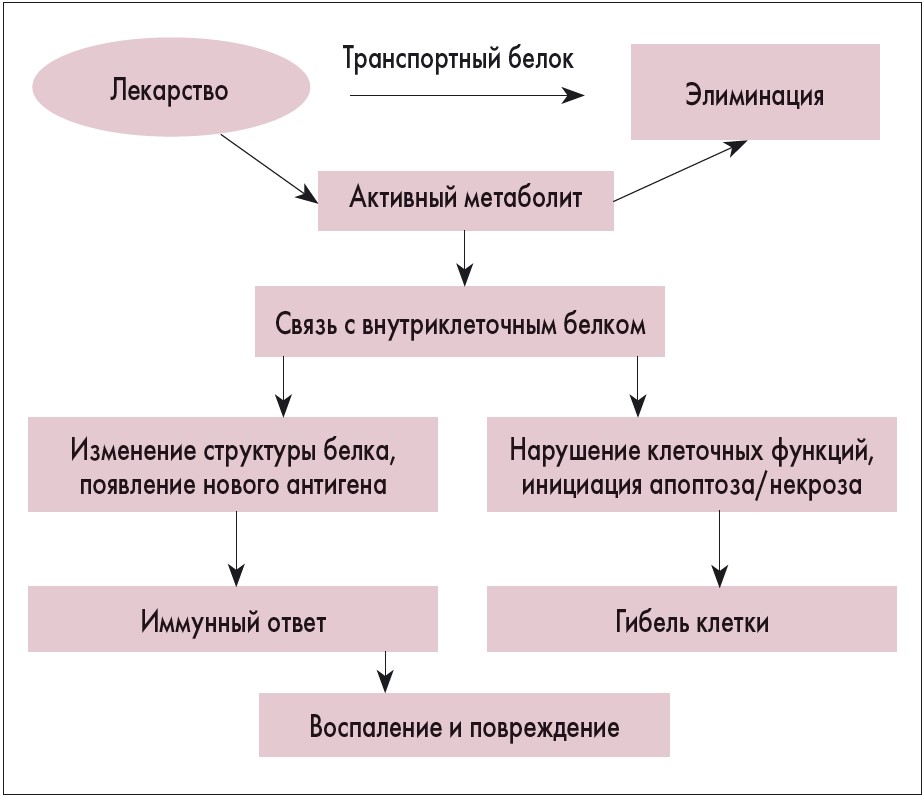
Наличие одного или нескольких указанных факторов, влияющих на метаболизм лекарственных средств, предопределяет запуск механизма ЛПП, основанного на образовании связи активных метаболитов с внутриклеточными белками [8]. Американская ассоциация по изучению болезней печени (AASLD) представила механизм развития ЛПП в виде схемы, приведенной на рисунке 2.
Рис. 2. Механизм ЛПП (AASLD, 2013)
Клинико-биохимические проявления ЛПП
Чаще всего встречаются три клинико-биохимических варианта ЛПП: печеночноклеточное повреждение (цитолиз), холестатическое и смешанное повреждение.
Клиническая картина острого ЛПП может варьировать от бессимптомной гиперферментемии до холестаза с зудом, активного дебюта с желтухой, имитирующей вирусный гепатит, острой печеночной недостаточности [9]. Наиболее частыми симптомами ЛПП являются субфебрилитет, слабость, отсутствие аппетита, тошнота, рвота, боль в правом верхнем квадранте живота, желтуха, ахоличный кал и темный цвет мочи. Пациенты с выраженным холестазом часто жалуются на зуд, и при их осмотре могут отмечаться расчесы. Кроме того, часто определяется гепатомегалия. В тяжелых случаях при развитии печеночной недостаточности могут наблюдаться печеночная энцефалопатия и коагулопатия [10].
Лекарственные средства, ассоциированные с ЛПП, могут вызывать повреждения печени дозозависимым и прогнозируемым способом (например, парацетамол) или непредсказуемо в виде идиосинкразических побочных реакций. Последние могут развиваться с участием иммунных и метаболических механизмов.
Прогнозируемые ЛПП характеризуются следующими особенностями:
– ожидаемое дозозависимое повреждение, включая некроз;
– короткий латентный период (от нескольких часов до нескольких дней);
– достаточно последовательные у разных людей и лабораторных животных;
– уровень трансаминаз повышается от 8 до 500 раз по отношению к верхней границе нормы, щелочной фосфатазы (ЩФ) – повышается в меньшей степени.
Клиническое применение таких препаратов часто запрещается, однако некоторые из них продолжают использоваться, несмотря на известную дозозависимую гепатотоксичность.
Идиосинкразические ЛПП являются непрогнозируемыми, имеют вариабельный латентный период, длительность которого может составлять до 3 мес. Вероятность таких побочных реакций возрастает при использовании высоких доз препаратов и большей длительности фармакотерапии.
Проявления побочных реакций могут иметь определенную специфику в зависимости от использования конкретных лекарственных средств или фармакологических групп. В таблице 4 приведены данные о клинических проявлениях ЛПП, возникающих на фоне приема разных препаратов [11].
Все случаи возникновения патологических изменений в печени, которые ассоциированы с началом приема лекарственных средств, диетических добавок или фитопрепаратов, подлежат диагностической оценке с целью подтверждения/исключения ЛПП. Такая оценка должна включать уточнение:
– длительности приема и воздействия препарата;
– наличия приема других медикаментов и сопутствующих заболеваний;
– ответа на прекращение приема препарата (и его возобновление, если производилось);
– наличия или отсутствия симптомов: сыпи, эозинофилии;
– результатов необходимых тестов для исключения (вирусная серология, визуальные исследования и др.) в соответствии с особенностями повреждения печени и характером изменений биохимических печеночных тестов;
– достаточного времени последующего наблюдения для точного определения клинического исхода – выздоровление или хронический процесс?
ЛПП считается острым, если патологические показатели печеночных тестов определяются в течение менее 3 мес, и хроническим – при длительности клинико-биохимической манифестации свыше 3 мес.
Дифференциация клинических вариантов ЛПП с помощью оценки результатов биохимических печеночных тестов приведена в таблице 5.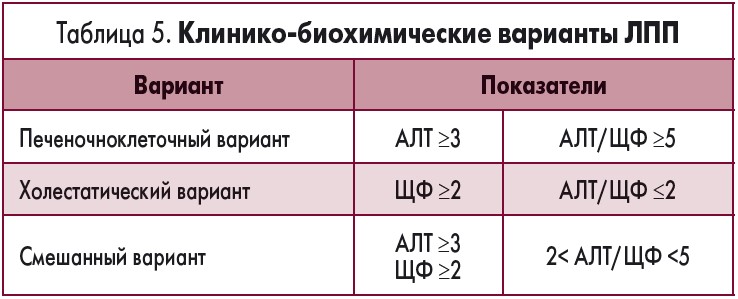
Присутствие желтухи (повышение уровня сывороточного билирубина более чем в 2 раза по отношению к верхней границе нормы) вместе с повышением уровня трансаминаз (более чем в 3 раза по отношению к верхней границе нормы) ассоциировано с менее благоприятным прогнозом [13] и смертностью, достигающей 14% [14, 15].
Диагностика и дифференциальная диагностика ЛПП
Диагностика ЛПП включает тщательный сбор анамнеза (особенно в части лекарственного анамнеза, выяснения приема фитопрепаратов и диетических добавок) и проведение исследований крови для поиска других причин поражения печени.
При наличии холестаза обязательно проводятся визуальные исследования для исключения билиарной обструкции. Если другие причины патологии печени исключены и пациент использовал препараты, которые имеют известную ассоциацию с ЛПП, в проведении биопсии нет необходимости.
Однако если диагноз остается неясным (особенно при наличии острой печеночной недостаточности) или имеются клинические признаки хронической патологии печени, тогда биопсию печени следует выполнить.
Гистологические признаки не являются специфическими для установления причины ЛПП. В то же время особенности морфологической картины могут помочь исключить другие причины поражения печени (например, болезнь Вильсона или гемохроматоз).
Подтверждение причинно-следственной связи между развитием патологии и приемом лекарственного средства является достаточно сложной задачей. При отсутствии специфических биохимических маркеров и патогномоничной биохимической картины выводы могут быть сделаны на основании следующих признаков [10,12]:
– прием препаратов предшествовал появлению признаков заболевания печени (в то же время латентный период может иметь широкую вариабельность);
– исключены заболевания печени, которые могут быть причиной аномальных показателей печеночных тестов;
– прекращение приема лекарств приводит к улучшению показателей;
– при повторной инициации приема препарата быстро развивается значительное поражение печени (подобная провокация не рекомендована);
– в истории применения «подозреваемого» лекарственного средства уже зафиксированы случаи ЛПП.
Прием лекарственных препаратов является одной из многих причин повреждений печени. Дифференциальная диагностика обычно основывается на характере изменений ключевых лабораторных показателей и особенностях гистологической картины в тех случаях, когда выполнялась биопсия печени (табл. 6).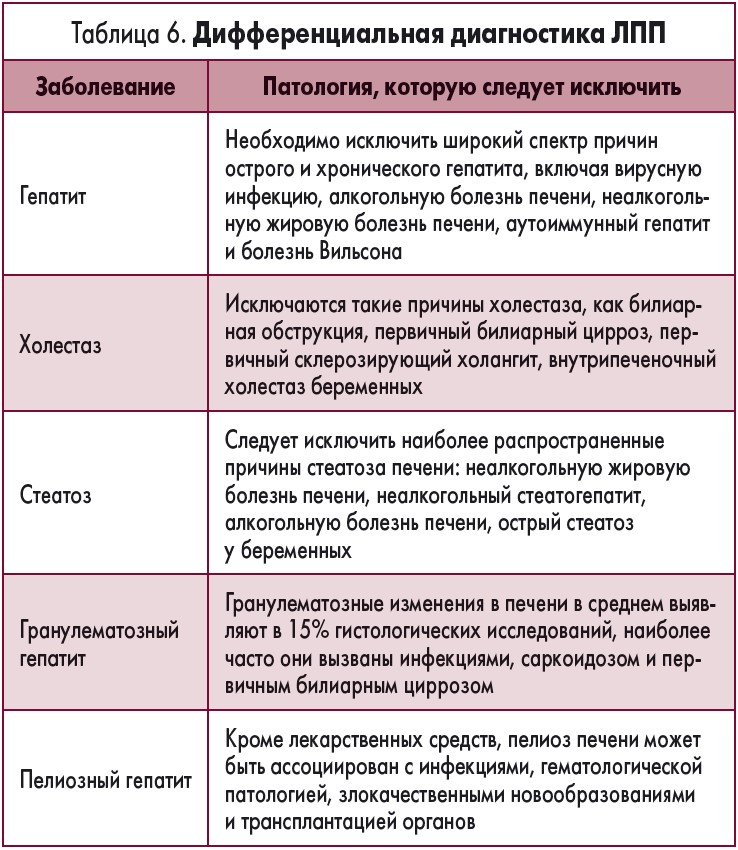
Лечение пациентов с ЛПП
Первым и ключевым лечебным мероприятием при ЛПП является отмена агрессивного лекарственного средства. Раннее распознавание гепатотоксичности фармакологических средств, фитопрепаратов и диетических добавок позволяет предупредить тяжелые клинические случаи и печеночную недостаточность.
Существует несколько вариантов специфической терапии, эффективность которых подтверждена в клинических исследованиях. Например, применение N-ацетилцистеина для лечения ЛПП, вызванных приемом парацетамола, и L-карнитина при превышении терапевтических доз вальпроевой кислоты [16, 17].
Кортикостероиды не имеют доказательств эффективности при ЛПП, за исключением случаев, которые сопровождаются реакциями гиперчувствительности [18]. Использование этих лекарственных препаратов может быть обосновано при прогрессирующем холестазе в случае сопутствующей реакции гиперчувствительности, несмотря на отмену гепатотоксического лекарственного средства.
Для уменьшения выраженности зуда пациентам с холестатическим вариантом ЛПП следует рекомендовать прием секвестрантов желчных кислот (холестирамина).
Для профилактики прогнозируемых ЛПП целесообразно использовать гепатопротекторы. Такая тактика наиболее обоснована у пациентов, у которых возникали случаи ЛПП в анамнезе при приеме препаратов определенных фармакологических групп.
Использование гепатопротекторов при развившихся ЛПП позволяет достичь более ранней нормализации показателей биохимических печеночных тестов и уменьшения выраженности клинических проявлений. Выбор гепатопротектора должен быть обусловлен клинико-биохимическими особенностями в каждом случае.
Эссенциальные фосфолипиды являются приоритетным выбором при печеночноклеточных вариантах ЛПП. Терапевтическая эффективность эссенциальных фосфолипидов обусловлена обеспечением восстановления структуры и функции мембран гепатоцитов. Их применение способствует достижению положительной динамики клинических симптомов и показателей биохимических печеночных тестов (уровни АЛТ, аспартатаминотрансферазы, билирубина).
При выборе эссенциальных фосфолипидов следует обращать внимание на наличие и состав вспомогательных веществ. Последние обеспечивают стабильность препарата, но одновременно некоторые из них (красители, детергенты, ароматизаторы, этиловый спирт и т.д.) могут усугубить течение печеночноклеточного варианта ЛПП. На сегодняшний день в Украине данным требованиям соответствует препарат эссенциальных фосфолипидов Энерлив® производства компании «Берлин-Хеми/А.Менарини». Энерлив® производится в форме мягких бесшовных желатиновых капсул, содержащих 300 мг обогащенных обезжиренных соевых фосфолипидов с максимально высокой степенью очистки и концентрацией фосфатидилхолина 76%. Около 68% остатков жирных кислот составляют линолевая и линоленовая ненасыщенные жирные кислоты. Суточная доза препарата при печеночноклеточных вариантах ЛПП составляет 1800 мг – по 2 капсулы 3 раза в день в течение 3 мес.
Пациенты с ЛПП должны состоять под наблюдением врача и повторно проходить биохимические печеночные тесты до нормализации их результатов.
Консультация гепатолога необходима в случаях, когда существует риск развития печеночной недостаточности или уже выражены ее признаки (печеночная энцефалопатия или коагулопатия), есть признаки хронической патологии печени, а также в ситуациях с неясным диагнозом после первичного обследования.
Профилактика ЛПП включает подробное информирование пациентов, принимающих гепатотоксические препараты (например, парацетамол), относительно правил их безопасного применения, оптимальной дозы и возможных взаимодействий с другими препаратами или алкоголем. Следует ознакомить пациента с возможными признаками развивающегося ЛПП и предупредить о необходимости неотложного обращения за медицинской помощью в таких ситуациях.
Эффективность мониторинга уровня АЛТ для оценки вероятности развития ЛПП при приеме потенциально гепатотоксического препарата остается спорной. Значение небольшой элевации этого показателя остается неясным, и связанная с ним отмена необходимых препаратов может во многих случаях оказаться неоправданной [19]. Обоснованным можно считать мониторинг уровня трансаминаз при приеме лекарственных средств, ассоциированных с высокой частотой тяжелых поражений печени, таких как метотрексат или изониазид.
Выводы
- ЛПП могут быть обусловлены приемом широкого спектра лекарственных средств, фитопрепаратов и диетических добавок.
- ЛПП у существенной части пациентов не имеют клинических проявлений и выявляются только благодаря аномальным результатам биохимических печеночных тестов.
- Неспецифические симптомы (например, тошнота, анорексия, недомогание, усталость, боль в верхнем правом квадранте живота или зуд), появляющиеся после начала приема лекарственного средства, могут быть следствием его гепатотоксичности. Такие случаи подлежат диагностической оценке с целью исключения/подтверждения ЛПП.
- У пациентов с печеночноклеточными повреждениями наблюдается диспропорциональное увеличение содержания трансаминаз по отношению к ЩФ. Холестатический вариант ЛПП имеет прямо противоположные биохимические характеристики (более существенное повышение уровня ЩФ).
- Прогноз ЛПП является менее благоприятным, если повышение уровня трансаминаз или ЩФ сопровождается более чем двукратным повышением содержания билирубина.
- Основой лечения ЛПП является отмена лекарственного средства, которое может быть потенциальной причиной патологических изменений, с последующим мониторингом показателей биохимических печеночных тестов до их нормализации.
- Выздоровление у большинства пациентов наступает после отмены гепатотоксических фармакологических средств, фитопрепаратов и диетических добавок.
Литература
1. Goldberg D.S., Forde K.A., Carbonari D.M. et al. Population-representative incidence of drug-induced acute liver failure based on an analysis of an integrated health care system. Gastroenterology 2015; 148: 1353.
2. Chang C.Y., Schiano T.D. Review article: drug hepatotoxicity. Aliment Pharmacol Ther 2007; 25: 1135.
3. Chen M., Vijay V., Shi Q. et al. FDA-approved drug labeling for the study of drug-induced liver injury. Drug Discov Today. 2011; 16 (15): 697-703.
4. Fontana R.J., Watkins P.B., Bonkovsky H.L., Chalasani N., Davern T., Serrano J. et al. Drug-Induced Liver Injury Network (DILIN) prospective study: rationale, design and conduct. Drug Saf. 2009; 32: 55-68.
5. Chen M., Suzuki A., Thakkar S. et al. DILIrank: the largest reference drug list ranked by the risk for developing drug-induced liver injury in humans. Drug Discov Today. 2016; 21 (4): 648-653.
6. Reuben A., Koch D.G., Lee W.M. et al. Drug-induced acute liver failure: results of a U.S. multicenter, prospective study. Hepatology. 2010; 52: 2065-2076.
7. Основні показники роботи системи фармаконагляду України за 2016 рік. – Режим доступу: dec.gov.ua.
8. Yuan L., Kaplowitz N. Mechanisms of drug-induced liver injury. Clin Liver Dis 2013; 17: 507.
9. De Abajo F.J., Montero D., Madurga M., Garca Rodrguez L.A. Acute and clinically relevant drug-induced liver injury: a population based case-control study. Br J Clin Pharmacol 2004; 58: 71.
10. Davern T.J. Drug-induced liver disease. Clin Liver Dis 2012; 16: 231.
11. Andrade R.J., Lucena M.I., Fernandez M.C., et al. Drug-induced liver injury: an analysis of 461 incidences submitted to the Spanish registry over a 10-year period. Gastroenterology 2005; 129: 512.
12. Navarro V.J., Senior J.R. Drug-related hepatotoxicity. N Engl J Med 2006; 354: 731.
13. Bjrnsson E. Drug-induced liver injury: Hy’s rule revisited. Clin Pharmacol Ther 2006; 79: 521.
14. Bjornsson E.S., Jonasson J.G. Drug-induced cholestasis. Clin Liver Dis 2013; 17: 191.
15. Chalasani N., Bjrnsson E. Risk factors for idiosyncratic drug-induced liver injury. Gastroenterology 2010; 138: 2246.
16. Polson J., Lee W.M. American Association for the Study of Liver Disease. AASLD position paper: the management of acute liver failure. Hepatology 2005; 41: 1179.
17. Bohan T.P., Helton E., McDonald I. et al. Effect of L-carnitine treatment for valproate-induced hepatotoxicity. Neurology 2001; 56: 1405.
18. Giannattasio A., D’Ambrosi M., Volpicelli M., Iorio R. Steroid therapy for a case of severe drug-induced cholestasis. Ann Pharmacother 2006; 40: 1196.
19. Graham D.J., Green L., Senior J.R., Nourjah P. Troglitazone-induced liver failure: a case study. Am J Med 2003; 114: 299.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 1 (47), березень 2018 р.