28 березня, 2016
Обзор Европейского медицинского агентства: брентуксимаб ведотин (Адцетрис) в лечении взрослых пациентов с рецидивирующей или рефрактерной CD30+ лимфомой Ходжкина или системной анапластической крупноклеточной лимфомой

Итоги научной оценки Комитета по лекарственным препаратам
25 октября 2012 года на всей территории Европейского Союза был утвержден по процедуре условного одобрения брентуксимаб ведотин для лечения взрослых пациентов с рецидивирующей или рефрактерной CD30+ лимфомой Ходжкина (ЛХ), а также для лечения взрослых пациентов с рецидивирующей или рефрактерной системной анапластической крупноклеточной лимфомой (АККЛ). Для ЛХ показание к лечению ограничено состоянием после аутологичной трансплантации гемопоэтических стволовых клеток (АТГСК) или по крайней мере двух предыдущих методов лечения в случае, когда проведение АТГСК или полихимиотерапии невозможно. В данном научном обзоре обобщен опыт применения брентуксимаба ведотина, приведший к его утверждению в ЕС.
Брентуксимаб ведотин в качестве монотерапии изучался в двух исследованиях. В исследование SG035-003 были включены 102 пациента с рецидивирующей или рефрактерной ЛХ. Объективный ответ наблюдался у 76 пациентов (75%), из них полная ремиссия – у 34 (33%). В исследование SG035-004 были включены 58 пациентов с рецидивирующей или резистентной АККЛ. Объективный ответ был зафиксирован у 50 пациентов (86%) с достижением полной ремиссии у 34 (59%). Наиболее часто наблюдаемыми видами токсичности были периферическая сенсорная нейропатия, усталость, тошнота, диарея, нейтропения, рвота, гипертермия и инфекции верхних дыхательных путей.
Вступление
Стандартом лечения рецидивирующей или рефрактерной ЛХ является вторая линия химиотерапии с последующим проведением АТГСК, которая может индуцировать длительную ремиссию приблизительно у 50% пациентов. В настоящее время нет консенсуса относительно типа химиотерапии спасения, используемой до трансплантации, а также стратегии лечения для пациентов, у которых трансплантация не может быть проведена. Лечение поздних стадий ЛХ, как правило, осуществлялось с применением режимов полихимиотерапии на основе антрациклина и радиотерапии и позволяло достичь успеха в 60-80% случаев. Общий долгосрочный прогноз для пациентов, у которых развился рецидив после АТГСК, неблагоприятен, медиана выживаемости – в пределах 24 мес. ЛХ делится на два основных подтипа в соответствии с иммуногистологическими особенностями и морфологическими признаками, видимыми под микроскопом. Нодулярный вариант лимфомы Ходжкина с лимфоидным преобладанием (NLPHL) составляет 5% от всех случаев ЛХ и характеризуется, как правило, более мягким течением по сравнению с классическим подтипом ЛХ. Большинство случаев NLPHL CD30-отрицательные. В противоположность этому экспрессия CD30 является стандартной для клеток Рида – Штернберга при классической ЛХ.
АККЛ – агрессивная неходжкинская лимфома из Т-клеток. Она имеет две различные формы – системную и первичную кожную. АККЛ составляет 2-8% от всех Т-клеточных лимфом. CD30 неизменно экспрессируется на поверхности клеток АККЛ. Приблизительно в 50-80% случаев системной АККЛ обнаруживается t(2;5)(p23;q35) хромосомная транслокация, при которой ген киназы анапластической лимфомы (ALK) на хромосоме 2 сливается с геном нуклеофозмина (NPM) на хромосоме 5 (ALK-положительная). ALK-положительные пациенты моложе и имеют лучший прогноз. Несмотря на то что у 75-85% больных удается добиться объективного ответа (полного или частичного) в первой линии полихимиотерапии на основе антрациклина, 5-летняя безрецидивная выживаемость после лечения составляет 60% у ALK-положительных пациентов по сравнению с 36% у ALK-отрицательных. Уровень пятилетней общей выживаемости составляет 70% для пациентов с ALK-положительными и 49% для пациентов с ALK-отрицательными формами АККЛ. Режимы полихимиотерапии ABVD (адриамицин, блеомицин, винбластин и дакарбазин) и MACOP-B (метотрексат, доксорубицин, циклофосфамид, винкристин, преднизолон и блеомицин) продемонстрировали сравнимую эффективность с рецидивом заболевания в течение двух лет приблизительно у половины пациентов. Нет консенсуса в отношении ведения рецидивирующей или рефрактерной форм заболевания. При применении стандартной терапии спасения у 30-40% пациентов может быть достигнута повторная полная ремиссия. Некоторые пациенты могут получить преимущество при проведении высокодозной химиотерапии с последующей АТГСК. Однако клинический эффект достигается только при сохранении чувствительности к химиотерапии.
Рецептор CD30 относится к надсемейству рецепторов фактора некроза опухоли. Он был выявлен на клетках Рида – Штернберга при классической ЛХ (CD30-положительные клетки лимфомы Ходжкина экспрессируют на своей поверхности 5-10 тыс. молекул CD30). Тем не менее он также экспрессируется при ряде неходжкинских лимфом, в том числе при АККЛ и кожной форме Т-клеточной лимфомы, а также при редких видах солидных опухолей, таких как карциномы яичка негерминального происхождения (эмбриональные карциномы). В неопухолевых клетках экспрессия CD30 присутствует на поверхности только активированных лимфоцитов (Т, В и натуральных киллеров) и в незначительной степени на поверхности активированных моноцитов. После связывания с лигандом CD153 рецептор CD30 приобретает способность активировать ядерный фактор kВ, Jun амино-концевую киназу и p38. Кроме того, CD30 экспрессируется в клетках децидуальной оболочки матки при беременности.
Брентуксимаб ведотин (также известный как SGN-35) – коньюгат моноклонального антитела, направленного против CD30, состоящий из химерного моноклонального антитела против CD30, ковалентно связанного посредством линкера с антимитотической молекулой монометила ауристатина Е (ММАЕ). После связывания с поверхностью CD30 конъюгат подвергается эндоцитозу. MMAE становится активной после расщепления линкера между MMAE и антителом в лизосомах. ММАЕ мешает полимеризации тубулина и, следовательно, разрушает образование митотического веретена деления клеток. Задержка последующего митоза в конечном итоге приводит к гибели клетки.
Европейское медицинское агентство разрешило применение брентуксимаба ведотина для лечения взрослых пациентов с рецидивирующей или рефрактерной CD30+ ЛХ после АТГСК или по крайней мере двух предшествующих линий терапии, когда ТГСК или полихимиотерапия не может быть проведена, а также для лечения взрослых пациентов с рецидивирующей или рефрактерной АККЛ. Брентуксимаб ведотин вводится внутривенно в течение 30 минут каждые три недели, рекомендуемая доза препарата составляет 1,8 мг/кг.
Клиническая эффективность
Ключевым в изучении эффективности брентуксимаба ведотина при ЛХ было исследование SG035-003. В этом многоцентровом несравнительном клиническом исследовании оценивалась эффективность и безопасность брентуксимаба ведотина в качестве монотерапии у пациентов с рецидивирующей или рефрактерной ЛХ. Критерии отбора включали рецидивирующую или рефрактерную ЛХ, предшествующую АТГСК, и CD30-положительное заболевание, гистологически подтвержденное результатами центральной лаборатории. Кроме того, исключались пациенты, получавшие ранее брентуксимаб ведотин или перенесшие аллогенную трансплантацию. Больные с застойной сердечной недостаточностью или известным церебральным/менингеальным синдромом также не включались в исследование. Брентуксимаб ведотин вводился в амбулаторных условиях в дозе 1,8 мг/кг внутривенно в первый день каждого 21-дневного цикла. Этот режим дозирования был основан на результатах исследования с эскалацией доз SG035-0001 у пациентов с рецидивными/рефрактерными CD30-положительными гематологическими злокачественными заболеваниями; максимальная переносимая доза составила 1,8 мг/кг каждые три недели. Задержка введения каждой дозы (более трех недель) и снижение дозы до 1,2 мг/кг допускались в связи с токсичностью. Пациенты могли продолжать лечение до прогрессирования заболевания или развития неприемлемой токсичности. Пациенты, которые достигли как минимум стабилизации заболевания, получали от 8 до 16 циклов терапии. Главной конечной точкой в исследовании эффективности была общая частота объективного ответа (ЧОО) в соответствии с Пересмотренными критериями ответа для злокачественных лимфом (Revised Response Criteria for Malignant Lymphoma), определяемыми независимым наблюдательным комитетом.
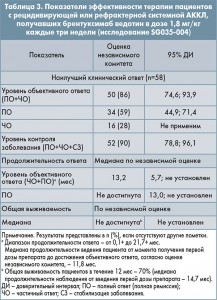
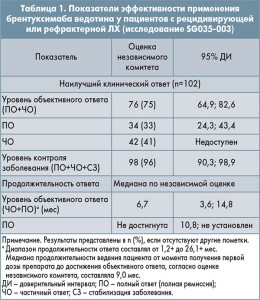
Результаты эффективности терапии рецидивирующей или рефрактерной ЛХ показаны в таблице 1. Компания-заявитель также предоставила результаты интраиндивидуального сравнения выживаемости без прогрессирования (ВБП) на фоне терапии брентуксимабом ведотином с показателями ВБП, достигнутыми на фоне предшествующей терапии. Увеличение ВБП при приеме брентуксимаба ведотина в сравнении с предыдущим режимом химиотерапии наблюдалось у 60 из 102 пациентов (59%).
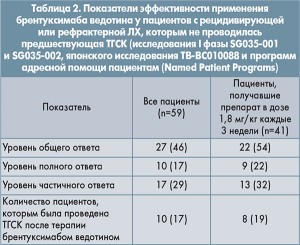
Данные об эффективности брентуксимаба ведотина при ЛХ у пациентов, у которых не проводилась АТГСК, были получены для 59 пациентов из исследований I фазы SG035-001 и SG035-002, японского исследования ТВ-BC010088 и программ адресной помощи пациентам (Named Patient Programs). Наиболее распространенной предшествующей химиотерапией были режимы на основе схем ABVD (66%) и BEACOPP (блеомицин, этопозид, адриамицин, циклофосфамид, онковин, прокарбазин, преднизолон; 10%). Наиболее распространенными режимами второй линии были ESHAP (этопозид, метилпреднизолон, высокие дозы цитарабина и цисплатин; 19%), лучевая терапия (17%) и ICE (ифосфамид, карбоплатин и этопозид; 13,5%). Показатели эффективности терапии у пациентов с ЛХ, которым не проводилась АТГСК, приведены в таблице 2.
Ключевым в изучении эффективности брентуксимаба ведотина при АККЛ стало исследование SG035-004. В ходе этого многоцентрового клинического испытания оценивалась эффективность и безопасность брентуксимаба ведотина в виде монотерапии у пациентов с рецидивирующей или рефрактерной АККЛ. В качестве критериев отбора использовались рецидивирующая или рефрактерная системная АККЛ, предшествующая химиотерапия первой линии с лечебной целью, а также гистологически подтвержденное CD30-положительное заболевание.
Для включения в исследование требовалось определение статуса ALK. В исследование не включались пациенты, ранее перенесшие аллогенную трансплантацию гемопоэтических стволовых клеток. Также не включались в исследование пациенты с текущим диагнозом «первичная кожная АККЛ». Однако пациенты, у которых заболевание претерпело трансформацию из кожной в системную форму АККЛ, могли быть включены в исследование. Показатели эффективности лечения пациентов с рецидивирующей или рефрактерной системной АККЛ представлены в таблице 3.
Данные по безопасности представлены в шести исследованиях с участием 357 пациентов с CD30+ злокачественными заболеваниями крови, которые получили как минимум одну дозу брентуксимаба ведотина. Средняя продолжительность лечения в исследовании SG035-003 составила 27 недель (в диапазоне 3-56), а среднее количество циклов, введенных одному пациенту, – 9 (в диапазоне 1-16). Медиана продолжительности лечения брентуксимабом ведотином в исследовании SG035-004 составила 20 недель (в диапазоне 3-51). В среднем одному пациенту было введено шесть циклов (от 1 до 16); чуть <50% пациентов получили семь или более циклов. Наиболее распространенными побочными реакциями у пациентов, получавших лечение, были периферическая сенсорная нейропатия, усталость, тошнота, диарея, нейтропения, рвота, лихорадка и инфекции верхних дыхательных путей. В исследованиях II фазы у 15% пациентов наблюдались серьезные побочные реакции на препарат, в том числе нейтропения, тромбоцитопения, запор, диарея, рвота, гипертермия, периферическая моторная нейропатия, периферическая сенсорная нейропатия, гипергликемия, демиелинизирующая полинейропатия, синдром лизиса опухоли, а также синдром Стивенса – Джонсона. Серьезными побочными реакциями, которые привели к прекращению лечения у двух или более пациентов с ЛХ или АККЛ, были периферическая сенсорная нейропатия (6%) и периферическая моторная нейропатия (2%). Шесть смертей произошло в исследованиях II фазы в течение 30 дней с момента последнего введения брентуксимаба ведотина. Все зарегистрированные случаи смерти произошли у пациентов с системной АККЛ и рассматриваются как не связанные с лечением.
Средняя продолжительность нейтропении 3-й и 4-й степени обычно ограничивалась одной неделей; 2% пациентов имели нейтропению 4-й степени, которая продолжалась і7 дней. Более половины пациентов, включенных в исследования II фазы, у которых развивалась нейтропения 3-й или 4-й степени, перенесли ассоциированные по времени с нейтропенией инфекции, большинство из которых были 1-й или 2-й степени.
Количество пациентов с инфекциями верхних дыхательных путей, развивавшимися на фоне лечения, было выше среди пациентов с ЛХ (37%) по сравнению с пациентами, страдающими АККЛ (12%). Вполне возможно, что эта разница объясняется нарушениями в клеточно-опосредованном иммунитете, которые развиваются у больных с классической формой ЛХ. Периферическая нейропатия является наиболее распространенным нежелательным явлением, наблюдавшимся у 55% пациентов (у 39% только сенсорная, у 3% только моторная, у 12% – обе формы), что привело к прекращению лечения у 12% и сокращению дозы препарата у 10% пациентов. Периферическая нейропатия обычно была следствием кумулятивного эффекта и в большинстве случаев носила обратимый характер. Частота возникновения и тяжесть нейропатии, ее характер (т. е. доминирование случаев сенсорной нейропатии над моторной, а также дистальной над проксимальной) были подобны тем, которые наблюдаются при терапии другими препаратами – ингибиторами микротрубочек (включая алкалоиды барвинка, таксаны и эпотилоны). При первоначальном утверждении брентуксимаба ведотина было зарегистрировано два подтвержденных и один подозреваемый случай развития прогрессирующей мультифокальной лейкоэнцефалопатии среди 2000 пациентов, получавших лечение во всем мире.
Отсутствует информация относительно безопасности терапии у пациентов детского и пожилого возраста, безопасности у пациентов с почечной, печеночной или сердечной недостаточностью, а также данные относительно долгосрочной безопасности.
Значимыми проблемами безопасности, выявленными с момента первоначального утверждения брентуксимаба ведотина, являются панкреатит, легочная токсичность, токсический эпидермальный некролиз, аномалии функции печени. У больных с почечной и печеночной недостаточностью может нарушаться выведение из организма химиопрепарата, входящего в состав брентуксимаба ведотина.
Оценка соотношения польза/риск
Комитет по лекарственным препаратам для человека (Committee for Medicinal Products for Human Use, CHMP) изначально посчитал, что отсутствие контролируемого исследования является основным недостатком для убедительной демонстрации эффективности лечения. С целью получения рекомендаций по трактовке полученных в представленных исследованиях результатов по эффективности была создана Консультативная научная группа (Scientific Advisory Group, SAG). По сообщению SAG, несмотря на ограниченные данные, наблюдаемая противоопухолевая активность брентуксимаба ведотина признана клинически значимой, так как высокая скорость и продолжительность ответа на лечение были связаны с уменьшением у пациентов B-симптомов (в частности, лихорадки, ночного потоотделения, потери веса). Более того, высокая частота полного ответа и длительность ответа при ЛХ могут обеспечивать клиническое преимущество, позволяя соответствующему количеству пациентов пройти АТГСК. Однако окончательные данные отсутствуют.
Scientific Advisory Group рекомендует дальнейшее изучение уровня и длительности ответа, частоты проведения повторной ТГСК. Результаты оценки отдельных субпопуляций могут предоставить подтверждение с точки зрения эффективности и безопасности у больных с рецидивирующей/резистентной системной АККЛ.
Согласно заключению CHMP, у пациентов с рецидивирующей или резистентной CD30+ ЛХ после АТГСК или у пациентов с рецидивирующей/резистентной формой системной АККЛ брентуксимаб ведотин демонстрирует эффективность в виде значительного увеличения ЧОО и ВБП, несмотря на отсутствие данных контролируемого исследования. Результаты интраиндивидуального сравнения ВБП на фоне терапии брентуксимабом ведотином с показателями ВБП, достигнутыми на фоне предшествующей терапии, свидетельствуют о наличии терапевтического эффекта у большинства включенных в исследование посттрансплантационных пациентов с ЛХ, а также пациентов с системной АККЛ. Что касается пациентов с рецидивирующей/рефрактерной ЛХ, пациентов, у которых АТГСК или полихимиотерапия не были допустимыми вариантами лечения, то противоопухолевая активность брентуксимаба ведотина оценивалась по частоте ответа. Важно отметить, что для всех этих случаев возможность достичь полного ответа на лечение, а также перспектива проведения потенциально лечебной АТГСК имеет огромное значение. Поскольку брентуксимаб ведотин был предложен, в частности, для терапии ранее леченого заболевания, его эффекты были расценены как клинически значимые. Учитывая приемлемый профиль безопасности и общую серьезность прогноза вовлеченных в исследование пациентов, Комитет по лекарственным препаратам заключил, что соотношение пользы и риска при применении брентуксимаба ведотина является положительным. Это утверждение касается лечения как взрослых пациентов с рецидивирующей или рефрактерной CD30+ ЛХ после ТГСК или по меньшей мере двух линий предшествующего лечения в случае, когда проведение ТГСК полихимиотерапии невозможно, так и взрослых пациентов с рецидивирующей или рефрактерной системной АККЛ.
Тем не менее CHMP рассматривает необходимость подтверждения преобладания пользы над риском для указанных популяций пациентов. Ожидаются результаты дальнейших исследований, посвященных этому препарату. Компания-заявитель стремится обеспечить всестороннее его изучение у больных с рецидивирующей/рефрактерной ЛХ после ТГСК и рецидивирующей/рефрактерной системной АККЛ. Кроме того, CHMP отмечает необходимость дальнейшего подтверждения безопасности брентуксимаба ведотина у пациентов с ЛХ и системной АККЛ. В качестве конкретного обязательства компания-заявитель будет проводить пострегистрационное исследование безопасности для предоставления комплексных данных о безопасности. Наконец, будут представлены обновления общих результатов выживаемости из базовых исследований SG035-003, SG035-004. Аналогичный подход был предпринят FDA при утверждении препарата Адцетрис по процедуре ускоренного одобрения.
Адаптировано и переведено по материалам оригинальной статьи.
Список литературы находится в редакции.
Перевод с англ. Катерины Котенко
UA/ADC/0216/0001