18 травня, 2017
Роль гама-аміномасляної кислоти в етіопатогенезі дисфункції гіпоталамуса. Методи корекції та попередження нейромедіаторних порушень
(Огляд літератури та власні дані)
Дисфункція гіпоталамуса (ДГ) – це нейроендокринна патологія, яка раніше описана неврологами під терміном «вегето-судинна дистонія» (ВСД) ще в 1972 році [3, 25]. Основою патогенезу вегетативної дисфункції, чи ВСД, є порушення інтегративної діяльності надсегментарних вегетативних структур (лімбіко-ретикулярного комплексу) з розвитком дезінтеграції вегетативних, емоційних, сенсорно-моторних, ендокринно-вісцеральних співвідношень та порушенням циклу «сон-активність» і, як наслідок, порушенням циркадного ритму гормонів і системи «зворотного зв’язку» гормональної регуляції. Клінічно ДГ, як і ВСД, проявляється неспецифічними симптомами судинної дистонії, тому «нейроциркуляторна дистонія» чи «вегето-судинна дистонія» є основними ознаками гіпоталамічної дисфункції, а не окремими захворюваннями [3, 6, 25, 30]. За даними епідеміологічних досліджень, близько 80% населення страждають різними вегетативними розладами, які клінічно проявляються симптомами вегетативної дисфункції і мають генералізований, переважно системний, характер.
Порушення рівноваги між переднім і заднім відділами гіпоталамуса, з активацією симпато-адреналової системи (САС) і пригніченням синтезу дофаміну (ДА) і гама-аміномасляної кислоти (ГАМК), з порушенням центрів парасимпатичної і симпатичної нервової системи, що регулюють роботу серця, тонус судин, терморегуляцію, психоемоційний стан, когнітивний і емоційний контроль апетиту тощо, саме і призводить до ДГ.
Таким чином, «Дисфункція гіпоталамуса» – це симптомокомплекс ендокринних, вегетативних і метаболічних порушень, які пов’язані з розладом функції гіпоталамуса і є правомірно визнаним діагнозом (код МКХ10: Е 23.3), включаючи різні клінічні форми [1, 3, 6, 11, 14, 25, 26, 27]. Встановлено, що ДГ супроводжується порушенням функції майже усіх ендокринних залоз, змінами рецепторної чутливості тканин до гормонів, порушеннями ліпідного, вуглеводного та білкового обміну і при прогресуванні призводить до формування гіпертонічної хвороби, атеросклерозу, цукрового діабету (ЦД) 2 типу, погіршення статевого здоров’я та проблем репродукції, що, в свою чергу, впливає на якість життя людини, на її працездатність та соціальну адаптованість. Отже, зрозуміло, що своєчасне виявлення, раціональне лікування та попередження розвитку ускладнень ДГ – не тільки важлива медична, але й соціальна проблема.
Взагалі, мозок людини – це жива система, яка іноді починає давати збій в роботі через перевтоми, різні хвороби, вікові процеси і, особливо, стрес.
В сьогоденні сформувалась така соціально-психологічна ситуація, яка на тлі спадкових факторів ризику розвитку хвороб та екопатогенів зумовлює більш високий рівень психоемоційного напруження, що і визначає стан хронічного стресу в організмі. Такий хронічний стрес можна визначити як «гіпоталамічний стрес», оскільки гіпоталамус – це своєрідний «вартовий» центральної нервової системи (ЦНС) і гомеостазу, який запускає роботу стрес-системи з гіпоталамічною дисфункцією у відповідь на дію стресора, що призводить до гормонального дисбалансу з порушенням енергетичного, ліпідного, вуглеводного обміну і нейросудинних порушень та порушень функціонування статевої системи в організмі.
Безпосередню причину ДГ з’ясувати, як правило, не вдається. Пусковим механізмом розвитку патології є спадковий фактор, який під дією екзогенних, або «пускових», факторів призводить до «гіпоталамічного стресу», що і стає основною причиною виникнення гіпоталамічної дисфункції.
До спадкових факторів ризику розвитку ДГ належать особливо ті чинники, що мають аутосомно-домінантний тип спадкової передачі, а саме: гіпертонічна хвороба, ожиріння, ЦД 2 типу, аутоімунні ендокринні синдроми і хвороби. Екзогенними факторами ризику виникнення ДГ є ендогенні депресії або хронічний стрес, який провокується наступними станами: патологічний перебіг вагітності (фетоплацентарна недостатність, токсикози чи гестози I та II половини вагітності), ускладнений перебіг вагітності (гострі та загострення хронічних хвороб під час вагітності, отруєння, інтоксикації тощо), патологічні чи ускладнені пологи (передчасні пологи, слабкість пологової діяльності, кесарів розтин, обвиття пуповиною тощо), родові травми (асфіксія, кефалогематоми), нейроінфекції, хронічний тонзиліт, неендокринні аутоімунні захворювання, черепно-мозкові травми, рецидивуючі тяжкі бронхіти (ХОЗЛ), ендокринні «disruptors» чи хімічні полютанти та психоемоційне напруження.
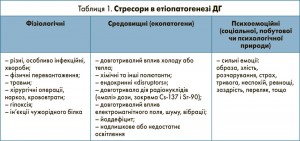
Стресори, що призводять до дистресу, розділяють на три групи (табл. 1), серед яких: дія іонізуючого випромінювання, йододефіцит та різні ендокринні «disruptors» і хімічні полютанти, та відносять до середовищних стресорів – екопатогенів.
Таким чином, хронічний стрес є основною і найважливішою причиною виникнення ДГ. Після довготривалого стресу відбувається виснаження саме ГАМК унаслідок активації ГАМК-трансамінази, що призводить до надмірного збудження та психоемоційного неспокою з порушенням балансу системи «збудження-гальмування». Оскільки основна фізіологічна роль ГАМК – це забезпечення стабільної рівноваги між збуджуючими і гальмувальними системами, нормалізація сну та забезпечення мозку енергією і його стійкість до гіпоксії, а також інших шкідливих впливів, у тому числі і до стресу, то при зниженні рівня ГАМК порушується рівновага збуджуваних і гальмівних нейронів, що призводить до дисонансу нейротрансмісії, порушення балансу нейроендокринної регуляції і, як наслідок, до гіпоталамічної дисфункції. Обмежувати активність стрес-системи і надмірну збудливу реакцію на центральному і периферичному рівні регуляції здатні стрес-лімітуючі системи.
У деяких випадках ДГ відмічається при розвитку пухлинного процесу в мозку (наприклад, краніофарингіома, септо-оптична дисплазія), порушеннях когнітивних реакцій, психічних порушеннях і епілепсії або неповноцінності гіпоталамуса, яка проявляється з підліткового віку [25].
При черепно-мозковій травмі спрацьовує гідродинамічний вплив спинномозкової рідини, яка пошкоджує ядра гіпоталамуса, що виступають в дно ІІІ шлуночка.
Серед інфекційних факторів на перше місце виходить вірус грипу та нейротропні аденовіруси, які, маючи низьку молекулярну масу і дуже малі розміри, легко уражують гіпоталамічні нейрони і блокують синтез ГАМК.
На розвиток ДГ впливають й токсичні агенти, серед яких ключову роль відіграють наркотики і алкоголь, які безпосередньо впливають на функцію аркоподібних ядер, особливо на два дискретних пула нейронів першого порядку, які продукують нейропептид-У (НПУ) і агуті-подібний білок (АПБ), проопіомеланокортин (ПОМК) і кокаїн-амфетамін-регульований транскрипт (КАРТ) та знижують синтез ГАМК. Саме ця група клітин в першу чергу отримує і трансформує інформацію про стан енергетичного балансу організму з контролем маси тіла та викликає порушення ЦНС з вегетативними проявами і з порушенням когнітивних і емоційних реакцій, що призводить до трагічних наслідків [7, 19].
Оскільки гіпоталамус – це складний регуляторний комплекс, який допомагає координувати гомеостаз і взаємодію між гормонами та клітинами-мішенями в звичайних умовах, то саме він відіграє провідну роль в активації і координації усіх змін в організмі у відповідь на стрес і зумовлює адаптивну реакцію на стресори. Довготривала дія стресора призводить до порушення адаптаційних механізмів організму і до розвитку дистресу та, як наслідок, до маніфестації різних захворювань – так названих психосоматичних хвороб.
В сьогоденні «психосоматичним» вважають захворювання за умови наявності чіткого зв’язку: схильність-особистість-ситуація, що стає поштовхом до прояву психосоматичної хвороби, яка потім розвивається відповідно до специфічності патогенезу. До таких хвороб належать: хронічний головний біль (цефалгія напруги); синдром хронічної втоми; захворювання серцево-судинної системи (ішемічна хвороба серця, аритмії, гіпертонічна хвороба); захворювання ендокринної системи (порушення терморегуляції, ЦД, гіперпролактинемія, гіперандрогенія, ожиріння, порушення репродуктивної системи, дифузний нетоксичний зоб, аутоімунний тироїдит – тобто окремі прояви або різні варіанти ДГ); онко-процеси; бронхіальна астма; захворювання шлунково-кишкового тракту (виразкова хвороба шлунка або дванадцятипалої кишки, неспецифічний виразковий коліт, дискінезії, синдром подразнення кишечника); порушення імунної системи (вторинний імунодефіцит, аутоімунна агресія, стрес-генетично детерміноване пригнічення Т-клітинного імунітету); тромбози.
Відомо, що психосоматичне захворювання має спадковий фактор розвитку, який в умовах дії стресора (фізіологічного, екологічного або психоемоційного) на тлі індивідуального типу реагування на нього призводить до порушення адаптаційних механізмів організму і до дистресу з порушенням гомеостазу та з дисонансом нейромедіаторів у відповідь. Індивідуальний тип реагування на стресори насамперед зумовлений станом нейротрансмітерів та інших мозкових структур, що безпосередньо або опосередковано впливають на функціонування гіпоталамуса з розвитком «гіпоталамічного стресу» і в подальшому – гіпоталамічної дисфункції.
Необхідно звернути увагу ще й на такий фактор провокації розвитку ДГ, як дія так названих ендокринних руйнівників («Endocrine-disruptors») [7]. До них належать: пластифікатори, поліхлоровані біфеніли, діоксін, пентахлорфенол та інші; штучні барвники (зокрема, тартазан (Е 102), хінолон (Е 104), сансет (Е 110), понсо 4-Р (Е 124); пестициди; фунгіциди (вінклозолін, просімідон, іпродіон); рослинні естрогени (пиво, продукти сої); фармпрепарати (діетилстільбестрол, глюкокортикоїди); продукти і напої, що містять аспартам, кодеїн, кокаїн, амфетамін або надмірну кількість кофеїну. Дія «Endocrine-disruptors» призводить переважно до зниження або блокування синтезу ГАМК, що призводить до гіпоталамічного дисбалансу і маніфестації ДГ.
Крім вищезазначених факторів, що провокують розвиток ДГ, є генетичні мутації – загалом приблизно 996 генів відповідають за розвиток ожиріння і ДГ.
Ризик виникнення ДГ значно зростає за наявності трьох і більше факторів ризику одночасно.
Найбільш важливими періодами життя, коли взаємозв’язок між нервовою і ендокринною системою проявляється найбільше, є народження, пубертат, вагітність і клімактеричний період. Вважається, що ДГ – це захворювання переважно підліткового (14-16 років) і репродуктивного віку. В пубертатному періоді зазначена патологія відмічається переважно у дівчат, а в молодому репродуктивному періоді – у чоловіків і жінок в рівному співвідношенні. Однак в останні роки побільшало випадків ДГ і в допубертатному періоді [25].
Етіологічні чинники ДГ призводять до порушень рецепторної чутливості до інсуліну і лептину та зниження основних нейромедіаторів ЦНС, перш за все ДА і ГАМК, які безпосередньо через Д1-, Д2-рецептори та два вищезгаданих дискретних пула нейронів аркоподібних ядер, які продукують НПУ і АПБ, та ПОМК і КАРТ, впливають на синтез гіпоталамічних і гіпофізарних гормонів з подальшим порушенням функціонування периферичної ендокринної системи.
Відомо, що гіпоталамус є найважливішим координатором сигналів і взаємозв’язку між нервовою системою та ендокринною. Крім того, гіпоталамус виконує роль своєрідного комутатора з багатьма гормонами, нейромедіаторами і нутрієнтами, греліном, НПУ, β-ендорфіном, сприймаючи нервові імпульси від органів чуття, трансформує їх в гормональну відповідь через нейротрансміттери ДА і серотонін при активній участі ГАМК і, таким чином, регулює енергетичний обмін і гомеостаз. Оскільки гіпоталамус регулює періодичність фізіологічних процесів і реакцій, має центри сну і активності, голоду і насиченості, терморегуляції, формує захисні реакції (гнів, страх) та синтезує рилізінг-гормони (ліберини і статини), які регулюють функцію гіпофіза та периферичних ендокринних залоз, то при ДГ відбувається збій в функціонуванні тієї чи іншої системи, що проявляється у вигляді вегетативного пароксизму (кризу), з порушенням центрів парасимпатичної і симпатичної нервової системи, які регулюють роботу серця, тонус судин, терморегуляцію, психоемоційний стан, когнітивний і емоційний контроль апетиту та інше.
Наявність у гіпоталамусі специфічних рецепторів до гормонів периферичних ендокринних залоз разом з рецепторами до тропних гормонів гіпофізу визначає його особливе положення у системі «зворотного зв’язку». Таким чином, в гіпоталамусі відбувається переключення інформації з нервово-медіаторного на нейрогормональний шлях, котрий формують ліберини і статини.
При ДГ перш за все порушується фізіологічний «зворотній зв’язок» між центральними та периферичними ендокринними залозами, і, як наслідок, концентрація периферичних гормонів, особливо гормонів надниркових залоз (ННЗ), не співпадає зі ступенем активації тропних гормонів гіпофіза.
Розробками в нейроендокринології [3, 4, 5, 8, 10, 11, 12, 14, 15, 16, 19, 22, 24, 27] доведено приналежність нейромедіаторів до нейроендокринної інтегративної дії нейросекреторних нейронів, які регулюють секрецію тропних гормонів гіпофіза. До цих нейромедіаторів належать норадреналін, адреналін, ДА, серотонін, ГАМК, гістамін, ацетилхолін, соматостатин, тироліберин (ТРГ), кортиколіберин (КРГ), соматоліберин та інші. Новий клас сполук цих нейромедіаторів регулює ендокринні функції і взємоз’язок між гіпоталамусом, гіпофізом та периферичними ендокринними залозами.
Систематичний гіпоталамічний стрес запускає в організмі ланцюг порушень – від незначних косметичних змін (наприклад, поява сивини у молодому віці) до формування тяжких і небезпечних хвороб, таких як онкологічні захворювання, які теж відносять до психосоматичних захворювань.
В організмі людини є специфічний білок Р‑53, який здатний пригнічувати ріст пухлин, тобто є своєрідним «вартовим» структури ДНК. Встановлено, що при хронічному стресі значно знижується об’єм протеїна Р‑53, а також кіспептина‑54 (метастин), що стає причиною порушень в геномі і розвитку онко-процесу. Крім того, через бета-аррестин і G-білки при хронічному стресі адреналін проникає в живу клітину і теж порушує структуру ДНК. Унаслідок довготривалого зниження ГАМК на тлі хронічного стресу на розвиток онкологічних процесів впливає і зниження мелатоніну, оскільки мелатонін сприяє зв’язуванню екзогенних канцерогенів і попереджає прогресування канцерогенезу [2].
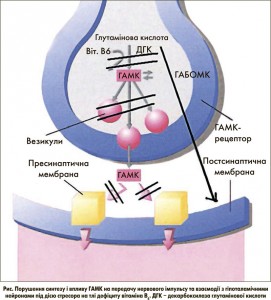
Після довготривалого стресу відбувається зниження синтезу і виснаження саме ГАМК унаслідок активації ГАМК-трансамінази та порушується передача нервового імпульсу в нейронах з підвищенням глутамату (ексайтотоксичної амінокислоти), що призводить до апоптозу клітин і відмирання нейронів та підвищення збудження з порушенням циклу Кребса і погіршенням когнітивних функцій організму (рис.).
На зниження ГАМК, яка саме і сприяє розвитку ДГ, впливають різні фактори і стани, які наведені у таблиці 2.
Зниження активності ГАМК і ДА призводить до підвищення синтезу КРГ, ТРГ і пролактину (Прл) та зниження синтезу гонадоліберинів (ГнРГ) і соматоліберину (СТ-РГ). Таким чином, при зниженні ДА і ГАМК на тлі хронічного стресу, ендогенної депресії чи недосипання відбувається значне підвищення гіпофізарних гормонів: адренокортикотропного гормона (АКТГ), гонадотропінів (ЛГ, ФСГ), тиреотропного гормона (ТТГ) і гормона росту (СТГ) з відповідним підвищенням гормонів периферичних ендокринних залоз, які регулюються цими тропними гормонами гіпофіза, в першу чергу – кортизолу, дегідроепіандростерону сульфату, інсуліноподібного фактора росту‑1 (ІФР1) та тиреоїдних гормонів.
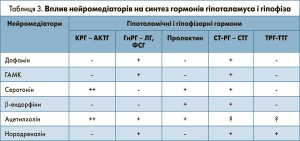
Вплив нейромедіаторів на синтез різних гормонів гіпоталамуса і гіпофіза різний – наведено у таблиці 3.
Отже, при знижені синтезу ГАМК відбувається підвищення КРГ-АКТГ, Прл і ТРГ-ТТГ з порушенням їх взаємозв’язку з секрецією гормонів периферичними ендокринними залозами. Таким чином, концентрація периферичних гормонів, особливо гормонів ННЗ, в першу чергу кортизолу, не співпадає зі ступенем активації тропних гормонів гіпофіза.
Дефіцит ГАМК в нейронах призводить до відчуття тривоги та стану неспокою з посиленням гіпоталамічного стресу і, як наслідок, порушенням гормональної рівноваги.
Патогенетичні аспекти розвитку ДГ включають порушення обміну біологічно-активних речовин, в першу чергу активацію САС і зниження ДА, ГАМК, опіатів, що призводить до гіперпродукції Прл і КРГ, з подальшим підвищенням синтезу і секреції так званих гормонів руйнівної дії: кортизолу, надниркових андрогенів, Прл, ТТГ, СТГ і, відповідно, ІФР‑1 з порушенням їх циркадного ритму.
На тлі гіперсекреції цих гормонів відбувається гіперплазія і гіперфункція окремих органів і систем та деструктивні зміни на клітинному, тканинному і органному рівні, що призводить до порушення рецепторів та рецепторної чутливості як до гормонів, так і до біологічно-активних речовин, нейроамінів та нутрієнтів, з ушкодженням тканин, що оточують рецептори, та з подальшим формуванням больового синдрому.
На тлі хронічного стресу і зниження синтезу ГАМК порушується основна фізіологічна роль ГАМК – формування стійкої рівноваги між збуджуваними і гальмівними системами. Таким чином, при дефіциті або блокуванні синтезу ГАМК знижується продуктивність мислення і пам’ять, відмічається порушення когнітивних функцій, підвищується тривожність і дратівливість, з’являється агресивність, знижується стійкість до гіпоксії, дії стресорів та витривалість організму, порушується цикл сну і, як наслідок, циркадний ритм гормонів. ГАМК по праву називають природним «заспокійливим агентом» мозку.
У відповідь на хронічний стрес розвивається загальний адаптаційний синдром або ДГ, який має три стадії динаміки (табл. 4). У будь-якій стадії розвитку ДГ відмічається зниження синтезу ГАМК чи повне її виснаження, що призводить до порушення психоемоційного стану та порушення синтезу гіпоталамічних гормонів та порушення реакції стрес-лімітуючих систем з розвитком психосоматичних хвороб, у тому числі і онко-процесів та порушення репродуктивної системи (табл. 4).
Таким чином, на усіх трьох стадіях розвитку дистресу при ДГ відмічається пригнічення синтезу ГАМК, що призводить до дисбалансу нейротрансмітерної регуляції синтезу гормонів у гіпоталамусі та до порушення системи «зворотного зв’язку» між гіпоталамічно-гіпофізарними і периферичними гормонами та між центральними та периферичними ендокринними залозами і клітинами-мішенями з порушенням рецепторної чутливості клітин-мішеней до гормонів, що призводить до розвитку такого патологічного процесу, як інсулінорезистентність (ІР) з розвитком ожиріння і ЦД 2 типу.
Центральний контроль енергетичного обміну відбувається з участю ефекторних систем головного мозку при участі нейромедіаторів, зокрема ГАМК, нейропептидів, моноамінів, ендоканабіоїдів та інших біогенних амінів. Периферична регуляція енергетичного обміну і гомеостазу регулюється сигналами від гормонів, які контролюють об’єм жирових депо (лептин, інсулін), гормонів шлунково-кишкового тракту (глюкагоноподібний пептид‑1, грелін та інші) та нутрієнтів (глюкоза, вільні жирні кислоти та інші) [22, 24, 25, 27]. ЦНС отримує інформацію про енергетичний обмін від периферичних органів через ендокринні і невральні сигнали, на основі яких формуються адекватні реакції, направлені на довготривалий контроль і підтримку маси тіла, та короткотривалий контроль гомеостазу. В реалізації цього контролю першочергово бере участь гіпоталамус і ствол мозку, які тісно взаємодіють з кортико-лімбічними структурами і, таким чином, забезпечують когнітивний мотиваційний і емоційний контроль харчової поведінки [11, 12, 16, 17, 22, 24, 25, 27].
До складу гіпоталамуса входять 32 пари ядер. Аркоподібні ядра гіпоталамуса грають пріоритетну роль в інтеграції сигналів, що забезпечують енергетичний гомеостаз і масу тіла. Нейрони, що містять НПУ і АПБ, стимулюють прийом їди, тобто чинять анаболічний вплив, в той час як інший пул клітин, з ПОМК і КАРТ, – притамовує апетит і процеси вживання їжі, тобто має катаболічний ефект. Обидві групи нейронів пов’язані з паравентрикулярними і вентромедіальними ядрами та дорсомедіальною, латеральною і перифорнікальною ділянкою гіпоталамуса, де містяться нейрони другого порядку, які також беруть участь у регуляції харчування і витрачання енергії. ПОМК- і АПБ-нейрони аркоподібних ядер безпосередньо чи опосередковано взаємодіють з багатьма гормонами, нейромедіаторами і нутрієнтами, що беруть участь в енергетичному обміні, зокрема з лептином, інсуліном, глюкозою, греліном, НПУ, β-ендорфіном, ДА, ГАМК, серотоніном, орексинами, ендогенними канабіоїдами тощо. В свою чергу, інсулін і лептин інгібують активність нейронів, які містять НПУ/АПБ і стимулюють ПОМК/КАРТ-продукуючі нейрони, що призводить до пригнічення апетиту і зниження маси тіла. На противагу цьому, грелін підвищує апетит за рахунок блокади ПОМК/КАРТ-нейронів і активації НПУ/АПБ-нейронів.
Отже, гіпоталамус виконує роль своєрідного комутатора з багатьма гормонами (лептином, інсуліном, пролактином, прогестероном, андрогенами, естрогенами, ІФР‑1), нейромедіаторами і нутрієнтами (глюкозою), греліном, НПУ, β-ендорфіном, сприймаючи нервові імпульси від органів чуття, трансформує їх в гормональну відповідь через нейротрансмітери ДА і серотонін при активній участі ГАМК і, таким чином, регулює енергетичний обмін і гомеостаз [19].
Враховуючи порушення дофамінергічної регуляції зі зниженням рівня ДА і ГАМК, провідна роль в патогенетичних аспектах розвитку ДГ з його клінічними проявами відводиться Прл як основному стресовому гормону і орексигену, зважаючи на його участь здебільшого в адіпогенезі та вплив на репродуктивну систему і фертильність.
Відомо, що секреція Прл у людини відбувається не тільки в гіпофізі, а й в інших органах і тканинах, включаючи адіпоцити, переважно у підшкірних і вісцеральних адіпоцитах. Прл впливає на диференціювання не тільки білих, але й бурих адіпоцитів, блокує секрецію адіпонектину, подавляє продукцію інтерлейкіну‑6, підсилює продукцію лептину і сприяє лептинорезистентності.
Пролактин – це класичний орексигенний гормон. Його рецептори знаходяться в декількох зонах ЦНС, що асоціюються з регуляцією апетиту, включаючи аркоподібні, вентромедіальні, паравентрикулярні і дорсомедіальні ядра гіпоталамуса.
Встановлено, що Прл негативно впливає не тільки на секрецію гонадотропінів з порушенням їх циркадного ритму, але й на інші гормони репродуктивної системи, з підвищенням продукції прогестерону і порушенням естроген-прогестинового балансу, а також проявляє метаболічні ефекти, що призводять до підвищення маси тіла та ожиріння. Метаболічні ефекти гіперпролактинемії, навіть транзиторної, в подальшому трансформуються в розвиток атеросклерозу, ожиріння і ЦД. Метаболічні ефекти гіперпролактинемії посилюються за наявності ІР на тлі гіперкортизолемії, дефіциту вітаміну D, гіперандрогенемії, підвищення СТГ і ІФР‑1.
Період маніфестації ДГ у ранньому пубертаті зумовлений активацією тропних функцій гіпофіза під впливом зниження концентрації ГАМК і ДА та підвищення активності серотоніну в клітинах мозку з активацією САС.
Значну роль у патогенезі ДГ відіграє гормон жирової тканини лептин, який відповідає за посилення відчуття насиченості. Концентрація лептину у крові хворих на ДГ в багато разів перевищує фізіологічні показники, особливо за абдомінального типу ожиріння. На цьому тлі формується лептинорезистентність, яку посилюють гіперпролактинемія і надлишок кортизолу і андрогенів ННЗ [4, 5, 12, 15, 16, 22, 27, 28].
На тлі зниження синтезу ДА, ГАМК і мелатоніну, з порушенням функції дофамінових рецепторів (Д‑1 і Д‑2) і підвищенням активності САС та, як наслідок, з підвищенням секреції кортизолу, андрогенів-ННЗ, СТГ, ІФР‑1, виникає ІР, що призводить до підвищення секреції імунореактивного інсуліну і С-пептиду. Клінічно це проявляється підвищенням апетиту, розвитком ожиріння і стеатогепатозу. В свою чергу, рівень гіперінсулінемії та ІР безпосередньо залежить від ступеня ожиріння і значно зростає при абдомінальному його типі. З розвитком ІР та гіперінсулінемії виникають порушення вуглеводного обміну.
ДГ має поліморфну клінічну картину і залежить від специфіки етіопатогенезу та вираженості гормональних порушень. Проблема і складність діагностики ДГ полягає в тому, що симптоми хвороби неспецифічні, проявляються як симптоми ВСД або НЦД з порушенням психоемоційного стану залежно від вираженості дефіциту ГАМК.
Сучасні технології лікування ДГ зважають на світовий досвід виявлених етіопатогенетичних особливостей патології з урахуванням перш за все змін балансу нейромедіаторів і, відповідно, гормонального балансу організму та особливості клінічних проявів цих змін. Однак необхідно зауважити, що рандомізовані дослідження ефективності такої терапії не проводились.
Лікування ДГ – комплексне, з проведенням базової терапії для будь-якого клінічного варіанту хвороб, та з лікуванням ожиріння чи надлишкової маси тіла залежно від етіопатогенетичних аспектів їх розвитку, а також додаткова корекція метаболічних і гормональних порушень в організмі.
Принципи лікування ДГ у дітей та підлітків:
1. Нормалізація режиму дня: праці та відпочинку.
2. Санація вогнищ хронічної інфекції; лікування хронічних аутоімунних захворювань неендокринного генезу.
3. Базова терапія:
– дегідратаційна терапія;
– препарати, що нормалізують синтез дофаміну і ГАМК (оскільки основним патогенетичним порушенням при ДГ є дефіцит ГАМК різного ґенезу): вітаміни В1 і В6, препарати магнію, препарати ГАМК і гама-аміно-бета-оксимасляної кислоти (ГАБОМК, наприклад, комплексний препарат Гамалате В6); адеметіонін; фолієва кислота.
– цереброваскулярна (з відновленням активності нейротрансмітерів, зокрема ГАМК і ДА) – препарати ГАМК і ГАБОМК, цитіколіна, мельдонія;
– антиоксидантна (в першу чергу – жиророзчинні вітаміни D і А);
– гепатотропна (сірковмісні амінокислоти).
4. Лікування ожиріння:
а) нормалізація якості та режиму харчування; б) гіпокалорійна дієта (корекція вмісту жирів); в) дозовані фізичні навантаження (50-60 хв на добу); г) етіопатогенетичні препарати: при інсулінорезистентності – бігуаніди (метформіну гідрохлорид); агоністи дофамінових рецепторів (у мінімальних дозах, курсами); рослинні і натуральні комбіновані препарати, які поновлюють «зворотній зв’язок» між гіпоталамусом і ННЗ, з ліквідацією ІР і нормалізацією ліпідного обміну; при лептинорезистентності – препарати альфа-ліпоєвої кислоти; жиророзчинні вітаміни D і А; д) для нормалізації екскреції мелатоніну та синтезу і секреції ЛГ, ФСГ: препарати ГАМК (з метою відновлення порушеного фолатного циклу та синтезу нейромедіаторів), метіонін або таурін; фолієва кислота (в максимальних дозах); препарати сульфату цинку; агоністи дофамінових рецепторів (у малих дозах, курсами).
Для нормалізації синтезу і функції нейротрасмітерів (ДА, ГАМК, серотонін, ацетилхолін тощо) та мелатоніну в якості базової патогенетичної терапії показані препарати ГАМК та вітаміни В1 і В6 (наприклад, Гамалате-В6), а також жиророзчинні вітаміни D і А – з метою поновити і нормалізувати «зворотній зв’язок» між ЦНС, гіпоталамо-гіпофізарною системою і периферичними ендокринними залозами. Крім того, встановлено, що застосування ГАМК відіграє провідну роль в попереджені і, можливо, зворотному розвитку ЦД, оскільки регенерує інсулін-продукуючі β-клітини підшлункової залози, зупиняє їх апоптоз та діє на імунну систему, зменшуючи аутоімунну агресію та блокує антитіла до GAD.
Препарат Гамалате В6 – це стрес-лімітуючий комплекс з унікальною комбінацією чотирьох природних метаболітів мозку, які регулюють процеси збудження і знімають стрес, тобто діють на етіопатогенез ДГ. Активні компоненти Гамалате В6: ГАМК, ГАБОМК, глутамат магнію гідробромід (ГМГ) і піридоксин (вітамін В6). Фармакологічна дія компонентів є патогенетичною при ДГ, а саме: ГАМК – швидко ліквідує дефіцит ендогенної ГАМК, поновлює її дію на гіпоталамічні рецептори та на синтез мелатоніну; ГАБОМК – має протисудомну дію та поповнює запаси ендогенної ГАМК; ГМГ – є антагоністом рецепторів до глутамату – блокує глутаматні рецептори і, таким чином, швидко знімає збудження і тривогу (клінічно доведено його ефективність при порушеннях сну, нейровегетативних порушеннях і гіпоталамічній дисфункції, зниженні концентрації уваги, при неспокої та нервозності); вітамін В6 – каталізатор метаболізму ГАМК в ЦНС з глютамінової кислоти в необхідних для організму кількостях, що, таким чином, поповнює дефіцит ГАМК за індивідуальними потребами організму без надлишку ГАМК при довготривалому застосуванні препарату і не викликає гіперседацію. Отже, Гамалате В6 є фактором синтезу ендогенної ГАМК та інших нейромедіаторів, зокрема ДА і серотоніну; бере участь в метаболізмі нейротрансмітерів ЦНС і збільшує енергетичний потенціал нервових клітин, що підвищує інтелектуальні здібності людини; нормалізує синтез Прл, кортиколіберину і АКТГ. Таким чином, Гамалате В6 надає можливість протистояти стресу, зняти тривогу і психоемоційне збудження, нормалізувати сон і відновити циркадний ритм гормонів, зупинити розвиток ДГ і її ускладнень, нормалізувати функцію репродуктивної системи, зменшити апоптоз клітин та регенерувати інсулін-продукуючі β-клітини підшлункової залози [26].
За наявності церебро-васкулярної патології та лікворно-венозної дисциркуляції призначають препарати, які покращують церебральний кровообіг і метаболічні процеси, – першочергово це теж препарати ГАМК (наприклад, Гамалате-В6), препарати магнію, калію, мельдонію, вітаміни D і А, цитіколін.
Критерії ефективності лікування: регресія клінічних проявів ДГ або їх відсутність; нормалізація антропометричних показників, особливо показників маси тіла; відсутність рецидиву проявів хвороби і збільшення маси тіла; позитивна динаміка або нормалізація метаболічних і гормональних показників, особливо вуглеводного і ліпідного обміну.
Профілактика розвитку ДГ передбачає збалансований режим життя з нормалізацією відпочинку і сну, адекватне і збалансоване харчування з обов’язковою складовою його якості, а також дозовані фізичні навантаження. Враховуючи, що головна роль у розвитку ДГ належить нейромедіаторам, особливо дефіциту ГАМК, то хворим із групи ризику необхідно профілактично призначати курсами вітаміни В1 і В6, жиророзчинні вітаміни D і А, а також обов’язково застосовувати препарати ГАМК і магнію (наприклад, препарат Гамалате-В6).
Таким чином, ДГ – це самостійне нейроендокринне захворювання, що має поліморфні клінічні прояви, які значною мірою зумовлені станом нейромедіаторів, зокрема ГАМК, і гіпоталамо-гіпофізарної системи, що призводить до порушення майже всіх ланок ендокринної регуляції та формування серії метаболічних розладів навіть на ранніх стадіях статевого дозрівання. Тому першочерговим завданням ендокринолога є виявлення ДГ з метою своєчасного призначення адекватної комплексної терапії для попередження розвитку ЦД 2 типу, атеросклерозу, гіпертонічної хвороби, безпліддя, що призводять до інвалідизації людини зі скороченням її життя, а також з метою покращення і нормалізації якості життя хворих з гіпоталамічною дисфункцією.
Список літератури знаходиться в редакції.