19 січня, 2018
Капсаицин при постгерпетической невралгии: потенциал средства первой линии
Постгерпетическая невралгия (ПГН) – осложнение латентной герпесвирусной инфекции, более известной как опоясывающий лишай. От 10 до 15% пациентов с типичной кожной сыпью, появляющейся в результате реактивации вируса, испытывают в продромальном периоде и/или после заживления кожи мучительную боль нейропатического характера.
Боль связана с повреждением кожных нервных окончаний и, как правило, медленно и недостаточно реагирует на терапию адъювантными аналгетиками – трициклическими антидепрессантами и антиконвульсантами, поскольку их эффект развивается постепенно. Кроме того, возможности пероральной терапии ограничены побочными эффектами этих препаратов, действующими на уровне центральной нервной системы (ЦНС) (M. Backonja et al., 2008).
В связи с очевидными недостатками фармакотерапии возрождается интерес к природным средствам и их производным. Лечебные свойства острого перца рода Capsicum обусловлены содержанием ключевого действующего компонента – капсаицина. Экстракт перца, или капсаицин, в местных лекарственных формах (мазях, кремах) при нанесении на кожу вызывает характерное ощущение жжения, которое эмпирически использовалось как отвлекающий фактор, способствующий облегчению болевого синдрома – мишени терапии. Современные исследования, проводимые в свете знаний о молекулярном функционировании нервной системы, показали, что механизм действия капсаицина сложнее, чем просто генерация отвлекающего жжения.
Капсаицин является лигандом рецепторов TRPV, принадлежащих к семейству неселективных ионных каналов, активируемых некоторыми веществами, например кислотами, а также температурой. TRPV1 – первый из открытых рецепторов этого типа, имеющий альтернативные названия – рецептор капсаицина или ваниллоидный рецептор 1. Функция TRPV1 – детекция температуры тела, а также ноцицепция. Этот температурный «датчик» генерирует характерное ощущение жжения при первой «встрече» с молекулой капсаицина. Однако при повторных аппликациях наступает аналгетический эффект. Считается, что он вызван локальной десенситизацией нейронов болевой и температурной чувствительности, несущих на своих мембранах TRPV1 (A.M. Bode и Z. Dong, 2011; S. Derry et al., 2013). Описан механизм «фармакологической абляции» (обратимой дегенерации) нервных окончаний кожи: под действием капсаицина наблюдалось снижение плотности эпидермальных нервных волокон, которая полностью восстанавливалась в течение 24 нед (W.R. Kennedy et al., 2010). В результате болевая трансмиссия блокируется на длительное время, однако без нарушений всех остальных видов чувствительности. Этот механизм капсаицина уникален и отличает его от других средств топической терапии боли, например лидокаина.
Группа исследователей из Австралии, Малайзии и Тайваня недавно опубликовала систематический обзор с метаанализом, посвященным вопросам применения капсаицина в качестве терапии ПГН у взрослых пациентов (Y.L. Yong et al. Frontiers in Pharmacology, 2017. doi: 10.3389/fphar.2016.00538). В обзор включали только рандомизированные двойные слепые плацебо-контролируемые исследования минимальной продолжительности 6 нед с участием взрослых пациентов с ПГН, в которых применялись топические формы капсаицина любых концентраций. Вопрос исследования был сформулирован так: является ли капсаицин достаточно эффективным и безопасным, чтобы стать средством первой линии в лечении ПГН?
Результаты исследований
Из 109 источников, обнаруженных при первичном поиске в биомедицинских базах данных, были отобраны 6 исследований, отвечающих критериям включения (табл.). Общее количество участников исследований – 1449. Длительность хронической нейропатической боли перед включением пациентов в исследования составила как минимум 3 мес.
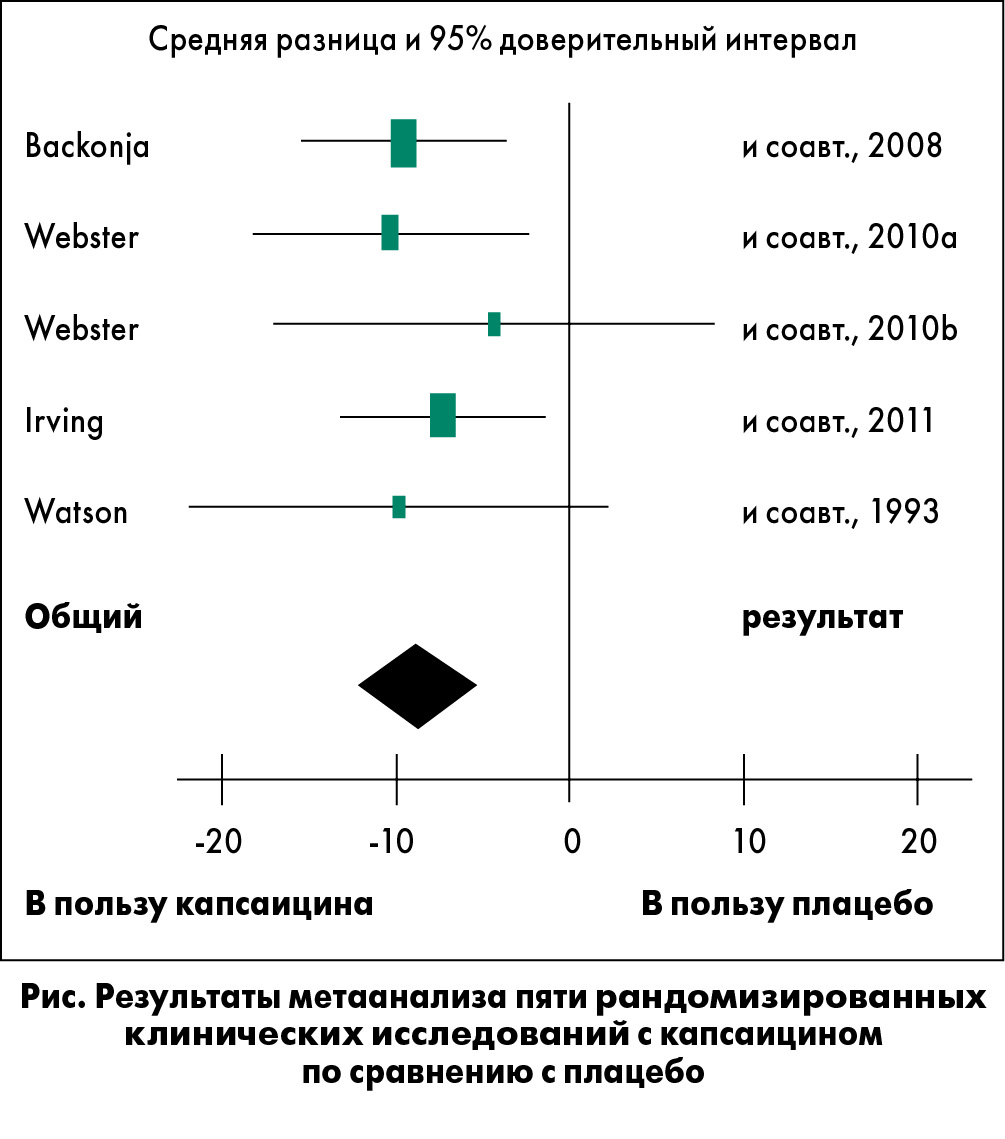
Результаты исследований свидетельствуют в пользу эффективности терапии капсаицином. Положительная динамика по 11-бальной шкале боли (NPRS) относительно исходных оценок варьировала от -4,3% в исследовании Irving и соавт. до -31% в исследовании Bernstein и соавт. Результат в исследовании Webster и соавт. (2010b) не достиг статистической достоверности.
Количество пациентов, у которых в результате применения капсаицина оценки боли по NPRS уменьшились более чем на 30%, составило от 37% в исследовании Webster и соавт. (2010a) до 47% в исследовании Irving и соавт. с достоверными отличиями от контрольных групп. Следует отметить, что эти результаты получены при применении для лечения ПГН только капсаицина, без сопутствующей фармакотерапии.
 Количество пациентов, у которых оценки боли по NPRS уменьшились более чем на 50%, определялось в трех исследованиях. В исследовании Webster и соавт. (2010b) таких пациентов было 39% в основной группе и 36% в контрольной (различия недостоверны); в исследовании Webster и соавт. (2010а) – 25 и 10% соответственно (различия достоверны); в исследовании Irving и соавт. – 30 и 21% соответственно (различия достоверны).
Количество пациентов, у которых оценки боли по NPRS уменьшились более чем на 50%, определялось в трех исследованиях. В исследовании Webster и соавт. (2010b) таких пациентов было 39% в основной группе и 36% в контрольной (различия недостоверны); в исследовании Webster и соавт. (2010а) – 25 и 10% соответственно (различия достоверны); в исследовании Irving и соавт. – 30 и 21% соответственно (различия достоверны).
Во всех исследованиях по семибалльной шкале глобального впечатления об изменениях (PGIC) пациенты из групп капсаицина отметили улучшение по сравнению с контрольными группами. Все сравнения были статистически достоверными (p<0,05), кроме исследования Webster и соавт. (2010a), в котором р-значения для этого параметра были недоступны.
Во всех исследованиях прослеживалась стабильная тенденция к большей частоте побочных эффектов в группах активной терапии по сравнению с плацебо, однако р-значения, а значит, и достоверность различий, не были доступными для анализа.
Для метаанализа использовали данные пяти крупнейших исследований, кроме Bernstein и соавт. Как видно из рисунка, топический капсаицин во всех исследованиях и при анализе их в совокупности обеспечивал эффективное купирование боли по сравнению с плацебо.
Обсуждение результатов. Место капсаицина в экспертных рекомендациях
Основываясь на оценках по шкале NPRS, большинство исследований, включенных в обзор, демонстрируют, что топический капсаицин в режиме монотерапии оказывает относительно выраженное противоболевое действие при ПГН. В ходе тестирования пациентов по шкале PGIC большее число участников групп терапии отметили облегчение боли по сравнению с участниками контрольных групп во всех шести исследованиях. Больше пациентов групп терапии испытывали побочные эффекты по сравнению с группами контроля, однако статистическая значимость этих результатов не может быть определена из-за отсутствия количественных данных. Также не сообщалось, насколько выраженными были эти побочные реакции и как пациенты их переносили. Таким образом, вопрос переносимости терапии капсаицином остается открытым, поэтому авторы обзора не смогли ответить и на главный вопрос исследования: может ли капсаицин быть первой линией терапии ПГН?
Тем не менее по сравнению с антидепрессантами и антиконвульсантами с их частыми центральными побочными эффектами капсаицин представляется идеальным кандидатом в первую линию средств терапии нейропатической боли в связи с отсутствием влияния на ЦНС и прочих системных механизмов действия. На сегодняшний день он входит в международные и национальные руководства по ведению пациентов с нейропатической болью как адъювантное или альтернативное средство. Например, в руководстве Национального института совершенствования клинической практики Великобритании (NICE, 2013) лечение нейропатической боли рекомендуется начинать с назначения одного из альтернативных препаратов – амитриптилина, дулоксетина, габапентина или прегабалина, а в качестве второй линии использовать опиатные аналгетики. Вместе с тем NICE рекомендует «предлагать капсаициновый крем пациентам с локализованной нейропатической болью, которые избегают или не переносят оральную фармакотерапию».
На практике капсаицин успешно применяется как доступное безрецептурное средство в комбинации с аналгетиками первой линии при разнообразных нейропатических и ревматических болевых синдромах. Комбинация с включением топического капсаицина позволяет уменьшить дозы системных препаратов, а также повысить переносимость и эффективность терапии боли.
Подготовил Дмитрий Молчанов
Тематичний номер «Неврологія, Психіатрія, Психотерапія» № 4 (43), грудень 2017 р.



