20 березня, 2018
Клинические факторы прогноза у пациентов с лимфомой Ходжкина

 Лечение пациентов с лимфомой Ходжкина (ЛХ) имеет длинную историю. Первое описание данного заболевания появилось в 1832 г., и в течение многих лет диагноз ЛХ оставался фатальным в большинстве случаев. За последние десятилетия ситуация значительно улучшилась, и сегодня вероятность излечения составляет 85-95%.
Лечение пациентов с лимфомой Ходжкина (ЛХ) имеет длинную историю. Первое описание данного заболевания появилось в 1832 г., и в течение многих лет диагноз ЛХ оставался фатальным в большинстве случаев. За последние десятилетия ситуация значительно улучшилась, и сегодня вероятность излечения составляет 85-95%.
Первые успехи терапии пациентов с ЛХ были связаны с лучевой терапией (ЛТ), которая долгое время считалась золотым стандартом. Дальнейшее усовершенствование техники ЛТ и правильное стадирование позволили значительно улучшить прогноз для пациентов с ранними стадиями ЛХ [7-10]. Для пациентов с продвинутыми стадиями или рецидивом химиотерапия – ХТ (сначала МОРР, а затем схема АВVD и ее варианты) – стала играть решающее значение [11, 12]. С идентификацией факторов риска рецидива для пациентов с неблагоприятным прогнозом ХТ стали сочетать с субтотальным или тотальным лимфоидным облучением. Десятилетия клинических исследований потребовались для выработки современных стандартов с использованием комбинированной ХТ и ЛТ. Объемы и дозы ЛТ на сегодняшний день значительно снижены, техника проведения ЛТ продолжает совершенствоваться, тем не менее исследования направлены на выделение групп пациентов, которые могли бы избежать проведения ЛТ.
 Комбинированная терапия в настоящее время позволяет излечить большой процент пациентов, при этом риски возникновения отдаленной токсичности (развитие вторичных опухолей, повреждение легких, сердца) и других серьезных последствий, проявляющихся через много лет и даже десятилетий, остаются высокими (рис. 1) [13].
Комбинированная терапия в настоящее время позволяет излечить большой процент пациентов, при этом риски возникновения отдаленной токсичности (развитие вторичных опухолей, повреждение легких, сердца) и других серьезных последствий, проявляющихся через много лет и даже десятилетий, остаются высокими (рис. 1) [13].
Поэтому усилия врачей направлены на дальнейшую оптимизацию терапии с целью максимально возможного снижения токсичности и сохранения высокой эффективности.
Патогистологический диагноз с обязательным иммуногистохимическим исследованием, компьютерная томография (КТ) и сочетание позитронно-эмиссионной томографии (ПЭТ) с КТ (ПЭТ-КТ) стали стандартом диагностики. В дополнение к правильному стадированию идентификация прогностических факторов позволяет выбрать оптимальный терапевтический алгоритм. Концепция риск-адаптированной терапии состоит в том, что наличие плохих прогностических факторов требует более интенсивного лечения [14-17]. В то же время у больных с благоприятными факторами используется менее агрессивный подход с меньшим числом непосредственных и отдаленных последствий. При этом результат терапии не должен ухудшаться.
Клинические исследования Европейской организации по изучению и лечению онкологических заболеваний (EORTC) и Немецкой группы по изучению ЛХ (GHSG) внесли существенный вклад в понимание прогностических факторов у пациентов после клинического стадирования [18-22].
Классические клинические факторы
Возраст старше 45-50 лет. Лимфома Ходжкина имеет 2 возрастных пика. Второй приходится на 50-55 лет, и выживаемость таких пациентов существенно хуже в связи с особенностями биологии лимфомы в этом возрасте, худшей переносимостью химиопрепаратов и нередко развитием сопутствующей патологии. В старшем возрасте чаще встречается смешанно-клеточный гистологический вариант с наличием вируса Эпштейна – Барр (ЭБВ) в злокачественных клетках [23]. ЭБВ-ассоциацию относят к фактору прогноза старшей возрастной группы [24, 25]. Лечение ЛХ в старшем возрасте связано с большим числом осложнений, и схема ABVD, как правило, не рекомендуется для пациентов старше 70 лет. Описанная в литературе частота встречаемости легочной токсичности у пожилых пациентов может достигать 32% с летальностью до 25% [26]. Интенсифицированные режимы типа BEACOPP-dose escalated не рекомендуются пациентам старше 60 лет [27]. Однако даже у больных старше 50 лет сопутствующей патологией смертность после BEACOPP-dose escalated режима достигала 13,3% [28]. Для пациентов старшей возрастной группы терапия недавно вышедшими на рынок таргетными препаратами, такими как брентуксимаб, может быть разумным выбором [29]*.
* В Украине брентуксимаб ведотин (МНН) зарегистрирован для лечения взрослых пациентов с рецидивной или рефрактерной формой CD30-положительной лимфомы Ходжкина (ЛХ): после аутологичной трансплантации стволовых клеток; после по крайней мере двух предыдущих линий терапии, если аутологичная трансплантация стволовых клеток или полихимиотерапия не рассматриваются как лечебная опция; для лечения взрослых пациентов с CD30-положительной ЛХ при наличии повышенного риска рецидива или прогрессирования заболевания после аутологичной трансплантации стволовых клеток.
Мужской пол. 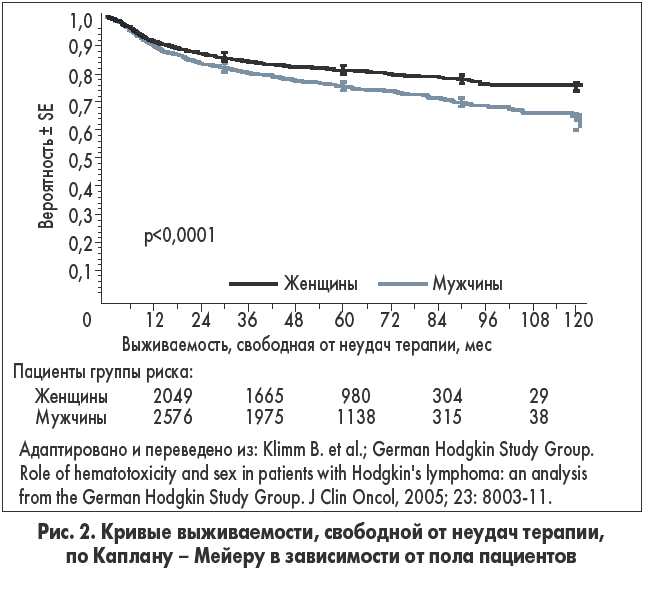 Пациенты-мужчины имеют худший прогноз (рис. 2). Вероятно, это связано с различиями в фармакокинетике химиопрепаратов. У женщин наблюдается большая гематологическая токсичность – например, более глубокая лейкопения, вероятно, связанная с половыми различиями в метаболизме цитостатиков в режиме ABVD [30]. Кроме того, гематологическая токсичность связана с более благоприятным прогнозом.
Пациенты-мужчины имеют худший прогноз (рис. 2). Вероятно, это связано с различиями в фармакокинетике химиопрепаратов. У женщин наблюдается большая гематологическая токсичность – например, более глубокая лейкопения, вероятно, связанная с половыми различиями в метаболизме цитостатиков в режиме ABVD [30]. Кроме того, гематологическая токсичность связана с более благоприятным прогнозом.
ß-симптомы. Конституциональные необъяснимые симптомы, такие как лихорадка >38 °C, профузные ночные поты и потеря веса >10% на протяжении 6 мес перед диагностикой, наблюдаются у 10-25% больных с I-II стадиями ЛХ и у <70% больных с продвинутыми стадиями заболевания [32]. Их наличие коррелирует с высокой вероятностью распространенного процесса, включая вовлечение лимфоузлов ниже диафрагмы. Причем лихорадка и потеря веса имеют большее прогностическое значение, чем только ночные поты. B-симптомы связывают с продукцией провоспалительных цитокинов клетками опухоли (IL‑1, TNF-α и IL‑6) [33].
Пациенты с I-II стадиями ЛХ, имевшие лихорадку и потерю веса, демонстрируют худшую выживаемость (57% в течение 7 лет) и меньшую выживаемость без болезни, независимо от терапии [34-37]. Больные только с ночными потами имеют такой же прогноз, что и пациенты без таковых. В мультивариантном анализе данных больных с одним из В-симптомов относительный риск рецидива был 4,3 для лихорадки, 2,4 для потери веса и 0,8 для ночных потов [35].
Объем медиастинальной опухоли. В литературе даются различные определения большой медиастинальной опухоли. Наиболее часто используют определение, основанное на измерении максимальной ширины медиастинальной массы на прямой рентгенографии органов грудной клетки в сравнении с максимальным интраторакальным диаметром. Соотношение более чем 1:3 определяют как bulky (Ann Arbor system). Другие измеряют ширину на уровне Т5-6 (Cotswolds system), а остальные используют абсолютные размеры опухоли, измерение ее объема или площади поверхности. Таким же образом измеряется и немедиастинальная опухоль. Некоторые протоколы считают bulky опухоль размером >10 см, другие – ≥5 или ≥6 см.
Одно ретроспективное исследование с участием 230 пациентов, получавших только ЛТ, продемонстрировало 55% рецидивов в течение 10 лет у пациентов с большой медиастинальной массой по сравнению с 17% больных без таковой [38].
Рецидивы у больных с большой массой в средостении возникают преимущественно в лимфоузлах или экстранодально выше диафрагмы; большинство из них развиваются в течение первых трех лет после терапии [39-42]. Рецидивы ниже диафрагмы встречались только у 4% пациентов, получавших комбинированное лечение [40]. Это наблюдение предполагает, что предпочтительным подходом является ХТ с последующей ЛТ. В одном из исследований 10-летняя выживаемость без прогрессирования (ВБП) у 172 пациентов с большой массой в средостении, лечение которых включало ХТ+ЛТ, была 88% в сравнении с 54% больных, получавших только ЛТ [42].
Пока еще не существует однозначного мнения относительно прогностического значения размеров периферических лимфоузлов >6 см в диаметре [43-44].
Низкий альбумин сыворотки. Низкий уровень альбумина (<4,0 г/дл в IPS) ассоциирован с неблагоприятным прогнозом. Альбумин продуцируется в печени, что составляет около 12-20% всей способности синтеза белка. Синтез альбумина снижается, когда синтез острофазовых протеинов стимулируется IL‑6 или является результатом недостаточного поступления в организм аминокислот. Уровень альбумина обратно коррелирует с уровнем IL‑6, TNF-α и IL‑1RA [45].
Анемия. Анемия наблюдается почти у 40% больных, носит нормоцитарный характер, относится к анемии воспаления и не зависит от возраста. Граничным уровнем для прогноза в IPS выбран уровень гемоглобина 10,5 г/дл. Было продемонстрировано, что повышенный уровень IL‑6 коррелирует с уровнем гемоглобина, и что уровень IL‑6 коррелирует с уровнем гепсидина – белка острой фазы и регулятора метаболизма железа [46]. Поэтому анемия является следствием провоспалительной активности клеток микроокружения, что и может объяснять ее прогностическое значение. Анемия воспаления характеризуется нарушениями метаболизма железа. Повышенная выработка гепсидина ведет к острому дефициту железа. Гепсидин блокирует кишечное всасывание железа и депо железа в ретикулоэндотелиальной системе, вследствие чего повышается уровень ферритина. Повышенный уровень ферритина при ЛХ был описан еще более 40 лет назад и также является плохим прогностическим фактором [47]. Аккумуляция железа в клетках микроокружения может оказывать биологические эффекты на клеточную функцию и вызывать их повреждение. Хотя при ЛХ уровень ферритина часто повышен, это не означает, что организм перегружен железом, так как насыщение трансферрина не увеличивается с повышением концентрации ферритина, и большинство пациентов имеют низкое или нормальное насыщение трансферрина. Однако в процессе ХТ и при проведении гемотрансфузий возможна истинная перегрузка железом, что может негативно сказаться на результатах высокодозовой ХТ и трансплантации стволовых клеток.
Низкое число лимфоцитов. Изменения в формуле крови часто наблюдаются при диагностике ЛХ. Типичные нарушения: лейкоцитоз с нейтрофилией, относительная или абсолютная лимфоцитопения и моноцитоз. В IPS прогностическим порогом выбрано число лимфоцитов 15 000/мкл, для лимфопении – 600/мкл, или менее 8%. Не так давно количество моноцитов, особенно по отношению к лимфоцитам, было выделено как фактор прогноза при ЛХ. В когорте 474 больных с ЛХ, наблюдавшихся с 1974 по 2010 г., число моноцитов >900/мкл было связано с худшей общей выживаемостью (ОВ) и ВБП. Также показательно влияние на прогноз соотношения между лимфоцитами и моноцитами <1,1. Возможна корреляция числа макрофагов в ткани опухоли и моноцитов в периферической крови.
ß2-микроглобулин (b2M). B2M – компонент HLA-I антигена, представленный на поверхности практически всех ядерных клеток организма. У здоровых людей он продуцируется в постоянном количестве и выделяется почками путем гломерулярной фильтрации. Лимфоциты являются основными продуцентами b2M, и воспалительные цитокины стимулируют продукцию b2M. Следовательно, повышенные уровни b2M могут быть связаны с активацией или пролиферацией иммунных клеток либо снижением почечного клиренса. Это прогностический маркер для многих лимфопролиферативных заболеваний, включая ЛХ. Повышенные уровни наблюдаются в 5-30% случаев на момент диагностики и связаны с неблагоприятным прогнозом [50-52]. В недавнем исследовании, включавшем 202 пациента с продвинутыми стадиями ЛХ, мультивариантный анализ продемонстрировал, что уровень b2M ≥2,5 мг/л является независимым прогностическим фактором для ВБП (р=0,001) и ОВ (р=0,034). 5-летняя выживаемость без болезни у таких пациентов была 66,8% в сравнении с 89,7% у больных, уровень b2M у которых был <2,5 мг/л (р<0,001) [53].
Исторически рассматривалось множество факторов прогноза, некоторые из них со временем утратили свою значимость, например, такие, как распространение опухоли на мягкие ткани грудной клетки, ночные поты, когда они являются единственным симптомом, вариант нодулярного склероза с обеднением лимфоцитами, вовлечение селезенки. Эти факторы, однако, могут быть приняты во внимание в определенных клинических ситуациях.
Другие факторы, связанные с биологией опухоли и трудноприменимые в рутинной клинической практике, – латентная ЭБВ-инфекция в клетках опухоли, высокий уровень циркулирующих CD30, IL‑1RA и IL‑6, инфильтрация ткани эозинофилами, тучными клетками или макрофагами, экспрессия клетками Рида – Штернберга BCL‑2, IL‑6, T-клеточных или цитотоксических антигенов, экспрессия nm23-H1 в цитоплазме и молекулярно-генетические маркеры – требуют особого внимания.
Прогноз для больных с I-II стадиями ЛХ
Важно отметить, что, интерпретируя результаты клинических исследований, разные группы используют разные определения неблагоприятного прогноза (табл. 1).
 Таким образом, современные прогностические факторы для I-II стадий ЛХ включают число вовлеченных зон, экстранодальное вовлечение, возраст, наличие В-симптомов, объем медиастинальной опухоли, уровень СОЭ.
Таким образом, современные прогностические факторы для I-II стадий ЛХ включают число вовлеченных зон, экстранодальное вовлечение, возраст, наличие В-симптомов, объем медиастинальной опухоли, уровень СОЭ.
Стартовая терапия пациентов с ЛХ I-II стадий сегодня назначается в зависимости от наличия прогностических факторов:
- пациенты с благоприятными факторами получают ЛТ на вовлеченную зону и модифицированную ХТ или только ХТ;
- пациенты с неблагоприятными факторами получают стандартную ХТ и ЛТ на вовлеченную зону в качестве первой линии терапии.
До настоящего времени были разработаны несколько прогностических систем, основанных на клинических и лабораторных параметрах. Такие системы позволяют более точно выявлять пациентов высокого риска, т.е. тех, у которых могут развиваться прогрессирование или рецидив, среди пациентов как с ранними, так и с продвинутыми стадиями заболевания [54-57].
Прогноз для больных с продвинутыми стадиями (III-IV)
Для лечения пациентов с продвинутыми стадиями ЛХ GHSG предложила Международный прогностический индекс – IPS [58]. Эта модель была основана на результатах исследования с участием 4600 пациентов, получавших терапию по схемам для продвинутых стадий до 1992 г. Она включает семь клинических параметров, а именно: возраст <45 лет, мужской пол, стадию IV, гемоглобин <105 г/л, лейкоциты >15 × 109/л, лимфоциты <0,6 × 109/л (или <8% от общего числа лейкоцитов) и альбумин <40 г/л [34]. Сложенные вместе, они позволяют оценить вероятность выживаемости без болезни. 5-летняя ВБП зависит от количества факторов риска и составляет >84% у пациентов с отсутствием таких факторов и от 0 до 42% у тех, кто имеет ≥5 факторов [58].
Однако этот индекс не нашел широкого клинического применения. Успехи терапии ЛХ, новые возможности сопроводительной терапии (ростовые факторы) и новые диагностические возможности с появлением ПЭТ-КТ требовали пересмотра прогностических факторов [59]. Diefenbach et al. создали шкалу из трех факторов, сохранивших прогностическое значение для ВБП и ОВ. Так называемая IPS‑3 использует возраст >45 лет, IV стадию и уровень гемоглобина <105 г/л, что позволяет выделить 4 прогностические группы [60]. 5-летняя ВБП при использовании IPS‑3 была 83, 74, 68 и 63%, а ОВ – 95, 85, 75 и 52% для пациентов с 0, 1, 2 и 3 факторами риска соответственно. Недостатком шкалы является отсутствие учета маркеров биологии опухоли и микроокружения.
В последнее время ПЭТ стала стандартом в стадировании и оценке ответа на терапию у пациентов с ЛХ. С новыми технологиями пришло понимание того, что ранний ответ на первичную системную терапию может стать важным прогностическим фактором и ключом к выбору дальнейшей тактики лечения. Ответ-адаптированная терапия активно изучается в последние годы [61]. Ее цель – уменьшить токсичность путем минимизации терапии у тех, кто достиг ремиссии по данным промежуточной ПЭТ, и/или интенсифицировать лечение у пациентов с субоптимальным ответом на промежуточную ПЭТ. Gallamini et al. оценивали прогностическую роль ранней промежуточной ПЭТ (пПЭТ) у пациентов с продвинутыми стадиями ЛХ (n=190), получавших терапию по схеме ABVD. 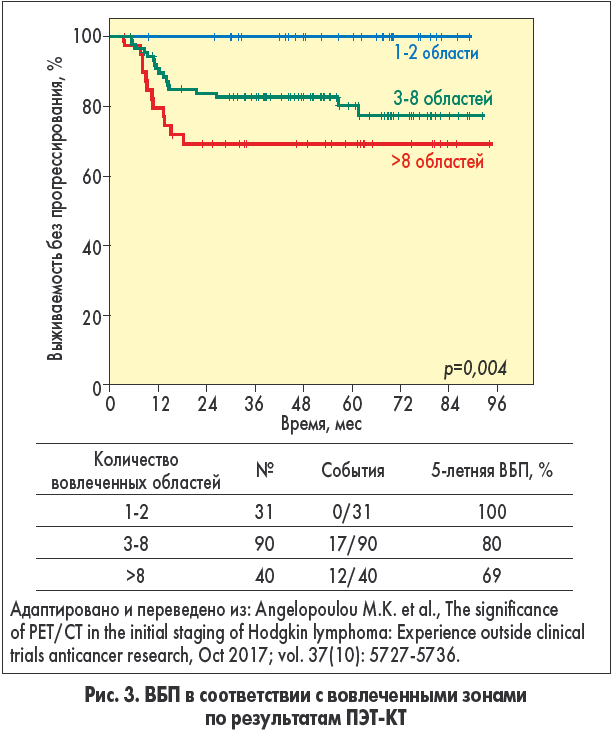 Пациенты с позитивным пПЭТ-ответом демонстрировали 2-летнюю ВБП в 12,8% случаев по сравнению с 95,0% больных с негативным пПЭТ-ответом. Результат имел высокую статистическую достоверность (р<0,0001). Как следствие, множество более поздних исследований стали включать ПЭТ в риск-адаптированную терапию.
Пациенты с позитивным пПЭТ-ответом демонстрировали 2-летнюю ВБП в 12,8% случаев по сравнению с 95,0% больных с негативным пПЭТ-ответом. Результат имел высокую статистическую достоверность (р<0,0001). Как следствие, множество более поздних исследований стали включать ПЭТ в риск-адаптированную терапию.
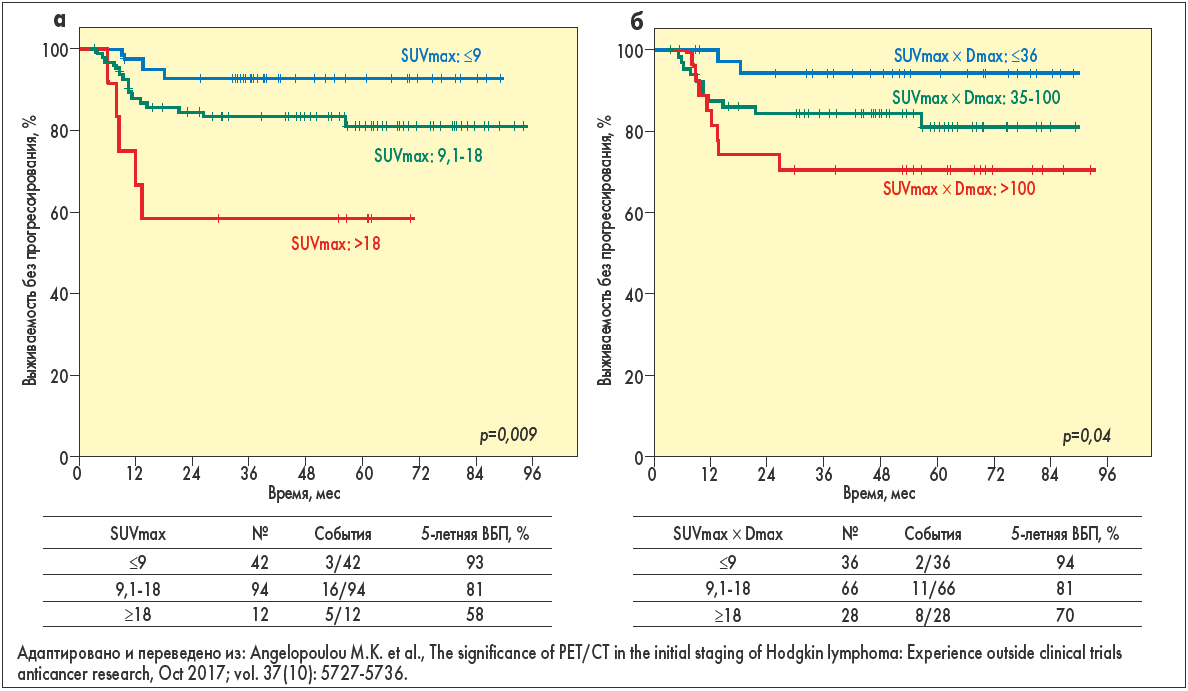
Более того, предпринимаются попытки использовать результаты ПЭТ-КТ до начала лечения в качестве маркеров прогноза. В недавно опубликованном греческом исследовании оценивалась прогностическая роль ПЭТ, проведенной перед первой линией терапии [80]. Были идентифицированы 3 потенциально прогностических параметра: число вовлеченных зон, максимальное значение стандартизованного уровня накопления радиофармпрепарата (SUVmax) и произведение SUVmax и максимального диаметра очага (Dmax) как маркера гликолиза в очаге. Все три параметра существенно коррелировали с ВБП (p=0,004, p=0,009 и p=0,04 соответственно) (рис. 3 и 4).
Рис. 4. ВБП в соответствии с SUVmax (a) и значением произведения SUVmax и Dmax (б)
Интерпретация результатов ПЭТ имеет ключевое значение. С целью стандартизирования интерпретации результатов ПЭТ международная консенсусная панель рекомендовала использование визуальной аналоговой шкалы – 5-балльной шкалы Довиль – для оценки промежуточного ответа и ответа после окончания лечения (табл. 2) [62-63]. Эта шкала использует в качестве референтных органов средостение (пул крови) и печень. Баллы 1, 2 или 3 означают полный ответ – ПЭТ-негативный (интерпретация при наличии 3-го балла должна проводиться с осторожностью), 4 и 5 баллов рассматриваются как ПЭТ-позитивные и свидетельствуют о неудаче терапии. Пациентам, имеющим, по данным ПЭТ, 4 или 5 баллов, показана биопсия поглощающего радиофармпрепарат образования для подтверждения наличия резидуальной опухоли перед проведением сальвадж-терапии.
Юго-западная онкологическая группа (SWOG) в исследовании S0816 (n=358) оценивала результаты пПЭТ-адаптированного лечения после 2 циклов ABVD у пациентов с III или IV стадией ЛХ [64]. Пациенты с позитивным значением пПЭТ (4-5 баллов по шкале Довиль; n=60) получали эскалированный BEACOPP до 6 циклов, в то же время пПЭТ-негативные (1-3 балла по шкале Довиль; n=271) продолжали получать терапию по схеме ABVD – ≥4 цикла. 2-летняя ВБП составляла 64% для ПЭТ-позитивной группы [33]. Эти значения были значительно выше, чем 15-30%, ожидавшиеся с учетом предыдущих исследований, таких как Gallamini et al [30]. Это позволило предположить, что интенсификация лечения может принести пользу.
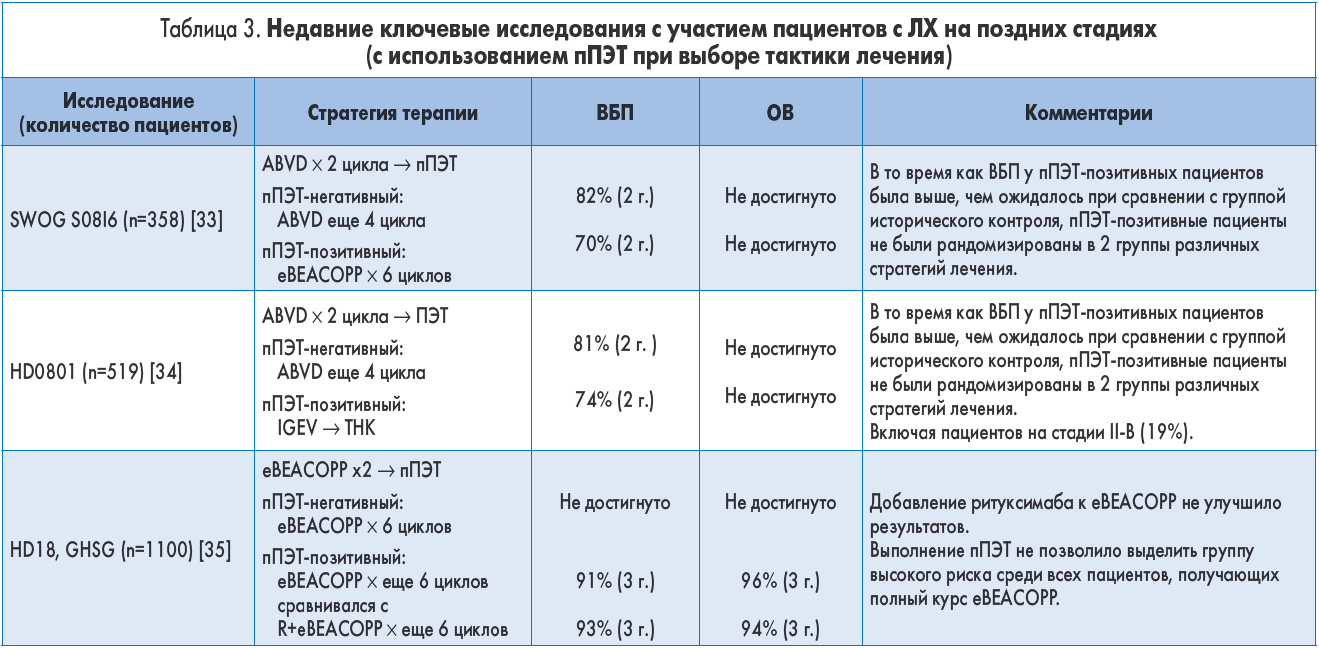
В таблице 3 приведены недавние ключевые исследования, использовавшие ПЭТ-адаптированную терапию для пациентов с продвинутыми стадиями ЛХ.
Прогностические факторы перед аутологичной трансплантацией стволовых гемопоэтических клеток
Среди пациентов, получавших стандартную ХТ, частота рецидивов составляет от 10 до 16% при благоприятном прогнозе (I-II стадия) [1] и 30-50% в случае продвинутой стадии [2-6]. Более того, у 10-15% пациентов наблюдается прогрессирование заболевания после ограниченного начального ответа.
После клинической адаптации ПЭТ-КТ для оценки ответа на ХТ первичная рефрактерность может иметь большую частоту встречаемости и в настоящее время определяется как прогрессирование на любом этапе ХТ или ЛТ и в течение 3 мес после окончания лечения и/или персистирование ПЭТ-позитивной резидуальной массы, то есть 4 или 5 баллов по шкале Довиль после окончания терапии, но при условии наличия опухолевой массы или увеличенного лимфоузла (для исключения возможного ложноположительного результата ПЭТ) [65].
Выбор второй линии терапии зависит от ожидаемых побочных эффектов и опыта клиники. Частота ремиссий составляет 30-40% [66]. После адекватной циторедукции стандартом терапии считают проведение высокодозовой ХТ с аутологичной трансплантацией стволовых гемопоэтических клеток (ауто-ТСГК), которая позволяет достичь увеличения ВБП у >50% больных [67]. Пациенты, имеющие первично рефрактерное заболевание и способные перенести такую терапию, имеют худший прогноз: 8-10-летняя ОВ варьирует от 21 до 27%, а ВБП составляет 16% [68, 69].
Наиболее значимым фактором хорошего прогноза для пациентов с рецидивом и рефрактерным течением ЛХ, которым планируется проведение высокодозовой ХТ, является статус заболевания перед трансплантацией.
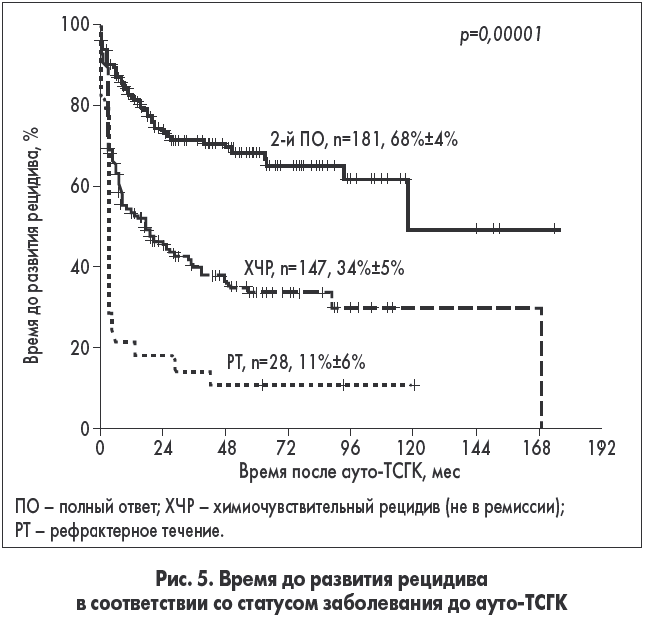 У пациентов, имевших вторую полную ремиссию, 5-летняя ВБП составила 68±4%. При этом у больных с химиочувствительным рецидивом (не в ремиссии) ВБП была 34±5%, а у пациентов с рефрактерным течением только 11±6% (рис. 5).
У пациентов, имевших вторую полную ремиссию, 5-летняя ВБП составила 68±4%. При этом у больных с химиочувствительным рецидивом (не в ремиссии) ВБП была 34±5%, а у пациентов с рефрактерным течением только 11±6% (рис. 5).
Прогностическое значение статуса заболевания перед трансплантацией также было подтверждено в исследованиях, которые использовали ПЭТ с фтордиоксиглюкозой или сканирование с галлием для оценки статуса болезни. В докладе Moskowitz и соавт. указано, что пациенты с негативным ПЭТ-ответом после второй линии терапии имели 77%-ную вероятность отсутствия прогрессирования после ауто-ТСГК по сравнению с 33%-ной вероятностью у больных с позитивными ПЭТ-значениями [70]. Похожие результаты были описаны и другими авторами [71-73].
В исследовании K. Spaepen и соавт. по данным ПЭТ также было установлено, что у пациентов с полной метаболической ремиссией перед ауто-ТСГК результаты были значительно лучше. Одно из исследований показало, что ВБП в ПЭТ-негативной группе перед высокодозовой ХТ с ауто-ТСГК составила 72% по сравнению с 23% для ПЭТ-позитивной группы [74].
Таким образом, ПЭТ-негативность перед ауто-ТСГК является важным индикатором длительной ремиссии после ауто-ТСГК. Сегодня считается, что любые шаги, направленные на достижение ПЭТ-негативности перед ауто-ТСГК, позволят улучшить ее результаты [70-73].
Для пациентов, у которых проведение ауто-ТСГК невозможно или которые не имели хорошего ответа на сальвадж-терапию, монотерапия брентуксимабом является хорошей опцией. В исследованиях А. Younes и A.K. Gopal пациенты с рецидивом / рефрактерным течением заболевания после ауто-ТСГК получали монотерапию брентуксимабом каждые 3 недели до 16 циклов. Общий ответ составил 75%, включая 34% случаев полного ответа. Медиана ВБП для всех пациентов составляла 5,6 мес, а средняя продолжительность ответа у тех, кто достиг полной ремиссии, была 20,5 мес. После медианы наблюдения 1,5 года 31 пациент жив и не имеет признаков прогрессирования [74].
Из 34 пациентов, которые участвовали в исследовании A.K. Gopal и достигли полной ремиссии, у 16 (47%) отсутствовало прогрессирование после медианы наблюдения 53,3 мес, 12 пациентов оставались в ремиссии после терапии брентуксимабом без консолидирующей терапии аллогенной трансплантацией СГК [75].
Результаты ПЭТ-КТ после ауто-ТСГК также могут иметь прогностическое значение. В ретроспективном исследовании 43 пациента с рецидивом или рефрактерным течением ЛХ и позитивным результатом ПЭТ-КТ, выполненной в ранние сроки после трансплантации (в течение 6 недель), имели значительно худшие показатели ВБП и ОВ, чем больные с позитивным ПЭТ перед ауто-ТСГК. Эти данные позволили предположить, что ПЭТ-КТ после трансплантации может быть лучшим предиктором исхода, чем ПЭТ-КТ, проведенная до высокодозовой ХТ. Позитивный результат ПЭТ-КТ после ауто-ТСГК может служить более простым и быстрым критерием выбора дальнейшего лечения.
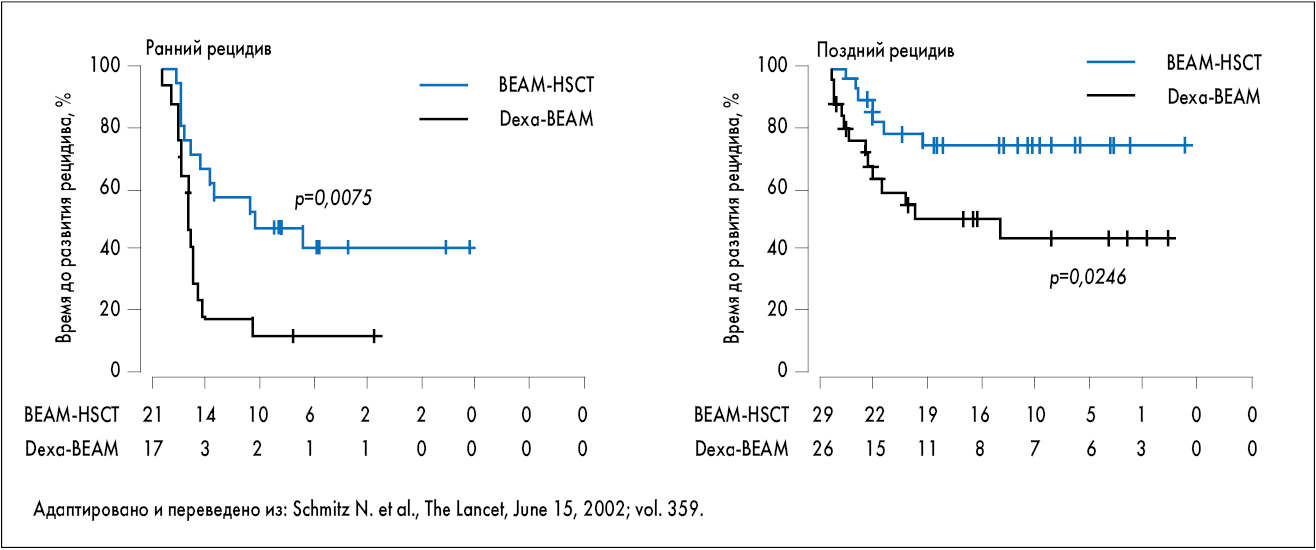
Важное прогностическое значение имеет также продолжительность первой ремиссии. Пациенты с поздним рецидивом (>1 года после завершения первой линии терапии) имеют лучший прогноз в сравнении с пациентами с ранним рецидивом (рис. 6) [77].
Рис. 6. ВБП у пациентов с ЛХ с ранним (слева) и поздним (справа) рецидивами
Существуют и другие факторы, имеющие прогностическое значение в рецидиве: анемия, время до рецидива, клиническая стадия, В-симптомы, экстранодальное вовлечение, число предшествующих режимов ХТ и состояние пациента [78, 79].
Выводы
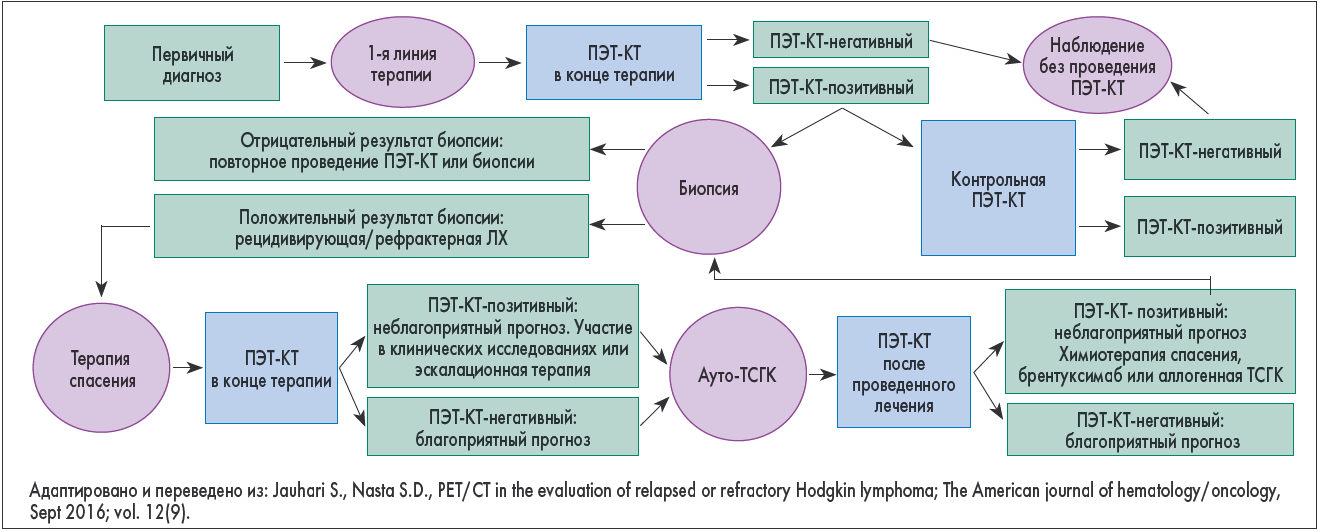
Определение пациентов в группы риска позволяет выбрать оптимальную терапевтическую тактику как в момент диагностики заболевания, так и в случае неудачи терапии. В последнее десятилетие клинические исследования ясно продемонстрировали прогностическую роль ПЭТ-КТ как в оценке раннего ответа на лечение, так и в выборе дальнейшей терапии при ЛХ (рис. 7). Достижение ПЭТ-негативности перед ауто-ТСГК должно быть целью лечения.
Рис. 7. Основанное на доказательствах использование ПЭТ-КТ при рецидивирующей или рефрактерной ЛХ
Список литературы находится в редакции.
При поддержке ООО «Такеда Украина».
UA/ADC/0218/0013
Тематичний номер Онкологія № 1 (52) лютий 2018 р.