21 березня, 2018
Всемирный день борьбы против рака
 Всемирный день борьбы против рака (World Cancer Day) ежегодно отмечается 4 февраля. Он был учрежден Международным противораковым союзом (UICC) в 2005 г. с целью привлечь внимание общественности к этой глобальной проблеме. Всемирный день борьбы с раком – это еще одна возможность повысить осведомленность населения и медицинских работников в вопросах профилактики и раннего выявления онкологических заболеваний, в том числе при тесном содействии СМИ. В этом году он проходит под девизом «Мы можем. Я могу», т.е. каждый из нас как совместно с другими людьми, так и индивидуально может внести свой вклад в снижение глобального бремени этого заболевания. Объединение усилий играет важную роль и открывает новые возможности в развитии онкологии [1].
Всемирный день борьбы против рака (World Cancer Day) ежегодно отмечается 4 февраля. Он был учрежден Международным противораковым союзом (UICC) в 2005 г. с целью привлечь внимание общественности к этой глобальной проблеме. Всемирный день борьбы с раком – это еще одна возможность повысить осведомленность населения и медицинских работников в вопросах профилактики и раннего выявления онкологических заболеваний, в том числе при тесном содействии СМИ. В этом году он проходит под девизом «Мы можем. Я могу», т.е. каждый из нас как совместно с другими людьми, так и индивидуально может внести свой вклад в снижение глобального бремени этого заболевания. Объединение усилий играет важную роль и открывает новые возможности в развитии онкологии [1].
Онкология – одна из наиболее изучаемых областей науки. Ежедневно делаются сотни открытий, способных приблизить человечество к успешному лечению этого заболевания. Поскольку в число приоритетных задач входят профилактика и раннее выявление онкологических заболеваний, ученые всего мира активно изучают возможности скрининга, а также предотвращения опухолевой трансформации, в чем достигнуты определенные успехи. Развитие таких технологий, как машинное обучение и «искусственный интеллект», существенно расширило возможности науки.
В 2017 г. завершился проект «Атлас ракового генома», целью которого была систематизация данных о генетических мутациях, приводящих к возникновению рака. Данный проект является результатом совместной работы Национального института рака и Института исследований генома человека (США).
Систематизация данных с помощью секвенирования и методов биоинформатики позволила создать многомерную карту ключевых геномных изменений для 33 типов злокачественных новообразований. Образцы, полученные более чем от 11 000 пациентов, были исследованы на наличие геномных и молекулярных особенностей опухолевых и соответствующих нормальных тканей (рис. 1).
В ходе масштабной работы было проведено описание геномов, секвенирование, а также анализ полученных данных. Описание генома включало профилирование экспрессии генов, вариации числа копий, метилирование ДНК генома, микро-РНК, генотипирование однонуклеотидного полиморфизма и секвенирование экзонов по меньшей мере 1200 генов, потенциально причастных к развитию опухоли. Путем секвенирования экзонов определялись мутации в ДНК, ассоциированные с определенным типом рака. Полученный массив информации проходил через специальные центры, где проводился анализ данных и разрабатывались инструменты для их визуализации. Это позволило ученым всего мира широко использовать эти данные.
Упомянутый проект сыграл большую роль в развитии современных представлений о биологии онкологических заболеваний, а также стал основой для дальнейших исследований в области ранней диагностики и лечения. В настоящее время любой желающий может ознакомиться с полученными данными на портале Genomics Data Commons [2].
Возможности скрининга онкологических заболеваний
Растущее понимание биологии злокачественных опухолей заставило ученых по-новому взглянуть на генетические мутации у людей с предрасположенностью к различным онкологическим заболеваниям. Знание того, что человек несет мутацию в гене восприимчивости к раку, может улучшить исходы благодаря регулярному скринингу или проведению профилактического оперативного вмешательства. Кроме того, выявление факторов восприимчивости к раку может помочь в выборе тактики лечения и предоставить информацию о планировании семьи.
В 10-15% случаев рак яичника связан с генетическими мутациями, которые передаются по наследству. Например, вероятность развития рака яичника составляет 36% для женщин с мутациями в гене BRCA1 и 12% – в BRCA2. Для сравнения, в общей популяции женщин риск развития рака яичника на протяжении всей жизни составляет всего 1-2%.
У индивидуумов с синдромом Линча значительно повышен риск развития в молодом возрасте колоректального рака, а также злокачественных новообразований эндометрия, яичника, желудка, поджелудочной железы, мочевыводящих путей. Синдром вызван мутациями в генах MLH1, MSH2, MSH6, PMS2 или EPCAM. Обычно при подозрении на наличие синдрома Линча тестирование направлено на выявление мутаций в этих пяти генах. Однако в половине случаев мутации в них отсутствуют, что предполагает наличие иных генетических изменений.
Чтобы решить эту проблему, исследователи оценили 25 генов предрасположенности к раку у 1260 человек, у которых предполагался синдром Линча. В 9% случаев присутствовала мутация в одном из 5 вышеперечисленных генов, в то же время у 6% выявлены мутации в других генах предрасположенности к раку. Например, у 15 человек были мутации BRCA1 или BRCA2 (связанные с увеличением вероятности развития рака молочной железы, яичника и других видов рака), а у 9 испытуемых была мутация в гене восприимчивости к колоректальному раку. Это исследование показывает, что более обширное генетическое тестирование позволяет получить информацию, которая может быть упущена при ограниченном традиционном тестировании на синдром Линча [3].
Исследователи Онкологического центра Джонса Хопкинса разработали единый анализ крови, который позволяет определить на ранних стадиях наиболее распространенные типы рака и установить первичную локализацию опухоли. Тест CancerSEEK одновременно оценивает уровень восьми онкобелков, а также мутации генов в опухолевой ДНК, циркулирующей в плазме крови. Тест направлен на скрининг восьми распространенных типов злокачественных новообразований, для пяти из которых в настоящее время не разработаны скрининговые методы диагностики. Использование комбинации выбранных биомаркеров потенциально может изменить методику скрининга.
Циркулирующие опухолевые ДНК могут быть высокоспецифичными маркерами. Авторы стремились разработать надежный тест, позволяющий обнаружить по крайней мере одну мутацию в подавляющем большинстве случаев. Фактически небольшое количество отобранных для теста мутаций позволяет минимизировать вероятность получения ложноположительных результатов и сделать тестирование более доступным.
Изначально было изучено несколько сотен генов и 40 белковых маркеров. По результатам исследования была отобрана относительно небольшая группа высокоселективных маркеров: 16 генов и 8 белков. Разработчики настаивают на том, что этот молекулярный тест направлен исключительно на скрининг онкологических заболеваний и, следовательно, отличается от других молекулярных тестов, которые проводят анализ большого количества генов для определения терапевтических мишеней.
Среди 812 здоровых добровольцев тест дал только семь ложноположительных результатов, продемонстрировав специфичность >99%. В исследовании также приняли участие 1005 пациентов с неметастатическим раком яичника, печени, желудка, поджелудочной железы, пищевода, колоректальной области, легкого или молочной железы I-III стадии. В среднем чувствительность составляла 70% и варьировалась от 98% для рака яичника до 33% для рака молочной железы. В случае злокачественных новообразований яичника, печени, желудка, поджелудочной железы и пищевода, для которых скрининговые тесты еще не разработаны, чувствительность варьировалась в пределах 69-98%.
Новизна метода заключается в том, что выявление различных мутаций ДНК сочетается в нем с измерением уровня нескольких белков. Еще один новый аспект – применение машинного обучения дает возможность точно определить местоположение опухоли у 83% пациентов. Этот тест представляет собой следующий шаг в изменении фокуса в сторону ранней диагностики заболеваний, что, по мнению исследователей, будет иметь решающее значение для снижения смертности от онкологических заболеваний в долгосрочной перспективе [4].
Исследователи из Великобритании обнаружили, что у пациентов с меланомой определение опухолевой ДНК в крови помогает спрогнозировать вероятность рецидива заболевания. Опубликованные в Annals of Oncology результаты позволят выявить пациентов, которые в наибольшей степени подвержены риску рецидива, а также тех, кто способен извлечь наибольшую пользу от проведения иммунотерапии.
Исследователи Манчестерского института рака при содействии Фонда Christie NHS Foundation изучили образцы крови, взятые после операции у 161 пациента с меланомой II и III стадии. Затем они искали мутации в двух генах – BRAF и NRAS, которые встречаются в 70% случаев при меланоме. Пятилетняя выживаемость пациентов с мутацией в обоих генах составила 33%, тогда как выживаемость пациентов без мутации – 65%. Результаты также показали, что у пациентов с мутацией в обоих генах меланома рецидивирует в течение года после операции гораздо чаще.
Возможность разработать систему, способную спрогнозировать вероятность рецидива заболевания, очень важна для пациентов. Исследования, подобные этому, показывают, что для некоторых видов рака решения могут зависеть от наличия опухолевой ДНК в крови. Если последующие исследования подтвердят эффективность подобного теста при выборе тактики лечения, это сыграет определенную роль в терапии распространенной меланомы [5].
Новые возможности в хирургии и интраоперационной диагностике
Одним из основных направлений лечения онкологических заболеваний остается хирургия. В мире активно используются и внедряются 3D-технологии для оптимизации хирургического процесса при технически сложных оперативных вмешательствах. 3D-модели опухоли и окружающей ее ткани в натуральную величину позволяют продумать ход операции до мельчайших деталей. Используя криогенику и технологии 3D-печати, команда исследователей придумала средство для создания структур мягких тканей, которые копируют мягкие органы, такие как человеческий мозг и легкие. Полученный продукт можно применять в медицинских процедурах, которые требуют регенерации ткани, а также для копирования органов.
 Процесс создания структур мягких тканей включает использование твердой двуокиси углерода (сухого льда) в качестве охлаждающего агента гидрогелевых чернил 3D-принтера (рис. 2). Механизм трехмерной печати остается прежним, но создаваемый объект, оттаивая, становится мягким, подобно тканям человеческого организма. При этом структуры не разрушаются под собственным весом, что очень важно, поскольку до сих пор эту проблему решить не удавалось.
Процесс создания структур мягких тканей включает использование твердой двуокиси углерода (сухого льда) в качестве охлаждающего агента гидрогелевых чернил 3D-принтера (рис. 2). Механизм трехмерной печати остается прежним, но создаваемый объект, оттаивая, становится мягким, подобно тканям человеческого организма. При этом структуры не разрушаются под собственным весом, что очень важно, поскольку до сих пор эту проблему решить не удавалось.
Структуры мягких тканей, создаваемые при помощи новой технологии, соответствуют некоторым тканям человеческого тела, таким как мозг и легкие. Следовательно, эти структуры могут использоваться в качестве «строительных лесов», т.е. как шаблоны для человеческих органов, нуждающихся в регенерации тканей.
Ученые утверждают, что путем «посева» пористых лесов с клетками поврежденные части тела могут легко восстановиться. Кроме того, отторжение тканей больше не будет проблемой, поскольку процедура не предполагает трансплантации.
Техника была проверена на коже человека, исследователи посеяли трехмерные печатные структуры с дермальными клетками фибробластов, и это привело к регенерации соединительной ткани кожи. Положительный результат исследования позволит выявить и другие возможности этой технологии.
Перспективным является то, что трехмерные печатные структуры мягких тканей могут быть признаны эффективным методом восстановления нейронных клеток в головном и спинном мозге, а также других тканей. С другой стороны, копии определенных частей тела или целых органов могут быть использованы при обучении хирургов [6].
Роботизированная хирургия активно используется во всем мире, позволяя интегрировать знания хирурга и высокоточные технологии. Согласно результатам исследования, опубликованным в марте 2017 г., биосовместимая система 3D-навигации, работающая в ближнем инфракрасном диапазоне, способна улучшить классическую и роботизированную хирургию благодаря беспрепятственному 3D-отслеживанию повышенной точности. Применение этой системы в данный момент ограниченно, но она продемонстрировала отслеживание тканей и хирургических инструментов с точностью до миллиметра в тестах ex vivo, а также на первом автоматическом роботе (STAR) при наложении швов.
Работа 3D-навигационной системы осуществляется с помощью инфракрасных флуоресцентных (NIRF) маркеров, а также с использованием робототехнических средств. В ходе исследования сравнивалась ее точность со стандартными методами оптического слежения. На скорости 1 мм/с команда исследователей наблюдала точность в 1,61 мм, которая снижалась до 1,71 мм, когда маркеры были покрыты кровью и тканью.
Основная проблема в хирургии мягких тканей заключается в том, что ткань-мишень перемещается и деформируется, видимость ухудшается за счет крови или других тканей, что затрудняет дифференциацию необходимого объекта от окружающей ткани. Эта инновационная разработка позволит добиться более точного отслеживания инструментов и тканей в операционном поле [7].
Не секрет, что миниинвазивная хирургия интенсивно развивается. Однако инструменты, используемые при таких операциях, не обеспечивают тактильной обратной связи, и хирург, работая на расстоянии, не способен адекватно оценить силу воздействия. Учредители SensOR Medical Laboratories из Торонто разработали инновационную чувствительную электрическую пленку Force Film, которая используется для покрытия хирургических инструментов и дает хирургам возможность «чувствовать» прикосновение.
Один из основателей лаборатории, доктор Роберт Брукс Наша, отметил, что основная цель этого изобретения – повышение безопасности операций. Ошибки врачей занимают третье место среди причин смертности. Около 12% ошибок возникают вследствие неправильного приложения силы к определенному инструменту во время операции.
 Сенсорное устройство SensOR (рис. 3) подключается к любому лапароскопическому инструменту и отсоединяется, не повреждая его. Данные передаются по беспроводной сети в режиме реального времени и в виде интуитивной визуальной обратной связи накладываются на эндоскопический монитор. Одновременно можно отслеживать силу воздействия нескольких инструментов, что позволяет хирургам быстро «чувствовать» безопасный уровень силы, необходимый для той или иной манипуляции. Данный продукт удобен в использовании и обеспечивает высокую надежность. Одной из основных задач при создании устройства было сделать его максимально ненавязчивым для хирурга, не ставя под угрозу первоначальную функцию инструмента. Устройство эластичное и легкое, и поэтому подходит для троакаров. Высококачественные материалы и электроника обеспечивают высокую точность и надежность самого устройства даже после стерилизации в автоклаве. Возможность быстрой корректировки действий и оценки качества в процессе работы достигнута благодаря плодотворному сотрудничеству с командой хирургов.
Сенсорное устройство SensOR (рис. 3) подключается к любому лапароскопическому инструменту и отсоединяется, не повреждая его. Данные передаются по беспроводной сети в режиме реального времени и в виде интуитивной визуальной обратной связи накладываются на эндоскопический монитор. Одновременно можно отслеживать силу воздействия нескольких инструментов, что позволяет хирургам быстро «чувствовать» безопасный уровень силы, необходимый для той или иной манипуляции. Данный продукт удобен в использовании и обеспечивает высокую надежность. Одной из основных задач при создании устройства было сделать его максимально ненавязчивым для хирурга, не ставя под угрозу первоначальную функцию инструмента. Устройство эластичное и легкое, и поэтому подходит для троакаров. Высококачественные материалы и электроника обеспечивают высокую точность и надежность самого устройства даже после стерилизации в автоклаве. Возможность быстрой корректировки действий и оценки качества в процессе работы достигнута благодаря плодотворному сотрудничеству с командой хирургов.
В перспективе планируется привлекать искусственный интеллект для того, чтобы устройство могло распознавать вид оперативного вмешательства и использовать данные предыдущих операций о силе воздействия, а также пределах безопасности для определенных тканей, для корректировки ошибочных действий врача в режиме реального времени. Платформа SensOR призвана свести к минимуму число медицинских ошибок, связанных с миниинвазивной хирургией, что потенциально сделает операцию более безопасной для миллионов пациентов [8].
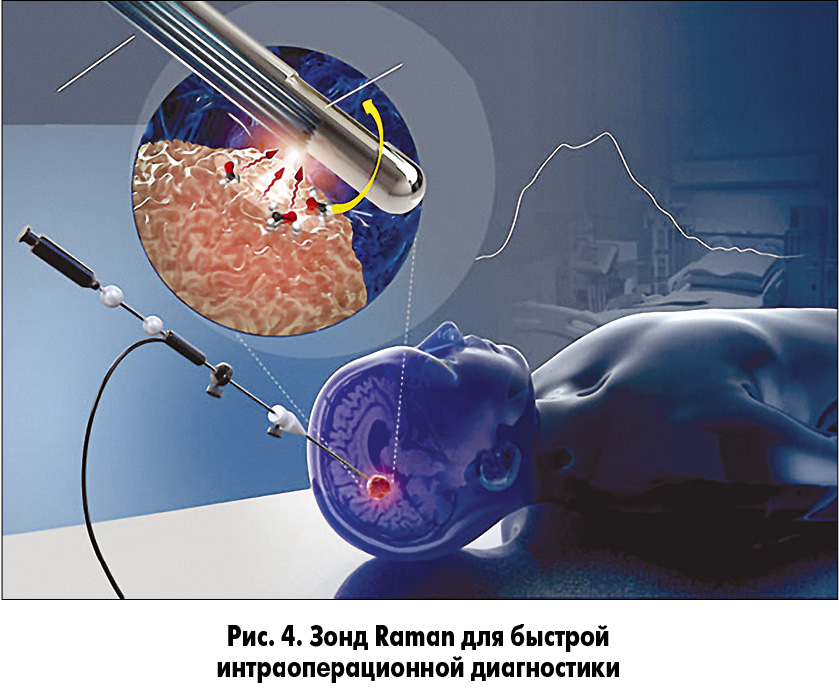 Многообещающим направлением остается возможность быстрой интраоперационной диагностики злокачественных клеток. Новая интегрированная система биопсии, механизм которой основан на спектроскопии спонтанного комбинационного рассеяния света (известного также как эффект Рамана), позволит получить данные о раке in situ. Метод рамановской спектроскопии заключается в измерении уникальных молекулярных сигнатур и, в отличие от визуального контроля или МРТ-сопровождения операций, позволяет произвести точную идентификацию ткани, пораженной злокачественными клетками. Устройство представляет собой интегрированный зонд Raman, встроенный в коммерчески доступную систему биопсии. Технология дает возможность проводить анализ опухоли до забора ткани без нарушения рабочего процесса. Высоковолновая рамановская спектроскопия обладает чувствительностью и специфичностью 80 и 90% соответственно, хорошо себя показала даже при количестве раковых клеток in situ >60% (рис. 4) [9].
Многообещающим направлением остается возможность быстрой интраоперационной диагностики злокачественных клеток. Новая интегрированная система биопсии, механизм которой основан на спектроскопии спонтанного комбинационного рассеяния света (известного также как эффект Рамана), позволит получить данные о раке in situ. Метод рамановской спектроскопии заключается в измерении уникальных молекулярных сигнатур и, в отличие от визуального контроля или МРТ-сопровождения операций, позволяет произвести точную идентификацию ткани, пораженной злокачественными клетками. Устройство представляет собой интегрированный зонд Raman, встроенный в коммерчески доступную систему биопсии. Технология дает возможность проводить анализ опухоли до забора ткани без нарушения рабочего процесса. Высоковолновая рамановская спектроскопия обладает чувствительностью и специфичностью 80 и 90% соответственно, хорошо себя показала даже при количестве раковых клеток in situ >60% (рис. 4) [9].
Другое устройство анализирует дым, который выделяется во время того, как коагуляционный нож разрезает или прижигает ткань, и сразу же определяет, есть в удаляемой ткани опухолевые клетки или нет.
Используя масс-спектрометрию для определения состава ткани, превращающейся в аэрозоль, химик Zoltan Takats совместно с коллегами из Имперского колледжа в Лондоне и других учреждений обнаружил, что можно за считаные секунды определить, является ли ткань злокачественной. Липиды в выделяемом дыме при горении различных типов тканей имеют характерные признаки.
Исследователи назвали разработку «умный скальпель», или iKnife. До сих пор хирурги были вынуждены делать перерывы во время операции, чтобы дождаться от лаборатории результатов патогистологического исследования. На это уходило длительное время. Теперь хирург с iKnife может почти мгновенно узнать, с какой тканью он имеет дело, и сразу принимать решение по поводу дальнейших действий.
 Стремясь показать, как работает технология iKnife, команда хирургов проанализировала несколько тысяч образцов злокачественных и нормальных тканей, взятых у 302 пациентов, и создала базу данных по их характерным признакам. Затем умные скальпели раздали хирургам, которые зафиксировали данные по дыму в ходе 91 операции. Изучив характерные признаки, исследователи обнаружили, что могут определить разницу между больными и здоровыми тканями, а также между различными типами рака.
Стремясь показать, как работает технология iKnife, команда хирургов проанализировала несколько тысяч образцов злокачественных и нормальных тканей, взятых у 302 пациентов, и создала базу данных по их характерным признакам. Затем умные скальпели раздали хирургам, которые зафиксировали данные по дыму в ходе 91 операции. Изучив характерные признаки, исследователи обнаружили, что могут определить разницу между больными и здоровыми тканями, а также между различными типами рака.
Образцы также анализировали с использованием традиционных методов выявления патологии, и оказалось, что iKnife (рис. 5) показал правильные результаты со стопроцентной точностью.
У этой технологии есть некоторые ограничения. Так, возникают сложности при применении прибора в ходе работы с тканями, которые плохо образуют дым: это в основном кожный покров и костные ткани. Однако iKnife может оказаться полезным для хирургов, которые чаще используют режущий и прижигающий инструмент, например, при проведении операций на молочной железе [10].
Реабилитация пациентов
Пациенты, перенесшие онкологическое заболевание, часто страдают от хронической усталости, и ученые предполагают, что воздействие яркого белого света даст возможность восстановить у них режим сна и бодрствования. В ходе одного из исследований в течение месяца 44 перенесших рак человека каждое утро 30 минут пребывали вблизи световой коробки. Пациенты были случайным образом разделены на группы, в одной из которых терапия проводилась с использованием яркого белого света, во второй – тусклого красного.
Более чем у половины участников исследования эффективность сна была снижена. Через месяц световой терапии у 86% представителей первой группы эффективность сна нормализовалась, в то время как у 79% людей во второй группе она по-прежнему оставалась низкой. По мнению авторов исследования, яркий белый свет помогает перенастроить биологические часы и восстановить циркадный ритм, при котором организм отдыхает ночью и бодрствует в течение дня.
Пациенты, которые большую часть дня находятся в помещении, могут не получать достаточно яркого света для того, чтобы синхронизировать биологические ритмы. Учитывая, что световое воздействие снаружи обычно намного ярче, чем в помещении, добавление искусственного яркого света в утренние часы поможет уменьшить усталость и улучшить качество сна.
Через три недели по окончании исследования участвовавших в нем пациентов снова подвергли контролю, по результатам которого выяснилось, что качество сна в первой группе существенно снизилось. Это говорит о том, что для стойкого эффекта может потребоваться постоянная терапия.
 Преимуществом исследования является то, что в него были включены люди с различными типами рака, в том числе со злокачественными новообразованиями крови, опухолями молочной железы и гинекологическими онкологическими заболеваниями. Предполагается, что механизмы, лежащие в основе нарушений сна, во многом схожи. Таким образом, световая терапия может проводиться при многих типах рака. Пациенты, не имеющие доступа к световой коробке (рис. 6), могут получить аналогичный эффект путем длительного пребывания на улице в дневное время и поддержания максимально яркого освещения в помещении по утрам [11].
Преимуществом исследования является то, что в него были включены люди с различными типами рака, в том числе со злокачественными новообразованиями крови, опухолями молочной железы и гинекологическими онкологическими заболеваниями. Предполагается, что механизмы, лежащие в основе нарушений сна, во многом схожи. Таким образом, световая терапия может проводиться при многих типах рака. Пациенты, не имеющие доступа к световой коробке (рис. 6), могут получить аналогичный эффект путем длительного пребывания на улице в дневное время и поддержания максимально яркого освещения в помещении по утрам [11].
Потенциал виртуальной реальности уже давно изучается в качестве обезболивающего во время медицинских процедур, а также у пациентов с хронической болью. Виртуальная реальность представляет собой захватывающую искусственную среду. Согласно последним исследованиям, она способна облегчить боль, а также снизить беспокойство пациентов. Spiegel и соавт. в Медицинском центре Cedars-Sinai изучали эту технологию и пришли к выводу, что она снижает выраженность болевых ощущений.
Группа ученых провела исследование, результаты которого были опубликованы в 2017 г. В нем приняли участие 100 пациентов, страдающих от желудочно-кишечной, сердечной, неврологической и послеоперационной боли. Пятьдесят пациентов пересматривали 15-минутное видео с элементами природы (горы и пр.) в сопровождении успокаивающей музыки. Другие 50 пациентов использовали очки виртуальной реальности в ходе 15-минутной анимированной игры под названием Pain RelieVR, которая была специально разработана для лечения пациентов с ограниченной подвижностью. Исследование показало, что у наблюдавших за природой пациентов отмечалось 13%-ное снижение болевых ощущений при оценке по визуально-аналоговой шкале, в то время как у тех, кто использовал очки виртуальной реальности, выраженность боли снижалась на 24%. Таким образом, дополнительные методы управления болью, такие как виртуальная реальность, имеют большие перспективы для сокращения применения опиоидов в клинической практике [12].
Искусственный интеллект – новые возможности в онкологии
На сегодняшний день благодаря техническим достижениям исследования в области рака предоставляют информацию невероятно быстрыми темпами, бросая вызов даже наиболее компетентным врачам, использующим новейшие данные для значительного улучшения ухода за пациентами. Примером является последняя информация о геноме рака: обнаружены миллионы молекулярных изменений, которые влияют на рост опухолевых клеток, а также могут отвечать за резистентность к терапии.
Было подсчитано, что врач должен читать 29 часов в течение рабочего дня, чтобы оставаться в курсе новых медицинских исследований. Кроме того, каждый год количество медицинской литературы увеличивается за счет удвоения объема информации. Это приводит к длительным поискам нужных данных, причем не всегда успешным. Соответственно, должен быть способ интегрировать имеющиеся знания, чтобы предоставить пациентам наилучшую помощь.
Одно из таких решений появилось в 1956 г. благодаря разработке технологии искусственного интеллекта. Одним из ведущих представителей когнитивных технологий является суперкомпьютер Watson компании IBM, который способен к «размышлению» и обработке огромного объема литературы, доступной для научного сообщества. Такая технология поможет установить связь между всеми данными, необходимыми для ответа на сложные медицинские вопросы в очень короткие сроки. Кроме того, такая система может обрабатывать всю опубликованную научную информацию, начиная с клинических данных каждого отдельного пациента и заканчивая основанным на доказательствах персонализированным лечением. К примеру, Watson for Genomics ежемесячно перерабатывает данные около 10 000 научных статей и 100 новых клинических исследований.
По одному из сценариев, клиницист может тренировать Watson for Oncology, предоставляя информацию о характеристиках опухоли, сопутствующих заболеваниях и добавляя любые конкретные пожелания от пациента. Основываясь на этой информации, а также на данных любых национальных и международных руководств, когнитивный компьютер сможет составить список возможных терапевтических опций. Кроме того, можно будет адаптировать предложения к определенным ограничениям. Так, в некоторых странах может потребоваться от 4 мес до 2 лет для поступления нового медицинского препарата на фармацевтический рынок, и компьютер будет учитывать это. Наконец, такая технология способна также оценить критерии включения того или иного пациента в возможные клинические исследования или его исключения из них и найти соответствующий список исследований, в которых пациент может участвовать.
Эти и многие другие возможности стали реальными благодаря сотрудничеству между исследователями компании IBM и онкологическим центром Memorial Sloan-Kettering, которые также обучили Watson тому, как принимать решение при проведении консилиума врачей. На конференции в Сан-Антонио в 2016 г. были представлены результаты двойного слепого исследования с участием 638 пациентов, в котором сравнивались решения, принятые группой врачей в Манипальском онкологическом центре (Индия), и результаты, полученные при обработке информации платформой Watson. Невероятно, но 90% рекомендаций, предложенных Watson, согласуются с рекомендациями консилиума врачей.
Это открывает новые возможности для крупных онкологических центров, где из-за ограничений во времени вопросы о лечении не могут быть вынесены на общее обсуждение. Исследователи из Индии, тестировавшие Watson, отметили, что работа с этой платформой была несложной. Проанализировав примерно за 40 с все клинические данные, результаты лабораторных исследований и комментарии врачей, Watson предоставил предложения о тактике лечения, а также научное обоснование для каждого из них.
Несколько онкологических центров, преимущественно в США, уже работают с этими платформами и совершенствуют возможности таких когнитивных компьютеров. Действительно, Watson развивается с невероятной скоростью, в частности в направлении проекта генома онкологических заболеваний. Партнерство Массачусетского технологического института, Гарвардского университета и компании IBM позволит провести полный анализ генома рака пациента при помощи компьютера, и в дальнейшем все данные будут обработаны для создания наилучших вариантов лечения. Невероятный потенциал этих технологий заключается в том, что они могут дополнительно самообучаться и совершенствоваться по мере поступления новых данных [13].
Watson можно применять и в других направлениях, в том числе в радиологии, где он будет обрабатывать данные тысячи радиологических снимков и обнаруживать те, что содержат информацию о патологии. Более того, Watson в дальнейшем сможет выявлять опухолевые клетки в гистологических образцах. Искусственный интеллект позволит уменьшить нагрузку на врачей в рутинной работе и высвободит им время для работы с пациентами и проведения исследований [14].
Литература
1. http://www.worldcancerday.org
2. https://cancergenome.nih.go
3. www.asco.org
4. Cohen J.D. et al. Detection and localization of surgically resectable cancers with a multi-analyte blood test. Science, 2018.
5. www.sciencedaily.com
6. Victorino C. 3D-printing, cryogenics create soft tissue to replicate brain, lungs, regenerate damaged parts, 2018.
7. Decker R., Shademan A., Opfermann J. et al. A biocompatible near-infrared 3D tracking system. IEEE Transactions on Biomedical Engineering, 2017.
8. www.medgadget.com
9. Desroches J. et al. A new method using Raman spectroscopy for in vivo targeted brain cancer tissue biopsy. Scientific Reports vol. 8, Article № 1792; 2018.
10. Brown E. iKnife’ device analyzes surgical smoke to ID cancers, 2013.
11. Wu L.M. et al. The effect of systematic light exposure on sleep in a mixed group of fatigued cancer survivors. J Clin Sleep Med, 2018.
12. www.forbes.com
13. Pennic J. IBM Watson, American Cancer Society partner to create virtual cancer health advisor, 2016.
14. Curioni-Fontecedro A. A new era of oncology through artificial intelligence, 2017.
Подготовила Екатерина Марушко
Тематичний номер Онкологія № 1 (52) лютий 2018 р.


