10 травня, 2018
Краткий обзор побочных реакций на пищевые продукты

В настоящее время проблема побочных реакций, развивающихся вследствие приема пищевых продуктов, прочно укрепилась в центре внимания медицинской общественности. В Европе наиболее частыми причинами аллергических реакций на пищу среди всех возрастных групп, о которых сообщают пациенты, являются такие продукты, как коровье молоко – 6% (95% доверительный интервал (ДИ) 5,7-6,4), яйца – 2,5% (95% ДИ 2,3-2,7), пшеница – 3,6% (95% ДИ 3,0-4,2), арахис – 0,4% (95% ДИ 0,3-0,6), лесные орехи – 1,3% (95% ДИ 1,2-1,5), рыба – 2,2% (95% ДИ 1,8-2,5) и моллюски – 1,3% (95% ДИ 0,9-1,7). При этом существует 10-кратная разница между сообщаемой и подтвержденной провокационным тестом распространенностью пищевой аллергии (ПА), что может зависеть от наличия различных видов аллергических реакций [1]. В Украине в настоящее время очень тяжело оценить распространенность ПА на различные продукты питания и их компоненты вследствие ограниченных диагностических возможностей и отсутствия унифицированного подхода. В данной работе намечаются шаги для проведения систематизированных исследований распространенности пищевой непереносимости, использования современных классификаций и методов диагностики.
Классификация
Непереносимость пищевых продуктов– это общий термин, включающий в себя весь спектр побочных реакций на прием пищевых продуктов, проявляющихся в виде различных патологических состояний, отличающихся своим патогенезом [2]. Общая характеристика таких реакций представлена в таблице 1.
Таблица 1. Общая характеристика побочных реакций на пищу
Непереносимость пищевых продуктов в своей основе определяется как общим состоянием индивидуума (особенностями метаболизма, нейро-эмоционального состояния и т. д.), так и особенностями принятой пищи – содержанием фармакологически активных (кофеин, тирамин) или токсических веществ (микробных продуктов, продуктов копчения скумбриевых рыб и т. д.). Эти реакции можно разделить на токсические и нетоксические [3]. Подобные реакции непереносимости характеризуются дозозависимостью, а также нерегулярностью возникновения и преобладают в структуре всех реакций на пищу.
ПА определяется как неблагоприятный эффект для здоровья, возникающий в результате специфического иммунного ответа, который развивается при воздействии данного продукта [4]. В отличии от пищевой непереносимости, ПА развивается вследствие нарушенного/измененного иммунного ответа на пищевые вещества у восприимчивого индивидуума. Характеристиками являются дозонезависимость и обязательное/регулярное возникновение после приема причинного продукта.
Наиболее полно охарактеризованы IgЕ-зависимые реакции, которые клинически проявляются анафилаксией, крапивницей, синдромом оральной аллергии, острым ринитом и острой астмой (реакции І типа), всегда характеризуются образованием IgЕ против пищевых аллергенов. Такая реакция сопровождается воспалением, вызванным клеточными компонентами и опосредуемым Т-клетками и эозинофилами. Пациенты с IgЕ-опосредованной аллергией на пищевые продукты выявляются путем обнаружения специфического IgЕ к пищевому аллергену в сыворотке и биологических жидкостях и путем измерения IgЕ-опосредованного клеточного ответа in vivoи in vitro [5]. Участие IgG-опосредованных реакций в развитии ПА (реакции II и III типов) подвергается обоснованным сомнениям [6].
Клеточно-опосредованные реакции с участием эффекторных иммунных клеток клинически проявляются преимущественно поражением пищеварительного тракта и кожи – контактный дерматит, герпетиформный дерматит, проктоколит, синдром энтероколита, вызванного белками пищи (FPIES) [7], и синдром Хейнера [8]. Например, при целиакии вследствие реакции гиперчувствительности IV типа Т-клетки, специфичные к пищевым антигенам, повреждают слизистую оболочку кишечника. В качестве антигенов выступают фракции пшеничного глютена, имеющие в своем составе спиртосодержащие глиадины и кислото-, щелочнорастворимые глютенины, в сочетании с аутоиммунным компонентом [9].
К реакциям со смешанным IgЕ-зависимым и клеточно-опосредованным механизмом относятся атопический дерматит, эозинофильный эзофагит и эозинофильный энтерит.
Патогенез ПА
В физиологических условиях воздействие на организм новых пищевых продуктов приводит к формированию толерантности. Одной из важных составляющих формирования пищевой толерантности является целостность и нормальная иммунологическая активность гастроинтестинальных барьеров. Такие барьеры образованы плотно прилегающими друг к другу эпителиальными клетками, толстым слоем слизи, ферментами щеточной каемки и люминального слоя, желчными кислотами, крайними значениями рН, что делает антигены пищи менее иммуногенными. Активный иммунологический аппарат представлен компонентами врожденного (естественные киллерные клетки, полиморфноядерные лейкоциты, макрофаги, эпителиальные клетки, толл-подобные и другие паттерн-распознающие рецепторы) и приобретенного (интраэпителиальные лимфоциты и лифоциты собственной пластинки, лимфоидные структуры Пейеровых бляшек, иммуноглобулины, цитокины) иммунитета [10, 11].
Нарушения пищевой толерантности могут определяться, таким образом, вследствие:
- особых свойств пищевых аллергенов;
- нарушения проницаемости гастроинтестинальных барьеров;
- изменения иммунологической реактивности.
Остановимся кратко на возможных причинах развития ПА.
Характерные свойства пищевых аллергенов могут оказывать воздействия на изменения иммунной реактивности. Относительно небольшое количество пищевых продуктов (преимущественно яйца, молоко, арахис, лесной орех, рыба, моллюски, пшеница и соя) отвечают за развитие большинства случаев ПА [12]. Общей характеристикой таких пищевых аллергенов являются водорастворимость, молекулярная масса 10-70 кДа и относительная устойчивость к действию нагревания, пептидаз и кислот. Часть из них способны оказывать адьювантный эффект, стимулируя Тh2-ответ [12].
В настоящее время принято выделять пищевые аллергены 1-го класса (молоко, яйца, арахис и т. д.), сенсибилизация которыми происходит через пищеварительный тракт [13], и пищевые аллергены 2-го класса, которые являются аэроаллергенами и сенсибилизация которыми развивается через дыхательные пути, например, для аллергена ольхи Bet v 1 показана перекрестная реактивность с аллергеном яблока Mal d 1 [14, 15].
Нарушение проницаемости барьеров пищеварительного тракта рассматривается как возможная причина нарушения толерантности, но чаще уже существующая ПА приводит к увеличению проницаемости [16]. Более того, существуют доказательства, что раннее воздействие пищевых аллергенов в определенных условиях может предотвращать развитие ПА [17]. Временное усиление проницаемости при воспалительных инфекционных процессах может увеличивать всасывание аллергенов и приводить к сенсибилизации [18]. В последние годы накапливаются сведения о роли альтернативных путей сенсибилизации через дыхательные пути и кожу в развитии ПА, например, при синдроме оральной аллергии и при нанесении на кожу (в частности, на детскую кожу) арахисового масла [19, 20].
Рис. 1. Нарушение иммунологической толерантности при развитии ПА
Ниже подробнее остановимся на механизме сенсибилизации пищевыми аллергенами в условиях нарушения проницаемости эпителиальных барьеров (рис. 1).
Изначально антигены накапливаются на таких барьерных поверхностях, как кожа, слизистые оболочки пищеварительного тракта и дыхательных путей. В пищеварительном тракте белки пищи подвергаются денатурации, расщеплению и проходят через эпителиальный барьер, где захватываются и процессируются антигенпредставляющими клетками (дендритными клетками, макрофагами) [21]. Дендритные клетки собственной пластинки процессируют антигены до пептидных фрагментов, мигрируют в лимфоидную ткань и представляют антигенные эпитопы наивным Т-клеткам. Наивные CD4+-Т-клетки распознают с помощью Т-клеточных рецепторов аллерген-специфические эпитопы на дендритных клетках. Под действием провоспалительных цитокинов и пищевых аллергенов дендритные клетки усиливают экспрессию OX40L, что дает дополнительный сигнал к дифференцировке наивных Т-клеток в Тh2.
В процессе дифференцировки Тh2-клетки пролиферируют и секретируют интерлейкины (IL) -4, -5 и -13, которые активируют эффекторные клетки и переключают синтез В-клетками с IgМ на IgЕ [23]. Затем IgЕ связывается на поверхности тучных клеток и базофилов со своим высокоаффинным рецептором.
Повреждение эпителиального барьера увеличивает проницаемость нерасщепленных пищевых аллергенов и играет важную роль в процессе сенсибилизации. Потеря целостности эпителия пищеварительного тракта увеличивает поступление антигенов в собственную пластинку и повышает секрецию эпителием IL-33, тимического стромального лимфопоэтина (ТСЛП) и ИЛ-25 [23]. Эти цитокины усиливают иммунный ответ, регулируемый Тh2-клетками, путем активации врожденных лифоидных клеток 2 (ILC2), тучных клеток, базофилов и дендритных клеток. Активация ILC2 стимулирует продукцию IL-4, -5, -13, в свою очередь усиливая ответ Тh2-клеток [24].
Изменения иммунологической реактивности с преимущественной активацией Тh2-ответа являются характерными для развития сенсибилизации пищевыми аллергенами. Такое изменение иммунорегуляторного баланса наблюдается вследствие нарушений взаимодействия между эпителиальными клетками, антиген-представляющими клетками и регуляторными Т-клетками [25, 26]. Эпителиальные клетки кишечника несут на себе молекулы главного комплекса гистосовместимости ІІ класса и способны к представлению антигена, но не способны к адекватному вторичному сигнализированию, что определяет их толерогенные свойства. Вместе с этим в лимфоидной ткани, ассоциированной с кишечником, присутствуют различные виды регуляторных клеток:
- Тh3-клетки, секретирующие трансформирующий фактор роста-β (TGF-β);
- регуляторные Т-клетки, секретирующие IL-10;
- регуляторные Т-клетки с фенотипом CD4+CD25+, экспрессирующие транскрипционный фактор Foxp3;
- CD8+-Т-клетки;
- γδ-Т-клетки [26].
Важными для развития ПА выглядят нарушения хомминга Т-клеток вследствие нарушений экспрессии адгезионных молекул и продукции хемотаксических факторов [27]. Кроме того, показаны нарушения продукции ряда цитокинов, таких как фактор некроза опухоли-α (TNF-α), IL-5, -13 и др. [28-30]. В настоящее время не оставляет сомнений роль генетической предрасположенности к развитию ПА, но эта проблема требует дальнейшего изучения [31-34]. Кроме того, обнадеживающими выглядят результаты исследований эпигенетических воздействий [35], более подробно с этим аспектом можно ознакомиться в работе [36]. Основные звенья патогенеза ПА суммированы на рисунке 2.
Рис. 2. Патогенез и проявления ПА (https://creativecommons.org/licenses/by/4.0/)
Клинические проявления ПА
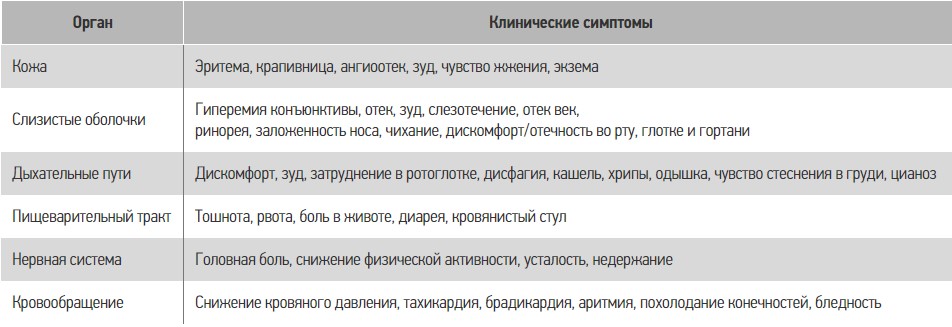
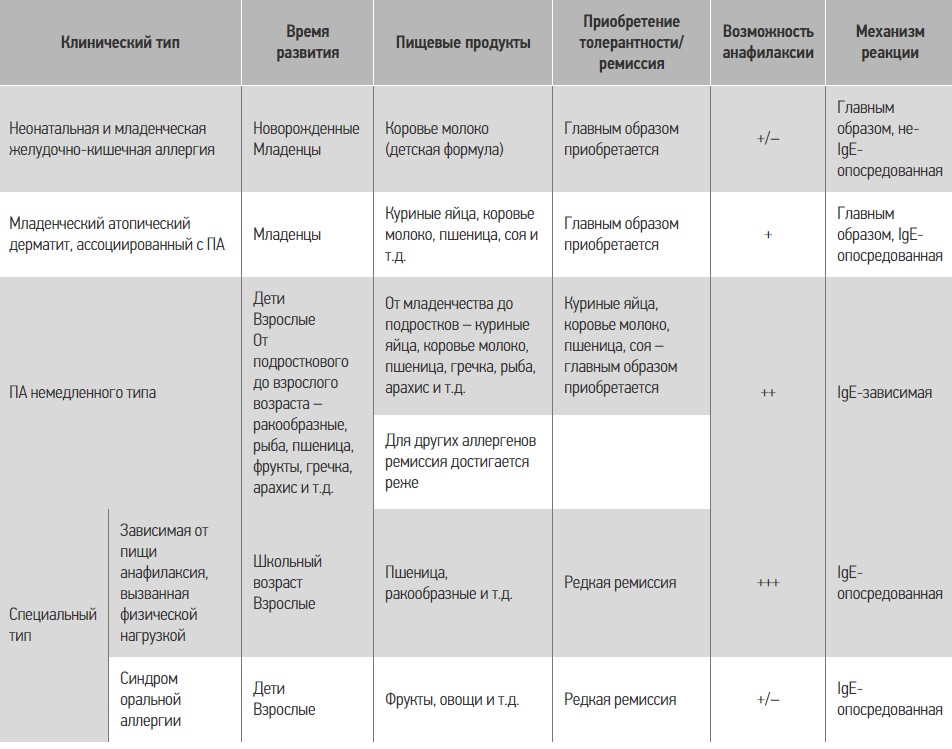
В настоящее время вследствие частой встречаемости ПА требуется особая внимательность как врачей общей практики, так и специалистов в отдельных областях медицины для раннего выявления симптомов ПА (табл. 2) [38]. Следует обратить внимание, что симптомы ПА могут наблюдаться без поражения пищеварительного тракта, что может существенно усложнять диагностику. В диагностическом процессе существенную помощь может оказать выделение клинических типов ПА (табл. 3) [38].
Таблица 2. Клинические симптомы ПА
Таблица 3. Клинические типы ПА
Значительные сложности может вызывать диагностика специального типа ПА – зависимой от пищи анафилаксии, вызванной физической нагрузкой, и синдром оральной аллергии. При зависимой от пищи анафилаксии, вызванной физической нагрузкой, пациент сначала принимает пищу, содержащую аллерген и/или гистаминолибераторы, а затем через некоторое время (обычно 30-60 мин) подвергается физической нагрузке, которая и вызывает приступ анафилаксии.
В настоящее время известно множество заболеваний, которые могут быть связаны с приемом отдельных продуктов: крапивница [39], атопический дерматит [40], эозинофильные желудочно-кишечные заболевания [41], энтеропатия с потерей белков [42], целиакия [43], первичный легочной гемосидероз (синдром Хайнера), осложненный аллергией к молоку [44]. К эозинофильным желудочно-кишечным заболеваниям относят эозинофильный эзофагит [45], эозинофильный гастрит [46], эозинофильный гастроэнтерит [47] и эозинофильный колит [48]. Более подробно с этими заболеваниями можно ознакомиться по соответствующим ссылкам.
Особенности перекрестных реакций при ПА
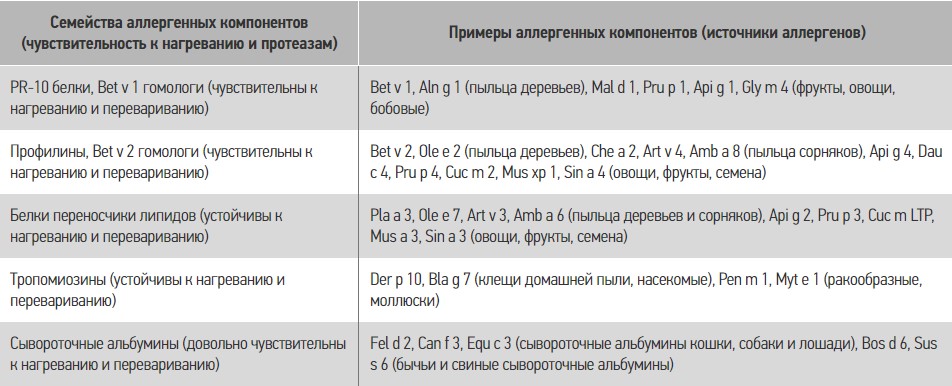
Одной из характерных особенностей течения ПА является развитие перекрестных реакций между разными группами аллергенных компонентов. При этом могут наблюдаться клинические реакции и синдромы на, казалось бы, совершенно разные группы веществ – пищевые продукты, пыльцу деревьев и сорняков, клещей домашней пыли, лекарственные вещества (вакцины, сыворотки, оболочки таблеток и т. д.) и многие другие вещества и организмы. Существенный прогресс в понимании причин развития таких клинических реакций был достигнут после широкого внедрения методов аллерген-компонентной диагностики, описания семейств аллергенов в зависимости от их химической структуры и функций [50]. Ниже остановимся на тех семействах аллергенных молекул, которые могут играть важную роль в развитии перекрестных реакций (табл. 4) [50].
Таблица 4. Семейства аллергенных компонентов, вызывающих перекрестные синдромы
Важность этих данных тяжело переоценить, так как аллергенные компоненты внутри семейства могут проявлять перекрестную реактивность, например, такие паналлергены, как тропомиозины, могут определять проявления ингаляционной аллергии на аллергены тараканов, клещей домашней пыли, пары готовящейся пищи и пищевой аллергии на ракообразных, рыбу, креветок и моллюсков.
Кроме того, сведения о чувствительности аллергена к нагреванию и действию протеаз дают возможность объяснить, почему ряд продуктов после термической обработки теряют свою аллергенность или почему нормализация процессов пищеварения вследствие восстановления протеолитического потенциала пищеварительного тракта уменьшает проявления ПА.
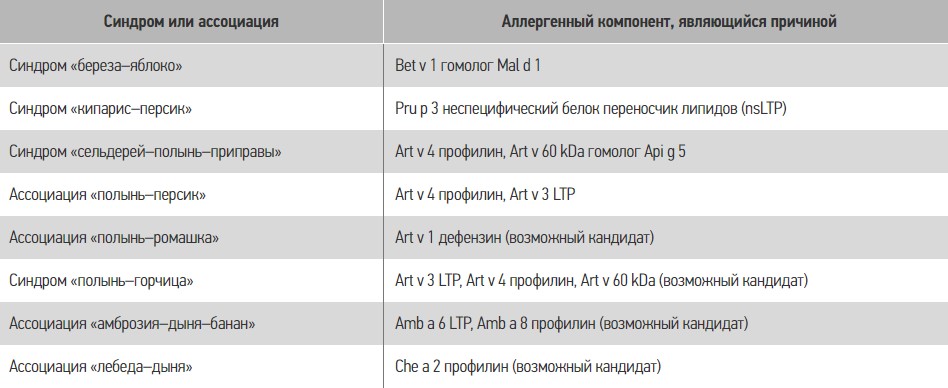
Одним из широко распространенных синдромов, встречающихся врачам различных специальностей (дерматологам, оториноларингологам, стоматологам, врачам общей практики), не говоря уже об аллергологах, является синдром оральной аллергии (oral allergy syndrome), в основе которого лежит перекрестная реактивность между пищевыми и ингаляционными аллергенами [51]. В таблице 5 приведены некоторые перекрестные синдромы, которые могут наблюдаться между пищевыми и ингаляционными аллергенами, и компоненты, вызывающие реакцию. Еще более сложными для диагностики являются случаи перекрестной реактивности между животными, грибковыми и ингаляционными аллергенами, представленные в таблице 6.
Таблица 5. Перекрестные синдромы между пищевыми и аэроаллергенами
Таблица 6. Перекрестные синдромы между животными, грибковыми и аэроаллергенами
Более подробно с особенностями перекрестных реакций между пищевыми и ингаляционными аллергенами на уровне сведений о молекулярных основах можно ознакомиться в работе [50].
Диагностические алгоритмы при ПА
Любой клинический диагностический алгоритм в случае подозреваемой ПА должен начинаться с тщательного сбора анамнеза. При сборе анамнеза нужно уделить пристальное внимание следующим вопросам:
- прием пищи и пищевых ингредиентов;
- описание всех симптомов;
- время наступления симптомов;
- количество пищи, приводящее к развитию симптомов;
- частота реакций и их воспроизводимость;
- описание последней реакции;
- сопровождающие факторы (физическая нагрузка, алкоголь, кофе, препараты, стресс и т.д.);
- ежедневные симптомы и употребляемая пища.
Все перечисленные позиции помогают выявить связь симптомов с приемом пищи, возможные продукты, вызывающие реакцию, заподозрить клинический тип ПА. Сформированная диагностическая версия позволяет перейти к дальнейшему аллергологическому исследованию пациента. При этом особое внимание уделяется тяжести наблюдавшихся эпизодов ПА, так как возможная анафилактическая реакция будет ограничивать проведение биологических проб.
В настоящее время широко применяется лабораторная диагностика при ПА, целью которой является выявление причинного аллергена и типа реакций гиперчувствительности:
- определение содержания общего IgЕ;
- определение специфических IgЕ к экстрактам пищевых аллергенов;
- компонентная диагностика с отдельными аллергенами, в том числе мультиплексная диагностика (микрочипы и т.д.);
- IgЕ-иммуноблоттинг с аллергенными экстрактами или иммуноферментный анализ (ИФА);
- тест активации базофилов: прямая активация (определение содержания гистамина, лейкотриенов, экспрессия CD63, CD203c); пассивная активация (загрузка клеток, экспрессирующих FcεRI);
- тест пролиферации Т-клеток;
- анализ секреции цитокинов.
Типичными аллергологическими пробами для таких пациентов являются:
- кожные тесты: кожная проба уколом (прик-тест), внутрикожная проба, атопическая аппликационная проба;
- элиминационная диета и повторное введение в рацион подозреваемого продукта: регистрация симптомов во время диеты и повторных приемов продуктов, ведение пищевого дневника;
- провокационные тесты: открытый оральный тест с нативным продуктом/пищевой добавкой; одинарный или двойной слепой провокационный оральный тест с продуктом; внутрижелудочный провокационный тест с фиброгастроскопией; колоноскопический аллергенный провокационный тест.
В контексте данной работы считаем необходимым остановиться на проведении нескольких важных аллергологических проб, которые в силу определенных причин не получили широкого распространения в нашей стране.
Золотым стандартом проведения аллергологической диагностики и доказательством причинности аллергена является пищевой провокационный тест (ППТ) [52]. Основными задачами, которые ставятся перед ППТ, являются:
- установление диагноза ПА и выявление аллергена:
- идентификация продуктов, к которым пациент сенсибилизирован, но которые не употреблял;
- установление продуктов, подозреваемых как причина немедленной реакции;
- определение диагноза детского атопического дерматита (проводится после элиминационной диеты);
- определения уровня приема продукта, который вызывает симптомы;
- определение дозы безопасно потребляемой пищи и верификация достижения толерантности:
- определение безопасной дозы продукта (малая или средняя);
- доказательство достижения толерантности (полная доза).
Перед проведением ППТ должны быть отменены следующие препараты: ингибиторы Н1-гистаминовых рецепторов (за 72 ч), ингибиторы лейкотриеновых рецепторов (за 24 ч), β2-агонисты (за 12 ч), ингибиторы Тh2-цитокинов (за 12 ч), теофиллин (48 ч), пероральный кромогликат натрия (48 ч), оральные стероиды (7-14 дней).
Проведение ППТ
Открытый тест. Как исследователь, так и субъекты знают содержание пробной пищи. Однако, если симптомы субъективны, тест следует проводить заслепленно. У детей дошкольного возраста приемлемым является открытый метод ППТ, поскольку можно пренебречь возможностью психогенной реакции.
Односторонний заслепленный тест. Исследователь знает содержание пробной пищи, а пациенты – нет. Для ослепления смешайте пробную пищу с маскирующим субстратом, таким как сок, пюре, овсянка или гамбургер. Порошкообразные пищевые материалы могут использоваться в качестве пробной пищи. ППТ проводят с использованием плацебо (например, только маскирующей пищи или смеси маскирующего средства и пищи, за исключением пробного пищевого продукта) в дополнение к подозреваемому продукту, представляющему интерес, в разные дни.
Двойное слепое плацебо-контролируемое тестирование проб пищи. Как испытуемые, так и исследователь, который оценивает симптомы, не знают о содержании подозреваемого продукта в пище. Проба пищи должна быть подготовлена людьми (контролерами), которые не являются исследователями. В дополнение к пробным испытаниям с использованием продуктов, представляющих интерес, тест с использованием плацебо должен проводиться в другой день.
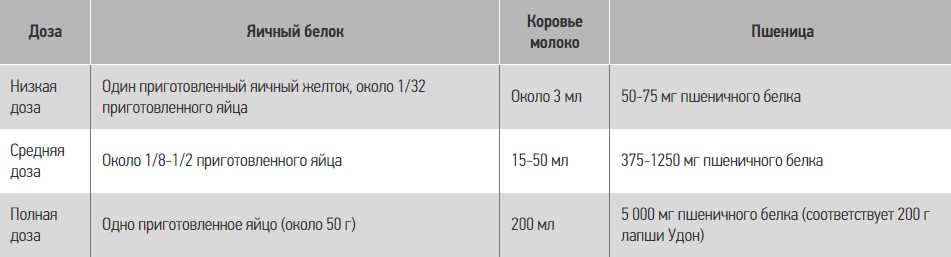
Важным является понятие общего количества аллергена, который получает пациент либо в одной дозе, либо частями. Пример назначаемого общего количества аллергена и его назначения приведен в таблице 7.
Таблица 7. Пример назначаемого общего количества аллергена и его назначения
Полная доза принимается для подтверждения толерантности, так как предполагает единичное количество приема пищи у детей начальной школы. У младенцев необходимо уменьшить общую пробную дозу. Низкая контрольная доза устанавливается дозой, которая может быть принята случайно, и назначается первоначально в случаях высокого риска. Что касается интервала введения, желательно 20 мин или более.
В таблице 8 приведены примеры для других продуктов в открытом тесте.
Таблица 8. Примеры доз продуктов в открытом тесте
Более подробно с методикой проведения ППТ можно ознакомиться по ссылке [53].
Выводы
Исследования в области непереносимости пищевых продуктов на сегодня являются бурно развивающейся отраслью аллергологии и клинической иммунологии. Прогресс в клеточной иммунологии, раскрытие цитокиновых механизмов регуляции иммунного ответа, определение генетических основ развития аллергических заболеваний, установление эпигенетических механизмов контроля, а также расшифровка молекулярных основ аллергенности компонентов пищи дали современному аллергологу мощные средства лабораторной и клинической диагностики, пути профилактики и лечения ПА.
Сегодня в нашей стране ограничены сведения о распространенности ПА в разных возрастных группах, не установлены наиболее часто встречающиеся пищевые аллергены, вызывающие реакции, отсутствуют широкомасштабные эпидемиологические исследования. Достаточно слабо внедрены в практику методы выявления ПА при различных аллергологических заболеваниях – не только лабораторные, но и клинические. Связано это с недостаточной подготовкой как на додипломном, так и на последипломном уровнях подготовки врачей.
Отсутствуют унифицированные подходы к диагностике ПА, ограниченно используются методы аллерген-компонентной диагностики, что снижает уровень выявляемости этой патологии. Вместе с тем, внедрение клинических руководств, подготовленных различными национальными системами здравоохранения, имеет ряд ограничений. Такие ограничения включают в себя не только экономические факторы, но и особенности питания различных популяций, аэропалинологические факторы территорий и т.д. Соответственно, национальные рекомендации по менеджменту ПА должны базироваться на знании перечисленных особенностей и экономических возможностей системы здравоохранения. Например, в Японии национальная система страхования покрывает определение специфических IgЕ к аллергокомпонентам следующих продуктов: яичный белок (Gal d 1 овомукоид), коровье молоко (Bos d 4 α-лактальбумин, Bos d 5 β-лактальбумин, Bos d 8 казеин), пшеница (Tri a19 w-5 глиадин), соя (Gly m4 PR-10), арахис (Ara h 2 2S альбумин), латекс (Hev b 6.02).
Благодаря проведению исследований по безопасности пищевых продуктов в Европе была внедрена маркировка продуктов, содержащих аллергены, как в магазинах, так и в учреждениях общественного питания. Целесообразным является внедрение подобной практики и в Украине, что даст возможность снизить уровень реакций на уже известные пациенту продукты, в том числе фатальных анафилаксий.
С 2017 г. в Европейском союзе начался процесс инициации совместных действий Европейского Парламента, профессиональных организаций (Европейской Академии Аллергии и Клинической Иммунологии), а также объединений пациентов, страдающих аллергическими заболеваниями. Такие совместные действия ставят своей целью создание европейской системы противодействия росту аллергических заболеваний с учетом национальных особенностей, как самих заболеваний, так и систем зравоохранения.
Таким образом, перед отечественной аллергологией и соответствующими профессиональными организациями стоят четко очерченные задания, которые должны быть решены в ближайшие годы. Вместе с тем, такие задания могут быть решены только при участии законодательных органов, руководящего органа национальной системы зравоохранения, организаций пациентов, страдающих аллергией, производителей и предпринимателей.
Список литературы
1. Nwaru B. I., Hickstein L., Panesar S. S., Roberts G., Muraro A., Sheikh A. On behalf of The EAACI Food Allergy and Anaphylaxis Guidelines Group. Prevalence of common food allergies in Europe: a systematic review and meta-analysis. Allergy. 2014. DOI: 10.1111/all.12423.
2. Cianferoni A., Spergel J. M. Food allergy: review, classification and diagnosis. Allergology International. 2009;58(4):457-466.
3. Bischoff S. C., Sellge G. 3rd ed. Blackwell Science; Malden, MA: 2003. Immune mechanisms in food-induced disease. P. 14-37.
4. Boyce J. A., Assa’ad A., Burks A. W. Guidelines for the diagnosis and management of food allergy in the United States: summary of the NIAID-Sponsored Expert Panel Report. J Allergy Clin Immunol. 2010;126:1105-1118.
5. Longo G., Berti I., Burks A. W. IgE-mediated food allergy in children. Lancet. 2013;382:1656-1664.
6. Stapel S. O., Asero R., Ballmer-Weber B. K. Testing for IgG4 against foods is not recommended as a diagnostic tool: EAACI Task Force Report. Allergy. 2008;63:793-796.
7. Caubet J. C., Ford L. S., Sickles L. Clinical features and resolution of food protein-induced enterocolitis syndrome: 10-year experience. J Allergy Clin Immunol. 2014;134:382-389.
8. Moissidis I., Chaidaroon D., Vichyanond P., Bahna S.L. Milk-induced pulmonary disease in infants (Heiner syndrome). Pediatric Allergy and Immunology. 2005;16: 545-552.
9. Schuppan D., Junker Y., Barisani D. Celiac disease: from pathogenesis to novel therapies. Gastroenterology. 2009;137:1912-1933.
10. Mowat AM. Anatomical basis of tolerance and immunity to intestinal antigens. Nat Rev Immunol. 2003;3:331-41.
11. Dahan S, Roth-Walter F, Arnaboldi P, Agarwal S, Mayer L. Epithelia: lymphocyte interactions in the gut. Immunol Rev 2007;215:243-53.
12. Radauer C, Breiteneder H. Evolutionary biology of plant food allergens. J Allergy Clin Immunol. 2007;120:518-25.
13. Han Y., Kim J., Ahn K. Food allergy. Korean J Pediatr. 2012;55:153-158.
14. Ortolani C., Ispano M., Pastorello E. The oral allergy syndrome. Ann Allergy. 1988;61:47-52.
15. Ebner C., Birkner T., Valenta R. Common epitopes of birch pollen and apples-studies by Western and Northern blot. J Allergy Clin Immunol. 1991;88:588-594.
16. Chehade M, Mayer L. Oral tolerance and its relation to food hypersensitivities. J Allergy Clin Immunol. 2005;115: 3-12; quiz 13.
17. Du Toit G, Katz Y, Sasieni P et al. Early consumption of peanuts in infancy is associated with a low prevalence of peanut allergy. J Allergy Clin Immunol. 2008;122:984-91.
18. Heyman M. Symposium on ‘dietary influences on mucosal immunity’. How dietary antigens access the mucosal immune system. Proc Nutr Soc. 2001;60:419-26.
19. Fernandez-Rivas M, Bolhaar S, Gonzalez-Mancebo E et al. Apple allergy across Europe: how allergen sensitization profiles determine the clinical expression of allergies to plant foods. J Allergy Clin Immunol, 2006.
20. Lack G, Fox D, Northstone K, Golding J. Factors associated with the development of peanut allergy in childhood. N Engl J Med. 2003;348:977-85.
21. Sampath V, Tupa D, Graham MT, Chatila TA, Spergel JM, Nadeau KC. Deciphering the black box of food allergy mechanisms. Annals of allergy, asthma & immunology: official publication of the American College of Allergy, Asthma, & Immunology. 2017;118(1):21-27. doi:10.1016/j.anai.2016.10.017.
22. Chinthrajah RS, Hernandez JD, Boyd SD, Galli SJ, Nadeau KC. Molecular and cellular mechanisms of food allergy and food tolerance. J Allergy Clin Immunol. 2016;137:984-997.
23. Hammad H, Lambrecht BN. Barrier epithelial cells and the control of type 2 immunity. Immunity. 2015;43:29-40.
24. Noval Rivas M, Burton OT, Oettgen HC, Chatila T. IL-4 production by group 2 innate lymphoid cells promotes food allergy by blocking regulatory T-cell function. J Allergy Clin Immunol. 2016;138:801-811.
25-54: список литературы находится в редакции
КОРОТКИЙ ОГЛЯД ПОБІЧНИХ РЕАКЦІЙ НА ХАРЧОВІ ПРОДУКТИ
І.П. Кайдашев
Українська медична стоматологічна академія, м. Полтава
Резюме
В статті наведено ключові положення щодо актуальності, механізмів розвитку, клінічних особливостей та можливостей сучасної діагностики харчової алергії, а також шляхи вивчення та менеджменту цієї проблеми в Україні.
Ключові слова: харчова алергія, харчова непереносимість, компонентна алергодіагностика, харчовий провокаційний тест.
REVIEW OF ADVERSE FOOD REACTIONS
I.P. Kaidashev
Poltava Ukrainian Medical And Dental Academy
Abstract
The article provides key points of the relevance, mechanisms, clinical features and possibilities of modern diagnosis of food allergy, as well as ways of studying and managing this problem in Ukraine.
Key words: food allergy, food intolerance, allergen component testing, food provocative test.