10 травня, 2018
Гіперсенситивний пневмоніт у контексті диференційної діагностики інтерстиційних захворювань легень

Інтерстиційні захворювання легень (ІЗЛ) представляють собою групу дифузних захворювань паренхіми легень (ДЗПЛ), які зустрічаються як в дитячому віці (табл. 1), так і у дорослих (табл. 2) та пов’язані з високим показником захворюваності й смертності, особливо в дитячому віці (при показнику захворюваності 13-16,2 випадку на 100 тис. дітей/рік, летальність становить у розвинених країнах від 6 до 19%) [1, 10, 17, 18, 25]. Згідно з проведеними дослідженнями, патологічні інтерстиційні зміни в легенях (Interstitial lung abnormalities) спостерігають приблизно в 2-10% пацієнтів, які були включені в клінічні дослідження, та 7% від загальної популяції [18].
Таблиця 1. Класифікація ІЗЛ в педіатрії (DPLD/ILD)
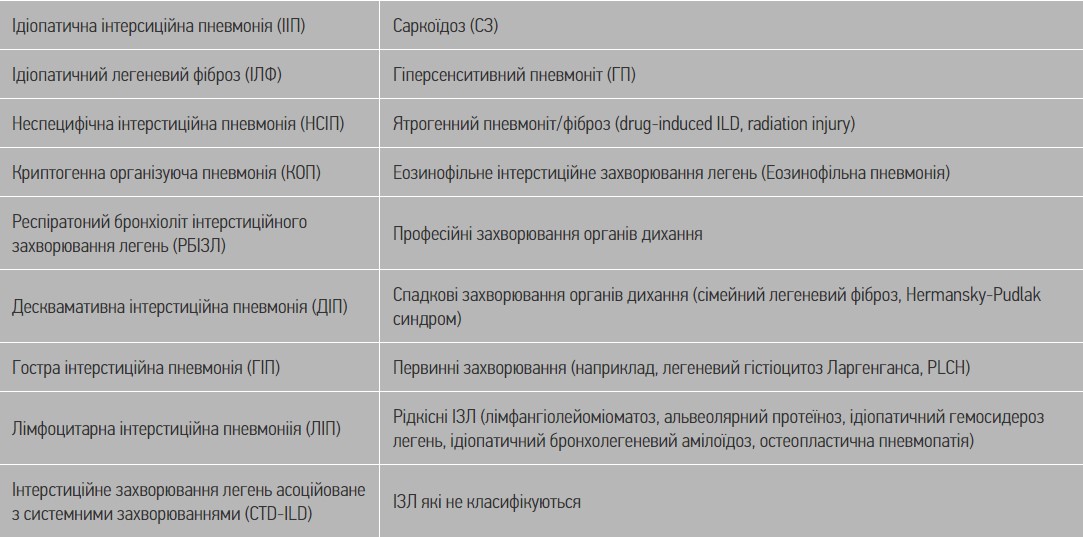
Таблиця 2. Класифікація ІЗЛ у дорослих (DPLD/ILD)
В 1944 р. Hamman і Rich описали кілька випадків «дифузного інтерстиційного фіброзу легень» з швидко-прогресуючим і фатальним перебігом протягом декількох тижнів або місяців. Це були випадки синдрому Хаммана – Річа, які отримали назву «ідіопатичний фіброз легень». Наступні дослідження показали, що синдром Хаммана – Річа слід називати гострою інтерстиційною пневмонією [19], яку слід диференціювати не лише з групою ІЗЛ, які можуть мати гострий початок або гостре загострення хронічного процесу, але й з гострим пошкодженням легень (дифузне альвеолярне пошкодження, гострий респіраторний дистрес-синдром) при багатьох гострих патологічних станах, які зустрічаються в клінічній практиці (табл. 3) [2, 3, 6, 8].
Таблиця 3. Клінічні розлади, асоційовані з розвитком гострого респіраторного дистрес-синдрому
На сьогодні є більш ніж 200 ІЗЛ з аналогічною клінічною, фізіологічною та рентгенологічною маніфестацією [19]. Проте сучасна класифікація ІЗЛ поділяє їх на чотири основні групи ДЗПЛ, де, в свою чергу, ідіопатичні інтерстиційні пневмонії поділяються на основні ІЗЛ, рідкісні ІЗЛ та ІЛЗ, які не класифікуються. Виходить, що складні для класифікації нозологічні одиниці можуть бути проліковані в залежності від перебігу захворювання [1, 20, 25].
ІЗЛ характеризуються багатьма спільними клінічними ознаками: невідома природа захворювання, прогресуюча задишка під час фізичного навантаження, непродуктивний кашель, інспіраторна крепітація при аускультації та/або інші аускультативні феномени, ознаки легеневої артеріальної гіпертензії, зміни на спіральній комп’ютерній томографії легень високої роздільної здатності (HRCT), рестриктивні вентиляційні зміни та зниження дифузійної здатності легень за СО (DLCO), розширення альвеоло-артеріального градієнта та порушення газового складу крові [1, 21, 22, 24, 25]. Для встановлення правильного діагнозу ІЗЛ можуть бути диференційовані між собою комплексно, згідно з вищезгаданою класифікацією, за клінічними проявами, рентгенологічною HRCT-знахідкою (центральне, мультифокальне, периферійне тощо), цитологічним дослідженням рідини бронхоальвеолярного лаважу (БАЛ) та дослідженням патологічно-морфологічних зразків біопсії легень, якщо остання показана, згідно з діагностичним алгоритмом (рис. 1) [6, 13, 14, 20, 22, 25].
Рис. 1. Алгоритм діагностичної стратегії ІЗЛ (Meyer)
При ІЗЛ патологічні інтерстиційні зміни в легенях на НRCT визначають як зміни, що вражають > 5% будь-якої зони легень, у тому числі ретикулярні зміни або у вигляді матового скла, дифузні центролобулярні вузлові зміни, неемфізематозні кісти, стільниковість (сотові зміни) або тракційні бронхоектази [18]. НRCT-зміни дуже схожі при різних ідіопатичних інтерстиційних пневмоніях, таких як ідіопатичний легеневий фіброз (ІЛФ), неспецифічна інтерстиційна пневмонія тощо, що призводить до помилкового встановлення первинного діагнозу ІЗЛ.
Наприклад, неспецифічну інтерстиційну пневмонію або ІЛФ плутають з гіперсенситивним пневмонітом (ГП) або навпаки, незважаючи на наявність рентгенологічних НRCT-відмінностей [12, 20]. Так, за даними одного проспективного дослідження, у пацієнтів зі встановленим діагнозом ІЛФ у 43% діагноз був змінений на ГП [15]. Окрім того, під час епідемії туберкульозу (ТБ) складною та невирішеною проблемою залишається первинна діагностика ІЗЛ/ДЗПЛ, які помилково під час первинного обстеження приймають за дисемінований ТБ легень та інші форми небацилярного ТБ легень [25]. Так, за результатами власного ретроспективного дослідження історій хворих на ІЗЛ та саркоїдоз (n = 121), які були проліковані у Волинській обласній клінічній лікарні з 2010 по 2015 р., нами було виявлено, що у 23,96% випадків (n = 29) був помилково встановлений первинний діагноз ТБ легень з наступним призначенням протитуберкульозних препаратів І ряду [25].
Гіперсенситивний пневмоніт
ГП (гіперчутливий пневмоніт, екзогенний алергічний альвеоліт, органічний пневмоконіоз, легеня фермера) – імунологічно опосередковане запальне захворювання паренхіми легень, індуковане різноманітними інгаляційними органічними або неорганічними антигенами, характеризується гіперчутливістю до антигена [4, 21, 23]. ГП проявляється як ІЗЛ внаслідок опосередкованої імунної відповіді в легенях у генетично схильних людей до тригерних факторів навколишнього середовища, проте, незважаючи на ретельні обстеження, пошук причинного індуктора ГП, за даними різних дослідників, в 30-60% випадках не встановлюється [12, 20].
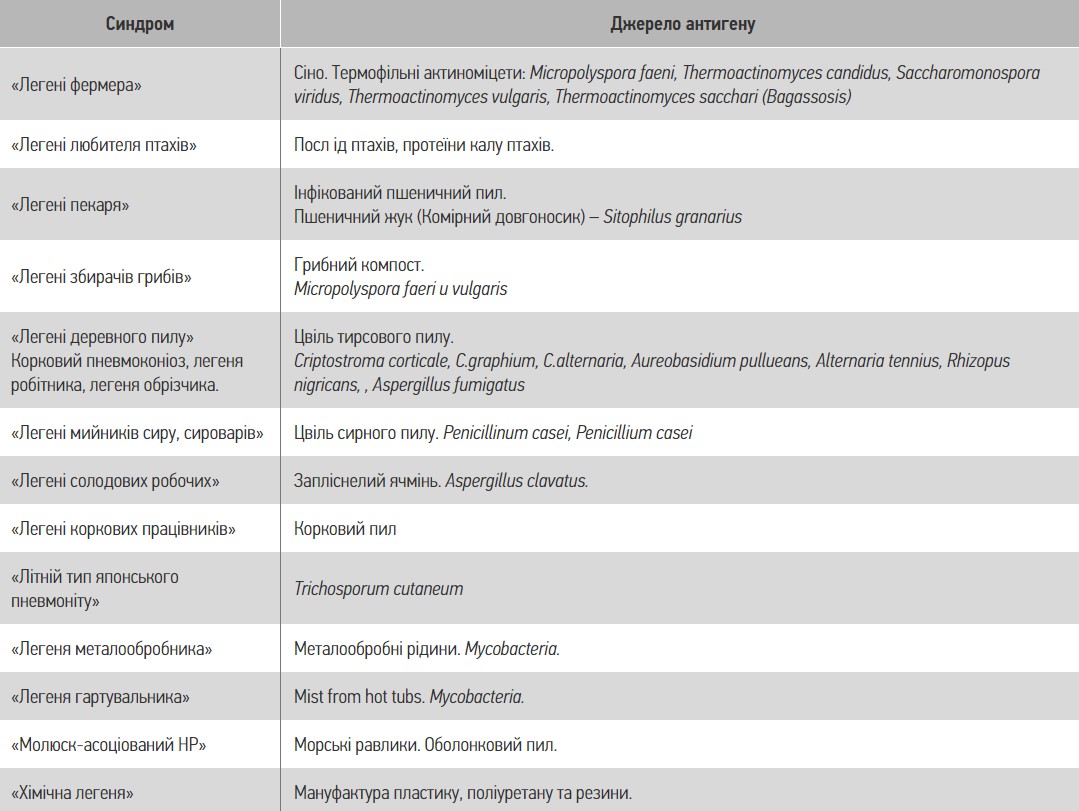
У виникненні ГП (табл. 4) основне значення мають бактерійні, грибкові, білкові антигени тваринного та рослинного походження, органічний матеріал; захворювання переважно спостерігається у працівників сільського господарства, харчової, текстильної, хімічної, деревообробної промисловості, а також серед людей у побуті та під час проведення бальнеологічних процедур [4, 5, 12, 21, 23].
Таблиця 4. Фактори розвитку ГП
Епідеміологія. Захворюваність на ГП, за різними даними, коливається від 0,3 до 0,9 на 100 тис. населення на рік («Farmer’s lung» у Швеції у 1980-х роках – 20 випадків/100 тис./рік; «НР patient» у Великій Британії – 1 випадок/100 тис./рік, у Японії – 1 випадок/млн/рік), а частка ГП від усіх ІЗЛ коливається від 2 до 47% та від 18 до 30%, за даними різних епідеміологічних досліджень [4, 12, 21]. Так, наприклад, за даними низки епідеміологічних досліджень, в Канаді серед 661 обстежених пацієнтів з ІЗЛ в 30% був встановлений ГП, в Іспанії серед 500 пацієнтів з ІЗЛ 18% мали ГП, в Індії серед 513 пацієнтів з ІЗЛ у 47% був встановлений ГП, в Данії частка ГП становить 7% від захворюваності на ІЗЛ 4,1:100 тис. хворих на рік, а в Нью-Мехіко – менше ніж 2% при показнику захворюваності на ІЗЛ 30:100 тис. [12]
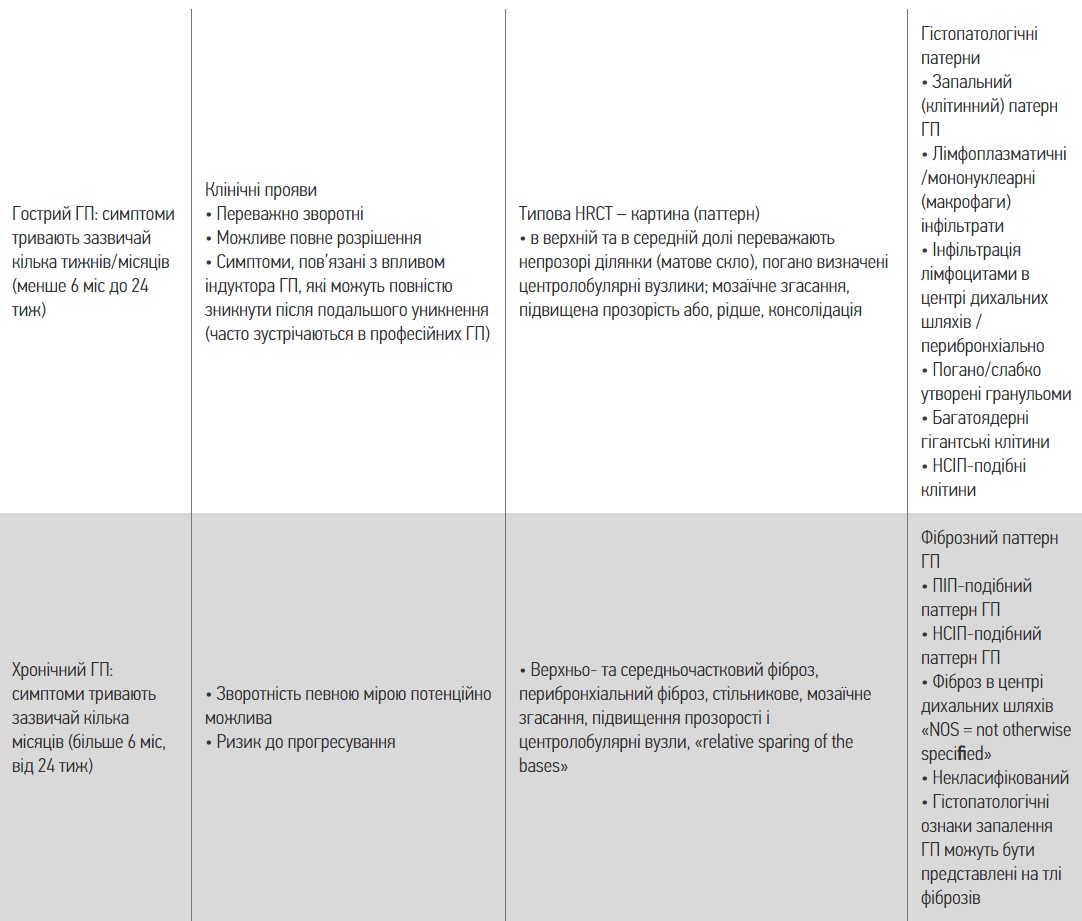
У 2017 р. на щорічному Науковому форумі з респіраторної медицини Європейського респіраторного товариства (ERS), який в 2017 р. відбувся у Мілані (Італія), на одній з наукових сесій провідними науковцями були висвітлені нові дані з епідеміології, патогенезу, менеджменту та лікування ГП, а також запропоновані нові діагностичні критерії та нова класифікація ГП, яка поділяє ГП на гострий (ГГП) і хронічний (ХГП) на основі міжнародного клінічного досвіду та доказів (табл. 5), які можуть бути використані в практиці лікаря-пульмонолога, який займається пацієнтами з ГП; проте, запропоновані критерії повинні бути підтверджені в наступних дослідженнях, тому вони поки не повинні трактуватися як гайдлайн [5, 12].
Таблиця 5. Нова запропонована класифікація ГП
Діагностика ГП потребує високопрофесійного індивідуального підходу з боку клініциста, який оцінює стан будь-якого пацієнта з ідіопатичним ІЗЛ. Діагностичні кроки повинні включати фізикальний огляд, проведення HRCT органів грудної клітки, дослідження на наявність специфічних антитіл класу IgG (SsIgG) для підтвердження впливу зовнішніх факторів або як лабораторний скринінг, а також дослідження БАЛ згідно з діагностичним алгоритмом (рис. 2) [4, 5, 12].
Рис. 2. Діагностичні критерії діагностики (алгоритм) ГП
Специфічні інгаляційні маркери можуть підтвердити етіологію захворювання і можуть бути корисними, якщо біопсія легень протипоказана. Проте біопсія легень у діагностиці ГП повинна розглядатися лише у випадку невизначеного діагнозу та лише після ретельного фізикального огляду, проведення дослідження функції дихання, інтерпретації зображень HRCT і клітинного аналізу БАЛ. Для біопсії легень у такому випадку слід розглядати трансбронхіальну кріобіопсію (TBLC) або хірургічну біопсію легень (SLB) [12, 18, 20, 26].
В патогенезі імунологічного запалення при ГП основну роль відіграють імунокомплексні алергічні реакції та алергічні реакції ІІ типу у вигляді масивного лімфоцитарного запалення в легенях з акумуляцією активованих Т-лімфоцитів у інтерстиції, з утворенням у крові преципітуючих специфічних антитіл класу IgG, активацією системи комплементу, альвеолярних макрофагів, продукцією інтерлейкіну-2 (IL-2), збільшенням вмісту фібробластів, утворенням колагену з наступним фіброзуванням інтерстицію при ХГП [4, 5, 21].
В лабораторній діагностиці використовується найбільш частий лабораторний метод для ідентифікації специфічних антитіл класу SsIgGs – імуноферментний метод (ELISA), метод імунодифузії та ImmunoCAP. Визначення причинного антигена є необхідним для діагностики, профілактичних заходів і прогнозу ГП, адже взаємозв’язок між впливом антигена і захворюванням очевидний, особливо у випадках професійного ГП. Наявність специфічних IgG може допомогти знайти зв’язок між експозицією та хворобою та/або пов’язаним з цим захворюванням, провести скринінг для виявлення потенційних індукторів, асоційованих з клінічними проявами ГП, та зменшити вірогідність причетності до етології ІЗЛ алергенів пір’я та грибків при негативних результатах. Окрім того, в лабораторній діагностиці додає цінності дослідження БАЛ, в якому наявність лімфоцитозу підвищує ймовірність діагнозу ГП – понад 80% пацієнтів з ХГП мають більше ніж 20% лімфоцитів у досліджуваному біологічному матеріалі [4, 5, 12].
На першому місці в лікуванні ГП передбачається уникнення контакту з індукуючим фактором (алергеном). Пацієнти повинні знати про індукуючі фактори ГП, в тому числі антигени в пухових ковдрах, подушках, системах вентиляції, печах, кондиціонерах, на робочому місці тощо. Якщо експозиція припинена, то симптоми швидко згасають, але погіршення функції легень може зберігатись [4, 12].
Основою фармакологічного лікування ГП в даний час є системні кортикостероїди (КС), які ефективно використовують для лікування ГГП, що підтверджено протягом останніх 25 років клінічного спостереження. Використовують різні дози і тривалість лікування, починаючи з 0,5 мг/кг (ідеальної маси тіла) за преднізолоном протягом декількох днів з повільним зниженням до найнижчої дози впродовж декількох місяців, до року або довше. У пацієнтів з ХГП, особливо з прогресуючим перебігом, можуть бути розглянуті допоміжні імуносупресивні препарати [4, 7, 12].
Слід враховувати, що групу імуносупресивних препаратів у лікуванні ГП використовують за відсутності рандомізованих клінічних випробовувань, проте в одному ретроспективному дослідженні лікування ГП азатіоприном і мікофенолатом мофетилом було відзначено покращенням газообміну та зниженням дози преднізону, що дає змогу застосовувати ці препарати в лікуванні прогресуючого ХГП [12, 16]. Також останнім часом з’явились повідомлення щодо лікування ГП такими імуносупресивними препаратами, як ритуксимаб та лефлуномід у пацієнтів, які не переносять та/або не реагують на азатіоприн або мікофенолат мофетил, проте дуже низька доказова база відкладає застосування лікарями цих препаратів у пацієнтів з ГП [11, 12].
Для лікування прогресуючого ХГП, особливо з паттерном простої інтерстиційної пневмонії, з перспективою розглядають антифібротичні препарати нінтеданіб і пірфенідон, які викристовують для лікування ІЛФ, тому рандомізовані контрольовані клінічні дослідження в цьому напрямі є доцільними [12].
Трансплантація легень залишається найкращим варіантом лікування для деяких ретельно відібраних пацієнтів з термінальною стадією ІЛЗ. Пацієнт з ГП може бути цінним кандидатом для трансплантації легень, якщо кінцева стадія його захворювання не піддається лікуванню, що призводить до низької виживаності, за умов, що він перебуває у віковому вікні та немає протипоказань до трансплантації легень. Пацієнти з прогресуючим захворюванням після трансплантації мають відмінну середньострокову виживаність і в них знижуються ризик смерті. Після першочергового візиту в центр трансплантації пацієнти проходять скринінг pretransplant, аби визначити його/її як хорошого кандидата та виявити можливі фактори ризику, які повинні бути вирішені, перш ніж пацієнт отримає лист очікування [9, 12, 26].
Клінічні випадки
Хворий С., 01.05.1977 р.н., поступив у відділення пульмонології Волинської обласної клінічної лікарні (ВОКЛ) зі скаргами на виражену задишку (MRC3), кашель, серцебиття. Вважає себе хворим протягом декількох місяців, коли з’явились вищеперелічені скарги, які наростали з часом, що змусило звернутись до лікаря за місцем проживання, який, в свою чергу, направив хворого до фтизіатра з підозрою на туберкульоз. Після консультації фтизіатра хворий був направлений до пульмонолога ВОКЛ.
Анамнез життя: працював 9 років шліфувальником дерева, 5 років – на шахті з вугільним пилом, з березня 2017 р., після участі в АТО, працює запільовщиком на термообробці чорного металу. Інфекційний, алергологічний і спадковий анамнез не обтяжений.
Об’єктивно: тілобудова нормостенічна, шкірні покриви чисті, набряки відсутні, лімфовузли не збільшені, слизові оболонки без особливостей. Перкуторно над легенями ясний легеневий звук, дихання в легенях ослаблене везикулярне, без додаткових дихальних шумів. ЧД в спокої 16-18/хв, після навантаження 28-30/хв. Сатурація киснем у спокої 90%, при навантаженні знижується до 82%. Серцеві тони ритмічні ослаблені, акцент ІІ тону над 2-ю точкою, ЧСС 100/хв. Пульс 100/хв. АТ 160/100 мм рт. ст. Живіт м’який, безболісний. Фізіологічні відправлення без особливостей.
Результати обстеження: еритроцити – 6,58х1012/л, гемоглобін – 169 г/л. КСП 2-і та Джин-Експерт – негативний результат. ВІЛ-1/2 – негативний результат. З харкотиння висіяні пневмокок, Candida. Серологічні обстеження на предмет виявлення специфічних IgG не проводились. ЕКГ: ритм синусовий, правильний, нормограма, ЧСС 100/хв. Дослідження ФЗД: форсована життєва ємність легень (ФЖЄЛ; FVC) – 2,12 л/сек (48%). Обєм форсованого видиху за 1-шу секунду (ОФВ1; FEV1) – 2,11 л (58%). Індекс Тіфно 99%. ФЗД з дифузією газів за СО (DLCO) – 38,1% (проведена в 2017 р. в ДУ НІФП ім. Ф. Яновського). ЕхоКГ – ознаки легеневої артеріальної гіпертензії І ст. (тиск у правому шлуночку – 35 мм рт. ст.). СКТ ОГК (рис. 3, А, Б).
Рис. 3. CКТ ОГК хворого С.
Клінічний діагноз: «Гіперсенситивний пневмоніт, гострий перебіг в поєднанні з пневмоконіозом. ЛН ІІ–ІІІ. MRC-3. Легенева артеріальна гіпертензія І ст. Гіпертонічна хвороба І ст. ІІ. ССР низький СН I ст., ФК І».
Призначене лікування: елімінаційні заходи вдома та на робочому місці; киснева терапія через кисневий концентратор 30% киснем зі швидкістю до 3 л/хв, вночі та після навантаження під контролем сатурації крові; медрол у дозі 32 мг/добу (з розрахунку 0,5 мг/кг за преднізолоном) – 1 міс, з поступовою відміною 4 мг/тиж до повної відміни; пантопразол по 40 мг/добу на період прийому ГКС; бісопролол 5 мг/добу.
Хвора А., 02.10.1970 р.н., звернулась до лікаря-пульмонолога ВОКЛ зі скаргами на виражену задишку при навантаженні (MRC3), кашель періодичного характеру з виділенням мокротиння молочного кольору, болі в суглобах, загальну слабкість, серцебиття, часті простудні захворювання, ожиріння (ІМТ – 42).
Анамнез захворювання: вважає себе хворою протягом останніх 4 років, проте наявність симптому «барабанних паличок з годинниковими скельцями» та задишку при навантаженні відмічала й раніше. Різке погіршення загального стану відбулось у лютому 2014 р. на тлі повного благополуччя з проявів ГРІ, зі встановленим діагнозом у ЦРЛдвобічної полісегментарної пневмонії з перебуванням на апараті ШВЛ у відділенні реанімації з ПІТ та позитивною динамікою у лікуванні на тлі КС-терапії. У 2014 р., після скерування з ЦРЛ до ВОКЛ, пульмонологом був встановлений діагноз ідіопатичного легеневого фіброзу, з призначенням схеми лікування: преднізолон + азатіоприн з наступним переходом на медрол 16 мг/добу, який був відмінений у зв’язку з виникненням стероїдного діабету. Пацієнка була консультована в ДУ НІФП ім. Ф. Яновського, де був встановлений діагноз «Гіперсенситивний пневмоніт» і призначений лефлуномід 20 мг/добу з позитивною динамікою в лікуванні (зменшення задишки).
Анамнез життя: протягом останніх 12 років до початку захворювання працювала на трикотажній фабриці кравчинею. Обтяжений онкологічний анамнез: екстирпації матки з придатками в 2005 р. з приводу раку шийки матки, з обліку знята. Інфекційний, спадковий та алергологічний анамнез не обтяжений. Гіпертонічна хвороба ІІ. Цукровий діабет ІІ типу.
Об’єктивно: тілобудова гіперстенічна, шкірні покриви чисті, набряки відсутні, симптом «барабанних паличок з годинниковими скельцями», лімфовузли не збільшені, слизові – акроціаноз губ. Перкуторно над легенями ясний легеневий звук, дихання в легенях ослаблене везикулярне, супроводжується інспіраторною крепітацією в нижніх відділах обох легень (значна динаміка аускультативної картини в легенях зі скороченням тривалості інспіраторної крепітації на тлі лікування). Частота дихання в спокої 18/хв, після навантаження 36/хв. Сатурація киснем у спокої 90%, при навантаженні знижується до 77%. Серцеві тони ритмічні ослаблені, ЧСС 96/хв. Пульс 96/хв. АТ 120/75 мм рт. ст. Живіт м’який, безболісний. Фізіологічні відправлення без особливостей. Місячні відсутні.
Результати обстеження: лейкоцити – 7,7х109/л. Еритроцити – 5,6х1012/л. Гемоглобін – 140 г/л. Тромбоцити – 247х109/л. ШОЕ – 26 мм/год. Глюкоза – 21,3 ммоль/л. Глікемічний профіль – 9,4; 13,7; 22,1; 13,0. Глікований гемоглобін – 9,2% С-реактивний протеїн – 26 мг/л. Креатинін – 70 ммоль/л. КСП 2-і та Джин-Експерт – негативний результат. ВІЛ-1/2 – негативний результат. Серологічні обстеження на предмет специфічних IgG не проводились. ЕКГ: ритм синусовий, правильний, лівограма, ЧСС 96/хв. ФЗД: ФЖЄЛ – 3,15 (37%), ОФВ1 – 2,70 (42,79%), індекс Тіфно – 99%. ФЗД з дифузією газів за СО (DLCO) – 26,2% (проведена в 2017 р. в ДУ НІФП ім. Ф. Яновського). ЕхоКГ: легенева артеріальна гіпертензія І ст. СКТ ОГК (рис. 4, А, Б).
Рис. 4. СКТ ОГК хворої А.
Клінічний діагноз: «Гіперсенситивний пневмоніт, хронічний перебіг. Легеневий фіброз. ЛН ІІІ. MRC-3. Легенева артеріальна гіпертензія І ст. Гіпертонічна хвороба І. ст. ІІ. СН І, ФК ІІ. Цукровий діабет ІІ, некомпенсований».
Призначене лікування: елімінаційні заходи; обмеження надмірного навантаження; вакцинація проти грипу «Ваксигрип» та проти пневмококової інфекції «Превенар 13»; киснева терапія через кисневий концентратор 30% киснем до 3-5 л/хв, вночі та після навантаження під контролем сатурації крові; лефлуномід 20 мг/добу за призначенням НІФП ім. Ф. Яновського – тривало (контроль лейкоцитарної формули та печінкових проб щомісяця); рекомендації кардіолога, ендокринолога.
Хворий М., 29.09.1961 р.н., звернувся до ВОКЛ зі скаргами на виражену задишку при мінімальному фізичному навантаженні (MRC4), кашель періодичного характеру, висипання на шкірі верхніх кінцівок і стоп геморагічного характеру, які супроводжувались свербежем, болі в суглобах і ранкову скутість, яка тривала впродовж дня, загальну слабкість і підвищення температури тіла до 38-39 °С під вечір періодичного характеру, періодичні носові кровотечі.
Анамнез захворювання: вважає себе хворим протягом багатьох років, захворювання розпочалось з задишки, яку почав помічати під час фізичного навантаження, працюючи на будівництві. У 2006 р. на підставі змін на рентгенографії ОГК був встановлений діагноз ВДТБ, інфільтративно-деструктивний обох легень, МБТ +/-, з наступним призначенням протитуберкульозних препаратів І ряду на 6 міс лікування. У 2016 р. відмітив різке погіршення стану, у зв’язку з чим звернувся до фтизіатра, який скерував хворого до пульмонолога ВОКЛ, який встановив діагноз «Гіперсенситивний пневмоніт, бульозна емфізема. Гістіоцитоз легень (?)» з наступним скеруванням в ДУ НІФП ім. Ф. Яновського, де був встановлений діагноз: «Гіперсенситивний пневмоніт («легеня ткачів»), хронічна форма, поширений пневмофіброз. Бульозна емфізема легень». З 2016 р. отримував КС-терапію (медрол 32-24–16-8) з незначною позитивною динамікою в лікуванні, проте в 2017 р. загальний стан погіршився, наросли ознаки дихальної недостатності, на тлі клінічних ознак дихальної недостатності в кінці 2017 р. з’явилися суглобовий і геморагічний синдроми (періодичні носові кровотечі та висипання геморагічного характеру), які зменшувалися на тлі КС-терапії. На підставі клініко-лабораторних критеріїв хворому був встановлений діагноз «Ревматоїдний артрит, поліартрит, акт ІІІ. ФНС ІІ» та призначена базисна терапія метотрексатом у дозі 10 мг/тиж на тлі КС-терапії медролом у дозі 6 мг/добу та фолієвої кислоти по 5 мг/добу/тиж.
Анамнез життя: протягом 20 років працював помічником майстра ткацького обладнання на меланжевому комбінаті, а також займався ремонтними роботами на будівництві без індивідуальних засобів захисту, працюючи зі шпаклівкою, фарбами та іншими хімічними речовинами (пінотекс, дьоготь). Соматичний анамнез: ідіопатичний риніт.
Об’єктивно: тілобудова нормостенічна, хворий астенізований, шкірні покриви – геморагічні, розеольозно-петехальні висипання (васкуліт) на шкірі передпліч і стоп, кушингоїдне обличчя (на тлі прийому медролу), набряки відсутні, симптом «барабанних паличок з годинниковими скельцями», лімфовузли не збільшені, слизові оболонки – акроціаноз слизових губ. Перкуторно над легенями коробковий звук, дихання в легенях ослаблене везикулярне, супроводжується інспіраторною крепітацією в середньо-нижніх відділах обох легень. ЧД в спокої 26/хв, після навантаження 45-50/хв. Сатурація киснем у спокої 83%, при навантаженні знижується до 51%. Серцеві тони ритмічні, посилені, ЧСС 100/хв. Пульс 100/хв. АТ 90/60 мм рт. ст. Живіт м’який, безболісний. Печінка виступає на 2 см з-під краю реберної дуги, безболісна. Селезінка не збільшена. Симптом Пастернацького негативний з обох боків. Фізіологічні відправлення без особливостей.
Результати обстежень: еритроцити – 4,4х1012/л. Гемоглобін – 145 г/л. Лейкоцити – 10,9х109/л. ШОЕ – 28 мм/год. Тромбоцити – 198х109/л. КСП 2-і та Джин-Експерт (попередні обстеження) – негативний результат. АСТ – 24 од./л, АЛТ – 12 од./л. Креатинін – 51 мкмоль/л. С-реактивний протеїн – 77 мг/л. ЦІК – 80 од. Кріоглобуліни – позитивний результат. Ревматоїдний фатор – 266 од. СІ. IgG до циклічного цитрулінового пептиду (A-CCP) – 468,7 од./мл. IgG до цитрулінового віментину (MCV) > 200 од./мл. Fc-фрагмент IgG автоантитіла IgA (РФ) > 13 R. Fc-фрагмент IgG автоантитіла IgM (РФ) > 13 R. ВІЛ-1/2 – негативний результат (попередні обстеження). HbsAg – негативний результат. Сумарні антитіла до HCV та HbcorAg – негативний результат. Кров на стерильність – негативний результат. Серологічні обстеження на предмет специфічних IgG не проводились. ЕКГ: ритм синусовий, правильний, нормограма, ЧСС 92/хв. ФЗД анамнестична, оскільки в зв’язку з тяжкістю стану на момент поступлення дослідити ФЗД не вдалось: ФЖЄЛ – 54,43%, ОФВ1 – 59%, індекс Тіфно – 112%. ВН ІІ, рестрикція. ФЗД з дифузією газів за СО (DLCO) – 30,3% (проведена в 2016 р. при поступленні в ДУ НІФП ім. Ф. Яновського). ЕхоКГ – ознаки легеневої артеріальної гіпертензії (55 мм рт. ст). ФВ 56%. СКТ ОГК (рис. 5, А, Б).
Рис. 5. СКТ ОГК хворого М.
Клінічний діагноз: «Гіперсенситивний пневмоніт, хронічний, прогресуючий варіант перебігу. Легеневий фіброз. Бульозна емфізема. ЛН ІІІ (MRC-4). Легенева артеріальна гіпертензія середнього ступеня. ФК ІІІ. Ревматоїдний артрит, поліартрит, активність ІІІ. ФНС ІІ. Геморагічний васкуліт. Синдром Каплана».
Стаціонарне лікування: киснева терапія 30% киснем зі швидкістю 5 л/хв; пульс-терапія солумедролом у дозі 1000 мг внутрішньовенно крапельно № 3; метотрексат у дозі 40 мг; метилпреднізолон у дозі 32 мг; сілденафіл по 60 мг/добу; пантопразол у дозі 40 мг; фолієва кислота по 5 мг; препарати кальцію.
Хворий виписаний додому з позитивною динамікою в лікуванні, проте, враховуючи кращу доказову базу з лікування ревматоїдного артриту та позитивний досвід застосування лефлуноміду для лікування хронічного ГП, хворий був переведений на даний препарат у дозі 20 мг/добу на тлі метилпреднізолону в дозі 32 мг/добу на місяць (зі зменшенням дози по 4 мг/тиж до повної відміни), + пантопразол по 40 мг/добу на період прийому КС, + сілденафіл по 60 мг/добу, + киснева терапія через кисневий концентратор 30-50% киснем до 5 л/хв, вночі та після фізичного навантаження під контролем сатурації крові, + планова вакцинація проти грипу «Ваксигрип» щороку та проти пневмококової інфекції «Превенар 13» 1 раз/5 років.
Враховуючи високу активність РА з клінічними проявами васкуліту та синдрому Каплана, пацієнту як альтернативне лікування запропонована імунобіологічна терапія Ритуксимабом. Даний пацієнт є цінним кандидатом для трансплантації легень через термінальну стадію захворювання легень, яке не піддається лікуванню, проте даний хірургічний метод лікування в нашій країні відсутній.
Висновки
Актуальним і частково невирішеним питанням у клінічній практиці лікаря-пульмонолога є грамотна тактика діагностики й лікування на основі доказової медицини, групи ІЗЛ (ДЗПЛ) як у дітей, так і у дорослих, до яких належить і ГП. Однією з частих лікарських помилок є неправильно встановлений первинний діагноз пацієнту з патологією органів дихання у вигляді ТБ легень, ІЛФ або інших ІЗЛ, і як наслідок – неправильно обрана тактика лікування. У статті викладена інформація з епідеміології, патогенезу, менеджменту та лікування хворих з ГП у контексті диференційної діагностики ІЗЛ згідно з сучасним діагностичним алгоритмом, а також рентген-патерни HRCT при ІЗЛ, на основі останніх наукових даних, представлених на конгресі Європейського респіраторного товариства в 2017 р. (Мілан, Італія), і огляду наукової літератури, з наведеними клінічними випадками з особистого клінічного досвіду, що, в свою чергу, може бути використано в клінічній практиці пульмонолога та лікарів інших спеціальностей.
Список літератури
1. Antoniou KM, Margaritopoulos GА et al.: Interstitial lung disease. Eur Respir Rev. 2014; 23: 40-54.
2. Dubini A. Acute lung injury and ILDs: Biological and pathological bases. Postgraduate Course. ERS2017.
3. Elizabeth R. Johnson et al. Acute Lung Injury: Epidemiology, Pathogenesis, and Treatment. Aerosol Med Pulm Drug Deliv. 2010 Aug; 23(4): 243-252.
4. ERS handbook. Respiratory Medicine/ 2nd Edition. 2013.
5. ERS International Congress, Milan 2017. Hypersensitivity pneumonitis: current concepts and perspectives in diagnosis, pathogenesis and management. http://www.ers-education.org/events/international-congress/milan-2017.aspx?idParent=186691
6. ERS International Congress, Milan 2017. PG11 Acute interstitial lung diseases (ILD). http://www.ers-education.org/events/international-congress/milan-2017.aspx?idParent=206071
7. Jouko I. Kokkarinen et al. Effect of Corticosteroid Treatment on the Recovery of Pulmonary Function in Farmer’s Lung. American Review of Respiratory Disease. Vol. 145, No. 1. Jan 01, 1992.
8. Kaarteenaho R. et al. Diffuse Alveolar Damage: A Common Phenomenon in Progressive Interstitial Lung Disorders. Pulmonary Medicine Volume 2011 (2011), Article ID531302, 10 pages http://dx.doi.org/10.1155/2011/531302.
9. Kern RM et al. Lung transplantation for hypersensitivity pneumonitis. Chest 2015;147:1558-1565.
10. Kurland G et al. An official American Thoracic Society clinical practice guideline: classification, evaluation, and management of childhood interstitial lung disease in infancy. Am J Respir Crit Care Med 2013.
11. Lota HK et al. Novel use of rituximab in hypersensitivity pneumonitis refractory to conventional treatment. Thorax 2013; 68: 780-781.
12. Martina Vasakova et al. Hypersensitivity Pneumonitis: Perspectives in Diagnosis and Management. American Journal of Respiratory and Critical Care Medicine Volume 196 Number 6. September 15 2017.
13. Meyer KC, Raghu G: Patient evaluation. In Interstitial Lung Disease: A Practical Approach. Second edition. Edited by: Baughman RP, Du Bois RM. New York: Springer. 2011; 3-16.
14. Meyer KC: Interstitial lung disease in the elderly: pathogenesis, diagnosis and management. Sarcoidosis Vasc Diffuse Lung Dis. 2011; 28: 3-17.
15. Morell et al. www.thelancet.com/respiratory. Vol 1 November 2013.
16. Morisset J et al. Use of mycophenolate mofetil or azathioprine for the management of chronic hypersensitivity pneumonitis. Chest 2017; 151: 619-625.
17. Neil J Hime et al Childhood interstitial lung disease: A systematic review Pediatr Pulmonol. 2015; 50:1383-1392.
18. Tomassetti S. et al Diffuse parenchymal lung disease / Eur Respir Rev 2017; 26: 170004.
19. Vijayan V. K. Classification of Interstitial. Lung Disease Medicine Update 2005.
20. William D. Travis et al. An Official American Thoracic Society/European Respiratory Society Statement: Update of the International Multidisciplinary Classification of the Idiopathic Interstitial Pneumonias. Аmerican journal of respiratory and critical care medicine. Vol. 188 2013.
21. Гаврисюк В. К. Очерки клинической пульмонологии. Под ред. В. К. Гаврисюка. Киев, 2016. 366 с.
22. Гаврисюк В. К. Редкие интерстициальные заболевания легких. Под ред. В. К. Гаврисюка. Киев, 2012. 148 с.
23. Ланге С., Уолш Дж. Лучевая диагностика заболеваний органов грудной клетки: руководство: атлас; перевод с анг. под ред С.К. Терновского, А. И. Шехтера. М.: ГЭОТАР-Медиа, 2010. 432 с.
24. Чучалин А. Г. Пульмонология: национальное руководство. Под ред. А. Г. Чучалина. М.: 2009. 960 с.
25. Яковенко О. К. зі спів. Клінічна імунологія. Алергологія. Інфектологія. Інтерстиційні захворювання легень. Діагностична дилема в умовах епідемії туберкульозу. 2016. 2 (91) .
26. Яковенко О. К. зі спів. Погляд на сучасну пульмонологію очима практикуючого лікаря. За матеріалами European Respiratory Society International congress, 2016 (London, UK). Клінічна імунологія. Алергологія. Інфектологія. Спецвипуск, 2017.
Гиперсенситивный пневмонит в контексте дифференциальной диагностики интерстициальных заболеваний легких
О. К. Яковенко1, Т. Л. Яковенко2
1 Волынская областная клиническая больница. 2 Луцкая городская детская поликлиника
Резюме
В статье изложена актуальная информация по эпидемиологии, патогенезу, менеджменту и лечению больных с гиперсенситивным пневмонитом на основе последних научных данных, представленных на конгрессе Европейского респираторного общества в 2017 г. (Милан, Италия), в контексте дифференциальной диагностики интерстициальных заболеваний легких с приведенными клиническими случаями, которая может быть использована в практике пульмонолога.
Ключевые слова: гиперсенситивный пневмонит, диагностика, дифференциальная диагностика, лечение.
Hypersensitive pneumonitis in the context of differential diagnosis of interstitial lung diseases
O. Yakovenko1, T. L. Yakovenko2
1 Volyn Regional Clinical Hospital. 2 Lutsk city children’s polyclinic
Abstract
The article contains current information on the epidemiology, pathogenesis, management and treatment of patients with hypersensitive pneumonitis based on the latest scientific data presented at the Congress of the European Respiratory Society in 2017 (Milan, Italy) in the context of differential diagnosis of interstitial lung diseases with the given clinical cases, which can be used in the practice of pulmonologists.
Key words: hypersensitive pneumonitis, diagnosis, differential diagnosis, treatment.