3 грудня, 2018
Лактімак форте: надійна профілактика дисбіозу у хворих на гострі респіраторні вірусні інфекції
 Гострі респіраторні вірусні інфекції (ГРВІ), за даними багатьох фахівців, посідають провідне місце у структурі інфекційних хвороб і становлять 80-90% усієї захворюваності. У період епідемії хворіє від 5 до 20% населення. В Україні щорічно реєструють приблизно 10-15 млн хворих на гострі респіраторні інфекції, у тому числі грип [1]. Майже у кожного четвертого хворого на ГРВІ різної етіології розвиваються бактеріальні ускладнення або відбувається загострення хронічних хвороб, що потребує призначення антибіотиків [2]. Останнє призводить до значних змін нормальної мікрофлори не лише шлунково-кишкового тракту (ШКТ), а й респіраторної та сечовидільної систем – дисбіозу.
Гострі респіраторні вірусні інфекції (ГРВІ), за даними багатьох фахівців, посідають провідне місце у структурі інфекційних хвороб і становлять 80-90% усієї захворюваності. У період епідемії хворіє від 5 до 20% населення. В Україні щорічно реєструють приблизно 10-15 млн хворих на гострі респіраторні інфекції, у тому числі грип [1]. Майже у кожного четвертого хворого на ГРВІ різної етіології розвиваються бактеріальні ускладнення або відбувається загострення хронічних хвороб, що потребує призначення антибіотиків [2]. Останнє призводить до значних змін нормальної мікрофлори не лише шлунково-кишкового тракту (ШКТ), а й респіраторної та сечовидільної систем – дисбіозу.
ГРВІ впродовж багатьох років залишаються проблемою охорони здоров’я багатьох країн, а економічні збитки, пов’язані з прямими та непрямими наслідками епідемій, спалахів захворювань становлять сотні мільярдів доларів [3].
Зменшення кількості ускладнень і запобігання негативним наслідкам ГРВІ перебувають у прямій залежності від способу лікування.
У патогенезі ГРВІ одним з основних синдромів є ендотоксикоз. Значне зростання показників ендогенної інтоксикації у сироватці крові хворих залежить від рівня токсемії та активності інфекційного процесу [4].
Дисбіоз – це якісна та кількісна зміна нормального видового складу бактерій, що призводить до порушення рівноваги мікрофлори кишечнику, респіраторного тракту чи сечостатевої системи [5].
Серед екзогенних факторів розвитку дисбіозу перше місце посідає необґрунтоване та нераціональне призначення антибактеріальних препаратів, серед ендогенних факторів друге місце належить гострим інфекційним захворюванням. Отже, пацієнти з ГРВІ, що були включені у наше дослідження, перебували під впливом поєднаних екзогенних та ендогенних факторів [5, 6].
Мікробний склад кишкової флори. У товстому кишечнику домінує облігатна мікрофлора, яка представлена строгими анаеробами (біфідобактерії, еубактерії, бактероїди), що становлять до 90% усієї кількості мікроорганізмів, і аеробами (лактобактерії, кишкова паличка й ентерококи), на які припадає 8-10%. Отже, на факультативну і транзиторну мікрофлору (золотистий стафілокок, різні види стрептококів, клебсієли, ентеропатогенна кишкова паличка, протей, клостридії, синьогнійна паличка, дріжджоподібні гриби і гриби роду Candida) припадає не більше 1-2%. Інші види бактерій з’являються в товстому кишечнику вкрай рідко. Тому для орієнтовної оцінки стану мікробіоценозу товстої кишки (еубіоз або дисбіоз) немає потреби щоразу визначати наявність кількасот видів мікроорганізмів, а достатньо встановити 15-18 із них [7, 8].
Функції мікрофлори слизових оболонок і шкіри здорової людини:
1. Забезпечення колонізаційної резистентності макроорганізму завдяки антагоністичним відносинам між облігатною мікрофлорою та умовно-патогенними мікроорганізмами.
2. Вироблення речовин з антибіотичними властивостями (бактеріоцинів), а також органічних кислот, що зміщують рівень рН у кислий бік (до 5,3-5,8), перешкоджаючи росту і розмноженню гнильної мікрофлори.
3. Детоксикаційна дія щодо ендогенних та екзогенних токсинів шляхом їх абсорбції (природний біосорбент) і виведення з організму (метали, феноли, різні отрути рослинного, тваринного та мікробного походження).
4. Участь у синтезі вітамінів (К і групи В, фолієвої, нікотинової кислот), у всмоктуванні вітаміну D і солей кальцію, продукуванні цитокінів і синтезі амінокислот.
5. Імунний захист макроорганізму із впливом на різні ланки тканинної та гуморальної імунної системи, включаючи синтез імуноглобулінів, інтерферону, а також підтримання функціональної активності неспецифічних факторів захисту (комплемент, лізоцим та ін.).
6. Вироблення біологічно активних речовин, що стимулюють метаболічні процеси в організмі (ферменти, медіатори, гістамін, β-аланін, γ-аміномасляна кислота тощо).
7. Ферментативне розщеплення харчових речовин, не перетравлених у тонкій кишці, в тому числі харчових волокон, з утворенням амінів, фенолів.
8. Морфокінетична (трофічна) дія, підсилення фізіологічної активності травного тракту [9, 10].
Жодна з функцій товстого кишечнику не може бути реалізована без участі мікрофлори [9, 10].
Усе вищевикладене характеризує важливість досліджуваної проблеми і визначає мету дослідження: оцінювання ефективності Лактімаку форте у хворих на ГРВІ з погляду профілактики розвитку дисбіозу, зокрема, на фоні антибіотикотерапії.
Матеріали та методи. Упродовж грудня 2017 – квітня 2018 рр. обстежено 150 хворих віком від 18 до 65 років (медіана – 24,5; міжквартильний інтервал 19,00-34,00) на базі інфекційного відділення міської клінічної лікарні № 4 м. Києва з діагнозом «гостра респіраторна вірусна інфекція середньотяжкого та тяжкого ступеня», у тому числі – 65 (43,3%) з ускладненням (пневмонією).
Чоловіків було 86 (57,3%), жінок – 64 (42,7%). Серед пацієнтів переважали особи молодого віку – 132 (88%). Хворих віком від 18 до 24 років було 81 (54%), від 25 до 44 – 51 (34%), від 45 до 65 – 18 (12%). За ступенем тяжкості ГРВІ хворі розподілені таким чином: середньотяжкий – у 95 (63,3%), тяжкий – у 55 (36,7%) осіб.
Згодом пацієнтів розподілили на 3 групи залежно від клінічних проявів хвороби, наявних ускладнень і відмови від використання Лактімак форте. До 1-ї групи (n=50) увійшли хворі, які на фоні основного лікування без антибіотикотерапії отримували Лактімак форте по 1 капсулі 2 рази на добу протягом 14 днів. До 2-ї групи включили 50 хворих, які основне лікування та антибіотикотерапію поєднували із вживанням Лактімак форте. До 3-ї групи увійшли 50 хворих, які отримували основне лікування з антибіотикотерапією або без неї та без Лактімак форте.
Групи були рандомізовані за статтю, віком, клінічними характеристиками.
У всіх пацієнтів брали кал для дослідження на дисбіоз у день госпіталізації та після 14-денного вживання Лактімаку форте в рекомендованих дозах.
Наведене вище основне лікування призначали згідно з чинним Уніфікованим клінічним протоколом первинної медичної допомоги дорослим та дітям «Гострі респіраторні інфекції», затвердженим наказом Міністерства охорони здоров’я України від 16.07.2014 № 499.
Відповідність даних дослідження закону нормального розподілу перевіряли тестом Колмогорова – Смірнова. Для опису даних використовували медіану та міжквартильний інтервал – Me, ІQR (Q1-Q3). Оскільки отримані результати мали відхилення від нормального розподілу варіаційного ряду, для порівняння груп ми використовували непараметричні методи статистики: U-критерій Манна – Уїтні (для незалежних груп), парний критерій Вілкоксона (для залежних груп). Для дослідження взаємозв’язку кількісних показників використовували кореляційний аналіз, ранговий критерій Спірмена (r), для якісних – аналіз таблиць спряженості, знаходили критерій χ2, силу взаємозв’язку φ. Для визначення факторів ризику (RR) та прогнозування ефективної терапії розраховували відношення шансів і його 95% довірчий інтервал. Застосовували програмно-математичний комплекс для персонального комп’ютера Microsoft Exel 2007 та комп’ютерні програми для статистичного аналізу й обробки даних Statistica 6.0 (Statsoft Inc., США), SPSS Statistica 20 (ІВМ, США).
Результати. Провідним синдромом у пацієнтів усіх груп був інтоксикаційний, який проявлявся підвищенням температури тіла, вираженою загальною слабкістю, ломотою у тілі, суглобах, головним болем, болем у м’язах. Відзначено тенденцію до тривалішої лихоманки при захворюваннях, ускладнених пневмонією. Катаральний синдром проявлявся певною мірою в усіх хворих.
У 38,4% пацієнтів на момент госпіталізації були виявлені симптоми, характерні для гастроінтестинального синдрому (дефекація до 3 разів на добу, біль у животі, здуття, бурчання, відрижка повітрям). Значно рідше пацієнтів турбувала нудота – тільки у 5,9% випадків, що могло би бути проявом як інтоксикаційного синдрому, так і безпосереднього ураження ШКТ. Під час дослідження нами була зафіксована виражена тенденція залежності розвитку дисбіозу від тривалості хвороби у днях (табл. 1).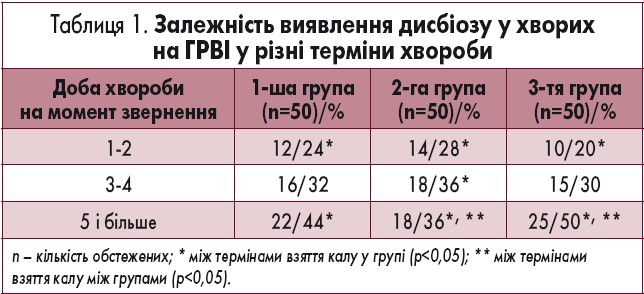
Проаналізувавши результати бактеріологічного посіву калу на дисбіоз, ми не виявили достовірних відмінностей між групами, всі пацієнти мали ознаки дисбіозу, але різного ступеня. Ми відзначили чітку залежність розвитку дисбіозу кишечнику від тривалості хвороби та методу амбулаторного лікування, якщо таке було. Чим раніше пацієнт звертався за медичною допомогою, тим нижчий ризик розвитку дисбіозу та ускладнень він мав. Ці фактори впливали на профілактику розвитку дисбіозу та швидшу корекцію якісного та кількісного складу мікрофлори кишечнику.
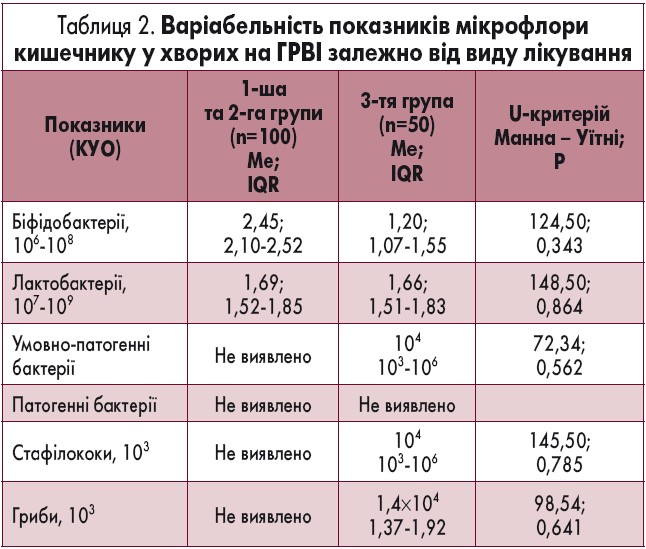 Після лікування у двох групах досягнуто повної ерадикації умовно-патогенної кишкової флори, у третій – ці збудники виявлено у 16 із 50 осіб (p<0,001). У разі використання у комплексному лікуванні досліджуваного комплексу Лактімак форте відзначено повноцінну нормалізацію кишкової мікрофлори у 92,5% пацієнтів 1-ї та 2-ї груп проти 39,5% – 3-ї (р<0,001; табл. 2).
Після лікування у двох групах досягнуто повної ерадикації умовно-патогенної кишкової флори, у третій – ці збудники виявлено у 16 із 50 осіб (p<0,001). У разі використання у комплексному лікуванні досліджуваного комплексу Лактімак форте відзначено повноцінну нормалізацію кишкової мікрофлори у 92,5% пацієнтів 1-ї та 2-ї груп проти 39,5% – 3-ї (р<0,001; табл. 2).
Відзначено вплив комплексного лікування із додаванням Лактімак форте на тривалість кашлю: 2-6 діб (IQR3,75-5,00) у пацієнтів 1-ї та 2-ї груп і від 3 до 8 діб (IQR4,00-7,00) у пацієнтів 3-ї групи.
У пацієнтів 1-ї та 3-ї груп істотно відрізнялася частота розвитку ускладнень з боку ШКТ (розвиток діареї на фоні прийому антибіотиків): такі ознаки мали 7% пацієнтів 1-ї групи і 87% – 3-ї групи (р<0,0001).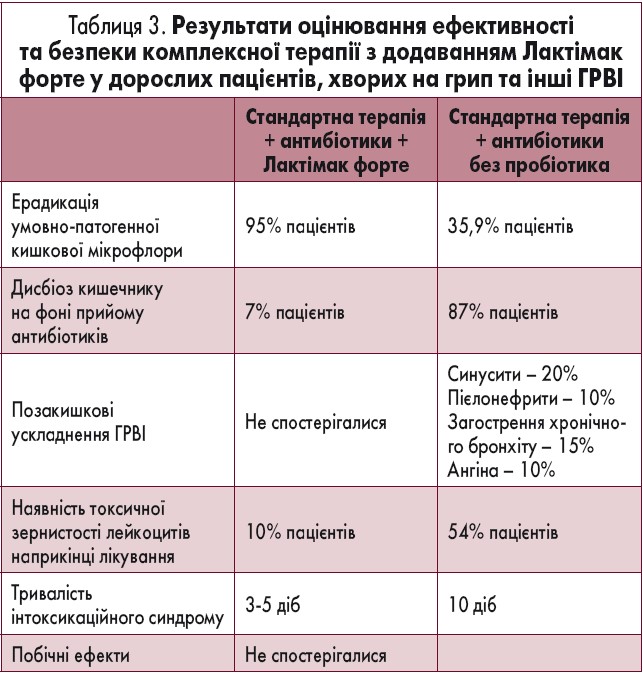
Відзначено також істотний вплив комплексного лікування з додаванням Лактімак форте на скорочення тривалості (в 2 рази і більше) інтоксикаційного та катарального синдромів як при середньому, так і при тяжкому перебігу ГРВІ (р<0,05). Виявлено сильний взаємозв’язок між комплексною терапією (з додаванням Лактімак форте) та зниженням ступеня тяжкості перебігу хвороби, зменшенням частоти розвитку ускладнень, нормалізацією імунологічних показників (χ2=31,97; φ= 0,942; р=0,0001).
Показники ризику розвитку ускладнень, вираженості клінічних симптомів та відсутності нормалізації імунологічних показників у 14 разів були вищі у пацієнтів з ГРВІ, які не використовували Лактімак форте (RR=14,00; 95% довірчий інтервал 2,11-92,54). Лактімак форте всі пацієнти переносили добре, побічні реакції не були зафіксовані (табл. 3).
Ці результати дають можливість із високою достовірністю (93% випадків, р<0,0001) рекомендувати хворим на ГРВІ, а особливо тим, що приймають антибіотики, вживання Лактімак форте по 1 капсулі 2 рази на добу з метою профілактики розвитку дисбіозу кишечнику та підвищення імунної опірності організму.
Список літератури знаходиться в редакції.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 3 (49), жовтень 2018 р.


