31 грудня, 2018
Идиопатическая тромбоцитопеническая пурпура у детей: алгоритм лечения и дискуссионные вопросы
Согласно современному определению, идиопатическая тромбоцитопеническая пурпура (ИТП, иммунная тромбоцитопения) представляет собой приобретенное иммунно-опосредованное заболевание, характеризующееся изолированной тромбоцитопенией, возникновение которой вызвано разрушением тромбоцитов антителами. ИТП может развиваться как у взрослых, так и у детей. Развитию ИТП у детей часто предшествует вирусная респираторая инфекция. В отличие от взрослых, у большинства педиатрических пациентов ИТП имеет доброкачественное течение, характеризуясь низким риском возникновения кровотечений и самоизлечением. Тем не менее у некоторых детей течение ИТП все же может осложняться значимыми кровотечениями, в частности внутричерепным кровоизлиянием. Кроме того, примерно у 20% пациентов это заболевание может принимать хронический характер.
Эпидемиология
За последнее десятилетие благодаря проведению крупных клинических и популяционных когортных исследований учеными были получены новые данные об эпидемиологии ИТП. Так, в датированном 2017 г. обзоре G.Moulis и соавт. приводятся следующие эпидемиологические данные: частота ИТП оценивается на уровне 3-4 случая на 100 тыс. населения в год, а риск развития внутричерепного кровоизлияния составляет около 1% в год. При этом заболевание несколько чаще встречается у лиц женского пола, а пиковые показатели заболеваемости приходятся на детский возраст и на возраст более 60 лет.
Персистирующая, хроническая и рефрактерная ИТП – определения понятий
В зависимости от продолжительности сохранения симптомов ИТП классифицируется следующим образом: впервые диагностированная (длительность заболевания <3 мес), персистирующая (3-12 мес) и хроническая (>12 мес). Следовательно, ИТП определяется как персистирующая в том случае, когда тромбоцитопения сохраняется у пациента спустя 3-12 мес после первого установления диагноза. Однако в определении понятия рефрактерной ИТП консенсуса нет. Так, у взрослых рефрактерная ИТП определяется как заболевание, при котором отсутствует ответ на лечение либо отмечаются рецидивы после спленэктомии, – критерий, который не может быть применен к педиатрической популяции, поскольку оперативное вмешательство во многих случаях не рассматривается в качестве терапии второй линии (A. Cuker, C.E. Neunert, 2016). Поэтому было предложено, чтобы это определение относилось к категории детей со значимыми кровотечениями, у которых не достигнут ответ на терапию первой линии, либо детей без значимого кровотечения, основная цель лечения которых состоит в улучшении качества жизни. Современный алгоритм подтверждения диагноза ИТП и разработки плана лечения представлен на рисунке (A. Cuker, C.E. Neunert, 2016; R. Beruecco et al., 2018).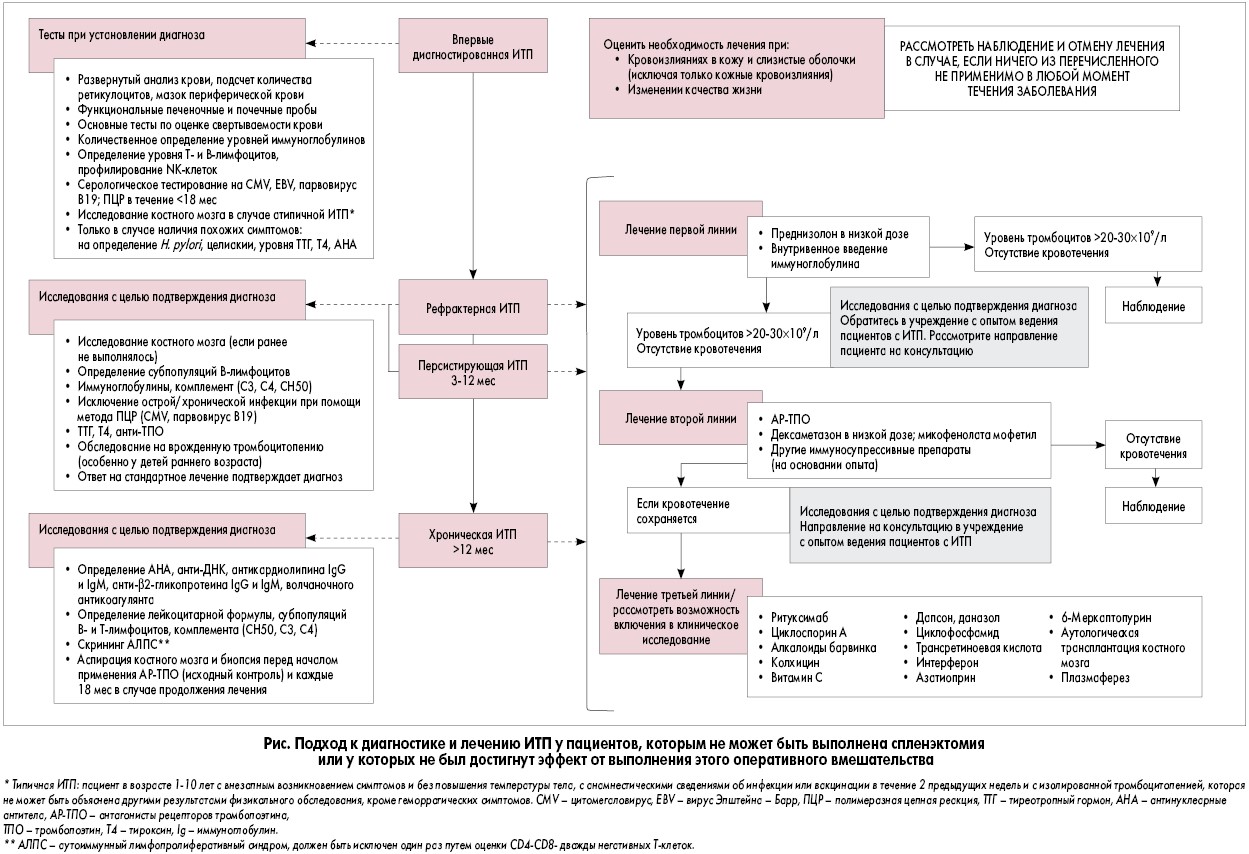
У младенцев в возрасте <1 года должна быть рассмотрена вероятность наличия врожденной тромбоцитопении или ИТП, вторичной по отношению к фоновому иммунодефициту. Сведения о рецидивирующей инфекции или о наличии сопутствующих иммунно-опосредованных цитопений в анамнезе должны побудить врача предположить имеющийся у ребенка первичный иммунодефицит. В этих случаях рекомендуется углубленное обследование пациента у клинического иммунолога. Важно также принимать во внимание, что ИТП может иметь вторичный характер по отношению к другим аутоиммунным заболеваниям. Поэтому следует исключать системную красную волчанку, антифосфолипидный синдром и другие аутоиммунные заболевания соединительной ткани у пациентов со сходными клиническими проявлениями (независимо от длительности заболевания) и как минимум один раз в год – у всех пациентов с хронической ИТП (особенно у девочек-подростков или после продолжительного течения заболевания; D. Provan et al., 2010; C. Neunert et al., 2011).
Современные подходы к лечению персистирующей и рефрактерной ИТП у детей
Когда речь идет о педиатрических пациентах с подозрением на ИТП, наиболее важным шагом перед началом лечения является оценка того, имеются ли у больного геморрагические проявления. Лечение следует назначать только пациентам с активными кровотечениями (кроме исключительно кожного кровоизлияния). Профилактика кровотечений у пациентов без симптомов была бы оправдана только в случае хирургического вмешательства или в случае, если ответственный за лечение клиницист считает, что у данного ребенка имеется высокий риск кровотечения, ассоциированный с его физической активностью (R. Beruecco et al., 2018). Другие факторы, такие как семейные обстоятельства (тревожность родителей либо социально-экономический статус среди прочих) или качество жизни пациента, также должны приниматься во внимание во время планирования лечения, при этом всегда следует индивидуально оценивать соотношение его рисков и преимуществ (J.М. Journeycake, 2012).
Если после надлежащего обследования делается вывод о том, что лечение показано, в качестве начальной стратегии рекомендуется применение препаратов первой линии – иммуноглобулинов и преднизолона. Следует избегать использования кортикостероидов в течение более чем 7-10 суток. От введения анти-D-иммуноглобулина необходимо воздержаться ввиду ранее полученных сообщений о развитии после его использования тяжелой гемолитической анемии (D. Provan et al., 2010). Методы лечения второй линии следует применять только у тех пациентов, у которых не достигнут ответ на терапию первой линии или которым требуется длительное лечение кортикостероидами с целью достижения адекватного ответа (C. Neunert et al., 2011; M. Michel, 2013). Они включают иммуносупрессивную терапию, назначение ритуксимаба, АР-ТПО и проведение спленэктомии. В таблице обобщены методы лечения, наиболее часто используемые в случаях персистирующей и рефрактерной ИТП (с указанием соответствующих дозировок и частоты ответа).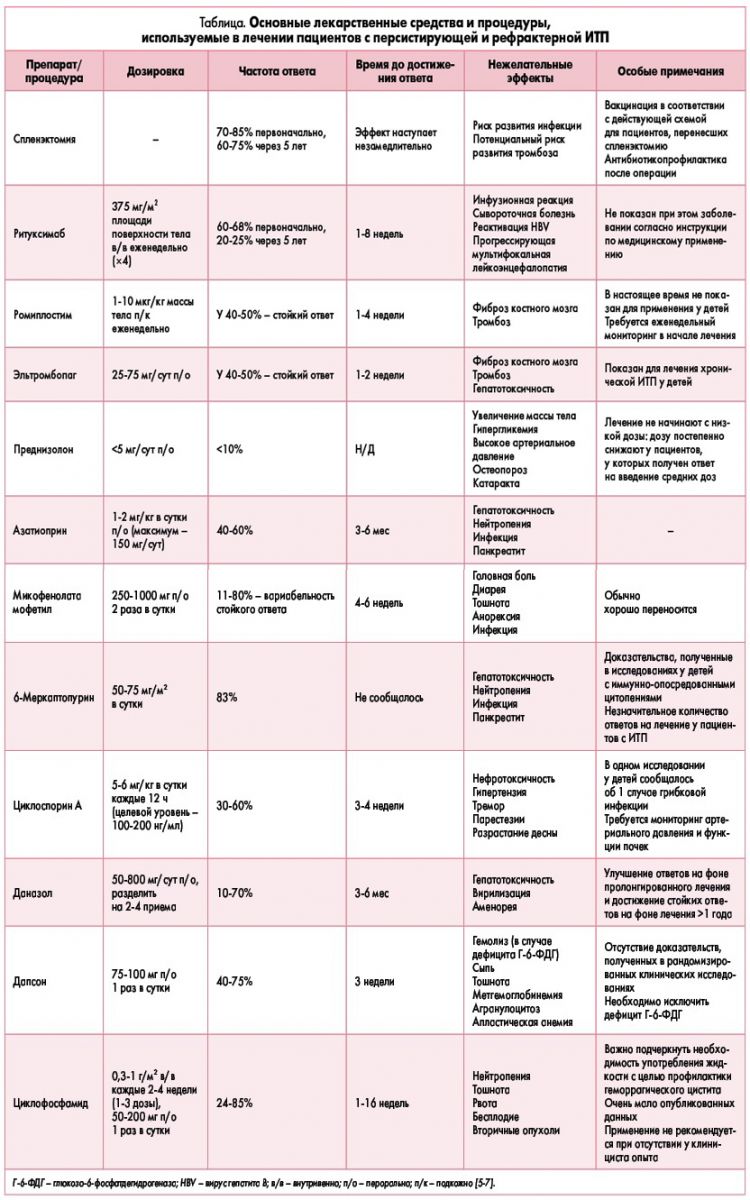
Иммуносупрессивная терапия с использованием таких препаратов, как циклоспорин, дапсон, дексаметазон или микофенолата мофетил, хорошо переносится и, по-видимому, не вызывает значимых осложнений. До сих пор нет доказательств более высокой частоты ответа в случае применения одного из этих препаратов в сравнении с другими (A. Cuker, C.E. Neunert, 2016). Более того, эти препараты пока не были зарегистрированы регуляторными агентствами для лечения ИТП ввиду того, что доступные в отношении их использования при данной патологии научные доказательства были получены в ходе обсервационных и (в большинстве случаев) ретроспективных исследований.
Пока нет доказательств и в пользу того, что при ИТП ритуксимаб более эффективен, чем другие виды лечения. Хотя целесообразность его применения у взрослых была доказана, и в литературе описываются клинические случаи с достижением стойкого ответа, следует принимать во внимание, что введение этого препарата детям может приводить к серьезным нежелательным эффектам (J.M. Journeycake, 2012).
В лечении пациентов с персистирующей или рефрактерной ИТП сегодня также используют АР-ТПО (эльтромбопаг и ромиплостим), при этом отмечается их адекватная переносимость и незначительное количество нежелательных явлений (C. Neunert et al., 2016; K. Ramaswami et al., 2014). Частота достижения долгосрочного ответа на фоне применения этих препаратов аналогична таковой при применении циклоспорина, дапсона или микофенолата мофетила (составляет примерно 45%), однако в случае АР-ТПО эти данные были получены в рандомизированных клинических исследованиях (J.B. Bussel et al., 2011, 2015; J.D. Grainger et al., 2015; M.D. Tarantino et al., 2016). В связи с этим важно отметить, что хотя одобренное показание к назначению АР-ТПО для лечения детей с ИТП в настоящее время ограничивается хронической формой заболевания, в категорию лиц с хронической ИТП на момент выполнения исследований были также включены пациенты, у которых ИТП персистировала на протяжении более чем 6 месяцев. Таким образом, эффективность АР-ТПО уже была доказана и для лечения персистирующей ИТП. Кроме того, сообщается, что у пациентов, у которых изначально получен ответ на лечение АР-ТПО, но в последующем они были вынуждены его прекратить, рецидив тромбоцитопении не отмечался (C. Neunert et al., 2016).
Спленэктомия продолжает оставаться тем видом лечения, который характеризуется наиболее высокой частотой достижения ответа. Безопасность этого хирургического вмешательства повысилась в последние годы вследствие использования антибиотикопрофилактики и вакцинации, а также совершенствования методов выявления и прогнозирования тромбоэмболических событий, которые могут развиваться у данной категории пациентов в средне- и долгосрочной перспективе (J.M. Journeycake, 2012). Однако сейчас, когда стали доступны АР-ТПО, обладающие лучшим профилем безопасности, представляется целесообразным их применение до спленэктомии с целью ее отсрочки.
Ритуксимаб в качестве терапии второй линии у детей: за и против
Показание к назначению ритуксимаба при ИТП основано на его способности контролировать гуморальный иммунный ответ посредством деплеции CD20+ В-клеток. Имеются также доказательства того, что ритуксимаб может модулировать клеточно-опосредованный иммунный ответ путем увеличения количества циркулирующих регуляторных Т-клеток и предотвращения активности аутореактивных Т-клеток (A. Cuker, C.E. Neunert, 2016). Хотя инструкция по медицинскому применению ритуксимаба не включает показания ИТП у детей, в медицинской литературе имеется довольно много ссылок на работы о его использовании. В одном проспективном исследовании, в котором оценивали применение ритуксимаба у 36 педиатрических пациентов, был сделан вывод о том, что результаты его использования могут быть благоприятными у некоторых пациентов с хронической ИТП (C.M. Bennett et al., 2006). Предикторами хорошего ответа на лечение ритуксимабом являются начальный полный ответ, пролонгированная деплеция В-клеток (V.L. Patel et al., 2012), хороший ответ на применение кортикостероидов и вторичный характер ИТП (R.F. Grace et al., 2012). В другом ретроспективном исследовании описаны долгосрочные исходы (5 лет) применения ритуксимаба у детей и взрослых с ИТП: в то время как частота начального ответа составляла 57%, количество пациентов со стойким ответом было намного меньше – примерно 26% (V.L. Patel et al., 2012). Эта постепенная утрата терапевтического ответа может быть обусловлена персистенцией аутореактивных клеточных клонов в герминативных центрах лимфатических узлов и костном мозге (J.M. Journaycake et al., 2012).
Назначение ритуксимаба в качестве терапии второй линии у педиатрических пациентов весьма противоречиво. До появления в арсенале врачей АР-ТПО в нескольких публикациях уже рекомендовалось выполнять спленэктомию у пациентов с рефрактерной ИТП (по возможности откладывая ее до 12 месяцев от начала заболевания; C. Neunert et al., 2011; H. Tamary et al., 2010). Хотя применение ритуксимаба у детей с хронической или рефрактерной ИТП было предложено в качестве альтернативы спленэктомии, авторы подчеркивали его потенциальные нежелательные эффекты (такие как сывороточная болезнь, повышенный риск развития вирусной инфекции, реактивации вируса гепатита В или вторичной гипогаммаглобулинемии), а также другие особенности, связанные с его введением, в частности необходимость отложить вакцинацию на срок до 6 месяцев после завершения лечения.
Самые последние руководства (M. Michel, 2013; A. Cuker, C.E. Neunert, 2016; J.M. Journaycake et al., 2012; A.L. Bredlau et al., 2011), изданные уже после выведения на фармацевтический рынок АР-ТПО, предлагают индивидуализированный подход к лечению. Однако ввиду отсутствия рандомизированных контролируемых исследований эти рекомендации не основаны на более высоком уровне доказательности чем экспертные мнения. Некоторые авторы продолжают рассматривать ритуксимаб как вариант лечения второй линии (наряду с АР-ТПО), но ряд других ученых решительно отстаивают использование именно АР-ТПО в качестве предпочтительной альтернативы. Это в основном обусловлено тем, что несмотря на отсутствие долгосрочных данных, в настоящее время имеются доказательства более стойкого ответа на лечение АР-ТПО и незначительного количества побочных эффектов. Фактически даже у перенесших спленэктомию пациентов, у которых не получен ответ на другие линии терапии, применение АР-ТПО может быть полезно после неудачного результата операции (M.E. Osman, 2012). Наконец, в отличие от ритуксимаба, эльтромбопаг был официально зарегистрирован для лечения педиатрических пациентов с хронической ИТП (как указано в его инструкции по медицинскому применению).
В заключение следует отметить, что, исходя из имеющихся в настоящее время доказательств, ритуксимаб, очевидно, не должен использоваться в качестве терапии второй линии у педиатрических пациентов с рефрактерной, персистирующей или хронической ИТП.
Роль и место спленэктомии в лечении педиатрических пациентов с ИТП на современном этапе
Всего несколько лет назад спленэктомия являлась одной из основных стратегий лечения ИТП у взрослых и детей в возрасте старше 5 лет. После внедрения в клиническую практику ритуксимаба фармакотерапия начала вытеснять хирургические вмешательства в нише лечения второй линии (C. Neunert et al., 2011; H. Tamary et al., 2010). В настоящее время многие эксперты рекомендуют использовать АР-ТПО у пациентов, у которых не достигнут ответ на первоначальное лечение кортикостероидами и иммуноглобулином, перед применением ритуксимаба либо перед выполнением оперативного вмешательства (A.L. Bredlau et al., 2011).
Хотя в большинстве руководств и не рекомендуется выполнять спленэктомию до тех пор, пока продолжительность ИТП не составит как минимум 12 месяцев (A. Schifferli, T. Kuhne, 2013), ее проведение по-прежнему остается дискуссионным вопросом. Некоторым пациентам – например, детям в возрасте младше 5 лет – спленэктомия вообще не выполняется, а в других ситуациях от ее проведения могут отказываться родители либо законные опекуны ребенка. У всех остальных пациентов, которые фактически являются кандидатами на проведение спленэктомии, риски ассоциированы с необратимым характером этого оперативного вмешательства. Поэтому, несмотря на хороший первоначальный ответ (70-85% случаев) и на тот факт, что у большинства пациентов сохраняется нормальное количество тромбоцитов через 5 лет после вмешательства (60-70% случаев), нельзя игнорировать ассоциированную с применением этого хирургического метода лечения заболеваемость (J.M. Journaycake et al., 2012; T. Kuhne et al., 2007; R. Ahmed et al., 2016). Так, риск развития инфекций у перенесших спленэктомию пациентов достигает 11-16% даже на фоне правильной вакцинации и применения антибиотикопрофилактики, доля пациентов с развитием тромбоза после операции колеблется в диапазоне 1,6-4,3%, а риск тяжелого интра- или послеоперационного кровотечения составляет 0,78% (S. Boyle et al., 2013).
Поскольку преимущества спленэктомии, по-видимому, все же не перевешивают ее недостатки у детей, это вмешательство должно использоваться лишь в отдельных случаях. В частности, оно показано тем педиатрическим пациентам, которые не переносят медикаментозное лечение либо не отвечают на него (включая кортикостероиды, иммуноглобулины, АР-ТПО и иммуносупрессивную терапию). Спленэктомия также однозначно показана пациентам с жизнеугрожающим кровотечением, хотя это крайне редкое явление при ИТП. Наконец, выполнение спленэктомии также может рассматриваться у пациентов, которые несмотря на получение другого лечения имеют неудовлетворительное связанное со здоровьем качество жизни (J.M. Journaycake et al., 2012).
Спленэктомия (планируемая только у пациентов в возрасте старше 5 лет) должна проводиться в отделениях персоналом, имеющим опыт лапароскопического выполнения данной операции. Перед процедурой пациент должен получить все соответствующие вакцины согласно действующим рекомендациям, а в послеоперационный период ему следует назначить надлежащую антибиотикопрофилактику (J.M. Journaycake et al., 2012). К сожалению, не существует какого-либо известного прогностического фактора, позволяющего предположить, у каких пациентов будет получен ответ на оперативное лечение. Таким образом, последние рекомендации требуют от врачей исчерпать все возможности медикаментозного лечения детей с хронической ИТП, прежде чем прибегнуть к спленэктомии, при этом особый акцент делается на применение АР-ТПО (рис.).
Возможности долгосрочного применения АР-ТПО у детей: в фокусе внимания – аспекты безопасности
Поскольку была подтверждена краткосрочная и долгосрочная безопасность и эффективность применения АР-ТПО при ИТП с длительностью течения более 6 месяцев, частота назначения данных препаратов в последние годы значительно возросла. Хотя известно, что существуют нежелательные явления, ассоциированные с применением этих лекарственных средств, доступные данные об их частоте у детей все еще весьма скудны.
Применение эльтромбопага ассоциировалось с развитием нарушений функции печени (повышение уровня печеночных ферментов в сыворотке крови). Однако существуют доказательства того, что показатели печеночной функции нормализуются после прекращения лечения, поэтому данное осложнение не должно представлять собой проблему в долгосрочной перспективе (J.B. Bussel et al., 2009).
Фиброз костного мозга был описан у взрослых пациентов, получавших лечение обоими типами АР-ТПО, но фактический риск возникновения этого осложнения в педиатрической популяции остается неизвестным. Хотя клинические исследования по изучению применения эльтромбопага в педиатрической популяции не включали данную переменную, о случаях возникновения этого нежелательного явления сообщалось в литературе (W. Ghanima et al., 2014). Что касается ромиплостима, то в клинических исследованиях, которые продолжаются в настоящее время, оценивают развитие фиброза и последующие исходы, чтобы определить, будет ли отмечаться спонтанное разрешение наблюдаемых аномалий после прекращения лечения, как у взрослых (D.J. Kuter et al., 2009).
Учитывая отсутствие убедительных данных и каких-либо сообщений о случаях значимого фиброза костного мозга у детей (наивысшие степени фиброза – I-II; K. Ramaswamy et al., 2014; W. Ghanima et al., 2014; J.D. Grainger et al., 2014), некоторые группы исследователей рекомендуют выполнение серийных биопсий каждые 18 месяцев с целью мониторинга потенциальных изменений в костном мозге (W. Ghanima et al., 2014). Периодическая оценка мазков периферической крови экспертом-гематологом может помочь исключить наличие косвенных признаков миелофиброза: анизоцитоза, пойкилоцитоза, дакроцитов, ядерных эритроцитов и полихромазии.
Лечение АР-ТПО у взрослых пациентов также ассоциировалось с тромбозом. Однако пока не ясно, связан ли риск тромбоза с лечением или с самим заболеванием (J.B. Bussel et al., 2009). У детей единственными доступными доказательствами является сообщение о двух случаях связанного с лечением эльтромбопагом тромбоза в недавно опубликованных сериях клинических случаев из США (K. Ramaswamy et al., 2014), поэтому фактический риск такого лечения в педиатрической популяции еще предстоит установить. В настоящее время врачам рекомендуется поддерживать высокую настороженность в плане своевременного выявления тромботических осложнений и принимать во внимание другие факторы риска их развития, такие как ожирение, использование гормональных методов контрацепции у подростков или наличие сведений о тромбозе в семейном анамнезе пациента перед лечением.
***
Таким образом, внедрение в клиническую практику АР-ТПО существенно расширяет возможности лечения педиатрических пациентов с ИТП, а также устанавливает новые подходы к ведению больных с персистирующей, хронической или рефрактерной к терапии первой линии формой заболевания, давая возможность отсрочить применение более агрессивных методов лечения (назначение ритуксимаба или спленэктомии). Однако поскольку препараты этой группы были разработаны относительно недавно, экспертам следует осуществлять мониторинг результатов их применения в клинической практике с целью выявления потенциальных нежелательных явлений.
Подготовила Елена Терещенко
Тематичний номер «Педіатрія» № 4 (47) грудень 2018 р.


