26 квітня, 2019
Оновлені рекомендації діагностики та лікування первинного гіперальдостеронізму
Первинний альдостеронізм (ПА) – це група патологічних станів, за яких утворюється надмірна кількість альдостерону. Така неадекватна продукція цього гормону призводить до патології серцево-судинної системи (ССС), у тому числі артеріальної гіпертензії (АГ), затримки натрію, пригнічення реніну плазми крові та розвитку гіпокаліємії. Перший випадок згаданого захворювання був описаний у 1953 р. польським лікарем-терапевтом Міхалом Літинським. У 1955 р. доктор Джером В. Кон (Jerome W. Conn), професор медицини в Університеті Мічігану (США), описав стан, який супроводжувався АГ, зниженням активності реніну плазми, а також збільшенням утворення альдостерону. Пізніше ПА отримав назву «синдром Кона». Вважають, що ПА виявляють у 3,2-12,7% хворих на АГ.
Рання діагностика ПА має дуже важливе значення, адже це захворювання здатне несприятливо вплинути на ССС і функцію нирок. Було чітко показано, що ПА призводить до зростання кінцевого діастолічного об’єму лівого шлуночка, потовщення стінок шлуночків порівняно з пацієнтами, які страждають на есенціальну гіпертензію (гіпертонічну хворобу, ГХ). У перехресному дослідженні, в якому порівнювали частоту серцево-судинних подій у пацієнтів із ПА та ГХ, співвідношення шансів у групі ПА становило 2,6 щодо розвитку інфаркту міокарда; 1,9 – симптоматичної повторно реваскуляризованої ішемічної хвороби серця; 2,9 – симптоматичної серцевої недостатності (СН) та 5,0 – фібриляції передсердь (ФП). Згідно з результатами метааналізу вплив на нирки проявлявся більшим зростанням гломерулярної гіперфільтрації в пацієнтів із ПА, ніж у хворих на ГХ [12]. Крім того, за умови однакового рівня артеріального тиску (АТ) в пацієнтів із ПА мікроальбумінурія виявлялася вдвічі частіше, ніж у пацієнтів із ГХ.
Вибір потрібного лікування ПА (хірургічного – у разі аденоми чи карциноми наднирників, терапевтичного – у разі [гіперплазії наднирників] ГН) залежить від точності діагнозу, ось чому так важливо визначити механізм розвитку захворювання. Саме тому метою цього огляду є висвітлення сучасних принципів діагностики та ведення пацієнтів із ПА.
Патогенез
Є дві основні причини ПА: двобічна ГН – 60% випадків, альдостерон-продукуюча аденома (АПА) – 30% випадків. Двобічна ГН, або ідіопатичний альдостеронізм, зазвичай проявляється у вигляді мікронодулярної (рідко макронодулярної) гіперплазії. АПА, відома також як аденома Кона, дещо частіше виявляється в жінок, ніж у чоловіків. Пацієнти з цією формою захворювання зазвичай молодші, ніж особи з двобічною ГН, а також частіше мають тяжку форму АГ, поєднану з вираженою гіпокаліємією. АПА часто є односторонньою одиничною пухлиною <1,5 см у діаметрі.
Рідшими причинами ПА є одностороння ГН, альдостерон-продукуюча карцинома та такі спадкові форми захворювання, як сімейний гіперальдостеронізм (СГА). Це рідкісний підтип ПА, представлений трьома формами: СГА 1 типу, або глюкокортикоїд-пригнічувальний альдостеронізм, СГА 2 та 3 типу. У ході аналізу даних 300 пацієнтів із ПА у двох був діагностований СГА 1 типу (поширеність 0,66%). З-поміж решти 199 сімей у 12 був діагностований СГА 2 типу (6%).
Клініко-лабораторні ознаки ПА
Зазвичай наслідками ПА є АГ, гіпокаліємія та метаболічний алкалоз. Надмірне утворення альдостерону призводить до збільшення обсягу плазми крові й підвищення периферичного опору судин, які лежать в основі розвитку резистентної гіпертензії.
У ході вивчення даних пацієнтів із ПА та хворих на ГХ Milliez та співавт. показали зростання ризику інсульту (12,9 проти 3,4% відповідно), нефатального інфаркту міокарда (4,0 проти 0,6% відповідно) та ФП (7,3 проти 0,6% відповідно). Ще приблизно 10 років тому було встановлено взаємозв’язок між гіперальдостеронізмом і ФП.
Лише в 9-37% пацієнтів із ПА спостерігається гіпокаліємія. У більшості випадків рівень калію сироватки крові є нормальним, а ймовірність розвитку гіпокаліємії зростає у тяжких випадках. Відсутність гіпокаліємії не вказує на відсутність у пацієнта ПА, оскільки знижений рівень калію сироватки крові має низьку чутливість у діагностиці цього захворювання. У тяжких випадках, які супроводжуються зниженням рівня калію <2,0 мЕкв/л, може розвинутися рабдоміоліз. Крім того, наявність гіпокаліємії може стати причиною нефрогенного нецукрового діабету, який може виникнути через резистентність ниркових канальців до антидіуретичного гормону, що призводить до легкої поліурії, полідипсії та ніктурії. Реабсорбція великої кількості натрію в пацієнтів із ПА веде до розвитку гіперволемії, але периферичні набряки виникають рідко, за умови, що функції серця та нирок залишаються збереженими. Виділення йонів водню в дистальних ниркових канальцях веде до розвитку метаболічного алкалозу, який зазвичай є незначним та не має жодних негативних наслідків.
Кому показаний скринінг ПА
Згідно з нещодавно опублікованими рекомендаціями Ендокринологічного товариства (Endocrine Society) скринінг ПА проводять пацієнтам:
- з АТ >150/100 мм рт. ст. після 3 вимірів, проведених у різні дні;
- з АГ, рефрактерною до 3 стандартних антигіпертензивних препаратів (АГП), а також із контрольованою АГ, якщо вони приймають ≥4 АГП;
- з АГ, асоційованою зі спонтанною чи діуретик-зумовленою гіпокаліємією, апное під час сну та сімейним анамнезом раннього розвитку АГ чи інсультів у молодому віці;
- з АГ, якщо їхні родичі першого ступеня мають ПА.
Важливим є виявлення ПА в пацієнтів з інціденталомами наднирників (ІН). Для визначення характеру утворення наднирника (доброякісне чи злоякісне) призначають МРТ, КТ чи позитронно-емісійну томографію з 18F‑2-дезокси-D-глюкозою. ІН – це додаткове утворення наднирника, виявлене випадково під час проведення візуалізаційного методу дослідження з приводу будь-якого стану, не пов’язаного із захворюванням наднирників. Особливо важливою є оцінка характеру ІН у дітей, підлітків, вагітних та в осіб у віці <40 років, оскільки в цих когортах пацієнтів є велика ймовірність малігнізації утворення.
Діагностика захворювання
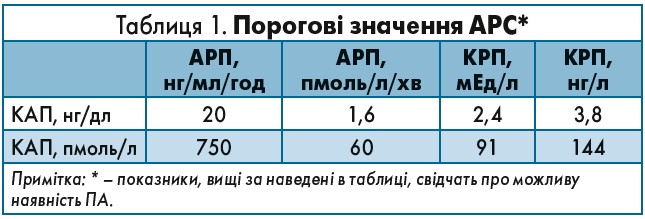 Альдостерон-ренінове співвідношення (АРС), яке отримують шляхом визначення концентрації альдостерону плазми (КАП) та активності реніну плазми (АРП) чи концентрації реніну плазми (КРП), є основним показником у скринінгу ПА і розглядається як абсолютно надійний метод діагностики. Щоб розрахувати АРС, показник КАП (нг/дл або пмоль/л) ділять на показник АРП (нг/мл/год) чи КРП (мЕд/л або нг/л). АРС має найвищу чутливість і специфічність у діагностиці захворювання та значні переваги перед ізольованим визначенням КАП, позаяк на значення останнього можуть впливати такі фактори, як вага тіла, його положення перед забором крові, прийом діуретиків й солі (табл. 1).
Альдостерон-ренінове співвідношення (АРС), яке отримують шляхом визначення концентрації альдостерону плазми (КАП) та активності реніну плазми (АРП) чи концентрації реніну плазми (КРП), є основним показником у скринінгу ПА і розглядається як абсолютно надійний метод діагностики. Щоб розрахувати АРС, показник КАП (нг/дл або пмоль/л) ділять на показник АРП (нг/мл/год) чи КРП (мЕд/л або нг/л). АРС має найвищу чутливість і специфічність у діагностиці захворювання та значні переваги перед ізольованим визначенням КАП, позаяк на значення останнього можуть впливати такі фактори, як вага тіла, його положення перед забором крові, прийом діуретиків й солі (табл. 1).
Радіоімунний аналіз (РІА) раніше широко використовувався для визначення КАП, проте поступово він був витіснений хемілюмінесцентним імуноаналізом (ХЛІА). Між ХЛІА і РІА з часом було виявлено значну відмінність. Крім того, ХЛІА – більш простий і дешевий тест, до того ж більш безпечний для довкілля.
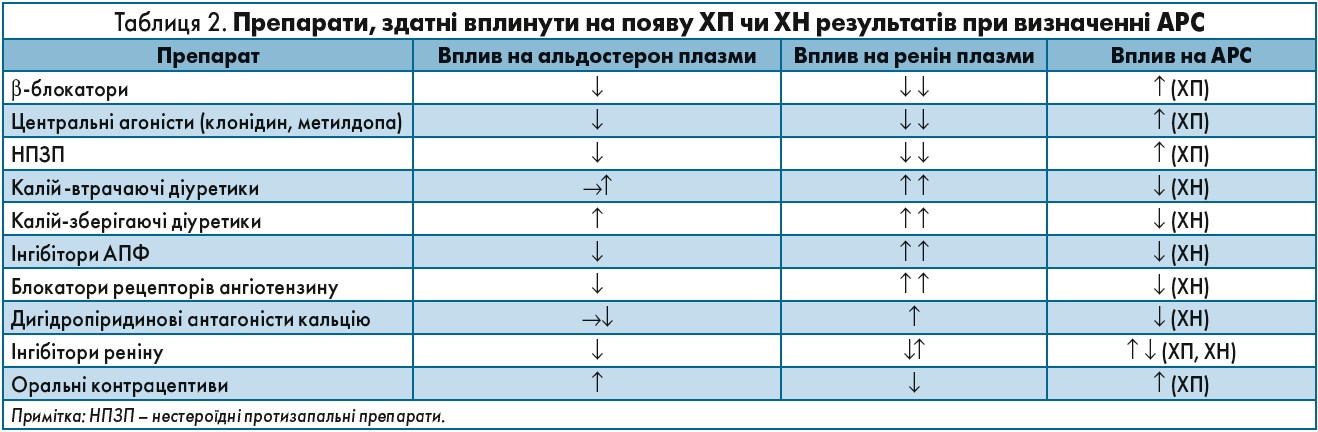
У ході визначення АРС можуть бути отримані як хибно-позитивні (ХП), так і хибно-негативні (ХН) результати. Це зумовлено цілою низкою факторів. Якщо є будь-які сумніви щодо інтерпретації результату чи впливу на нього тих чи інших медикаментів, тест потрібно повторити. Такі фармакологічні препарати, як β-блокатори, інгібітори ангіотензинперетворюючого ферменту (АПФ), селективні інгібітори зворотного захвату серотоніну чи оральні контрацептиви, впливають на результати скринінгу захворювання (табл. 2). За можливості АГП мають бути замінені на блокатори кальцієвих каналів та/або доксазозин принаймні за 3 тиж, а якщо застосовувався спіронолактон – за 6 тиж до дослідження.
Положення тіла під час дослідження – ще один фактор, який може впливати на значення АРС, тому пацієнт під час процедури може лежати, сидіти або стояти. Згідно з рекомендаціями Європейської спілки ендокринологів АРС є більш чутливим, коли зразки для дослідження беруться вранці, не менше ніж через 2 год після вставання з ліжка та після 5-15 хв відпочинку сидячи.
Тести виключення
Для остаточного підтвердження ПА визначення АРС недостатньо. Кожен пацієнт має пройти принаймні одне з таких обстежень: тест із пероральним чи внутрішньовенним натрієвим навантаженням: тест із каптоприлом; супресивний тест із флудрокортизоном (табл. 3). Проте пацієнтам зі спонтанною гіпокаліємією, реніном плазми нижчим за норму, КАП >20 нг/дл (0,555 нмоль/л), підтверджувальні тести не потрібні. Проте дехто з авторів стверджує, що ці тести різняться за чутливістю, специфічністю та достовірністю і що відсутні певні докази переваги будь-якого з них, тому вибір методу обстеження має базуватися на оцінці його вартості, коплаєнсу пацієнта, можливостях лабораторії та досвіду спеціалістів.
Гіперсекреція альдостерону при ПА може бути як двобічною (при ГН), так і однобічною (у разі альдостерон-продукуючої аденоми чи однобічної ГН). Цю різницю дуже важливо враховувати при виборі методу лікування, яке може бути хірургічним або медикаментозним. Для ідентифікації субтипу ПА потрібно провести КТ/МРТ та дослідити кров із вен наднирників.
Візуалізація надниркових залоз
Візуалізація надниркових залоз може бути корисною перед проведенням додаткових інвазивних обстежень. Перевага віддається КТ, адже вона дає можливість виключити наявність великих утворень, які можуть виявитися альдостерон-продукуючою карциномою. Крім цього, за допомогою вказаного методу можна отримати інформацію про анатомічне розташування вен наднирників перед проведенням їх катетеризації. Треба зазначити, що гіперплазія надниркових залоз та альдостерон-продукуючі аденоми малих розмірів на КТ виявляються не завжди. Крім того, КТ не надає інформації про секреторну активність вузлів, адже вони можуть бути нефункціонуючими, особливо в пацієнтів >35 років. Це все веде до збільшення кількості ХП результатів.
Ladurner і співавт. вважають, що передопераційної МРТ чи КТ для визначення локалізації процесу при ПА недостатньо. Забір крові з вен наднирників є важливим діагностичним кроком для визначення субтипу захворювання. МРТ призначають за неможливості виконати КТ, бо МРТ більш дорожчий за вартістю метод і характеризується нижчою роздільною здатністю, ніж КТ.
Забір крові з надниркових вен
Забір крові з надниркових вен є найбільш достовірним методом визначення субтипу ПА, чутливість якого становить 95%, а специфічність – 100%. Прийом медикаментозних препаратів потрібно припинити за 3 тиж до обстеження, а при використанні альдостерону – за 6, аби уникнути стимуляції протилежної надниркової залози, маскуючи однобічне утворення альдостерону. Перед процедурою важливо скорегувати гіпокаліємію, адже вона може призвести до зниження секреції альдостерону та потенційно замаскувати однобічну АПА. Зазвичай катетеризацію надниркових вен проводить інтервенційний радіолог із використанням феморального доступу. Використання індексу селективності (ІС) та індексу латералізації (ІЛ) дають можливість підтвердити правильність катетеризованої ділянки та виявити латералізоване надмірне утворення альдостерону, якщо воно наявне (табл. 4).
ІЛ використовується для діагностики надлишкової продукції альдостерону з певної сторони. ІЛ визначається як співвідношення альдостерону/кортизону домінантної сторони до альдостерону/кортизону недомінантної сторони. Концентрація альдостерону плазми з кожної сторони ділиться на відповідну концентрацію кортизолу для уникнення потенційного ефекту розведення. Якщо процедура проводиться зі стимуляцією косинтропіном, латералізація підтверджується тоді, коли скоректоване кортизолом співвідношення альдостерону домінантної до альдостерону недомінантної сторони становить більш як 4:1; двобічна гіперсекреція альдостерону є ймовірною, якщо співвідношення менше ніж 3:1. Значення між 3:1 та 4:1 має розглядатися з урахуванням клінічної картини, результатів КТ, допоміжних тестів і, якщо це можливо, повторного проведення дослідження крові вен наднирників. Є докази, що значення ІЛ між 2 та 4 можуть бути наявні в пацієнтів без підтвердженого ПА.
Контралатеральний супресивний тест (КСТ) застосовується для визначення супресії альдостерону в недомінантній наднирковій залозі, адже може бути надмірна продукція альдостерону з протилежної сторони. Контралатеральна супресія розглядається тоді, коли альдостерон-кортизолове співвідношення у недомінатному наднирнику менше, ніж співвідношення в нижній порожнистій вені чи в пробі з периферичної вени. КСТ може застосовуватися тоді, коли провести канюляцію іншої надниркової вени неможливо, або коли ІЛ знаходиться між 3:1 та 4:1. Є докази того, що наявність КСТ може бути предиктором успішного хірургічного лікування АГ в пацієнтів із ПА. Проте результат КСТ є недостатнім показником однобічного ПА, оскільки до 30% пацієнтів із двобічною наднирковою гіперплазією мають супресію при проведенні КСТ. Слід урахувати, що наявності гіперпродукції альдостерону при альдостерон-продукуючій аденомі часто недостатньо для супресії утворення альдостерону контралатеральним наднирником.
Лікування
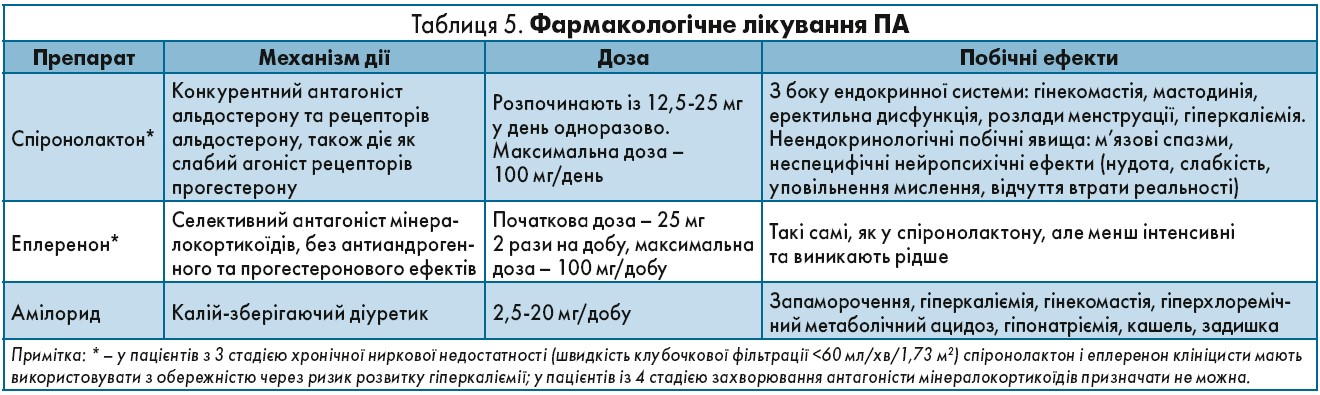
У пацієнтів із підтвердженим однобічним ПА рекомендовано проведення однобічної лапароскопічної адреналектомії. Якщо пацієнту неможливо провести хірургічне лікування або він від нього відмовляється, хворому пропонують фармакологічну терапію з використанням антагоністів мінералокортикоїдів (табл. 5). Якщо пацієнт зі зміненим АРС не хоче чи не може пройти подальші обстеження, йому також рекомендують медикаментозне лікування.
Фармакологічне лікування
Спіронолактон є препаратом першої лінії в лікуванні ПА, а дані літератури свідчать, що його використання ефективне не лише щодо АГ, але й для захисту деяких органів-мішеней. Препарат є конкурентним антагоністом рецепторів альдостерону та андрогенів, а також діє як слабкий агоніст рецепторів прогестерону. Спіронолактон пригнічує реабсорбцію натрію головними клітинами базолатеральної мембрани збірних ниркових каналів шляхом пригнічення Na/K-АТФ-ази та опосередковано інгібує натрієві канали епітелію. Натрійуретичний ефект зберігається декілька днів після припинення прийому препарату, у той час як вплив на секрецію реніну може зберігатися протягом декількох діб. Це треба взяти до уваги, якщо пацієнтам потрібно провести біохімічне обстеження для діагностики ПА: за 6 тиж до обстеження прийом спіронолактону необхідно припинити. Незважаючи на пряму кореляцію між дозою препарату та кількістю небажаних явищ, останні навіть при використанні спіронолактону в дозі 25-50 мг/добу спостерігаються доволі часто. В одному дослідженні було показано, що гінекомастія виникає в 7% пацієнтів після 6 міс лікування спіронолактоном у дозі <50 мг/добу, та у 52% – у дозі >150 мг/добу.
Еплеренон – це селективний антагоніст мінералокортикоїдів, в якого відсутні антиандрогенний і прогестероновий ефекти, завдяки чому кількість побічних реакцій є мінімальною. Активність еплеренону становить 50% мінералокортикоїдної активності спіронолактону. Його краща переносимість мала бути збалансована з високою вартістю та з тим, що спіронолактон може більш активно знижувати АТ у пацієнтів із ПА. Еплеренон є хорошою альтернативою в разі розвитку побічних реакцій спіронолактону.
Амілорид – блокатор натрієвих каналів епітелію, який є калій-зберігаючим діуретиком і може покращувати контроль АГ та ступінь гіпокаліємії в пацієнтів із ПА. Препарат добре переноситься і не має негативного впливу на статеві стероїд-залежні побічні реакції спіронолактону, але не покращує функціонування ендотелію. Цей препарат можна використовувати, коли пацієнт погано переносить побічні явища на тлі прийому спіронолактону та еплеренону. Амілорид додають до антагоністів мінералокортикоїдів, щоби зменшити їхню дозу, а відповідно, і кількість побічних ефектів.
Блокатори кальцієвих каналів, інгібітори АПФ, блокатори рецепторів ангіотензину – ефективність цих препаратів оцінювалася в невеликій кількості пацієнтів із ПА, позаяк основною їхньою дією є антигіпертензивна, без впливу на активність мінералокортикоїдів. А втім вони часто застосовуються для зниження АТ (у комбінації з антагоністами мінералокортикоїдів), якщо його показники перевищують нормальні.
Фінеренон хоча і є конкурентним антагоністом мінералокортикоїдів, але має більший натрійуретичний ефект, ніж спіронолактон і еплеренон. Безпека та переносимість фінеренона вивчалася в дослідженні ARTS у пацієнтів із СН та хронічною хворобою нирок легкого та середнього ступеня. При використанні зазначеного препарату гіперкаліємія, на відміну від прийому спіронолактону, виникала рідше. Тривалі ефекти фінеренону продовжують вивчатися в ході ІІІ фази дослідження лікування пацієнтів із СН.
Інгібітори альдостерон-синтази (FAD286). Ключовим ферментом у процесі утворення альдостерону є альдостерон-синтаза (CYP11B2), яка переважно наявна в наднирниках, хоча також виявляється в тканинах ССС та мозку. R – це енантіомер фадрозолу, який спочатку використовувався в терапії раку молочної залози, а пізніше показав переваги в лікуванні серцево-судинних розладів на експериментальних моделях, які включали наявність захворювання ССС та ЦД. ІІ фаза дослідження з іншим агентом, LCI699, показала, що в пацієнтів із ПА, які мають тяжку гіпертензію та гіпокаліємію, спостерігалося зворотне та дозозалежне (на 70-80%) зменшення концентрації альдостерону в плазмі та сечі зі значним накопиченням альдостеронового попередника – деоксикортикостерону в плазмі.
Хірургічне лікування
Однобічна лапароскопічна адреналектомія є найкращим методом лікування більшості пацієнтів із локалізованою альдостерон-продукуючою аденомою та однобічною гіперплазією наднирника, оскільки цей метод лікування успішно нормалізує секрецію альдостерону, гіпокаліємію, покращує контроль АТ і зменшує кількість препаратів, необхідних для цього, що є економічно вигідним. Переваги зазначеної процедури набагато вищі за можливі ризики. Проте підвищений АТ може зберігатися після адреналектомії, особливо це стосується тих випадків, коли ГХ асоціюється з ПА.
Після оперативного втручання необхідно виміряти концентрацію альдостерону плазми та активність реніну, для того щоби переконатися в задовільній біохімічній відповіді. Рівень реніну зразу може не знизитися. Слід припинити прийом калію, спіронолактону та переглянути інтенсивність АГТ на 1-й день після операції. Крім того, протягом 1-го тижня після операції рекомендована дієта з високим вмістом натрію, аби уникнути розвитку гіперкаліємії. Цей феномен виникає через гіпоальдостеронізм, який пов’язаний із хронічною супресією контралатерального наднирника. Персистуючий гіпоальдостеронізм може розвинутися у 5% пацієнтів після адреналектомії, після чого вони будуть потребувати замісної мінералокортикоїдної терапії з використанням флудрокортизону.
Висновки
АРС є тестом вибору для скринінгу ПА. Для підтвердження ж діагнозу проводять тест із пероральним натрієвим навантаженням (oral sodium loading, OSL) або тест з інфузією фізіологічного розчину (saline infusion test, SIT). Різниця між гіперплазією надниркових залоз та альдостерон-продукуючою аденомою наднирника є важливою для вибору необхідного лікування. Такі візуалізаційні методи обстеження, як КТ чи МРТ, або ж інвазивні дослідження, наприклад катетеризація вен надниркових залоз, є важливими для визначення підтипу ПА. Залежно від цього призначається лікування: хірургічне – для альдостерон-продукуючої аденоми, та фармакологічне – для гіперплазії надниркових залоз.
Sofia M. Dick, Marina Queiroz, Bаrbara L. Bernardi, Angеlica Dall’Agnol, Letіcia A. Brondani and Sandra P. Silveiro: Update in diagnosis and management of primary aldosteronism, Clin Chem Lab Med 2018; 56(3):360-372.
Переклав з англ. Валерій Палько
Тематичний номер «Діабетологія, Тиреоїдологія, Метаболічні розлади» № 1 (45) березень 2019 р.