3 вересня, 2019
Антигістамінні препарати з неседативним ефектом у лікуванні алергічного риніту
Антигістамінні препарати (АГП) таргетно впливають на Н1-гістамінові рецептори, відіграючи важливу роль у підтримці високої якості життя у пацієнтів з алергічним ринітом (АР). АГП другого покоління включені в усі гайдлайни і є першою лінією терапії АР, але для їх ефективного та безпечного використання повинна бути розроблена класифікація на підставі головних характеристик. Седативна активність АГП пов’язана не з центральною дією, а з пригніченням центральних гістамінових рецепторів, тому окупація мозкових Н1-рецепторів (Н1РО) є важливим показником, що корелює з показниками, отриманими під час клінічних досліджень. З урахуванням Н1РО АГП поділяють на неседативні (<20%), менш седативні (20-50%) і седативні (≥50%) групи. Фексофенадин і біластин, що належать до неседативної групи, класифікуються як АГП, що не проникають у головний мозок. Обидва препарати схожі за своїми хімічними властивостями, але біластин має більшу спорідненість до Н1-рецепторів, що зумовлює його більш тривалу дію. У добре контрольованих дослідженнях із використанням об’єктивних показників було виявлено, що біластин не пригнічує психомоторні функції й не впливає на здатність керувати транспортним засобом навіть при збільшенні дози в 2 рази, що треба брати до уваги при виборі АГП для лікування АР. Ця робота демонструє доцільність вибору цієї групи препаратів у якості першої лінії терапії для лікування помірного АР.
АР – це алергічна реакція першого типу з розвитком IgE-опосередкованого запалення у відповідь на потрапляння алергенів у слизову оболонку носа. Приєднання комплексу антигену (алергену) і IgE тучними клітинами й базофілами через високоафінні Fcε-рецептори першого типу індукує дегрануляцію цих клітин із вивільненням медіаторів запалення: гістаміну, лейкотрієнів, тромбоцит-активуючого фактора тощо з розвитком класичної назальної тріади (ринорея, часте чхання, порушення носового дихання).
Виділяють інтермітуючий, або сезонний, алергічний (поліноз) і персистуючий риніт.
За різними оцінками, кількість пацієнтів з АР перевищує 500 млн по всьому світу, з них 150 млн – в Азіатсько-Тихоокеанському регіоні. В Японії захворюваність АР збільшилася з 29,8% у 1998 р. до 39,4% у 2008 р., значною мірою за рахунок полінозу.
Лікування АР включає видалення алергену або запобігання його дії за допомогою медикаментозного лікування, імунотерапії або оперативного втручання. Серед усіх фармпрепаратів, які використовуються для лікування АР, найбільш поширені АГП. Вони значно підвищують якість життя хворих на АР. Так, наприклад, дані, отримані під час проведення наглядового дослідження в Азії, показали, що пацієнти з АР значно частіше застосовували АГП (понад 50%) у порівнянні з назальними формами стероїдів (майже 30%).
АГП мають тривалу історію застосування, але друге покоління препаратів з’явилося тільки після 1980 року. До того ж часу використовувалися лише АГП першого покоління, які демонструють низьку специфічність і високу частоту побічних ефектів, зумовлених центральною седативною та антихолінергічною дією (спрага, затримка сечовипускання, тахікардія). Більшість АГП другого покоління не має цих недоліків і сьогодні включені в усі керівництва й рекомендації з лікування АР. Однак ця група охоплює велику кількість препаратів, які відрізняються за своїми фармакологічними властивостями; їх потрібно брати до уваги під час вибору ефективного й безпечного лікування конкретного пацієнта.
Мета даної роботи – розглянути фармакологічні характеристики АГП, приділяючи особливу увагу відсутності седативних ефектів як одному з важливих критеріїв вибору, а також проаналізувати особливості основних АГП, які було виявлено експертами, для оптимального вибору АГП у лікуванні хворих з АР на основі міжнародних рекомендацій.
Фармакологічні аспекти седації АГП
Гістамін та його рецептори
Гістамін – це біогенний амін, що утворюється з L-гістидину під дією гістидин-декарбоксилази. Клітини, які продукують гістамін, включають гістамінові нейрони, ентерохромафінні клітини шлунку, тучні клітини й базофіли. Дія гістаміну опосередковується чотирма типами рецепторів – H1, H2, H3 і H4, кожен з яких – це G-білок-зв’язаний рецептор (GPCR). Їхні функції численні: нейромедіація, скорочення гладенької мускулатури, судинна проникність, секреція шлункового соку, базофільна функція тощо. Рецептори Н1, які зв’язуються АГП, широко представлені в клітинах різних органів і тканин: центральна нервова система (ЦНС), гладенька мускулатура кровоносних судин і бронхів, ендотелій, хондроцити, гепатоцити, дендроцити, моноцити, нейтрофіли й лімфоцити. Слід зазначити, що АГП є зворотними агоністами. Вони не блокують, а конкурентно зв’язуються з рецептором Н1, переводячи його в неактивний стан.
Формування кристалічного комплексу між Н1-рецептором і АГП першого покоління доксепіном було виявлено в 2011 році. Н1-рецептор складається з 7 трансмембранних спіралей із зовнішнім N-кінцем і внутрішньоклітинним С-кінцем, що є спільною характерною особливістю всіх GPCR. Але структура петлі між спіралями відрізняється від інших амінних рецепторів, що зумовлює їх низьку схожість. Більшість амінокислотних залишків, які знаходяться в сайті зв’язування доксепіну й H1-рецептора, є висококонсервативними в порівнянні з іншими амінними рецепторами, але під час взаємодії з фосфат-іоном вони специфічні щодо Н1-рецептора.
У моделі з’єднання карбоксильної групи (негативний заряд) АГП другого покоління (олопатадину, акривастину, левоцетиризину й фексофенадину) із сайтом зв’язування фосфат-іона була припущена висока специфічність цих препаратів щодо Н1-рецептора. Також на моделі стикування карбоксильної групи зі зв’язуючим доменом фосфат-іона, висока специфічність до Н1-рецепторів була припущена в біластину. Епінастин, дезлоратадин, лоратадин і рупатадін належать до іншого типу аминогрупп, тому мають низьку специфічність до Н1-рецепторів і зв’язуються також з іншими GPCR.
Седативний потенціал АГП і їх класифікація на підставі окупації Н1-рецепторів головного мозку
Седативні властивості АГП (сонливість, порушення працездатності та ін.) опосередковані пригніченням функції центральних гістамінергічних нейронів. Клітинне тіло нейрона локалізується в туберо-мамілярному ядрі гіпоталамуса з поширенням нервових волокон у спинний мозок і формуванням моноамінергічної нервової системи.
Активація гістамінергічних нейронів призводить до викиду гістаміну, який безпосередньо активує функцію кори головного мозку через Н1 і Н2-гістамінові рецептори або за допомогою збудження ацетилхолінових і норадреналінових нейронів у стовбурі головного мозку. У свою чергу, активація кори головного мозку тісно пов’язана з підтриманням стану збудження, посиленням когнітивних функцій і пригніченням апетиту.
Для реалізації своїх седативних властивостей АГП мають проникати крізь гематоенцефалічний бар’єр і з’язувати Н1-рецептори. Таким чином, окупація Н1-рецептора (Н1RO) визначена як індекс седативного потенціалу цієї групи препаратів. Для його оцінки була проведена позитронно-емісійна томографія з використанням [11C] доксепіна. Як приклад наводиться дослідження АГП другого покоління фексофенадину і цетиризину, де Н1РО фексофенадину (120 мг) була мінімальною (0,1%), тоді як цетиризину (20 мг) – помірною (26,0%). За даними психомоторних тестів у цьому ж дослідженні фексофенадин не показав значних відмінностей у порівнянні з плацебо, і його вплив був істотно нижчим порівняно з цетиризином. Суб’єктивна оцінка цетиризину показує, що його прийом викликає сонливість; дія фексофенадину була порівнянна з плацебо. Також при оцінці впливу різних АГП на здатність керувати автомобілем було зазначено, що АГП першого покоління гідроксизин (30 мг) значно погіршує показники в порівнянні з фексофенадином, дія якого не відрізнялася від плацебо. Крім цього, пропорційний коефіцієнт погіршення (proportional impairment ratio, PIR), заснований на суб’єктивних відчуттях і об’єктивних даних, був використаний у якості індексу седації Н1-рецепторів для оцінки багатьох АГП другого покоління. За результатами дослідження PIR різних препаратів розподілився наступним чином:
- фексофенадин 0,00;
- цетиризин 0,25;
- гідроксизин 2,43.
Отже, за допомогою ПЕТ була підтверджена кореляція між PIR, частотою розвитку седативних ефектів і Н1РО.
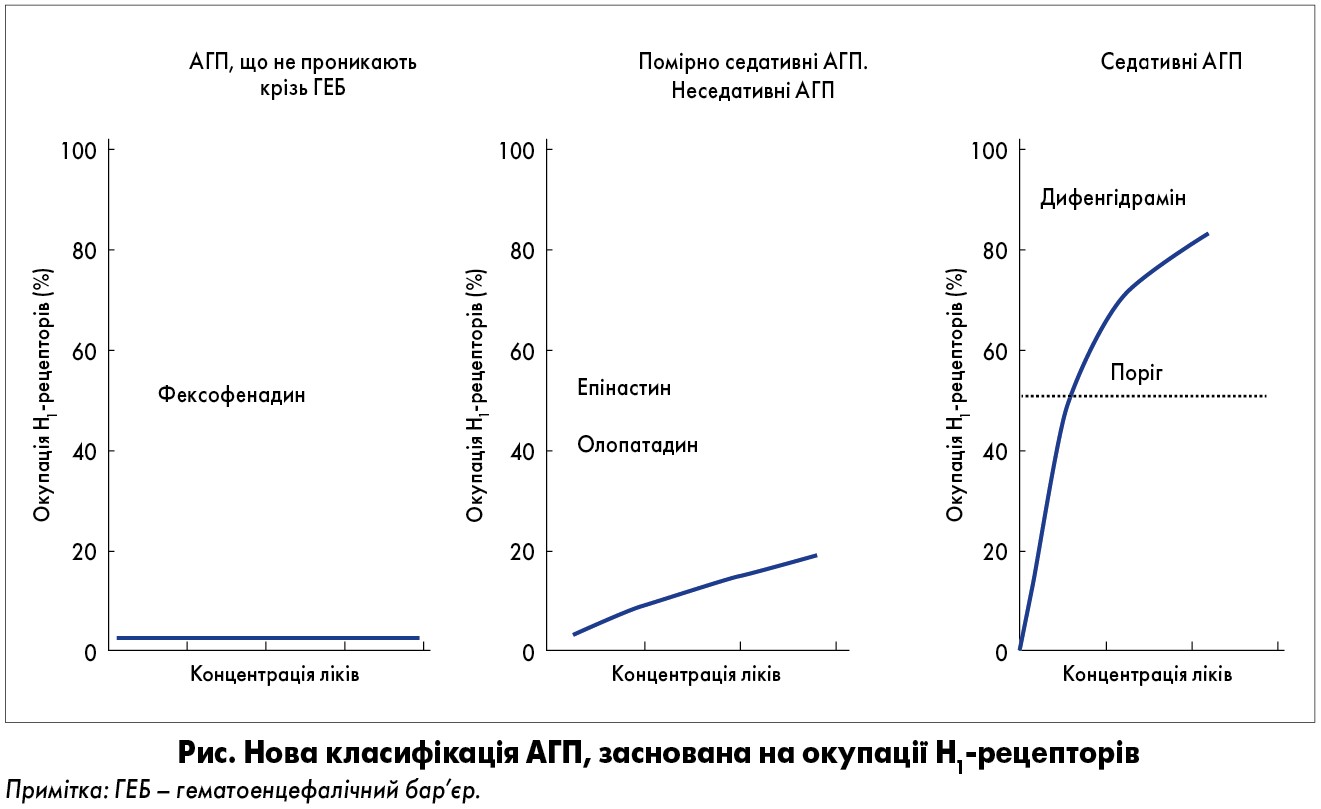
Yanai та співавт. запропонували класифікацію АГП першого і другого покоління в залежності від ступеня Н1РО. Важливість окупації Н1-рецепторів як показника неседативних властивостей АГП була підтверджена консенсусною групою за новими АГП (Consensus Group of New Generation of Antihistamines, CONGA), вони були розділені на 3 групи залежно від ступеня Н1РО після одноразового застосування (рис.):
- неседативні (<20%);
- помірно седативні (20-50%);
- седативні (≥50%).
Згідно з даними численних досліджень, до неседативних АГП належать: біластин (20 мг), фексофенадин (60-120 мг), левоцетиризин (5 мг), епінастин (20 мг), ебастин (10 мг), лоратадин (10 мг), терфенадин (60 мг), цетиризин (10 мг), олопатадин (5 мг) і бепотастін (10 мг).
Хімічна структура АГП неседативної групи характеризується наявністю гідрофільної функціональної групи, тобто карбоксильної (-COOH) і/або аміногрупи (-NH2), які, ймовірно, перешкоджають проникненню крізь ГЕБ.
АГП, що не проникають крізь ГЕБ: біластин та фексофенадин
Біластин і фексофенадин – це неседативні АГП, фактично з нульовим значенням Н1РО, які мінімально проникають крізь ГЕБ. Молекули обох препаратів біполярні (N+ і COO-). Зв’язування з Н1-рецептором у них є подібним. Крім цього, молекулярні маси більше в порівнянні з іншими АГП, константа кислотно-основної дисоціації (рКа) також не відрізняється (біластин, рКа1=4,06 і рКа2=9,43; фексофенадин, рКа1=4,04 і pKa2=9,01), при фізіологічному рівні рН вони повністю дисоціюються (іонізуються). Більшість неседативних АГП, включаючи біластин та фексофенадин, є субстратами Р-глікопротеїну; відповідно, їх проникнення крізь ГЕБ обмежено. Однак внесок Р-глікопротеїну в проникність ГЕБ буде варіювати в окремих препаратах. Крім гідрофобності, молекулярної маси й електричного заряду (сумарний заряд у фізіологічних умовах) з’єднань, важливу роль відіграють такі фактори, як ферменти цитохрому Р450, енантіомери тощо. У разі пасивної дифузії проникність крізь ГЕБ збільшується зі зменшенням молекулярної маси.
Що стосується афінності різних АГП до Н1-рецепторів, в умовах in vitro експериментально було показано, що фексофенадин має меншу спорідненість у порівнянні з біластином, тому для отримання аналогічного ефекту його доза мусить бути збільшена.
Залишкові ефекти седативних АГП
Період напіврозпаду АГП у головному мозку може бути довшим, ніж у плазмі крові, тому потрібна обережність. Оцінка Н1РО в динаміці після прийому седативних АГП (дифенгідрамін 50 мг і кетотифен 1 мг) через 3-23 год дозволила виявити, що період напіврозпаду цих препаратів становить приблизно 30 і 45 год відповідно, а період напіввиведення в плазмі крові – 6-8. Таким чином, у головному мозку період напіврозпаду препаратів у 5 разів більше, ніж у плазмі. Повідомляється, що АГП впливають на циркадний ритм сну/неспання, збільшуючи або зменшуючи тривалість сну, а також викликають сонливість і знижують працездатність на наступний день після їх прийому. Ці спостереження вказують на залученість головного мозку в фармакокінетику седативних АГП. Слід зазначити, що й місцеве застосування седативних АГП (очні краплі, назальний спрей) також спричиняє центральну дію з окупацією Н1-рецепторів.
Клінічні аспекти неседативних АГП другого покоління
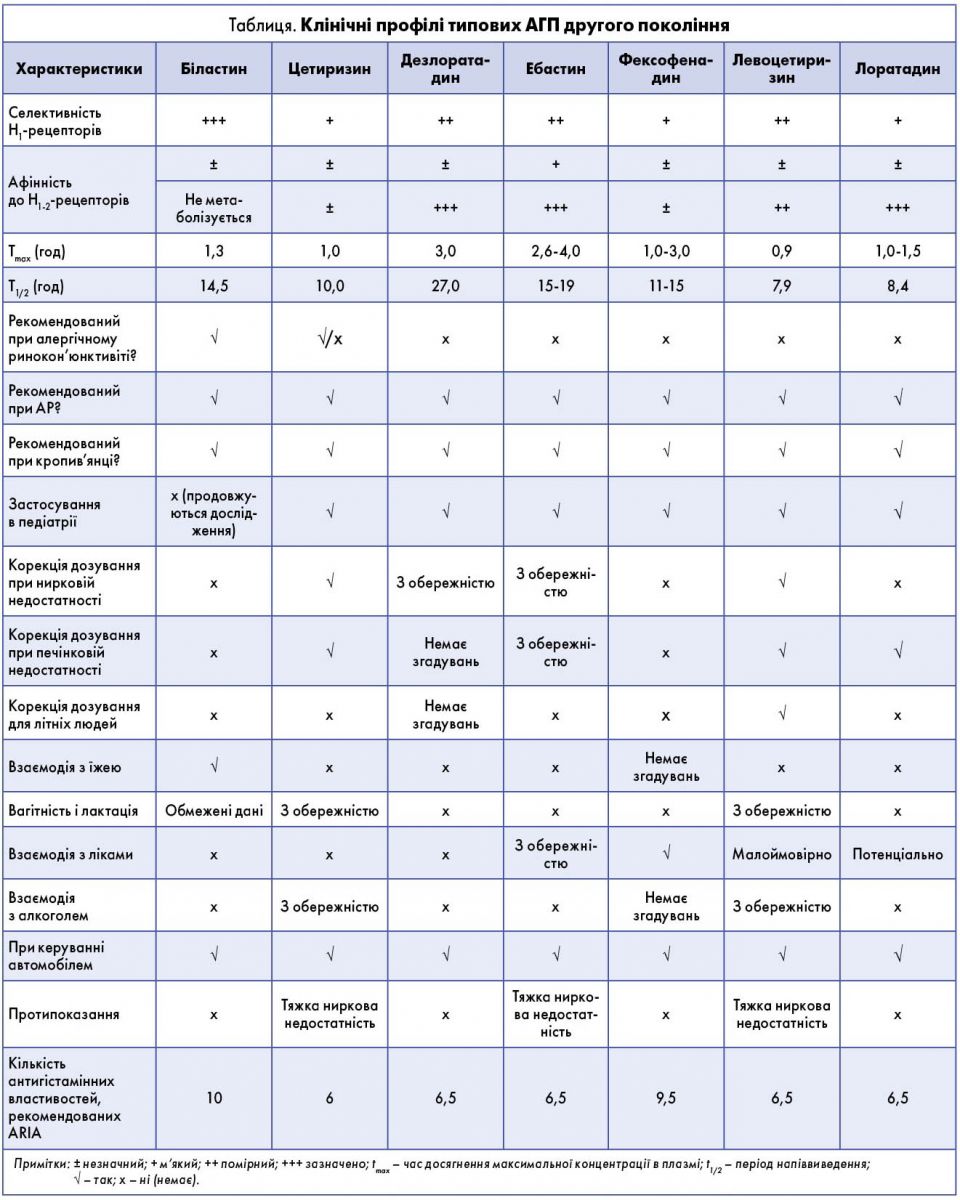
Клінічні профілі типових АГП
Лоратадин і дезлоратадин, що належать до типу аміногрупи, мають антихолінергічну активність, тоді як біластин, фексофенадин, цетиризин, левоцетиризин і ебастин, що належать до типу карбоксигрупи, демонструють більш високу специфічність до H1-рецепторів, проявляючи властивості антагоністів. Усі ці препарати показані при АР і кропив’янці. Вони мають нетривалий час максимальної концентрації в плазмі (приблизно 3 год) і тривалий період напіввиведення (≥10 год, за винятком левоцетиризину і лоратадину). Фексофенадин призначається двічі на день на відміну від інших препаратів цієї групи. Біластин, фексофенадин і цетиризин не метаболізуються або метаболізуються мінімально. Біластин і фексофенадин не потребують корекції дози в пацієнтів із порушенням роботи нирок і печінки. Хворий має бути попереджений про можливу появу сонливості під час прийому цих препаратів. Проте керувати автомобілем можна. Препарати, які максимально відповідають вимогам ARIA для пероральних АГП, – це біластин і фексофенадин. З усіх перерахованих АГП тільки біластин не може бути використаний у педіатричній практиці в Японії. Крім цього, з огляду на вплив їжі на ефективність препарату, біластин рекомендується приймати натщесерце. Також всмоктування фексофенадину й біластину знижується при одночасному вживанні грейпфрутового соку, що потрібно враховувати.
Таким чином, вибір АГП має бути індивідуальним з урахуванням усіх особливостей (табл.).
Ефективність при сезонному АР
У багатоцентровому рандомізованому подвійному сліпому паралельному порівняльному дослідженні у 683 пацієнтів із сезонним АР (САР), які приймали перорально біластин (20 мг), цетиризин (10 мг) і плацебо одноразово щодня протягом 14 днів, біластин і цетиризин значно зменшували площу кривої загальної симптоматики (ЗС – оцінка носових симптомів (НС) + оцінка не носових симптомів, ННС) у порівнянні з плацебо (76,5 і 72,3 відповідно для біластину і цетиризину проти 100,6 для плацебо; р<0,001 (дисперсійний аналіз, ANOVA). В обох препаратах темпи зниження вираженості симптомів і ефективність були практично однаковими і значно перевищували такі в плацебо. У цьому дослідженні частота виникнення сонливості в групі біластину була значно нижчою, ніж у групі цетиризину (1,8 проти 7,5%; p<0,001 [X2 test]; плацебо 2,2%).
У багатоцентровому рандомізованому подвійному сліпому паралельному порівняльному дослідженні серед 721 пацієнта із САР, які приймали перорально біластин (20 мг), дезлоратадин (5 мг) і плацебо 1 р./добу протягом 14 днів, біластин і дезлоратадин значно знижували площу кривої ЗС у порівнянні з плацебо (98,4 і 100,5 відповідно проти 118,4; р<0,001 [ANOVA]). Крім цього, при окремій оцінці НС і ННС, а також дискомфорту, пов’язаного з АР, ці препарати показали порівнянну ефективність і частоту розвитку побічних ефектів.
Чотирибічне рандомізоване подвійне сліпе перехресне дослідження біластину (20 мг), цетиризину (10 мг), фексофенадину (120 мг) і плацебо включило 75 добровольців із САР, які штучно піддавалися впливу пилку протягом 2 днів поспіль: 6 год у перший день і 4 – у другий. АГП вводилися через 2 год від початку провокації тільки в перший день. Очні, носові та загальні симптоми оцінювалися як у перший, так і в другий день. Біластин відрізнявся швидкою і більш тривалою дією – понад 26 год, ефективно пригнічуючи симптоматику САР. Дія цетиризину була порівнянною. Фексофенадин також був ефективний у перший день застосування, але його ефективність знижувалася на другий день, що вказує на більш коротку тривалість дії. Всі препарати в цьому дослідженні показали свою ефективність і добру переносимість.
В іншому рандомізованому подвійному сліпому чотирибічному перехресному дослідженні біластину (10 або 20 мг), фексофенадину (60 мг двічі з інтервалом 12 год) і плацебо у 136 японських пацієнтів із САР (поліноз японського кедра) з використанням камери OHIO (штучна провокація пилком) було показано, що загальна назальна симптоматика на тлі біластину 20 мг була значно менше виражена в порівнянні з групою фексофенадину через 3 год після прийому.
Ефективність біластину в пацієнтів із САР порівнянна з такою в цетиризину й дезлоратадину й вище, ніж у фексофенадину. Біластин у меншій мірі викликає сонливість у порівнянні з цетиризином. Усі три препарати також ефективні при персистуючому АР. Частота сонливості, викликаної біластином (20 мг 1 р./добу) і фексофенадином (60 мг 2 р./добу), протягом 2 тиж в японських пацієнтів із ПАР склали 0,8 і 0,4% відповідно.
Безпека біластину для ЦНС
Психомоторні показники оцінювалися за допомогою декількох об’єктивних тестів: оцінка моторної активності (Fine Motoric Test, FMT), сприйняття (Critical Flicker-Fusion Frequency Test, CFF), уваги («d2» Cancellation Test, D2T) і асоціативної інтеграції (Simple Reaction Time, SRT) у рандомізованому подвійному сліпому п’ятисторонньому перехресному дослідженні на 20 здорових добровольцях із використанням біластину (20, 40 або 80 мг), гідроксизину (25 мг) і плацебо 1 р./добу протягом 7 днів. Було зазначено значну зміну психомоторного стану після одноразового прийому (1 день) 80 мг біластину й гідроксизину. При цьому тести продемонстрували більш значущий вплив гідроксизину в порівнянні з біластином. Однак після повторного прийому (7 днів) будь-якого препарату суттєвих змін у психомоторному стані зазначено не було. Незалежно від кратності застосування біластину в дозі 20 і 40 мг психомоторна активність не змінювалася.
У рандомізованому подвійному сліпому чотирибічному перехресному дослідженні у 22 здорових добровольців, які отримували біластин (20 або 40 мг), гідроксизин (50 мг) і плацебо 1 р./добу протягом 8 днів, за допомогою тесту SDLP (Standard Deviation Lateral Position) оцінювалася здатність керувати автомобілем. Погіршення показників SDLP було виявлено в групі, що одержувала гідроксизин, у порівнянні з плацебо, тоді як у групі біластину 20 або 40 мг істотних змін не спостерігалося.
У рандомізованому подвійному сліпому шестисторонньому дослідженні на 24 здорових добровольцях оцінювалися психомоторні показники за допомогою об’єктивних тестів (включаючи FMT, CFF, D2T і SRT). Учасники отримували біластин (20 або 80 мг), цетиризин (10 мг) або гідроксизин (25 мг) у поєднанні зі спиртом (0,8 г/кг), тільки спирт у поєднанні з плацебо (препарат) і плацебо (й алкоголь, і препарат). Значне погіршення показників зазначалося в усіх групах, крім плацебо, і найбільш значущим воно було серед пацієнтів, які отримували 80 мг біластину, цетиризину або гідроксизину в поєднанні з алкоголем. Погіршення психомоторної активності на тлі застосування біластину в дозі 80 мг і гідроксизину було порівнянним і більш вираженим, ніж у цетиризину. Не відрізнялися показники в учасників, які отримували біластин у дозі 20 мг у поєднанні з алкоголем і тільки алкоголь.
Таким чином, біластин у дозах 20 і 40 мг не продемонстрував зниження працездатності через седативну дію, а в стандартній дозі 20 мг не показав взаємодії з алкоголем.
Висновки
Окупація Н1-рецепторів є корисним інструментом, що дозволяє розділити АГП на неседативні, помірно седативні та седативні групи. Препарати з неседативною дією – біластин і фексофенадин – у стандартних дозах не окупують центральні Н1-рецептори, відповідно, їх можна віднести до АГП, що не проникають крізь ГЕБ. Крім цього, щодо хімічної структури, обидва препарати схожі між собою в багатьох аспектах, однак біластин має більшу афінність до Н1-рецепторів у порівнянні з фексофенадином.
Не було виявлено суттєвих відмінностей в ефективності типових представників АГП другого покоління, але важливим критерієм у виборі цих препаратів є проникнення крізь ГЕБ і наявність або відсутність седативного ефекту, з яким пов’язана безпека лікування. Об’єктивно було показано, що біластин не впливає на психомоторну й рухову активність навіть у дозі 40 мг, яка вдвічі перевищує терапевтичну, а отже, є ефективним і безпечним у лікуванні пацієнтів з АР.
Думка експертів
Для лікування АР мають бути рекомендовані не просто АГП другого покоління, а неседативні АГП, оскільки окремі представники цієї групи мають седативну дію. АГП першого покоління, крім вираженої седативної дії, можуть також спричинити побічні явища, пов’язані з антихолінергічною дією, при цьому їхня ефективність не обов’язково вища. Слід зазначити, що прийом АГП з седативною дією (що викликає сонливість) перед сном також не рекомендується, оскільки вони можуть погіршувати якість сну, а ефект післядії може зберігатися й протягом наступного дня.
Ефективність АГП другого покоління щодо АР приблизно порівнянна серед усіх препаратів, проте вибір має бути зроблений на користь неседативних. Такі препарати, як фексофенадин, біластин, дезлоратадин і лоратадин, включені в рекомендації з лікування АР для членів екіпажу літаків. Однак, за даними низки досліджень щодо окупації Н1-рецепторів і когнітивних функцій, повідомляється про м’який седативний ефект лоратадину, тому необхідно його подальше вивчення. Незважаючи на те що оцінка окупації Н1-рецепторів є корисним інструментом із точки зору визначення седативного потенціалу АГП, залишається багато питань, які потребують подальшого розгляду. Так, наприклад, є гендерні та вікові особливості Н1РО. Крім цього, невідомо, чи корелює ступінь Н1РО у здорових людей і пацієнтів з алергічними захворюваннями. Також після повторного введення деяких препаратів Н1РО збільшується. Однак сучасні дані, безумовно, корисні і можуть використовуватися в клінічній практиці. Відповідно до класифікації, заснованої на Н1РО, фексофенадин і біластин можуть бути розглянуті як препарати, які не проникають крізь ГЕБ на відміну від інших представників АГП другого покоління (що відповідає вимогам ARIA до ідеального АГП). Незважаючи на те що ці два препарати мають схожі хімічні властивості, між ними є деякі відмінності: біластин характеризується більш високою спорідненістю до Н1-рецепторів у порівнянні з фексофенадином; біластин призначається 1 раз на добу, а фексофенадин – двічі; біластин не застосовується в педіатрії. Виходячи з результатів клінічних досліджень і з точки зору фармакології, біластин може вважатися одним із кращих АГП у лікуванні АР. Крім цього, безпека і переносимість 10 мг біластину 1 р./добу протягом 12 тиж вже були підтверджені в дітей від 2 до 12 років, тому очікується розширення показань до його застосування в педіатрії.
Зниження працездатності на тлі прийому біластину не спостерігалося навіть при застосуванні 40 мг, що вдвічі перевищує терапевтичну дозу. Згідно з міжнародними рекомендаціями при лікуванні кропив’янки, рекомендується збільшення дози АГП у 4 рази, проте варто уникати застосування 80 мг біластину, оскільки, попри високу ефективність, у цій дозі він впливає на психомоторну активність. Тому необхідні окремі дослідження, які будуть оцінювати седативний ефект підвищених доз.
У рекомендаціях ARIA ефективність при закладеності носа й тощо є однією з вимог до ефективних пероральних АГП, тобто вони мають чинити супутню протизапальну дію. І насправді, у дослідженнях було показано, що блокатори Н1-рецепторів інгібують Т-хелпери – Th1, інтерферон та інтерлейкін – IL‑2, збільшуючи продукцію Th2, ІL‑4 та ІL‑13. Проте в клінічній практиці протизапальний ефект мається на увазі тільки емпірично, тому вибір АГП варто засновувати на ефективності, безпеці, седативних ефектах та можливості підвищення дозування за неефективності стандартних доз. Важливо також ураховувати лікарські взаємодії, тому перевага буде віддана АГП, метаболізм яких відбувається без участі цитохрому Р450. Біластин задовольняє цим вимогам, оскільки мінімально метаболізується в організмі.
Для ефективного лікування пацієнтів з алергічними захворюваннями не менш важливий зв’язок між лікарем і пацієнтом. Потрібно враховувати не тільки симптоми, а й спосіб життя пацієнта, ступінь задоволеності лікуванням, економічні можливості та прийом інших препаратів для лікування супутніх захворювань. Вибір терапії має бути індивідуальним, а пацієнт мусить усвідомлювати всі переваги й ризики обраного препарату.
Заключення
- При виборі АГП для лікування АР особливо важлива відсутність у нього центральної седативної та антихолінергічної дії.
- Різні АГП другого покоління відрізняються за своїми седативними й антихолінергічними ефектами.
- Беручи до уваги здатність АГП окупувати Н1-рецептори головного мозку, можна виділити біластин і фексофенадин у групу неседативних АГП, які не проникають крізь ГЕБ.
- Відсутні значущі відмінності в ефективності неседативних АГП у лікуванні АР.
- Безпека АГП у ЦНС має оцінюватися не тільки за суб’єктивними показниками, такими як сонливість, а й за результатами об’єктивних тестів.
- Було підтверджено, що в АГП, які не проникають у мозок, відсутні седативні властивості навіть при підвищенні звичайної дози вдвічі, тому вони вважаються препаратами першої лінії в лікуванні АР.
H. Kawauchi, K. Yanai et al. Antihistamines for Allergic Rhinitis Treatment from the Viewpoint of Nonsedative Properties // Int. J. Mol. Sci. – 2019, 20, 213.
Переклала з англ. і підготувала Ірина Чумак
Тематичний номер «Пульмонологія, Алергологія, Риноларингологія» № 2 (47), 2019 р.