9 вересня, 2019
Тромбоз коронарных артерий у пациента с миокардитом
В большинстве случаев в основе острого коронарного синдрома (ОКС) лежат развитие и прогрессирование коронарного атеросклероза с последующим повреждением атеросклеротической бляшки и тромбообразованием. В то же время, по нашим данным, у молодых пациентов до 45 лет с ОКС с элевацией сегмента ST диагноз инфаркта миокарда (ИМ) устанавливается только в 80% случаев, из них у 20% не выявляют гемодинамически значимых ОКС с элевацией сегмента ST стенозов коронарных артерий при проведении коронаровентрикулографии (КВГ) [1]. Таким образом, молодые больные ОКС зачастую требуют проведения целого ряда дополнительных исследований для подтверждения окончательного диагноза. Именно такой случай развития коронарного тромбоза на фоне хронического диффузного миокардита (диагностированого ретроспективно) мы хотим представить вашему вниманию.
Клинический случай
Пациент, 35 лет, строитель, доставлен каретой скорой помощи по переводу из стационара по месту жительства с жалобами на интенсивные боли в грудной клетке, слабость, чувство нехватки воздуха через четыре часа от развития заболевания. Боли в грудной клетке возникли впервые в жизни. Сахарный диабет и артериальная гипертензия ранее не диагностировались, уровень холестерина не знает. В семейном анамнезе у ближайших родственников не отмечено случаев раннего развития атеросклероза, а также острого ИМ или инсульта. Пациент курит более одной пачки сигарет в день, регулярно употребляет алкоголь, в процессе профессиональной деятельности контактирует с лакокрасочными материалами.
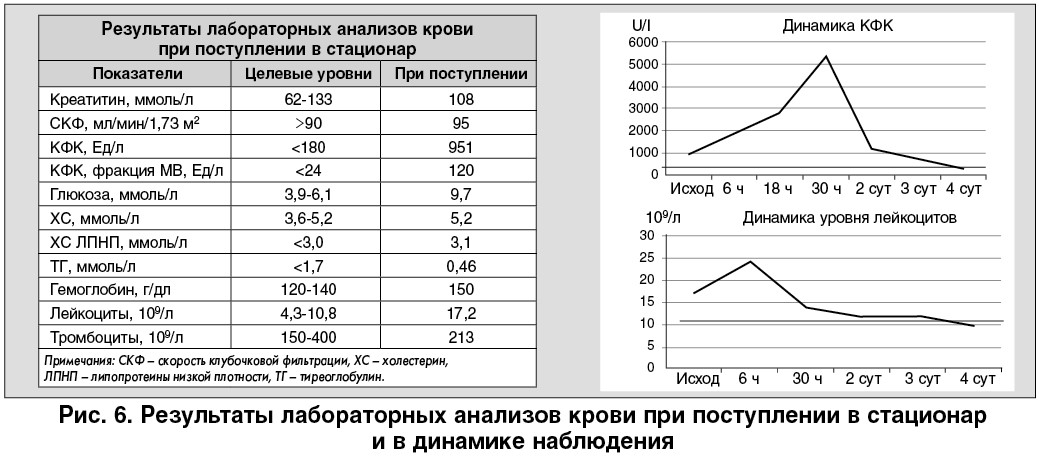
 На догоспитальном этапе снята электрокардиограмма (ЭКГ), выставлен диагноз ОКС с элевацией сегмента ST в области задней и боковой стенок левого желудочка (ЛЖ). Пациент доставлен в наш ННЦ «Институт кардиологии имени академика Н.Д. Стражеско НАМН Украины» г. Киева (далее – Институт кардиологии) для проведения реперфузионной терапии. Первая ЭКГ больного (на этапе кареты скорой медицинской помощи) представлена на рисунке 1.
На догоспитальном этапе снята электрокардиограмма (ЭКГ), выставлен диагноз ОКС с элевацией сегмента ST в области задней и боковой стенок левого желудочка (ЛЖ). Пациент доставлен в наш ННЦ «Институт кардиологии имени академика Н.Д. Стражеско НАМН Украины» г. Киева (далее – Институт кардиологии) для проведения реперфузионной терапии. Первая ЭКГ больного (на этапе кареты скорой медицинской помощи) представлена на рисунке 1.
Уровень артериального давления (АД) на этапах догоспитальной помощи находился в пределах 90‑100 мм рт. ст. систолическое и 60‑65 мм рт. ст. диастолическое. На ЭКГ отмечалась атриовентрикулярная (АВ) блокада 2-й (периодически 3-й) степени с замедлением частоты сердечных сокращений (ЧСС) до 45‑48 уд./мин. При этом сатурация кислорода при дыхании воздухом по данным пульсоксиметрии (SPO2) снижалась до 86‑88%. До поступления в стационар пациент получил 180 мг тикагрелора и 300 мг аспирина перорально, 80 мг эноксапарина – нефракционного гепарина (НФГ) подкожно. Для купирования болевого синдрома вводили морфин, использовали внутривенное введение (в/в) нитропрепаратов. После развития АВ-блокады для стабилизации гемодинамики применяли атропин, дофамин и дексаметазон. Проводили оксигенотерапию.
В рекомендациях Европейского общества кардиологов (ESC) четко прописана логистика оказания первой помощи пациентам с элевацией сегмента ST [2]. За точку отсчета – «нулевое» время – выбран момент первого медицинского контакта. Именно тогда включается секундомер медицинского этапа оказания помощи, а соблюдение рекомендуемых временных интервалов характеризует качество оказания медицинских услуг. Под «первым медицинским контактом» (ПМК) следует понимать момент, когда больного впервые осмотрел врач, парамедик, медсестра или другой обученный персонал, который может снять и интерпретировать ЭКГ и оказать неотложную помощь (например, дефибрилляция). ПМК может произойти как догоспитально, так и после приезда пациента в больницу (например, в приемном покое).
В соответствии с рекомендациями, ЭКГ у больного с болью в грудной клетке должна быть записана и проанализирована в течение первых 10 минут от ПМК. В дальнейшем пациент с уже подтвержденным диагнозом ИМ с элевацией сегмента ST (STEMI) должен быть направлен в реперфузионный центр для проведения первичного чрескожного коронарного вмешательства (ЧКВ). При этом время от постановки диагноза до открытия коронарной аретрии не должно превышать 60 мин, если пациент сразу обратился в реперфузионный центр, или 90 мин, если ПМК был вне специализированного медучреждения (большинство пациентов). Максимальное время между постановкой диагноза STEMI и первичным ЧКВ не должно превышать 120 мин. Если это условие не может быть выполнено независимо от причин, следует немедленно (в пределах 10 мин от постановки диагноза) начать фибринолитическую терапию (при отсутствии противопоказаний).
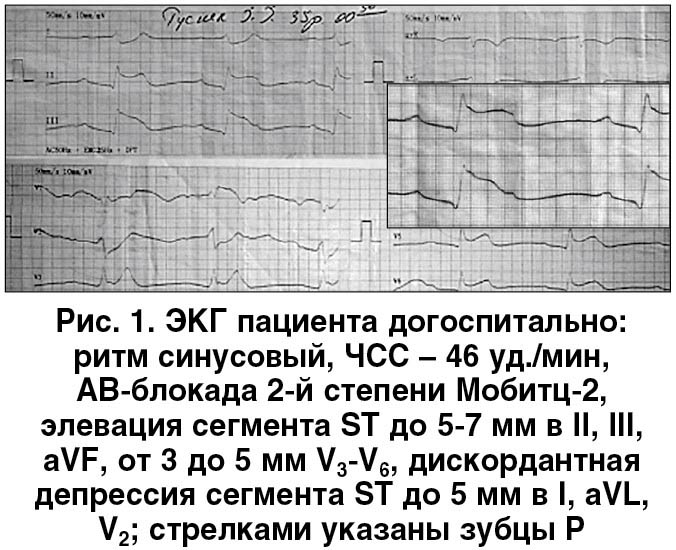
 В нашем случае использование дополнительного звена (районная больница) в цепи оказания догоспитальной помощи данному больному не позволило соблюсти необходимые временные интервалы по доставке, и госпитализация в реперфузионный центр была проведена только через 2 часа 28 минут (148 мин) после регистрации первой ЭКГ. При этом тромболитическая терапия на догоспитальном этапе пациенту не проводилась. Несмотря на существенную задержку времени на этапах госпитализации, состояние пациента при поступлении было гемодинамически стабильным. Сохранялись жалобы на боли загрудинного характера, выраженную слабость. Уровень АД составлял 125/80 мм рт. ст. (без введения прессорных аминов); ЧСС – 105 уд./мин; SPO2 (без ингаляции кислорода) – 98%. Дополнительных тонов и шумов при аускультации сердца не было. В легких влажные хрипы не выслушивались (острая левожелудочковая недостаточность [ОЛЖН] по Killip I). ЭКГ на момент поступления в стационар представлена на рисунке 2.
В нашем случае использование дополнительного звена (районная больница) в цепи оказания догоспитальной помощи данному больному не позволило соблюсти необходимые временные интервалы по доставке, и госпитализация в реперфузионный центр была проведена только через 2 часа 28 минут (148 мин) после регистрации первой ЭКГ. При этом тромболитическая терапия на догоспитальном этапе пациенту не проводилась. Несмотря на существенную задержку времени на этапах госпитализации, состояние пациента при поступлении было гемодинамически стабильным. Сохранялись жалобы на боли загрудинного характера, выраженную слабость. Уровень АД составлял 125/80 мм рт. ст. (без введения прессорных аминов); ЧСС – 105 уд./мин; SPO2 (без ингаляции кислорода) – 98%. Дополнительных тонов и шумов при аускультации сердца не было. В легких влажные хрипы не выслушивались (острая левожелудочковая недостаточность [ОЛЖН] по Killip I). ЭКГ на момент поступления в стационар представлена на рисунке 2.
Предварительный диагноз: ОКС со стойкой элевацией сегмента ST. Пациент помещен под мониторное наблюдение. Согласно рекомендациям, оксигенотерапия при ОКС должна проводиться только в случае значимой гипоксемии (SaO2 <90%, PaO2 <60 мм рт. ст.). Данные нескольких исследований свидетельствуют о том, что гипероксия может оказывать дополнительное повреждающее действие на миокард у лиц с неосложненным ИМ [3‑5]. Поэтому рутинное назначение кислорода больным ОКС с сатурацией SaO2 ≥90% по данным пульсоксиметрии не рекомендовано. Таким образом, оксигенотерапия в стационаре не проводилась.
Уже на догоспитальном этапе пациенту была назначена двойная антитромбоцитарная терапия – даны нагрузочные дозы тикагрелора (180 мг) и аспирина (300 мг). Именно тикагрелор или прасугрель в дополнении к аспирину рассматриваются в настоящее время как препараты выбора у пациентов со STEMI, которым планируется проведение ЧКВ [2, 6‑8]. В соответствии с рекомендациями, антикоагулянтная терапия показана всем больным во время проведения первичного ЧКВ, причем приоритетным является использование нефракционированного гепарина (класс I, уровень С), эноксапарина (класс IIа, уровень А) или бивалирудина (класс IIа, уровень А) [2]. Нашему пациенту не назначали антикоагулянты при поступлении в отделение неотложной кардиологии, так как он получил эноксапарин догоспитально.
При поступлении в стационар пациент также применял 40 мг пантопразола для профилактики желудочно-кишечных кровотечений на фоне тройной антитромботической терапии и 80 мг аторвастатина. Назначение статинов в ранние сроки ОКС рекомендовано, полагаясь на быструю реализацию их плеотропных эффектов (антитромбоцитарный, противовоспалительный, нормализация функции эндотелия и др.), а также основываясь на данных по предупреждению контраст-индуцированной нефропатии [2, 9]. Результаты наших исследований подтверждают целесообразность такого подхода и свидетельствуют о лучшем восстановлении микроциркуляции после первичной ЧКВ и предупреждении развития синдрома no-reflow на фоне раннего назначения статинов в высоких дозах [10].
Пациент поступил в отделение неотложной кардиологии, минуя приемный покой. Задачами отделений неотложной кардиологии перед проведением первичной ЧКВ являются подтверждение диагноза ОКС, более четкое уточнение сроков от начала заболевания; исключение других, угрожающих жизни состояний (тромбоэмболия легочной артерерии, расслаивающая аневризма аорты, острая сердечная недостаточность и др.), которые могут сопровождаться болями в грудной клетке; стабилизация параметров центральной гемодинамики (по возможности); оценка и коррекция терапии, проведенной на догоспитальном этапе.
Мы не являемся сторонниками положения рекомендаций ESC относительно того, что пациенты с ОКС с элевацией сегмента ST должны напрямую поступать в катетеризационную лабораторию, однако, безусловно, согласны, что задержка времени на этом этапе должна быть минимальной. Большую помощь в решении поставленных задач на данном этапе оказывает эхокардиография (ЭхоКГ). Этот метод обследования должен выполнять дежурный персонал, желательно в месте первичного осмотра пациента. Зачастую достаточно проведения фокусного ЭхоКГ-исследования, нацеленного на выяснение причин неотложного состояния с качественной оценкой сократимости, что занимает в среднем до 2‑4 мин времени.
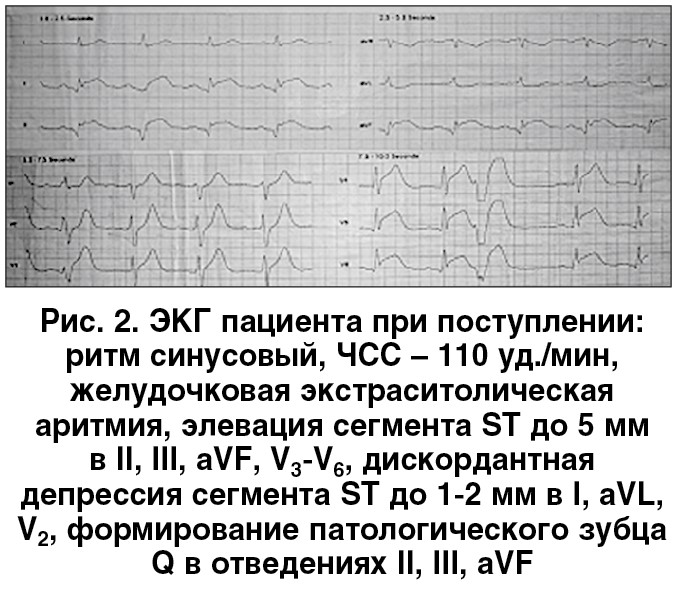
 В рассмотренном случае уже при поступлении пациента были выявлены существенная дилатация полости и снижение сократительной способности ЛЖ, которые не могли развиться в течение нескольких часов от начала симптоматики заболевания. Эти данные указывали на наличие у больного предшествующей (до развития ОКС) патологии сердца, которая в свою очередь не имела активных клинических проявлений. Об этом же свидетельствовало отсутствие клинических признаков ОЛЖН на фоне существенного снижения фракции выброса (ФВ) ЛЖ. Обращали на себя внимание умеренная гипертрофия миокарда ЛЖ и повышение интенсивности сигнала (гиперэхогенность) межжелудочковой перегородки (МЖП). Данные ЭхоКГ при поступлении представлены на рисунке 3.
В рассмотренном случае уже при поступлении пациента были выявлены существенная дилатация полости и снижение сократительной способности ЛЖ, которые не могли развиться в течение нескольких часов от начала симптоматики заболевания. Эти данные указывали на наличие у больного предшествующей (до развития ОКС) патологии сердца, которая в свою очередь не имела активных клинических проявлений. Об этом же свидетельствовало отсутствие клинических признаков ОЛЖН на фоне существенного снижения фракции выброса (ФВ) ЛЖ. Обращали на себя внимание умеренная гипертрофия миокарда ЛЖ и повышение интенсивности сигнала (гиперэхогенность) межжелудочковой перегородки (МЖП). Данные ЭхоКГ при поступлении представлены на рисунке 3.
Задержка времени на этапе отделения неотложной кардиологии составила 16 мин, после чего пациент был направлен в катетеризационную лабораторию. При проведении КВГ (рис. 4) выявлен тромбоз в передней межжелудочковой ветви (ПМЖВ) левой (ЛКА) и правой коронарной артерии (ПКА) в проксимальных сегментах. Обе артерии были частично проходимы, при этом хвостовая часть тромба как в ЛКА, так и в ПКА распространялась до их дистальных отделов. На ангиограмме отсутствовали четкие признаки атеросклеротического поражения, что свидетельство о необходимости поиска альтернативных механизмов тромбообразования.
Второй по частоте причиной коронарного тромбоза является спонтанная диссекция коронарной артерии (СДКА), которая более распространена именно у пациентов молодого возраста без четких признаков атеросклероза и привычных факторов риска. Однако СДКА значительно чаще наблюдается у женщин [11]. Раннее выявление СДКА очень важно с практической точки зрения, так как подходы к ведению таких пациентов имеют ряд существенных отличий. По данным клиники Майо, лица со СДКА имеют более высокую частоту осложнений при проведении ЧКВ, даже в случае исходно сохраненного коронарного кровотока. Из 189 пациентов с СДКА и нормальным или почти нормальным коронарным кровотоком при ангиографии процедура ЧКВ была неуспешной практически в половине случаев, а у 13% впоследствии потребовалась экстренная операция по шунтированию коронарной артерии. Поэтому зачастую при открытой коронарной артерии этих больных специалисты клиники рекомендуют вести медикаментозно [12].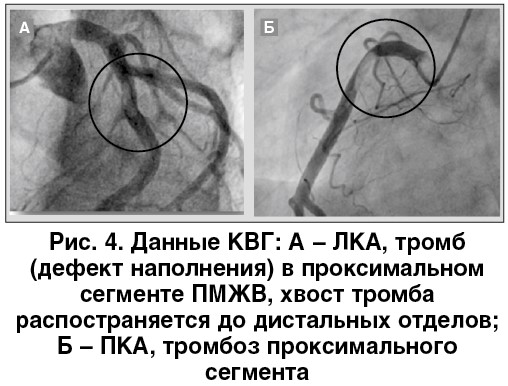
Существует и альтернативная точка зрения, поддерживающая ургентную реваскуляризацию миокарда у таких пациентов [13]. В то же время четкие признаки СДКА в виде эндотелиального лоскута или образования ложного канала в коронарной артерии у нашего больного отсутствовали. В литературе описаны случаи спазма коронарной артерии, ассоциированного с острой алкогольной интоксикацией, который на фоне протромботического состояния и повреждения эндотелия, связанных с курением сигарет, приводил к развитию коронарного тромбоза и последующего острого ИМ [14]. Подобные тромбозы описаны также на фоне проведения химиотерапии и других интоксикаций [15].
В нашем случае развитию ОКС предшествовала острая алкогольная интоксикация, а также работа с лакокрасочными материалами в закрытом помещении, а из анамнеза известно, что пациент курит более 1 пачки сигарет в день в течение длительного времени. Данные ЭхоКГ при поступлении свидетельствовали в пользу предшествовавшего заболевания миокарда, которое могло иметь воспалительную природу и способствовать нарушению функции эндотелия и развитию вазоспазма. На основании данных КВГ, с учетом изложенных выше рассуждений, было принято решение о проведении ургентной реваскуляризации миокарда.
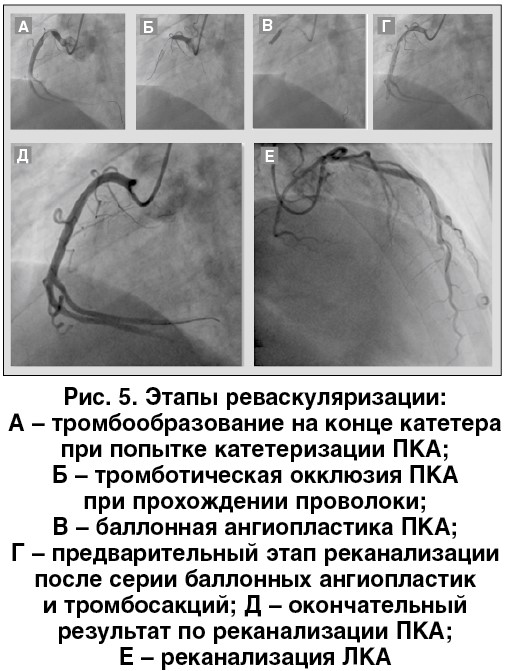 Поскольку на ЭКГ наблюдались преимущественно изменения в области задней стенки ЛЖ, вначале была выполнена попытка реканализации ПКА. После введения проволоки в ПКА отмечено образование дополнительного тромба на конце катетера (рис. 5А), который развился несмотря на активную гепаринизацию (80 мг эноксапарина догоспитально и 10 тыс. Ед НФГ внутриартериально) и примененную на догоспитальном этапе антитромбоцитарную терапию (аспирин и тикагрелор). Это свидетельствовало о выраженной свертывающей готовности у пациента. В дальнейшем была отмечена тромботическая окклюзия коронарной артерии (рис. 5Б). К терапии добавили блокатор IIb/IIIa-рецепторов тромбоцитов эптифибатид (внутрикоронарное болюсное введение и последующая внутривенная инфузия). Реканализация ПКА стала возможной только после многократных тромбосакций и баллонных ангиопластик на фоне продолжающейся инфузии блокаторов гликопротеиновых рецепторов тромбоцитов. Промежуточные этапы и конечный результат процедуры представлены на рис. 5А-Д. Те же этапы были проведены и при реканализации ПМЖВ ЛКА. Конечный результат процедуры приведен на рис. 5Е.
Поскольку на ЭКГ наблюдались преимущественно изменения в области задней стенки ЛЖ, вначале была выполнена попытка реканализации ПКА. После введения проволоки в ПКА отмечено образование дополнительного тромба на конце катетера (рис. 5А), который развился несмотря на активную гепаринизацию (80 мг эноксапарина догоспитально и 10 тыс. Ед НФГ внутриартериально) и примененную на догоспитальном этапе антитромбоцитарную терапию (аспирин и тикагрелор). Это свидетельствовало о выраженной свертывающей готовности у пациента. В дальнейшем была отмечена тромботическая окклюзия коронарной артерии (рис. 5Б). К терапии добавили блокатор IIb/IIIa-рецепторов тромбоцитов эптифибатид (внутрикоронарное болюсное введение и последующая внутривенная инфузия). Реканализация ПКА стала возможной только после многократных тромбосакций и баллонных ангиопластик на фоне продолжающейся инфузии блокаторов гликопротеиновых рецепторов тромбоцитов. Промежуточные этапы и конечный результат процедуры представлены на рис. 5А-Д. Те же этапы были проведены и при реканализации ПМЖВ ЛКА. Конечный результат процедуры приведен на рис. 5Е.
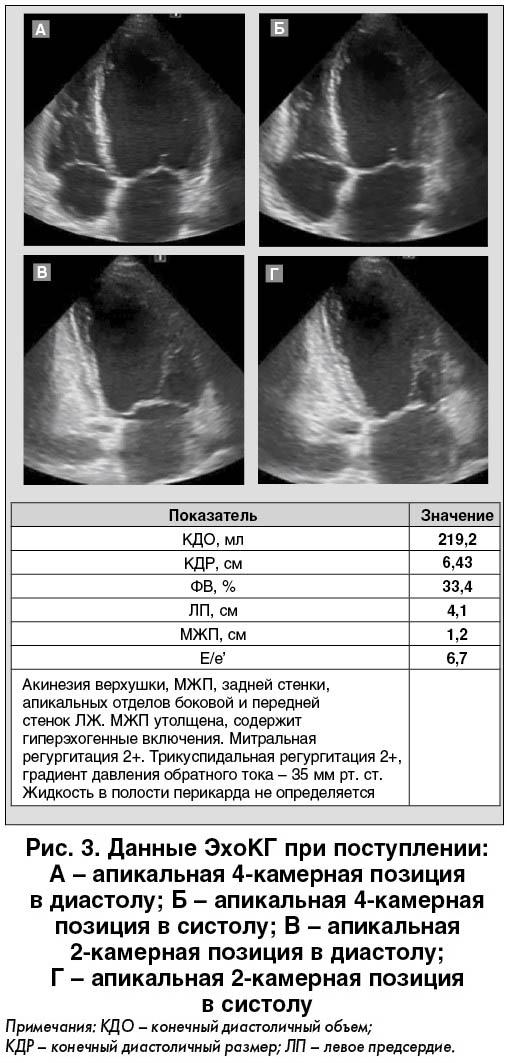
После реваскуляризации пациент в гемодинамически стабильном состоянии вернулся в отделение неотложной кардиологии для дальнейшего лечения. Помещен под мониторное наблюдение. Признаки ОЛЖН на уровне Killip II (единичные влажные хрипы в нижних отделах легких), SPO2 – 96%. Больному продлена двойная антитромбоцитарная терапия (тикагрелор + аспирин), назначены эноксапарин (лечебные дозы в связи с высоким тромботическим риском и отсутствием стентирования), пантопразол, аторвастатин, тестирующие дозы β-блокаторов, ингибиторов ангиотензинпревращающего фермента, эплеренона. Результаты лабораторных анализов крови при поступлении в стационар представлены на рисунке 6. Обращает на себя внимание, что при относительно раннем поступлении в стационар (около четырех часов от развития болевого синдрома) уровень креатинфосфокиназы (КФК) и миокардиальной (MB) фракции КФК при поступлении в стационар был более чем в пять раз выше верхней границы нормы. Вероятно, это обусловлено остаточной проходимостью коронарных артерий и большой зоной ишемии (некроза) миокарда. У пациента не наблюдалось признаков дислипидемии, уровень глюкозы был повышен только исходно и в последующем нормализовался. Динамика уровня КФК и общего количества лейкоцитов в течение госпитального периода отражены на рисунке 6.
На фоне проводимой терапии боли ангинозного характера не рецидивировали, жалоб не было. На вторые сутки течение заболевания осложнилось развитием пароксизма фибрилляции предсердий (ФП), который купировали внутривенным введением амиодарона. Еще несколько кратковременных пароксизмов были зафиксированы при мониторном наблюдении за пациентом. В связи с этим (оценка по CHA2DS2-Vasc 2 балла – сосудистая патология и сердечная недостаточность) пациенту рекомендована длительная антикоагулянтная терапия. Однако с учетом высокого тромботического риска до седьмых суток была продолжена тройная антитромботическая терапия, включавшая тикагрелор, аспирин и эноксапарин в лечебных дозах (1 мг/кг каждые 12 часов). С восьмых суток пациента перевели на прием клопидогреля (начиная с нагрузочной дозы 600 мг через 24 часа после последней таблетки тикагрелора и затем 75 мг/сут) и ривароксабана 15 мг/сут (начат через 12 часов после последней инъекции эноксапарина), при этом аспирин был отменен.
 После стабилизации состояния проводили дальнейший поиск возможных причин исходной дилатации ЛЖ. В качестве наиболее вероятной причины таких изменений рассматривался перенесенный ранее миокардит на фоне хронической интоксикации. Поэтому на следующем этапе диагностического поиска пациенту была проведена магнитно-резонансная томография (кардиоМРТ) сердца с контрастированием для выявления выраженности, характера, локализации и давности повреждений миокарда (рис. 7).
После стабилизации состояния проводили дальнейший поиск возможных причин исходной дилатации ЛЖ. В качестве наиболее вероятной причины таких изменений рассматривался перенесенный ранее миокардит на фоне хронической интоксикации. Поэтому на следующем этапе диагностического поиска пациенту была проведена магнитно-резонансная томография (кардиоМРТ) сердца с контрастированием для выявления выраженности, характера, локализации и давности повреждений миокарда (рис. 7).
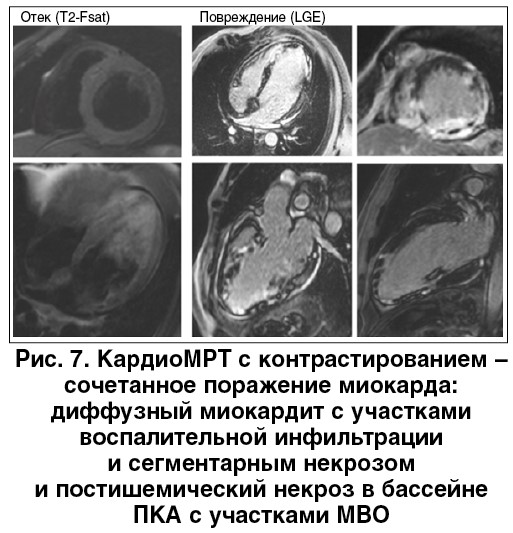
По данным кардиоМРТ, на третьи сутки после госпитализации было выявлено сочетанное поражение миокарда: диффузный миокардит с участками воспалительной инфильтрации и сегментарным некрозом и постишемический некроз в бассейне ПКА с участками микроваскулярной обструкции (МВО). О наличии миокардита свидетельствовал характер распределения контрастного вещества, накопление которого проходило не только по ишемическому типу от эндокарда к эпикарду, но и выявлялись очаги интрамиокардиальной и субэпикардиальной локализации. Расположение этих очагов также не соответствовало только бассейнам кровоснабжения ПКА и ПМЖВ ЛКА, тромбоз которых был обнаружен при ангиографии. МВО в участках воспалительной инфильтрации отсутствовала. Подтверждены выраженная систолическая дисфункция и дилатация ЛЖ. Конечно-диастолический объем ЛЖ по данным кардиоМРТ составил 212 мл, ФВ – 24,7%. Таким образом, у пациента были обнаружены признаки предшествующего развитию ОКС хронического миокардита (возможно, токсического), который привел к дилатации и частично дисфункции ЛЖ, отмеченных при первом ЭхоКГ-исследовании.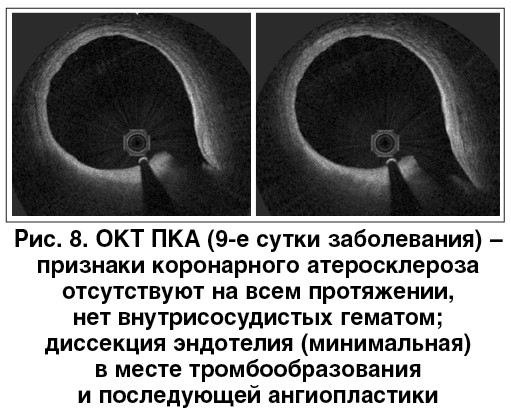
Однако в чем же причина коронарного тромбоза? Чтобы ответить на этот вопрос, пациенту на девятые сутки от момента поступления в стационар проведена повторная ангиография с использованием оптической когерентной томографии (ОКТ) (рис. 8).
По данным исследования, у пациента не было выявлено даже начальных признаков коронарного атеросклероза (в том числе эксцентрических атеросклеротических бляшек) на всем протяжении сосуда. Не отмечалось признаков, характерных для спонтанной диссекции коронарной артерии в виде отслойки эндотелия, образования ложного канала или внутрисосудистой гематомы. Отсутствовали также признаки (инфильтрация, гранулемы), характерные для воспалительного поражения, на доступных для обследования участках ПКА. При более тщательном анализе полученных результатов отмечены участки диссекции эндотелия в месте предшествующего тромбообразования, что, однако, могло быть следствием проведенного коронарного вмешательства (серия коронарных ангиопластик).
Параллельно с проведением инструментальных исследований сердца и коронарных сосудов был выполнен лабораторный поиск возможных причин коронарного тромбоза. Иммунологические маркеры аутоиммунных заболеваний (Ro/SS-A52, La/SS-B, CENP-B, Scl‑70, dsDNA, Jo‑1, MPO, PR3, AMA m2, LC1, LKM1, PM/Scl 100, SRP 54, SP 100, gp 210, Ku, Sm, U1-snRNP), которые могли бы стать причиной миокардита и коронарного васкулита, у пациента не выявлены. По данным генетического тестирования, ряд наиболее частых мутаций генов, ответственных за синтез белков, которые участвуют в процессах тромбооразования (фактор 2 протромбин 20210 G>A, фактор 5 Leiden 1691 G>A, фактор 5 R24070 A>G, фактор 55279 A>G, MTHFR677 C>T, MTHFR1298 A>C), не подтвержден. К сожалению, проведение других тестов, выявляющих наличие тромбофилии (дефицит антитромбина 3, протеинов С, S, наличие антифосфолипидных антител, гипергомоцистеинемия и др.) было технически невыполнимо.
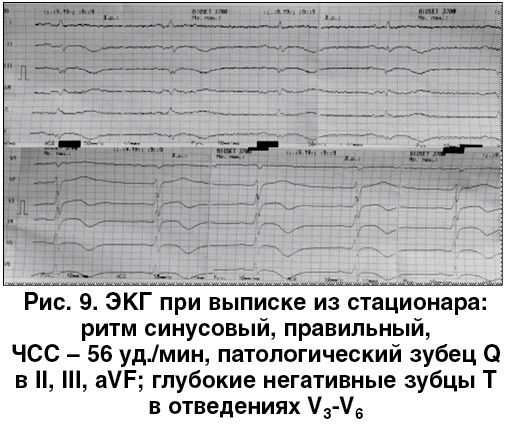 Пациент настоял на выписке из Института кардиологии на 13-й день от момента госпитализации и был направлен под наблюдение кардиолога по месту жительства. При выписке состояние пациента стабильное. Боли ангинозного характера не отмечает, одышка на уровне второго функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA), отеков нет. ЭКГ при выписке представлена на рисунке 9. По данным ЭхоКГ, конечно-диастолический объем – 224 мл, ФВ – 36%.
Пациент настоял на выписке из Института кардиологии на 13-й день от момента госпитализации и был направлен под наблюдение кардиолога по месту жительства. При выписке состояние пациента стабильное. Боли ангинозного характера не отмечает, одышка на уровне второго функционального класса (ФК) по классификации Нью-Йоркской ассоциации сердца (NYHA), отеков нет. ЭКГ при выписке представлена на рисунке 9. По данным ЭхоКГ, конечно-диастолический объем – 224 мл, ФВ – 36%.
Диагноз при выписке. ИБС: острый Q-ИМ задней стенки ЛЖ с вовлечением передне-боковых отделов. АВ-блокада II ст. по типу Мобитц-2. Хронический диффузный миокардит неуточненной этиологии. Желудочковая экстрасистолическая аритмия (Lown III‑IV). Персистирующая форма ФП. CHA2DS2-VASc – 2 балла. Сердечная недостаточность IIА со сниженной ФВ ЛЖ (ФВ‑36%), II ФК по NYHA.
При выписке пациенту продолжен прием 75 мг/сут клопидогреля в комбинации с 15 мг/сут ривароксабана, карведилола, рамиприла, эплеренона с постепенной титрацией дозировок до максимально переносимых. Несмотря на отсутствие атеросклеротического поражения коронарных артерий и выраженной дислипидемии, при выписке было продолжено использование аторвастатина по 20 мг/сут, полагаясь на плеотропные (антитромботический, нормализация функции эндотелия, противовоспалительный) эффекты статинов. Пациенту даны рекомендации по диете, настоятельный совет отказаться от курения и алкоголя, найти работу без контакта с лакокрасочными материалами.
Выводы
В данном клиническом случае у пациента с ОКС был использован ряд самых современных инструментальных и лабораторных методов диагностики, которые, однако, не помогли полностью ответить на все поставленные вопросы. Мы столкнулись со случаем развития острого коронарного тромбоза у пациента с хроническим диффузным миокардитом. Вероятно, предпосылками для возникновения заболевания были дисфункция эндотелия и протромботическое состояние на фоне курения, хронической интоксикации и воспалительного процесса в миокарде, а непосредственной причиной тромбоза стала острая алкогольная интоксикация. Нарушение микроциркуляции в связи с отеком миокарда на фоне воспалительного процесса также способствовало развитию тромбоза. Однако мы четко не знаем механизм тромбообразования у данного больного. Был ли он связан с вазоспазмом или нет? Почему образование тромба отмечалось именно в ПКА и ПМЖВ ЛКА и не развилось в огибающих ветвях ЛКА, а также других сосудистых бассейнах? Мы продолжаем наблюдать за этим больным и постараемся продолжить его обследование.
Литература
- Пархоменко О.М., Лутай Я.М., Іркін О.І., Білий Д.О., Степура А.О., Кушнір С.П., Скаржевський О.А., Шумаков О.В. Клініко-анамнестична характеристика та перебіг госпітального періоду захворювання у хворих молодого віку з гострим коронарним синдромом з елевацією сегмента ST // Український кардіологічний журнал. – 2018. – № 4. – С. 31‑39.
- Ibanez B., James S., Agewall S. et al. 2017 ESC guidelines for the management of acute myocardial infarction in patients presenting with ST-segment elevation: the Task Force for the management of acute myocardial infarction in patients presenting with ST-segment elevation of the European Society of Cardiology // European Heart Journal. – 2018. – 39. – Р. 119‑177.
- Stub D., Smith K., Bernard S. et al. Air versus oxygen in STsegment-elevation myocardial infarction // Circulation. – 2015. –131 (24). – Р. 2143‑2150.
- Cabello J.B., Burls A., Emparanza J.I. et al. Oxygen therapy for acute myocardial infarction // Cochrane Database Syst Rev. – 2013. – 8: CD007160.
- Hofmann R., James S.K., Svensson L. et al. Determination of the role of oxygen in suspected acute myocardial infarction trial // Am Heart J. – 2014. – 167 (3). – Р. 322‑328.
- Wallentin L., Becker R.C., Budaj A. et al. Ticagrelor versus clopidogrel in patients with acute coronary syndromes // N Engl J Med. – 2009. – 361. – Р. 1045‑1057.
Полный список литературы находится в редакции.
Спецвипуск «Клінічні випадки та сценарії у невідкладній кардіології», вересень 2019 р.