2 жовтня, 2019
Ефективність та доцільність використання інтерферонів під час лікування рекурентної респіраторної вірусної інфекції у дітей
 Коли мова йде про гостру респіраторну інфекцію (ГРІ) або гостру респіраторну вірусну інфекцію (ГРВІ), зазвичай мається на увазі ряд таких захворювань, як риніт, риносинусит, назофарингіт, фарингіт, трахеїт, ларингофарингіт, бронхіт. Викликають їх переважно віруси або вірусно-бактеріальні збудники. У дітей, які часто хворіють на ГРІ різної бактеріальної етіології, зустрічаються мікоплазми та хламідії, що потребує призначення антибіотиків. Однак, незважаючи на різноманіття різних збудників, вважається, що до 95% захворювань верхніх дихальних шляхів у дошкільному віці спричиняють віруси. Їх значення у формуванні даної патології є визначальним. Незважаючи на стрімкий розвиток сучасної медицини, методи лікування таких відносно простих і доволі зрозумілих захворювань залишаються до кінця не визначеними і навіть контраверсійними. Доволі часто виникає питання щодо використання антибіотиків під час лікування таких захворювань. На перший погляд все здається простим. Є хворий з вірусною інфекцією. Відомо, що антибіотики не впливають на віруси, тому у даному випадку призначати їх недоцільно і навіть шкідливо. Але лікарі доволі часто спостерігають у дітей з ГРВІ різноманітні бактеріальні ускладнення, затяжний перебіг захворювань, наростання інтоксикаційного синдрому, що супроводжується підвищенням рівня лейкоцитів, збільшенням показників С-реактивного протеїну та прокальцитоніну. Найбільш ілюстративним прикладом може слугувати бронхіоліт, який викликається вірусом RSV. За усіма міжнародними рекомендаціями, для лікування цього захворювання не радять використовувати антибактеріальну терапію [1, 2]. Але у 2015 році у мультидисциплінарному журналі SCIENTIFIC REPORTS з’явилася стаття, у якій відомий китайський дослідник Yuqing Wang та співавт. зазначають, що за даними, які вони отримали, у 23,9% дітей з бронхіолітом у віці 6-12 місяців був ідентифікований дуже небезпечний збудник Mycoplasma pneumoniae [3], при якому потрібна доволі інтенсивна антибіотикотерапія.
Коли мова йде про гостру респіраторну інфекцію (ГРІ) або гостру респіраторну вірусну інфекцію (ГРВІ), зазвичай мається на увазі ряд таких захворювань, як риніт, риносинусит, назофарингіт, фарингіт, трахеїт, ларингофарингіт, бронхіт. Викликають їх переважно віруси або вірусно-бактеріальні збудники. У дітей, які часто хворіють на ГРІ різної бактеріальної етіології, зустрічаються мікоплазми та хламідії, що потребує призначення антибіотиків. Однак, незважаючи на різноманіття різних збудників, вважається, що до 95% захворювань верхніх дихальних шляхів у дошкільному віці спричиняють віруси. Їх значення у формуванні даної патології є визначальним. Незважаючи на стрімкий розвиток сучасної медицини, методи лікування таких відносно простих і доволі зрозумілих захворювань залишаються до кінця не визначеними і навіть контраверсійними. Доволі часто виникає питання щодо використання антибіотиків під час лікування таких захворювань. На перший погляд все здається простим. Є хворий з вірусною інфекцією. Відомо, що антибіотики не впливають на віруси, тому у даному випадку призначати їх недоцільно і навіть шкідливо. Але лікарі доволі часто спостерігають у дітей з ГРВІ різноманітні бактеріальні ускладнення, затяжний перебіг захворювань, наростання інтоксикаційного синдрому, що супроводжується підвищенням рівня лейкоцитів, збільшенням показників С-реактивного протеїну та прокальцитоніну. Найбільш ілюстративним прикладом може слугувати бронхіоліт, який викликається вірусом RSV. За усіма міжнародними рекомендаціями, для лікування цього захворювання не радять використовувати антибактеріальну терапію [1, 2]. Але у 2015 році у мультидисциплінарному журналі SCIENTIFIC REPORTS з’явилася стаття, у якій відомий китайський дослідник Yuqing Wang та співавт. зазначають, що за даними, які вони отримали, у 23,9% дітей з бронхіолітом у віці 6-12 місяців був ідентифікований дуже небезпечний збудник Mycoplasma pneumoniae [3], при якому потрібна доволі інтенсивна антибіотикотерапія.
Ще більше питань виникає щодо використання при ГРВІ противірусних препаратів. Ряд авторів зазначають ефективність використання інтерферонів при цих захворюваннях, інші піддають сумніву доцільність їх застосування, посилаючися на відсутність метааналізу відповідних РКД.
Що ж сьогодні відомо про респіраторні вірусні інфекції? ГРВІ – це захворювання, які найчастіше зустрічаються у дітей. Так, діти у віці до 5 років хворіють на ГРВІ приблизно 6-8 разів за рік [4, 5]. Особливо висока захворюваність реєструється в дитячих дошкільних установах та початковій школі протягом перших двох років відвідування, що пояснюється збільшенням контактів з іншими дітьми і посиленим «знайомством» з чужими вірусами. В епідемічні періоди захворюваності, переважно в осінньо-зимово-весняний період, ГРВІ спостерігається майже у 30% населення, серед яких діти становлять близько 20%. Найчастіше хворіють діти 3-14 років. В Україні щороку на грип та ГРВІ хворіють 10-15 млн осіб, більше половини з яких становлять діти [6, 7]. Але статистика не на 100% достовірна, тому що батьки доволі часто не звертаються до лікаря, лікуючи дітей вдома самостійно.
Багато питань виникає у педіатрів/сімейних лікарів під час лікування дітей, що часто хворіють на ГРВІ або, як зараз прийнято називати, з рекурентними респіраторними інфекціями. Зазвичай перебіг вірусних захворювань у них більш тяжкий, затяжний, з ускладненнями. Ймовірно, імунна система таких дітей не встигає відновлювати свої функціональні можливості, через що вони хворіють більш тяжко, досить часто розвиваються аутоімунні реакції. Крім того, навіть легка респіраторна інфекція може стати причиною загострення хронічного процесу, якщо він наявний у дитини [8, 9].
ГРВІ – це поліетіологічне захворювання, що викликається численними вірусами різних родів і сімейств. На сьогодні відома значна кількість збудників (понад 250 типів), які належать до 9 різних нозологічних груп вірусної природи, що тісно пов’язані з захворюваннями респіраторного тракту людини, спричиняючи розвиток ГРВІ. Серед усього різноманіття вірусів переважають риновіруси (30-50%) і віруси грипу (5-15%), які зумовлюють спалахи захворювань в осінньо-зимовий період. Значно рідше спостерігаються захворювання, викликані аденовірусами, вірусами парагрипу, респіраторно-синцитіальними вірусами. В останні роки, з появою нових діагностичних технологій – полімеразної ланцюгової реакції (ПЛР), спеціалісти стали виявляти раніше невідомі вірусні інфекції: бокавірусну – HBoV, метапневмовірусну – HMPV, SARS, коронавірусну – HcoV-HKU1, NL63, грип А-H1N1swL.
На поширеність певних вірусів доволі істотно впливає вік дитини. Ці віруси здатні викликати цілий спектр захворювань, переважно верхніх відділів дихальних шляхів, які мають доволі подібні клінічні симптоми. Віруси, які потрапляють до організму дитини, можуть набувати схильності до персистенції та призводити до значної імуносупресії, погіршувати перебіг інших захворювань, сприяти виникненню аутоімунних ушкоджень. Експерти Всесвітньої організації охорони здоров’я підкреслюють, що в останні роки спостерігається тенденція до зростання рівня захворюваності, спричиненої цими інфекціями [10, 11]. Для дітей ГРВІ – це не тільки пряма шкода здоров’ю, але й пропущені заняття у школі, погіршення засвоєння шкільного матеріалу [12], розвиток астенічного синдрому.
Щорічно з’являється багато публікацій на тему профілактики, діагностики та лікування грипу. В той же час, враховуючи поширеність ГРВІ у дітей, сумарний ризик від цих захворювань може переважати такий від захворювань на грип.
На сьогоднішній день існує багато методів діагностики і верифікації ГРВІ різної достовірності, складності та вартості. Серед них такі:
- імуноферментний аналіз (ІФА);
- імуноблотинг;
- реакція непрямої гемабсорбції;
- реакція ланцюгової полімеризації (РЛП);
- вірусологічне біологічне дослідження (курячі ембріони, лабораторні тварини, клітинні культури, реакція нейтралізації);
- за наростанням титру специфічних антитіл у парних сироватках в динаміці (сироватка береться з проміжком у 10-14 днів) – РНГА, РГГА, РЗК тощо;
- флюороімунологічний метод з моноклональними антитілами;
- метод молекулярної гібридизації нуклеїнових кислот.
На практиці більшість лікарів орієнтується на доволі специфічний комплекс клініко-інструментальних і лабораторних даних, які є характерними практично для всіх ГРВІ [13, 14]. Початок ГРВІ, на відміну від грипу, частіше поступовий, симптоматика зростає повільно. У дитини виникають симптоми загальної інтоксикації, катаральні явища, біль у горлі, нежить, сухий кашель. Характерна поява симптомів катарального запалення: гіперемії слизових оболонок зіва, характерної зернистості задньої стінки глотки внаслідок збільшення лімфатичних фолікулів, виділення серозного або серозно-слизового мокротиння. При деяких типах вірусів можливий розвиток кон’юнктивіту, епісклериту з серозними виділеннями. За аналізами крові зазвичай спостерігається лейкопенія або нормоцитоз з паличкоядерним зсувом, лімфомоноцитоз, нормальний або помірно збільшений рівень ШОЕ. Якщо збудником ГРВІ є аденовірус, може спостерігатися лейкоцитоз. При рентгенографії легень помітне посилення судинного легеневого малюнка. Клінічна симптоматика пов’язана з локалізацією інфекції та її активним поширенням у клітинах слизової оболонки верхніх дихальних шляхів, де віруси продовжують розмножуватися та атакують інші клітини організму протягом 2-3 днів, перш ніж імунна система починає активно включати специфічні механізми захисту.
Згідно з діючим Уніфікованим клінічним протоколом первинної медичної допомоги дорослим та дітям «Гострі респіраторні інфекції» № 499 (затвердженим наказом Міністерства охорони здоров’я України від 11.02.2016 № 85), можна виокремити такі етапи патогенезу ГРВІ:
- ураження чутливого епітелію. Для частини ГРВІ існує певна «вибірковість» ураження верхніх дихальних шляхів (ВДШ), пов’язана з рецепторно-лігандними взаємовідносинами, що дозволяє клінічно припустити етіологію ГРВІ;
- розмноження вірусів в епітелії ВДШ та його ушкодження;
- генералізація процесу, вірусемія, ураження судинної стінки з розвитком вторинних процесів;
- формування системної клітинної імунної відповіді, стимуляція розвитку серологічного захисту;
- усунення інфекційного процесу, розвиток серологічного захисту, репаративні процеси відновлення.
Важливим наслідком вивчення патогенезу ГРВІ є розуміння, що одужання відбувається за рахунок активізації клітинного захисту, антитіла з’являються пізно, вже в період ранньої реконвалесценції, мають значення переважно для профілактики повторного інфікування.
Симптоми ГРВІ є результатом не стільки впливу самих вірусів, скільки реакції системи вродженого імунітету. Уражені клітини епітелію виділяють цитокіни, в тому числі інтерлейкін-8 (ІЛ-8), кількість якого корелює як зі ступенем залучення фагоцитів в підслизовий шар і епітелій, так і з виразністю симптомів. Збільшення назальної секреції пов’язане з підвищенням проникності судин, кількість лейкоцитів у секреті може підвищуватися багаторазово, змінюючи його колір з прозорого на біло-жовтий або зеленуватий [15]. Твердження, що під час будь-якої вірусної інфекції активується бактеріальна флора (так звана «вірусно-бактеріальна етіологія ГРІ» на підставі, наприклад, наявності у хворого лейкоцитозу), не підтверджується практикою. Бактеріальні ускладнення ГРВІ виникають відносно рідко, якщо імунітет дитини відповідає нормі.
Більшість дітей, хворих на ГРВІ, не потребують госпіталізації та лікуються у домашніх умовах.
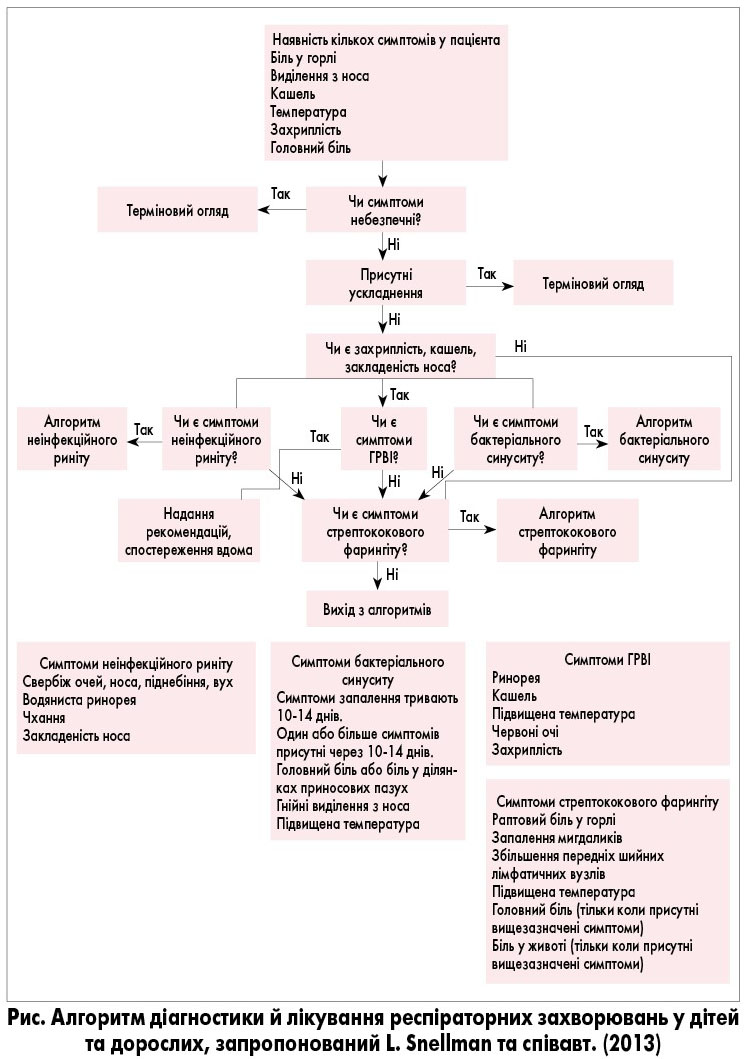
В останні роки у своїй практиці ми з успіхом користуємося алгоритмом діагностики й лікування респіраторних захворювань у дітей та дорослих (рис.), який був запропонований у 2013 р. L. Snellman та співавт. в Institute for Clinical Systems Improvement (ICSI) [16].
Лікування ГРВІ має бути комплексним, з урахуванням етіології, тяжкості клінічних проявів, провідних симптомів та наявності ускладнень.
До останнього часу серед лікарів доволі популярною була група імуномоделюючих та імуностимулюючих препаратів, які широко застосовувалися в педіатрії. Проте сучасні імунологи не радять робити це з метою профілактики та лікування ГРВІ і грипу через можливість виникнення феномену імунорефрактерності. Крім того, самі віруси є достатніми стимуляторами відповідних імунних клітин, органів і систем та змушують їх працювати з максимальною напругою й ефективністю.
Сьогодні імунологи, вірусологи, практичні лікарі з великою обережністю ставляться до індукторів інтерферону (ІНФ). В експерименті на тваринах було показано, що індуктори ІНФ можуть викликати гіпореактивність, тобто різке зниження рівня індукції при введенні наступних доз індуктору з інтервалом у 12-24 год. Сучасні уявлення про механізм індукції, синтезу та дії ІНФ дозволяють припустити, що гіпореактивність є захисним механізмом від гіперпродукції ІНФ та реалізується за принципом негативного зворотного зв’язку. Синтезований внаслідок індукції ІНФ призводить до пригнічення синтезу білків у цих клітинах, через що синтез нових порцій ІНФ у відповідь на наступні індукційні сигнали стає раз від разу слабшим. За межами країн колишнього СРСР індуктори ІНФ (зокрема, в країнах Західної Європи та Північної Америки) не зареєстровані в якості лікарських засобів, а їх клінічна ефективність не опублікована в авторитетних наукових журналах [17].
Доведено, що вікові особливості дитячого імунітету сприяють високій чутливості дітей до респіраторних вірусів і респіраторних інфекцій. Значною мірою цьому сприяє знижена продукція ІНФ та інших інтерлейкінів; переважання у дітей перших років життя синтезу «раннього» ІНФ, що відрізняється за фізико-хімічними, біологічними властивостями і характеризується низьким рівнем противірусної активності, відносна незрілість макрофагально-фагоцитарної ланки, схильність до незавершеного фагоцитозу, низька цитотоксичність CD8+ клітин і природних кілерів (CD16+ клітин), відтермінований синтез антитіл і знижена концентрація окремих класів імуноглобулінів (особливо IgA) [18, 19, 20]. Поряд з цим, під час вивчення причин несприятливого перебігу та ускладнень деяких вірусних інфекцій було встановлено важливу роль пригнічення системи ІНФ і функціональної активності зазначених факторів вродженого і адаптивного імунітету, що розвиваються або посилюються під час вірусної інфекції. Очевидно, що певний вплив на ці процеси має не тільки вік, а й стан преморбідного фону, екологічні умови проживання тощо. Крім цього, рекурентні ГРІ та можливість тривалої персистенції респіраторних збудників на тлі вікових особливостей імунітету відіграють важливу роль у формуванні хронічних бронхо-легеневих захворювань, негативно впливають на подальший розвиток дитини, що може зумовлювати додаткові економічні витрати на лікування можливих віддалених несприятливих наслідків [21, 22].
Етіотропна терапія рекомендована при грипі А (в тому числі H1N1) і В у перші 24-48 год хвороби. Найбільш ефективними є інгібітори нейрамінідази. Щодо застосування ІНФ у дітей при лікуванні ГРВІ, то їх призначення вважається можливим протягом перших днів хвороби (ІНФ-α), проте надійних доказів ефективності такого лікування недостатньо. Під час їх застосування у дітей старше 7 років гарячковий період ГРВІ скорочується менш ніж на 1 добу, тобто їх застосування при більшості ГРВІ з коротким фебрильним періодом невиправдане [23]. Для лікування ГРВІ у дітей не рекомендовані гомеопатичні засоби, тому що їх ефективність не доведена. У той же час застосування ІНФ у дітей до 7 років та при рекурентних вірусних інфекціях з очікувано низьким інтерфероногенезом може бути доцільним і потребує подальшого вивчення.
Основою лікування ГРВІ у таких дітей можна вважати ІНФ. У 1957 р. вчені A. Isaacs та J. Lindenmann виділили невідомий раніше білок, відповідальний за феномен інтерференції (взаємне пригнічення) вірусів: після зараження клітин вірусами одного типу клітини ставали несприйнятливими до зараження іншими вірусами. Інтерференція вірусів була пов’язана з продукцією клітинами невідомого білка, який назвали ІНФ [24].
Що ж таке ІНФ? Це група цитокінів, які утворюються і виділяються клітинами у відповідь на їх вірусне ураження, дію ендотоксинів бактерій, деяких паразитів, найпростіших та онкобілків. Завдяки ІНФ клітини стають несприйнятливими до цих агентів. Механізм дії ІНФ полягає у розвитку цілого ряду реакцій, що призводять до руйнування РНК та деяких інших молекул. ІНФ людини поділяють на групи залежно від типу клітин, в яких вони утворюються: α, β, γ тощо. ІНФ включають кілька видів білків з молекулярною масою близько 20 000 Да.
Аналіз зібраних даних про структуру і будову ІНФ, їх рецептори, через які відбувається сигнальна дія ІНФ, дозволив класифікувати білки за 3 типами [25]. Тип I включає в себе ІНФ-α, який продукують лейкоцити, Т- і В-лімфоцити, макрофаги і нейтрофільні гранулоцити; ІНФ-β, що продукується фібробластами; ІНФ-ω. Спочатку припускали, що ІНФ-α представлений одним білком, але виявилося, що це ціла група білків, які кодуються 14 генами і мають відмінності в 1-2 амінокислотах у первинній структурі. На даний момент виділяють 18 субтипів ІНФ-α. При цьому субтип ІНФ-α2 має 3 алельних форми: 2a, 2b, 2c. ІНФ-α2a і ІНФ-α2b набули широкого поширення в клінічній практиці. Тип II представлений ІНФ-γ, який виробляється природними клітинами-кілерами і Т-клітинами. ІНФ-λ, або інтерлейкіни-29, 28А і 28В, формують групу інтерфероноподібних білків, або тип III.
Найбільш вивченою властивістю ІНФ є його здатність перешкоджати розмноженню вірусів. Клітини, які зазнали дії ІНФ в невеликих концентраціях, пізніше, після відповідної стимуляції, виділяють його більше, ніж клітини, які не зазнали його дії [26].
Досліджено, що при зараженні клітини вірус починає реплікувати свій геном усередині клітини та розмножуватися, вбиваючи її. Клітина-господар при зараженні вірусом починає продукцію ІНФ, який виходить з клітини і вступає в контакт з сусідніми клітинами, роблячи їх несприйнятливими до вірусу. ІНФ діє, запускаючи ланцюг подій, що призводить до припинення синтезу вірусних білків і в деяких випадках – збірки і виходу вірусних частинок. Таким чином, ІНФ не має прямої противірусної дії, але викликає в клітині такі зміни, які перешкоджають розмноженню вірусу [7].
ІНФ має високу біологічну активність. Достатньо від 1 до 50 молекул ІНФ, щоб зробити клітину резистентною до вірусної інфекції на кілька днів. Крім того, ІНФ викликає й інші біологічні ефекти: пригнічує розмноження клітин, діє на імунну систему і викликає зміну клітинних мембран [25].
Таким чином, ІНФ індукує в клітині різноманітні антивірусні механізми: уповільнює швидкість ураження клітини вірусами та реплікацію вірусів на рівні транскрипції і трансляції, ускладнює формування віріонів, пригнічує трансляцію вірусної мРНК, пригнічує ініціацію синтезу білкового ланцюжка та його видовження. Завдяки такому різноманіттю противірусних механізмів віруси практично не володіють ефективними формами захисту від ІНФ.
На даний момент у практичній медицині представлені два покоління лікарських препаратів на основі ІНФ-α. Препарати I покоління мають природне походження, виробляються у вигляді суміші субтипів ІНФ-α. У цьому випадку джерелом цитокінів є лінії трансформованих лімфоїдних клітин, які продукують білок у великих кількостях. Основний компонент одержуваної субстанції – ІНФ-α2. Лейкоцитарний ІНФ виробляють з маси лейкоцитів донорської крові після інфікування вірусом Сендай. Основні компоненти лейкоцитарного ІНФ – ІНФ-α1, ІНФ-α2, ІНФ-α4 і ІНФ-ω, які становлять 95% суміші. Зрозуміло, що можливості масштабного виробництва цих препаратів обмежені.
Більша група лікарських препаратів – це препарати II покоління, розроблені на основі рекомбінантного ІНФ-α. Він відрізняється від нативного ІНФ відсутністю глікозильних груп у молекулі. Крім того, можливі різні заміни у первинній послідовності ІНФ-α, які не змінюють його біологічну активність, але в той же час збільшують стабільність білка або полегшують технологію його одержання. Суттєвий прогрес у виробництві ІНФ відбувся з початком використання методів генної інженерії. З активованих людських клітин був виділений мРНК для ІНФ, синтезовано комплементарну нитку ДНК для наступного її вбудовування до геному бактерій кишкової палички. Вироблення цього рекомбінантного ІНФ за допомогою E. coli дешевше у 10 разів, а продукт чистіший від ІНФ, отриманого традиційними методами, приблизно у 100 разів. На основі ІНФ-α2b створені такі лікарські препарати, як Інтрон-А, Пегінтрон, Реальдирон, Лаферобіон® («Біофарма») та ін. [25]. Використання рекомбінантного ІНФ замість природного дозволило вирішити кілька завдань: подолати дефіцит природної сировини (крові) для виробництва, зменшити вартість кінцевого продукту, забезпечити повну безпеку препарату з точки зору контамінації вірусами гепатитів, цитомегаловірусом, вірусом імунодефіциту людини тощо [27].
На сьогоднішній день у клінічній практиці для лікування ГРВІ використовують рекомбінантний ІНФ-α2b у вигляді назального спрею, ін’єкцій та супозиторіїв. Перорально препарати ІНФ не використовують через руйнівну дію ферментів травної системи. Хоча існують певні технологічні прийоми, що дозволяють підвищити стійкість білків до протеолітичної дії ферментів шлунково-кишкового тракту, наприклад, іммобілізація білкових молекул на інертному носії (поліетиленгліколі), за допомогою електронно-променевої технології. Проте іонізуюче випромінювання може змінювати структуру білкових молекул аж до їх руйнування, що зменшує біологічні ефекти білків. Відразу слід зазначити, що парентеральне введення високих доз препаратів ІНФ доцільно застосовувати тільки при тяжких вірусних захворюваннях, в умовах інтенсивної терапії, через частий розвиток побічних ефектів – підвищення температури тіла, головний біль, біль у кістках та м’язах, тахікардію тощо. У той же час лікарські засоби на основі ІНФ довели свою ефективність у лікуванні широкого кола захворювань: герпетичних інфекцій, вірусу папіломи людини, гострих і хронічних форм вірусного гепатиту, розсіяного склерозу, червоного вовчака, онкологічних захворювань, грипу, а також СНІДу.
Метою нашого спостереження було визначення ефективності застосування вітчизняного рекомбінантного ІНФ-α2b під торговою назвою Лаферобіон® (супозиторії ректальні, які містять 500 000 МО противірусного ІНФ-α2b у сполученні з токоферолом ацетатом та аскорбіновою кислотою) у дітей від 1 до 7 років з рекурентними ГРВІ, для яких характерним є затяжний перебіг захворювання та частий розвиток бактеріальних ускладнень. Перевагою використання супозиторіїв при ГРВІ у дітей є краща біодоступність препарату, істотно менша ймовірність трансформації у печінці. Це зменшує ризик небажаної взаємодії з жарознижуючими, антигістамінними препаратами, які часто використовуються для лікування симптомів ГРВІ. Наявність у комплексі препарату Лаферобіон® мембраностабілізуючих компонентів і цитопротекторів – токоферолу ацетату та вітаміну С – обумовлює підвищення противірусної активності ІНФ в 10-14 разів шляхом посилення його впливу на Т- і В-лімфоцити. Крім того, включення до складу препарату Лаферобіон® антиоксидантів перешкоджає окислювальному руйнуванню молекул ІНФ і сприяє кращій біологічній активності [28]. В опублікованих роботах Г.В. Бекетової (2011) та А.Н. Васильева (2010) вказується на наявність противірусної активності самих антиоксидантів. Проведені дослідження наочно демонструють, що комбінація ІНФ з тим чи іншим антиоксидантом має більш високу противірусну активність у порівнянні з монопрепаратом ІНФ (як відносно пандемічного штаму вірусу грипу, так і відносно вірусу простого герпесу 1 типу). Це дозволяє знизити курсові дози препарату Лаферобіон®, а також тривалість курсів антибіотикотерапії на тлі його гарної переносимості [29, 30].
Критеріями включення у наше спостереження була наявність 5 або більше епізодів ГРВІ протягом останнього року, вік дитини від 1 до 7 років, наявність клінічних симптомів ГРВІ, не більше 2 діб від початку захворювання на момент огляду, наявність інформованої згоди батьків. Критерії виключення: непереносимість одного з компонентів препарату, клініко-рентгенологічні ознаки пневмонії, прийом інших імуномодуляторів та/або противірусних препаратів. Спостереження проводилося на базі консультативної поліклініки та II педіатричного відділення КНП «Міська дитяча клінічна лікарня м. Львова».
Основну групу склали 30 дітей, яким Лаферобіон® призначався ректально у формі супозиторіїв протягом 5 днів у дозі 500 000 МО 2 р/добу. Крім того, діти отримували симптоматичне лікування згідно з уніфікованим клінічним протоколом МОЗ України № 499 у відповідності до важкості стану і клінічних проявів захворювання. Спостереження проводилися на 1-й, 3-й, 5-й, 7-й та 10-й день захворювання. В якості контролю нами ретроспективно була проаналізована медична документація 20 дітей аналогічного віку, які зверталися за консультацією або лікуванням у КНП «Міська дитяча клінічна лікарня м. Львова» з подібним діагнозом.
Аналіз показав, що використання препаратів ІНФ у формі супозиторіїв при неускладнених рекурентних ГРВІ сприяло скороченню тривалості підвищеної температури (3,9±0,59 днів проти 4,8±0,21 у дітей, які не отримували ІНФ), інтоксикації (4,1±0,44 днів проти 5,6±0,71 у дітей контрольної групи), катарального синдрому (5,7±0,82 днів проти 6,5±0,32 у дітей контрольної групи), а також скорочення термінів прийому препаратів для симптоматичного лікування, в тому числі жарознижуючих, в середньому на 1,4 дня. У дітей основної групи швидше нормалізувався апетит (на 4,2±0,42 день проти 5,8±0,51), сон (4,7±0,63 дня проти 5,9±0,54) та загальний стан (4,6±0,82 дня проти 5,7±0,65 у контрольній групі). Надзвичайно важливим результатом застосування препарату Лаферобіон® стала відсутність бактеріальних ускладнень у дітей основної групи і, відповідно, потреби у застосуванні антибіотиків. Тоді як у контрольній групі 20% дітей з рекурентними ГРВІ були додатково призначені антибіотики через розвиток бактеріальних ускладнень, переважно риносинуситів та отитів, затяжних бронхітів, в одному випадку – пневмонії.
При використанні препарату Лаферобіон® в дозі 500 000 МО 2 р/добу у дітей віком 1-7 років з рекурентними ГРВІ не спостерігався розвиток побічних ефектів, алергічних реакцій та інших ускладнень.
Дані про позитивний ефект від використання препарату Лаферобіон® можна знайти у роботах проф. Г.В. Бекетової [31], проф. А.П. Юрцевої та співавт. [32], проф. Ю.В. Марушка та співавт. [33, 34], проф. Є.І. Юліша [12, 28], проф. С.О. Крамарьова [35] та ін.
Висновки
Застосування у дітей дошкільного та раннього шкільного віку з рекурентними ГРВІ препарату Лаферобіон® у формі супозиторіїв у дозі 500 000 МО 2 р/добу протягом 5 днів підтверджує клінічну ефективність і безпечність препарату, що проявляється у скороченні тривалості температурної реакції, катарального та інтоксикаційного синдрому, загальної тривалості захворювання та попереджає розвиток бактеріальних ускладнень у дітей.
Література
- Гончар М.О., Муратов Г.Р., Логвінова О.Л., Башкірова Н.В. Світові стандарти діагностики та лікування гострих бронхіолітів у дітей. Современная педиатрия 2 (90) / 2018. – С: 81-87.
- Nelson’s Pediatric Antimicrobial Therapy 2019. Published by the American Academy of Pediatrics, 2019, 331 р.
- Yuqing Wang, Chuangli Hao, Wei Ji, Yongdong Yan, Xuejun Shao2 & Jun Xu. Bronchiolitis Associated With Mycoplasma Pneumoniae in Infants in Suzhou China Between 2010 and 2012 SCIENTIFIC REPORTS | 5: 7846 | DOI: 10.1038 / srep 07846.
- Hay A.D., Heron J., Ness A. ALSPAC study team. The prevalence of symptoms and consultations in pre-school children in the Avon Longitudinal Study of Parents and Children (ALSPAC): a prospective cohort study. Family Practice. – 2005; 22: 367-374. DOI: 10.1093 / fampra / cmi 035.
- Fendrick A.M., Monto A.S., Nightengale B., Sarnes M. The economic burden of non-influenza-related viral respiratory tract infection in the United States. Arch Intern Med. – 2003 Feb 24; 163 (4): 487-94.
- Дуда А.К., Дубровский Е.И. Грипп и другие ОРВИ: клиника, осложнения и оптимизация лечения // СЕМЕЙНАЯ МЕДИЦИНА № 6 (56), 2014, С. 127-134.
- Няньковський С.Л., Няньковська О.С., Яцула М.С. Клінічні особливості використання інтерферонів при лікуванні ГРВІ у дітей // Здоровье ребенка. – 2015. – № 5 (65). – С. 77-82.
- Краснов В.В. Эффективность рекомбинантного интерферона α в лечении и профилактике ОРВИ // Вопросы практической педиатрии, 2016; 11 (4): 44-52. DOI: 10.20953 / 1817-7646-2016-4-44-52.
- Романцов М.Г., Мельникова И.Ю., Ершов Ф.И. Респираторные заболевания у часто болеющих детей. – М., 2015, 159 с.
- World Health Organization. A programme for controlling acute respiratory infections in children. Memorandum from a WHO meeting. Bull World Health Organ. – 1984; 62: 47-58.
- Косенко И.М. Профилактика и лечение острых респираторных вирусных инфекций // Медицинский Совет. – 2014. – № 15. – С. 72-77.
- Юлиш Е.И. Подходы к терапии острых респираторных заболеваний у часто и длительно болеющих детей / Юлиш Е.И., Кривущев Б.И., Ярошенко С.Я. // Здоровье ребенка. – 2011. – № 2 (29). – С. 85-89.
- Возіанова Ж.І. Гостре респіраторне захворювання – проблема з багатьма невідомими // http://m-l.com.ua/issues.php?aid=108.
- Волох Н.Г., Черепок А.А., Баранова Н.В. Что надо знать о гриппе и орви 2017. – Видавництво ЗДМУ, Запоріжжя, 26 с.
- Van den Broek M.F., Gudden C., Kluijfhout W.P., Stam-Slob M.C., Aarts M.C., Kaper N.M., van der Heijden G.J. No evidence for distinguishing bacterial from viral acute rhinosinusitis using symptom duration and purulent rhinorrhea: a systematic review of the evidence base. Otolaryngol Head Neck Surg. – 2014 Apr; 150 (4): 533-7. Doi: 10.1177/0194599814522595. Epub, 2014 Feb 10.
- Adams W., Anderson G., Godfrey A., Gravley A., Johnson K., Marshall P., Myers C., Nesse R., Short S. Diagnosis and treatment of respiratory illness in children and adults. Bloomington (MN): Institute for Clinical Systems Improvement (ICSI). – 2013. – 86 p.
- Stringfellow D.A. Production of the interferonprotein: hyporesponsiveness // Tex. Rep.Biol. Med. – 1997. – Vol. 35. – P. 126-131.
- Малиновская В.В., Тимина В.П., Мазанкова Л.Н., Чеботарева Т.А. Иммунопатогенез острых респираторных инфекций, тактика рационального выбора этиотропной и иммуномодулирующей терапии у детей // Детские инфекции. – 2014. – № 4. – С. 14-19.
- Обоснование, опыт лечения и профилактика острых респираторных вирусных инфекций препаратами рекомбинантного интерферона: методические рекомендации / Учайкин В.Ф. и др. – М., 2012. – 48 с.
- Щеплягина Л.А. Возрастные особенности иммунитета детей: лекция для врачей. – М., 2008. – 36 с.
- Захарова И.Н., Чебуркин А.В., Малиновская В.В. Значение системы интерферонов в формировании иммунного ответа у детей с острыми респираторными вирусными инфекциями // Вопросы практической педиатрии. – 2009. – Т. 4, № 6. – С. 38-45.
- Современные аспекты герпесвирусной инфекции. Эпидемиология, клиника, диагностика, лечение и профилактика: методические рекомендации / Каражас Н.В. и др. – М.: Спецкнига, 2012. – 128 с.
- Острая респираторная вирусная инфекция (ОРВИ) у детей. Клинические рекомендации. – Союз педиатров России. – 2016 . – 33 с.
- Isaacs A., Lindemann J. Virus interference. The interferon. In: Proc. Roy. Soc., series B, 1957. – Vol. 147. – P. 258-267.
- Meager A. The Interferons. Characterization and Application / Meager A. Wiley – VCH, 2006. – Ed.1. – pp. 22-27, 73-80.
- Якобисяк М. Імунологія / Переклад з польської за редакцією Чопяк В.В. – Вінниця: НОВА КНИГА, 2004. – 672 с.
- Денисов Л.А., Шолохов И.В. Открытие интерферона и его клиническое применение // ИНФЕКЦИОННЫЕ БОЛЕЗНИ: новости, мнения, обучение. – 2017. – № 1. – С. 23-31.
- Юлиш Е.И. Этиопатогенетическая терапия острых респираторных вирусных инфекций у детей. / Юлиш Е.И., Чернышова О.Л. // Здоровье ребенка. – 2014. – № 1 (52). – С. 71-75.
- Бекетова Г.В. Интерфероны в лечении острых респираторных инфекций у детей // Ліки України. – 2011. – № 3. – С. 106-109.
- Васильев А.Н. Оценка влияния антиоксидантов на специфическую противовирусную активность интерферона-α2b человеческого рекомбинантного в отношении вируса простого герпеса в культуре клеток // Антибиотики и химиотерапия. – 2010. – № 7. – С. 20-25.
- Бекетова Г.В. Интерфероны в лечении острых респираторных инфекций у детей // Ліки України. – 2011. – № 3 (149). – С. 106-109.
- Юрцева А.П. Ефективність застосування лаферобіону в дітей із рецидивуючим бронхообструктивним синдромом, які часто хворіють на гострі респіраторні захворювання / Юрцева А.П., Фофанова О.В., Осадець Н.Б., Боднар О.П. // Здоровье ребенка. – 2014. – № 5 (56). – С. 81-86.
- Марушко Ю.В. Місцева терапія гострих фарингітів / Марушко Ю.В., Мельніков О.Ф., Зелена Н.А., Мовчан О.С. // Современная педиатрия. – 2011. – № 4. – С. 107-110.
- Марушко Ю.В., Голубовська Ю.Є., Марушко Є.Ю. Застосування рекомбінантного інтерферону-α2b у педіатричній практиці // Здоровье ребенка. – 2016. – № 2 (70). – С. 81-86.
- Крамарьов С.О., Євтушенко В.В. Оцінка ефективності рекомбінантного інтерферону-α для профілактики та лікування гострих респіраторних вірусних інфекцій у дітей // Здоров’я України. – 2008. – № 18/1. – С. 49-50.
Тематичний номер «Педіатрія» №3 (50), 2019 р.