16 листопада, 2016
Диференційна діагностика кардіомегалії у дітей
Наведений клінічний випадок ілюструє реальну ситуацію, що може трапитися в практиці неонатолога, педіатра, сімейного лікаря, дитячого кардіолога. Кардіомегалія, або значне збільшення розмірів серця внаслідок гіпертрофії його стінок, дилатації шлуночків чи передсердь, може виявлятись у дитини будь-якого віку, починаючи з раннього неонатального періоду, а іноді діагностується ще пренатально. Наявність КМ у дитини викликає обґрунтовану занепокоєність лікарів, потребує термінового дообстеження, уточнення діагнозу та лікування, іноді не тільки медикаментозного, а й кардіохірургічного.
 Нерідко гіпертрофія міокарда є компенсаторною реакцією, що дозволяє підтримувати нормальний кровообіг за наявності серцевої недостатності (СН) або перешкоди (обструкції) у вихідних відділах шлуночків. Функціональна або компенсаторна гіпертрофія зазвичай не призводить до значного збільшення розмірів серця й супроводжується лише помірним розширенням його меж. Значна КМ частіше виникає у разі розвитку міогенної дилатації серця, характеризується симптомами СН, порушеннями ритму серця. Залежно від причин, що викликають КМ, може спостерігатися збільшення окремої серцевої камери (наприклад, за наявності вродженої вади серця зі значним шунтуванням через дефект або з обструкцією викиду крові з лівого (ЛШ) чи правого шлуночка (ПШ); розвиток тотальної КМ визначається тривалістю та прогресуванням патологічного процесу. КМ може розвинутися також у результаті накопичення продуктів порушеного обміну речовин у міокарді, за наявності інфільтративних або неопластичних процесів тощо. Дифузні ураження міокарда (кардит, хвороби накопичення) можуть одразу призводити до тотальної КМ.
Нерідко гіпертрофія міокарда є компенсаторною реакцією, що дозволяє підтримувати нормальний кровообіг за наявності серцевої недостатності (СН) або перешкоди (обструкції) у вихідних відділах шлуночків. Функціональна або компенсаторна гіпертрофія зазвичай не призводить до значного збільшення розмірів серця й супроводжується лише помірним розширенням його меж. Значна КМ частіше виникає у разі розвитку міогенної дилатації серця, характеризується симптомами СН, порушеннями ритму серця. Залежно від причин, що викликають КМ, може спостерігатися збільшення окремої серцевої камери (наприклад, за наявності вродженої вади серця зі значним шунтуванням через дефект або з обструкцією викиду крові з лівого (ЛШ) чи правого шлуночка (ПШ); розвиток тотальної КМ визначається тривалістю та прогресуванням патологічного процесу. КМ може розвинутися також у результаті накопичення продуктів порушеного обміну речовин у міокарді, за наявності інфільтративних або неопластичних процесів тощо. Дифузні ураження міокарда (кардит, хвороби накопичення) можуть одразу призводити до тотальної КМ.
Загальними ознаками КМ є такі:
- фізикальні дані: розширення меж відносної серцевої тупості, приглушеність або глухість тонів серця (частіше 1 тону на верхівці), поява 3 та 4 тонів (протодіастолічного або пресистолічного ритму галопу), систолічних шумів регургітації на атріовентрикулярних клапанах (мітральному чи тристулковому); за умови вираженої КМ можуть з’являтися діастолічні шуми: Флінта (функціонального мітрального стенозу), Грехема-Стіла (діастолічний шум відносної недостатності клапанів легеневої артерії);
- порушення серцевого ритму і провідності.
Специфічні ознаки КМ визначаються тим захворюванням, що призвело до її розвитку:
- кардіоміопатії первинні (дилатаційна, гіпертрофічна, рестриктивна);
- вади серця (природжені або набуті);
- міокардити (ревмокардит, неревматичний міокардит, міокардит ідіопатичний Абрамова-Фідлера);
- постміокардитичний кардіосклероз;
- гіпертензії артеріальні (первинні або вторинні) та ін.
Природжені вади серця слід насамперед виключати у дитини з КМ, яка виявлена в періоді новонародженості або в ранньому віці.
Поява ще в пологовому будинку перших ознак дисфункції серцевої діяльності, тахікардії, задишки, інтенсивних кардіальних шумів, швидка стомлюваність при харчуванні, припинення набору маси тіла у немовляти, блідість, поява ціанозу, КМ, гепатомегалія, зміни на ЕКГ у вигляді підвищення електричної активності ПШ чи ЛШ мають бути основою для призначення термінового проведення допплер-ЕхоКГ, консультації кардіолога, а за необхідності – кардіохірурга.
Своєчасна діагностика ПВС у новонароджених є складним завданням, адже одразу після народження діти можуть бути безсимптомними, і під час звичайного клінічного обстеження в більшості випадків не виявлятимуться специфічні зміни з боку серцево-судинної системи. Навіть кваліфікований медичний огляд новонародженого не може достовірно відокремити дітей з ПВС і без ПВС. Фізикальне обстеження має чутливість приблизно 50%, тому не може бути ефективним методом скринінгу для виявлення ПВС. Пульсоксиметрія як метод скринінгу призначена для виявлення асимптоматичних дітей з ПВС, які мають субклінічні ознаки гіпоксемії; є специфічним, помірно чутливим і економічно ефективним тестом, який відповідає критеріям для загального скринінгу. Ця програма була схвалена в США та інших розвинених країнах у рамках рекомендованої Єдиної панелі для скринінгу новонароджених в усьому світі. Пульсоксиметрія є неінвазивним методом для оцінки насичення артеріальної крові киснем і визначення частоти пульсу від сигналів поглинання, що отримуються від датчика, який встановлено на шкірі правої руки і ноги. Показники SpO2 пов’язані з парціальним тиском кисню в крові (РаО2), у нормі – 80-100 мм рт. ст. Пульсоксиметрію слід використовувати поряд із клінічним обстеженням пацієнта. Метод не виключає наявності некритичної ПВС. Специфічність пульсоксиметрії становить 99%, чутливість – 69,6%. Так, у нормі сатурація кисню крові становить ≥95%; за наявності ціанотичної ПВС реєструють зниження сатурації кисню крові, як правило, <90-92% в обох точках визначення. Новонародженим із показниками сатурації нижче 90% невідкладно необхідно провести допплер-ЕхоКГ для верифікації діагнозу ПВС; при показниках SрO2 >90%, але <95% необхідно здійснювати повторне двократне вимірювання сатурації з інтервалом між вимірюваннями 1 год; у разі стійкого зниження сатурації <95% або її прогресуючого зниження слід провести допплер-ЕхоКГ для верифікації діагнозу ПВС (частіше комбінованої або критичної).
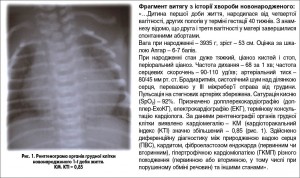
Рентгенографія органів грудної клітки у немовляти з підозрою на ПВС дозволяє визначити наявність та ступінь вираження КМ, а також венозної гіпертензії, набряку легень. ЕКГ-обстеження дає уявлення про положення електричної осі серця, вольтаж, гіпертрофію та перевантаження відділів серця, порушення ритму і провідності, а також є одним із важливих діагностичних критеріїв аномального відходження лівої коронарної артерії від легеневої артерії (АВЛКА, синдром Бланда-Гарленда-Уайта). Допплер-ЕхоКГ є золотим стандартом діагностики ПВС та визначення їх топіки, оцінки показників центральної гемодинаміки, тиску в стовбурі легеневої артерії, співвідношення легеневого й системного кровотоку (Qp/Qs), систолічної та діастолічної функцій міокарда. За показаннями можуть бути призначені катетеризація порожнин серця з манометрією і аналізом газів крові, ангіографія, вимірювання центрального венного тиску, комп’ютерна та магнітно-резонансна томографія (МРТ), гемограма, дослідження кислотно-лужного стану тощо.
Після виключення ПВС продовжують діагностичний пошук в інших напрямах (рис. 2).
Фіброеластоз ендоміокарда (ФЕ) – рідкісне захворювання у новонароджених (приблизно 1 випадок на 70 тис.) неуточненого генезу, при якому на внутрішній поверхні стінок шлуночків формується товстий шар ендокарда, що значно погіршує скоротливу здатність. Ураження може бути первинним, якщо етіологічний фактор встановити неможливо, і вторинним – на тлі ПВС зі значною обструкцією вивідного відділу ЛШ (ВВЛШ); стенозом, гіпоплазією, атрезією або коарктацією аорти. Не виключають також роль генетичних факторів і гіпоксії в розвитку ФЕ. Виявляють типові порушення серцевого ритму та провідності, кулеподібну форму серця за даними рентгенографії. Новонароджені з первинним ФЕ, вираженою КМ, різко зниженою скоротливою здатністю міокарда, з товстим (до 10,0 мм) малорухливим високоехогенним шаром ендокарда в ділянці задньої стінки ЛШ, з резистентною до терапії СН мають дуже поганий прогноз для виживання. Діти з ФЕ вторинного походження можуть виживати після кардіохірургічного усунення обструкції лівих камер, але прогноз неможливо визначити однозначно.
Частота неонатальних кардитів становить приблизно 1 випадок на 8 тис. новонароджених. Запальний процес у міокарді може поєднуватися з проявами енцефаліту і гепатиту.
При ранньому антенатальному кардиті, коли ураження серця переважно вірусної етіології відбувається в першому триместрі вагітності, запальний процес завершується ще до народження дитини; при народженні діагностується кардіоміопатія з КМ та СН. При пізньому антенатальному кардиті (запалення серцевих оболонок формується в третьому триместрі) симптоми захворювання, зумовлені гострою фазою запалення, виявляють одразу після народження: прогресують тахікардія, тахіпное, шумне дихання, ретракція міжреберних ділянок за відсутності ураження легенів; дитина бліда, млява, відмовляється від їжі. При народженні діагностують КМ, переважно внаслідок збільшення порожнини ЛШ. Патогенез СН пов’язують з ушкодженням міофібрил і розвитком гострого інтерстиціального набряку. Наявність аритмій вважають більш характерною для пізнього антенатального кардиту. Гострий постнатальний кардит, як і пізній антенатальний кардит, часто має різноманітну вірусну етіологію, але маніфестує стрімким розвитком СН приблизно на 5-7-му добу життя, тяжкими розладами серцевого ритму, має прогредієнтний перебіг нерідко з летальним наслідком. Завжди наявна КМ, на тлі якої трансклапанна регургітація зумовлює появу інтенсивного систолічного шуму. КТІ перевищує показник 0,60. Вольтаж на ЕКГ низький, типова депресія сегмента ST, інверсія зубця T в лівих прекордіальних відведеннях. Систолічна дисфункція міокарда, фракція викиду (ФВ) ЛШ значно знижена, може становити 25-30%. Підвищення рівня кардіоспецифічних ферментів (КФК-МВ, ЛДГ-1, ЛДГ-2) є важливим для діагностики запальних уражень міокарда. Міокардит у більш старшому віці – це також запальне захворювання серцевого м’яза, причиною якого слугує інфекція, частіше вірусна; але також може розвиватися при коллагенозах, васкулітах, алергічних станах, після впливу токсинів, іонізуючого випромінювання, хімічних речовин, на тлі прийому деяких лікарських засобів. До типових клінічних проявів належать тахікардія, аритмія, СН неясного генезу зі скаргами на підвищену втомлюваність, слабкість. Іноді міокардит перебігає безсимптомно. Вірусному міокардиту передують інфекції верхніх дихальних шляхів з фебрильною лихоманкою, захворювання шлунково-кишкового тракту.
Дані фізикального дослідження варіюють від помірно вираженої тахікардії до симптомів декомпенсованої право- і лівошлуночкової недостатності (застій у легенях, набряк шийних вен, гепатомегалія, периферичні набряки). Під час рентгенографії органів грудної клітки виявляють КМ. На ЕКГ спостерігаються порушення серцевого ритму та проведення, ознаки порушення процесів реполяризації міокарда. Дані лабораторних досліджень не є специфічними. Зрідка виявляють запальні порушення в периферичній крові, які пов’язані не стільки з міокардитом, скільки з його причиною, а також еозинофілію, базофілію. Активність серцевих ізоферментів не завжди є підвищеною. Біопсія також може надавати сумнівні результати у разі вогнищевого ураження серцевого м’яза. За допомогою ІФА-діагностики підтверджують вірусну, бактеріальну, внутрішньоклітинну етіологію міокардиту. Найбільшу діагностичну інформативність має МРТ. Міокардит може призвести до летального наслідку, розвитку дилатаційної кардіоміопатії (ДКМП) або постміокардитичного міокардіосклерозу; може перебігати безсимптомно й завершуватися повним одужанням. Минущі зміни кінцевої частини шлуночкового комплексу на ЕКГ і позитивна динаміка симптомів СН, нормалізація розміру ЛШ та скоротливої здатності міокарда під впливом лікування дають змогу відокремити діагноз міокардита від ДКМП.
Дилатаційна кардіоміопатія у дітей першого року життя нерідко маніфестує (або вперше виявляється!) після респіраторної вірусної інфекції, гострих бронхітів, пневмонії, коли ознаки КМ виявляють неочікувано під час проведення рентгенографії органів грудної клітки з приводу «респіраторної» патології. Іноді застійну бівентрикулярну СН, що розвинулася «без очевидної причини», діагностують уже при зниженні ФВ ЛШ <30%. Аускультативно виявляють порушення ритму, ритм галопу, слабкий або помірної звучності систолічний шум мітральної або тристулкової регургітації, акцент 2 тону над легеневою артерією у разі розвитку легеневої гіпертензії. На ЕКГ: прогресуюча гіпертрофія ЛШ й лівого передсердя, стійкі неспецифічні зміни сегмента ST і зубця T, стійкі блокади. Під час проведення рентгенологічного дослідження органів грудної клітки виявляють КМ (КТІ >0,56). Допплер-ЕхоКГ дає змогу оцінити дилатацію порожнин серця, переважно шлуночків, більше лівого, за практично незмінної товщини стінок; дилатацію лівого передсердя, значне зниження ФВ ЛШ, дифузний характер гіпокінезії стінок шлуночків, ступінь мітральної регургітації, підвищення тиску в легеневій артерії.
Під час загальноклінічного й біохімічного дослідження крові характерні патологічні зміни не виявляються. Іноді у хворих реєструють підвищення активності MB-фракції креатинфосфокінази, що свідчить про незворотне ушкодження кардіоміоцитів, має несприятливе прогностичне значення щодо прогресування СН, потреби в трансплантації серця й ризику раптової смерті.
У сумнівних випадках з метою уточнення діагнозу можливим є проведення радіонуклідної вентрикулографії, сцинтиграфії міокарда, коронарографії, катетеризації серця й МРТ.
За наявності відповідних клінічних та інструментальних критеріїв ДКМП цьому діагнозу відповідають неспецифічні дистрофічні зміни, некроз кардіоміоцитів, інтерстиціальний фіброз і замісний склероз різного ступеня вираження, що виявляють під час проведення ендоміокардіальної біопсії (ЕМБ). Метод використовують переважно для виключення специфічних захворювань міокарда, що мають патогномонічні морфологічні ознаки. Уточнити діагноз ДКМП допомагають результати спостереження в динаміці, прогресування СН, КМ. Наведені диференційно-діагностичні критерії є досить відносними, і верифікувати діагноз міокардиту на відміну від ДКМП сьогодні дає змогу лише ЕМБ.
Гіпертрофічна кардіоміопатія характеризується гіпертрофією ЛШ без явної причини. Може бути проявом сімейної (наслідуваної) форми з аутосомно-домінантним типом спадкування з високою пенетрантністю або виникати спорадично. Гіпертрофія може поширюватися на різні ділянки міокарда, найчастіше – на міжшлуночкову перегородку й бокову стінку ЛШ. Рання діагностика є утрудненою не тільки у дітей, а й у дорослих у зв’язку з відсутністю типових клінічних проявів. Так, результати дослідження CARDIA (Coronary Artery Risk Development in Young Adults) свідчать про високу частоту ГКМП (близько 1:500 серед дорослого населення), при цьому наголошується на реальних труднощах діагностики захворювання в популяції. Золотим стандартом діагностики гіпертрофії (концентричної або гіпертрофічної) та виявлення діастолічної дисфункції залишається допплер-ЕхоКГ. При цьому дійсна етіологія КМП не завжди встановлюється.
Порушення форми, розмірів і взаєморозташування міоцитів, посилення фіброзу міокарда при сімейній формі ГКМП відбувається на тлі мутації гена важкого b-ланцюга міозину міокарда. Спостерігається зниження податливості й розвиток діастолічної дисфункції ЛШ за рестриктивним типом. Порожнина ЛШ нормальних розмірів або зменшена. ФВ може бути навіть збільшеною. Розрізняють обструктивну й необструктивну форми. При обструктивній формі виникає градієнт тиску у ВВЛШ, який збільшується при тахікардії (наприклад, під час фізичного навантаження), підвищенні скоротливості міокарда (наприклад, при призначенні інотропних засобів).
За наявності тяжкої обструкції ВВЛШ може розвинутися клінічна картина «малого серцевого викиду» з наростанням проявів СН, СПБ >3 с, похолоданням кінцівок, гіпотонією, приглушеністю серцевих тонів уже в неонатальному періоді.
В іншої частини хворих обструкція наростає поступово, протягом років, захворювання упродовж певного часу перебігає безсимптомно; реєструють скарги на кардіалгії, задишку при навантаженні; синкопе і пресинкопальні стани з’являються частіше в шкільному віці. Водночас першим проявом ГКМП може стати раптова смерть (при фізичному навантаженні, переважно у підлітків або молодих спортсменів). Вважають, що якщо ГКМП є симптоматичною вже в неонатальному періоді, прогноз є несприятливим. Основним симптомом обструктивної ГКМП вважають інтенсивний пансистолічний шум вигнання, що найкраще вислуховується в III-IV міжребер’ї ліворуч від грудини. Інтенсивність шуму залежить від ступеня обструкції ВВЛШ. У дітей шкільного віку і дорослих виконують інформативний діагностичний тест – пробу Вальсальви (форсований видих при закритій голосовій щілині), під час якої відбувається збільшення градієнта у ВВЛШ за рахунок зменшення порожнини шлуночка; тому зростає інтенсивність шуму і зменшується наповнення пульсу на сонній артерії. На ЕКГ вважають типовими ознаки гіпертрофії ЛШ, глибокі зубці Q у відведеннях II, III і aVF (або лівих грудних відведеннях), значні порушення процесів реполяризації шлуночків. Призначають добове моніторування ЕКГ з метою виявлення суправентрикулярних та шлуночкових аритмій; наявність останніх погіршує прогноз.
Під час рентгенографії виявляють помірне збільшення або нормальні розміри серця. ЕхоКГ дає змогу встановити асиметричний характер гіпертрофії ЛШ, уточнити та моніторувати ступінь обструкції ВВЛШ, мітральної регургітації, оцінити діастолічну функцію ЛШ, а також виявити типовий передньосистолічний рух передньої стулки мітрального клапана в напрямку міжшлуночкової перегородки. Частка раптової смерті становить щороку близько 3% у дорослих з ГКМП і 6% – у дітей.
За наявності гіпертрофії міокарда у новонародженого у процесі диференційної діагностики ідіопатичної/первинної ГКМП необхідно виключити низку метаболічних та мітохондріальних захворювань, для чого проводять клінічний аналіз крові (нейтропенія може бути ознакою Barth-синдрому), досліджують рівень електролітів у крові, концентрації лактатів у крові та сечі; органічних кислот у сечі; рівень жирних кислот; шкірна біопсія та електронна мікроскопія рекомендуються для діагностики захворювань із порушенням профілю ензимів. У новонароджених з ГКМП також виключають хворобу Помпе шляхом проведення біопсії шкіри та дослідження слини з визначенням рівня аміномальтази. За наявності «китів» для проведення генетичного обстеження важливим є виключення мутацій, асоційованих із гіпертрофією/дилатацією міокарда.
У пацієнта, витяг з історії хвороби якого було представлено вище, за даними допплер-ЕхоКГ встановлено значну гіпертрофію міжшлуночкової перегородки (до 11,0 мм при нормі <5,0 мм) з градієнтом тиску у ВВЛШ 68 мм рт. ст.; виявлено діастолічну дисфункцію ЛШ рестриктивного типу, середній тиск у стовбурі легеневої артерії – 48 мм рт. ст. Кардіоспецифічні ферменти – в нормі. Встановлено діагноз: ГКМП, асиметрична форма, з порушенням діастолічної функції ЛШ за рестриктивним типом. Легенева гіпертензія 2 ст.
Таким чином, клінічні прояви неонатальних кардіоміопатій є надзвичайно варіабельними, діагностичний процес ускладнюється диференційною діагностикою окремих форм. Кардіомегалія є основною ознакою первинної неонатальної КМП поряд із систолічною та/або діастолічною міокардіальною дисфункцією, що прогресує за відсутності морфологічних ознак активного запалення в міокарді. На жаль, маніфестація ГКМП в неонатальному періоді свідчить про несприятливий прогноз. У літературі досі постійно дискутуються питання клініко-лабораторної та інструментальної діагностики ГКМП і ДКМП у новонароджених, триває пошук інформативних діагностичних методів із послідовним удосконаленням питань терапії та профілактики.
Рестриктивна кардіоміопатія (РКМП) становить до 5% випадків кардіоміопатій у дорослих і виникає при збільшенні жорсткості одного або обох шлуночків унаслідок фіброзу міокарда або ендокарда з розвитком тяжкої незворотної діастолічної дисфункції шлуночків за рестриктивним типом. Розвивається мітральна і тристулкова регургітація. Систолічна функція протягом тривалого часу залишається збереженою. Причину РКМП зазвичай виявити не вдається; уражаються шлуночки, причому розміри їх порожнин залишаються нормальними, на відміну від прогресуючого збільшення передсердь. З останнім пов’язують розвиток миготливої аритмії, шлуночкових аритмій. Значно збільшується діастолічний тиск у ПШ і ЛШ, виникає легенева гіпертензія. Типовими клінічними ознаками вважають шуми мітральної і тристулкової регургітації та аускультативні ознаки легеневої гіпертензії; а також набряк шийних вен, який збільшується під час вдиху.
Гостра ревматична лихоманка – запальне захворювання, викликане стрептококами групи А (Streptococcus pyogenes), у дітей зустрічається дуже рідко, переважно уражає пацієнтів віком від 5 до 15 років, часто після перенесеного стрептококового фарингіту. Основними симптомами є лихоманка, панкардит, мігруючий «летючий» поліартрит, ревматичне висипання, підшкірні вузлики й ревматична хорея, а також ефективність антибактеріальної терапії, що призначається. Ураження клапанних структур може призводити до формування набутої вади серця (переважно з ураженням аортального або мітрального клапанів), адже антистрептококові антитіла перехресно реагують із клітинами ендокарда й інших оболонок серця. Доведено, що якщо при гострому або рецидивуючому фарингіті з підвищенням титру антистрептолізину О не проводити лікування, то ризик розвитку ревматичної лихоманки зростає до 2-3%.
Попередній діагноз встановлюють на підставі модифікованих критеріїв Киселя-Джонса-Нестерова. Діагноз вважають імовірним у хворих, що перенесли стрептококовий фарингіт за 2-3 тижні до розвитку захворювання та мають два «великі» або один «великий» і два «малі» діагностичні критерії. До великих критеріїв належать кардит, поліартрит, хорея, кільцеподібна еритема й підшкірні вузлики. До малих критеріїв – артралгії, лихоманка, збільшення швидкості осідання еритроцитів (ШОЕ), підвищення рівня С-реактивного білка, подовження інтервалу PQ на ЕКГ. Якщо перша ревматична атака не супроводжується кардитом, то надалі ураження клапанів виникає рідко. Якщо перша ревматична атака супроводжується тяжким кардитом, то він зазвичай призводить до прогресуючого ураження серця з формуванням КМ, СН.
Інфекційний ендокардит – тяжке запальне захворювання ендокарда з переважним ураженням клапанів. Виділяють гостру й підгостру форми ІЕ, також класифікують ІЕ залежно від типу збудника (наприклад, стрептокок, S. aureus, энтерококи та ін.) і анатомічного субстрату (природні або протезовані клапани). Вторинний ендокардит розвивається на тлі природжених або набутих вад серця, у тому числі після кардіохірургічного лікування. Є відомості про розвиток ІЕ після застосування судинних катетерів, екстракції зуба. Найчастіше уражаються мітральний і аортальний клапани, значно рідше – праві відділи серця і клапан легеневої артерії.
Клінічними проявами ІЕ є інтермітуюча лихоманка з ознобами, нездужання, нічне профузне спітніння, анорексія, артралгії. З’являються та посилюються кардіальні шуми, прогресують ознаки СН. Можливою є дисемінація інфекції з розвитком менінгіту, остеомієліту, абсцесів селезінки, пієлонефриту, а також емболічні ураження.
До типових клінічних проявів належать петехії (на слизових оболонках та кон’юнктиві), безболісні геморагічні плями на долонях і стопах, невеликі болючі вузлики Ослера, зазвичай розташовані на пальцях рук і ніг; можливим є виникнення плям Рота (крововиливів у сітківку). Лабораторно виявляють нормохромну нормоцитарну анемію, лейкоцитоз, зсув лейкоцитарної формули вліво, тромбоцитопенію, збільшення ШОЕ, позитивний ревматоїдний фактор.
На підставі даних допплер-ЕхоКГ вегетації на клапанах реєструють, якщо їх розмір перевищує 2 мм, зазвичай через 4-6 тижнів від початку захворювання. Більш чутливим методом діагностики є черезстравохідна ЕхоКГ, МРТ. Вважають, що якщо розмір вегетації перевищує 9 мм, медикаментозне лікування не матиме ефекту, буде необхідним кардіохірургічне втручання. Таким чином, виключати ІЕ слід у кожного пацієнта з лихоманкою неясного генезу в поєднанні з шумом у серці. Класичні ознаки ІЕ (мінливий характер шуму або поява нового шуму) встановлюють лише у 15% пацієнтів. Важливим діагностичним тестом є виявлення збудника в гемокультурі. Однак доведено, що після курсу антибактеріальної терапії й при грибковому генезі ендокардиту результат аналізу може бути негативним. Забір крові для посіву рекомендують здійснювати з різних вен не менше трьох разів. Частота ускладнень (СН, тромбоемболія) залишається високою навіть за умови адекватної терапії; у 10% хворих ІЕ виникає повторно. У разі відсутності лікування ІЕ зазвичай призводить до смерті пацієнта.
Крім вищезазначеного, причинами КМ також можуть бути такі рідкісні захворювання, як амілоїдоз серця, гемохроматоз і саркоїдоз.
Амілоїдоз серця. Залучення до патологічного процесу серця властиве первинному амілоїдозу. Залежно від локалізації відкладень амілоїду розвивається переважне порушення або скорочувальної функції міокарда, або його діастолічного комплаєнсу. Відповідно, клінічна картина й гемодинамічні розлади нагадуватимуть ДКМП або РКМП. Ураження коронарних артерій зумовлює ангінозний біль і зміни процесів реполяризації на ЕКГ. Амілоїдоз серця супроводжують системні ознаки цього захворювання: полінейропатія, макроглоссія, ураження шлунково-кишкового тракту з порушенням процесів всмоктування, а також лімфатичних вузлів і нирок. Для уточнення діагнозу проводять біопсію слизової оболонки ясен або прямої кишки, а у разі її негативного результату – ЕМБ, під час якої виявляють типові для амілоїдозу морфологічні зміни.
Поява СН при амілоїдозі серця у поєднанні зі збільшенням товщини задньої стінки ЛШ і зменшенням амплітуди комплексу QRS свідчить про несприятливий прогноз.
Гемохроматоз – захворювання, зумовлене відкладенням заліза в паренхіматозних органах, за перебігом також може нагадувати ДКМП або РКМП. Діагностика гемохроматозу передбачає пошук характерних позасерцевих проявів (цироз печінки, бронзова пігментація шкіри, артрит, цукровий діабет). Уточнення діагнозу здійснюється за допомогою лабораторних даних (підвищення рівня заліза в плазмі крові й сечі, насичення ним трансферину та збільшення вмісту сироваткового феритину). Патогномонічні для гемохроматозу морфологічні зміни виявляють у біоптатах печінки й міокарда.
Саркоїдоз, при якому ураження серця формується в результаті утворення специфічних гранульом з наступним розростанням сполучної тканини, проявляється порушеннями діастолічного наповнення. Рідше формується систолічна дисфункція, за якої перебіг захворювання нагадує ДКМП. Є типовими пароксизмальні суправентрикулярні і шлуночкові аритмії, а також передсердно-шлуночкові блокади різного ступеня, інші порушення провідності. Останні можуть бути предикторами синкопальных станів і раптової серцевої смерті. Можливим є поєднання з характерними для саркоїдозу ознаками ураження інших органів (внутрішньогрудних лімфатичних вузлів, легенів, завушних слинних залоз та шкіри).
Таким чином, диференційна діагностика КМ у дітей, у тому числі раннього віку і новонароджених, є складним невідкладним завданням, яке потребує швидкого і безпомилкового вирішення за участю мультидисциплінарної команди фахівців з метою збереження здоров’я і навіть життя пацієнта.




