13 січня, 2016
Анемия у пациента с ХСН: как оценивать и как лечить?
 Истекшие полтора десятилетия принесли немалый объем новых знаний о механизмах развития анемии, нередко наблюдающейся у пациентов с хронической сердечной недостаточностью (ХСН).
Истекшие полтора десятилетия принесли немалый объем новых знаний о механизмах развития анемии, нередко наблюдающейся у пациентов с хронической сердечной недостаточностью (ХСН).
Частота выявления анемии, критериями которой согласно ВОЗ является концентрация гемоглобина (Нb) в крови менее 13 г/дл у мужчин и менее 12 г/дл у женщин, по данным современных исследований, колеблется от 16 до 48%, возрастая по мере увеличения класса по NYHA. Причинами стойкого интереса исследователей к проблеме анемии при ХСН является, с одной стороны, ее существенное негативное влияние на клинический прогноз пациентов с ХСН, а с другой – значительное, пропорциональное выраженности анемии снижение функциональных возможностей и качества жизни пациентов.
Возможные механизмы снижения уровня Нb при ХСН многообразны и могут сочетаться у одного и того же пациента, что в целом позволяет говорить о многофакторном генезе феномена анемии при данном синдроме.
Механизмы, которые могут участвовать в формировании анемии у пациента с ХСН
1. Ренальный механизм. Его актуальность не вызывает сомнений, поскольку существенное и тесно сопряженное с ухудшением клинического прогноза снижение скорости клубочковой фильтрации (СКФ) <60 мл/мин/1,72 м2 наблюдается у 50-57% пациентов с ХСН. Классическая схема анемии почечного генеза предполагает снижение эритропоэтин (ЭП)-синтезирующей функции почек, пропорциональное выраженности повреждения последних, что влечет за собой уменьшение эритропоэза. Вышеуказанный ренальный, связанный со снижением выработки ЭП механизм становится актуальным при уменьшении СКФ <35-40 мл/мин/1,72 м2.
У пациентов с ХСН снижение ренального кровотока, обусловленное вазоконстрикторным влиянием высоких нейрогормонов (РАС, норадреналин) на почечные сосуды, выступает стимулом к усилению выработки ЭП через механизм гипоксии. С этим согласуется тот факт, что у большинства пациентов с ХСН и анемией определяются не сниженные, а, напротив, повышенные либо нормальные уровни ЭП. Данную ситуацию трактуют как резистентность к эндогенному ЭП, в основе которой лежат десенситизация рецепторов к ЭП, обусловленная влиянием воспалительных цитокинов, дисфункция таргетных клеток костного мозга на фоне его хронической гипоксии, прямое угнетение пролиферации последних воспалительными цитокинами. В то же время для пациентов с ХСН, имеющих тяжелую ренальную дисфункцию, которая, как правило, отражает выраженные необратимые структурные изменения паренхимы почек, характерным является снижение ЭП-образующей функции последних. Поэтому бытующий ныне в литературе термин «кардиоренальный анемический синдром» в строгом смысле применим именно к категории пациентов с анемией с сопутствующим тяжелым нарушением азотовыделительной функции почек. По данным D. Scrutinio и соавт., из 326 пациентов с систолической ХСН и сопутствующей анемией снижение величины СКФ <30 мл/мин/1,73 м2 имело место у 50 (15,3%).
2. Иммуновоспалительный механизм. Последний играет ведущую роль в подавлении эритропоэза в условиях хронических инфекций, онкологических заболеваний и при некоторых других состояниях, характеризующихся системной иммуновоспалительной активацией (ревматоидный артрит, диффузные болезни соединительной ткани, сахарный диабет и др., а также ХСН). В вышеозначенном механизме главным «действующим лицом» выступают провоспалительные цитокины (TNF, интерлейкины 1 и 6, гамма-интерферон, бактериальные липополисахариды), те или иные из которых прямо либо опосредованно: 1) блокируют транспорт железа внутри энтероцита в кровь; 2) угнетают высвобождение депонированного железа из РЭС (ретикулоэндотелиальный блок) и гепатоцитов. Ключевым посредником такого рода блокады выступает синтезируемый в печени гепсидин, секреция которого стимулируется провоспалительными цитокинами, а также застойными явлениями в печени. В результате возникает так называемый функциональный дефицит железа, состоящий в том, что при наличии достаточных запасов этого элемента наблюдается его нехватка для эритропоэза. Наконец, провоспалительные цитокины играют ведущую роль в формировании резистентности к эндогенному ЭП (см. выше).
Анемия, наблюдающаяся на фоне функционального железодефицита в условиях системного воспаления, терминологически определена как анемия хронического заболевания (АХЗ). Для данного состояния, наряду с уменьшением содержания железа в крови и сниженной сатурацией железом трансферрина, характерен нормальный либо повышенный уровень ферритина. В пользу АХЗ могут также свидетельствовать повышенные уровни циркулирующих биомаркеров воспаления (С-реактивный протеин, воспалительные цитокины). Для АХЗ более характерен нормоцитоз – средний корпускулярный объем эритроцита (MCV) находится в пределах 80-100 фл, однако у 1/5-1/3 таких пациентов анемия носит характер микроцитарной (показатель MCV <80 фл). Доля АХЗ в структуре всех случаев анемии при ХСН достигает 60%.
3. Истинный (абсолютный) железодефицит. При ХСН он может быть связан с нарушением кишечной абсорбции железа и микропотерями крови. К возможным причинам нарушения всасывания железа у пациентов с ХСН относят отек и утолщение стенок кишечника, снижение кровотока в органах брюшной полости, анорексию и недостаточное питание. Микропотери крови, роль которых у пациентов с ХСН, возможно, недооценивается, могут быть связаны с регулярным приемом большинством из них ацетилсалициловой кислоты либо антикоагулянтов.
Частота истинного железодефицита среди пациентов с ХСН и сопутствующей анемией колеблется, по разным данным, от 5 до 21%. Для абсолютного железодефицита, помимо сниженной сатурации трансферрина и повышения содержания в плазме его растворимых рецепторов, характерным является снижение концентрации циркулирующего ферритина. Хотя традиционным критерием абсолютного железодефицита считается уровень ферритина <30 мкг/л, для пациентов с ХСН в последнее время в качестве такого критерия рассматривается величина <100 мкг/л. Это обусловлено результатами оценки уровней ферритина у пациентов с тяжелой ХСН в зависимости от наличия у них истощения депо железа по данным пункционной биопсии костного мозга. Так, у пациентов с истощением запасов Fe средний уровень ферритина в крови составил 75 мкг/л, а у пациентов с сохранным пулом депонированного железа – 211 мкг/л [40].
Истинная железодефицитная анемия является микроцитарной (показатель MCV (<80 фл) и гипохромной (среднее содержание Hb в эритроците – МСН – <27 пг).
4. Гемодилюция. Увеличенный объем циркулирующей плазмы, характерный для гиперволемии, наблюдающейся в фазе декомпенсации ХСН, снижает гематокрит и, соответственно, показатель концентрации Hb в крови – так называемая псевдоанемия, о которой представляется возможным говорить лишь в случаях, когда достижению эуволемии сопутствует нормализация уровня Hb без применения специфической терапии. Вместе с тем вышеозначенный гемодилюционный механизм, по-видимому, может принимать участие в формировании показателя Hb крови и у многих клинически стабильных пациентов с ХСН. Об этом могут свидетельствовать результаты исследований, в которых с помощью современных радиоизотопных методов было продемонстрировано увеличение объема циркулирующей плазмы у 40-50% пациентов с ХСН, не имевших на момент исследования явных объективных признаков гиперволемии.
5. Дефицит витамина В12 или фолиевой кислоты. Удельный вес макроцитарной анемии, связанной с вышеуказанным дефицитом, относительно невысок (5-8%) и, как правило, сопряжен с соответствующими коморбидными состояниями (алкоголизм, парентеральное питание, заболевание либо резекция желудка или тонкого кишечника и т.п.).
6. Влияние лекарственных препаратов. Помимо препаратов, способных обусловить повреждение слизистых ЖКТ и тем самым спровоцировать микро- или макрокровопотерю (аспирин, нестероидные противовоспалительные средства), следует упомянуть ряд лекарств, применению которых сопутствует риск подавления эритропоэза, – цитостатики, некоторые антибактериальные средства. Наибольшее внимание привлекают данные о способности ингибиторов ангиотензинпревращающего фермента (ИАПФ) подавлять эритропоэз. Это, в частности, объясняют тем, что АПФ принимает активное участие в биодеградации белка Ас-SDKP – мощного ингибитора гемопоэза. Вместе с тем на сегодняшний день клинические исследования, убедительно подтверждающие связь приема ИАПФ со снижением уровня Hb, отсутствуют, а наличие анемии в действующих рекомендациях не относится к числу противопоказаний к назначению данного класса препаратов.
Вышеизложенное наглядно демонстрирует многофакторный характер анемии при ХСН. Это естественным образом предполагает возможность сочетания различных механизмов ее формирования у одного и того же пациента. Вместе с тем уточнение вышеозначенных механизмов развития анемии в каждом конкретном случае остается актуальным. Учитывая потенциально сложную природу анемии при ХСН, у данной категории пациентов понятия «ренальная анемия», «анемия хронического заболевания», «дилюционная анемия» вряд ли должны звучать как диагностические термины. Однако точная оценка природы анемии, безусловно, представляется полезной для правильного подхода к ее коррекции.
Переходя к теме лечения ХСН, сразу следует заметить, что до настоящего времени в документах Европейского кардиологического общества по лечению ХСН, включая ныне действующий документ редакции 2012 г., не содержится сформулированных в соответствии с существующей доказательной базой конкретных рекомендаций по фармакотерапии сопутствующей анемии. Вместе с тем расширение наших знаний в данной области за последние годы, базирующееся на результатах некоторых новых завершенных исследований (см. далее), позволяет надеяться на изменение ситуации в лучшую сторону в новых Европейских рекомендациях по лечению СН, выход которых ожидается в 2016 г.
До недавнего времени в качестве оправданной рассматривалась стратегия лечения анемии при ХСН с помощью эритропоэзстимулирующих агентов, в том числе используемых в комбинации с препаратами железа. В ряде рандомизированных клинических испытаний, выполненных начиная с 2000 г., было установлено, что применение рекомбинантного ЭП (эпоэтин) у пациентов с ХСН и анемией способно восстанавливать уровень Hb до целевых значений с сопутствующими благоприятными клиническими эффектами в виде снижения класса по NYHA, увеличения толерантности к физической нагрузке, улучшения параметров качества жизни, улучшения систолической функции левого желудочка (ЛЖ). Вместе с тем еще с конца 1990-х годов начали накапливаться данные о повышении риска сердечно-сосудистых осложнений, в том числе фатальных, на фоне использования эритропоэзстимулирующих препаратов. Так, крупное исследование NHCT (1998), включившее более 1 тыс. гемодиализных пациентов с сопутствующей ишемической болезнью сердца или ХСН, было прекращено досрочно из-за соображений безопасности в связи с выявленным статистически достоверным трендом в сторону увеличения частоты случаев смерти. Конец эры эритропоэтинстимулирующих средств при ХСН наступил после окончания широкомасштабного (2278 пациентов) исследования RED-HF, в котором использование дарбэпоэтина у пациентов с систолической ХСН и уровнем Hb от 9,0 до 12,0 г/дл хотя и сопровождалось, в сравнении с плацебо, нормализацией уровня Hb и улучшением качества жизни, было ассоциировано с достоверным (р=0,01) увеличением частоты тромбоэмболических осложнений. Более того, в выполненном в США и обнародованном в 2014 г. ретроспективном обсервационном исследовании, включившем более 2 тыс. пациентов с ХСН и ренальной дисфункцией (СКФ <60 мл/мин/1,73 м2), лечение ЭП ассоциировалось с увеличением риска смерти на 40% (р=0,02), почти двукратным высокодостоверным (р<0,001) возрастанием риска возникновения острого коронарного синдрома наряду с достоверным увеличением количества госпитализаций.
В качестве возможных причин вышеуказанных неутешительных результатов рассматривается повышение гематокрита (и, соответственно, вязкости крови), влекущее за собой возрастание риска тромбоза, а также повышение артериального давления у пациентов с артериальной гипертензией, нередко сопутствующее применению ЭП. Так или иначе, в сложившейся ситуации для лечения хронической немакроцитарной анемии при ХСН у клиницистов осталось единственное «оружие» в виде препаратов железа. Последние представлены пероральными и внутривенными формами.
Пероральные формы. Их преимуществом является относительно невысокая стоимость, а главным недостатком – низкая всасываемость. До последнего времени пероральные препараты железа были представлены исключительно двухвалентными формами в виде сульфатной и глюконатной солей. Их существенный недостаток состоит в том, что окислению Fe2+ в Fe3+ в слизистой кишечника сопутствует образование свободных радикалов, оказывающих локальное токсическое действие. Оксидантный стресс клеток ЖКТ является причиной весьма частых, наблюдающихся примерно у 60% пациентов, гастроинтестинальных жалоб в виде изжоги, тошноты, запоров либо диареи, которыми сопровождается применение пероральных препаратов двухвалентного железа. Переносимость последних улучшается при совмещении их приема с приемом пищи, однако такой подход, в свою очередь, существенно ухудшает их всасываемость, что обусловливает значительные трудности в достижении баланса между минимизацией побочных эффектов и максимализацией усвояемости препарата Fe2+. Значение оксидантного стресса ЖКТ, провоцируемого поступлением экзогенного Fe2+, не ограничивается желудочно-кишечным дискомфортом как таковым. Согласно данным экспериментальных исследований длительный прием солей двухвалентного железа через механизм оксидантного стресса может вызывать деструкцию клеточных мембран, повреждение ДНК и иммунные нарушения. Через тот же механизм вышеуказанные соли усугубляют выраженность экспериментального колита, негативно влияют на кишечную микрофлору, а также могут увеличивать риск развития железистых опухолей кишечника.
Вышеуказанных последствий, связанных со свободнорадикальным повреждением ЖКТ, возможно избежать при применении трехвалентного железа в виде перорального Fe3+ – полимальтозного комплекса; он содержит полимальтозную оболочку, обеспечивающую контролируемое высвобождение железа и одновременно минимизирующую его контакт с пищей и другими лекарствами.
Универсальным ограничением пероральной ферротерапии является ее малодейственность при патологических состояниях, сопровождающихся нарушениями всасывания железа, которые имеют место у большинства больных с клинически выраженной ХСН. В качестве причин недостаточной абсорбции железа у таких пациентов рассматриваются отек слизистой кишечника и сниженный (на 30-43%) кишечный кровоток. Кроме того, при АХЗ, механизм которой актуален для ХСН, повышенные уровни гепсидина угнетают транспортировку ферропортином железа внутри энтероцита, целью которой является поступление Fe в кровь. К дополнительным факторам, способным ограничить всасывание препаратов железа в кишечнике, относятся прием некоторых медикаментов (например, блокаторов Н2-рецепторов), паретические расстройства со стороны желудка, нередко наблюдающиеся при диабете.
Наиболее существенным недостатком стратегии коррекции железодефицита с помощью пероральных форм Fe является недостаточная скорость восполнения ими запасов железа. Так, суточная доза железа, требующаяся для восполнения его дефицита, составляет 1000 мг. Биодоступность пероральных форм железа составляет примерно 10%. Исходя из обычной дозы сульфата железа (100-200 мг/сут), в том «идеальном» случае, если пациент адекватно переносит дозу в 200 мг и не имеет предпосылок к нарушению всасывания железа, ежедневное восполнение его запаса составит 20 мг, что потребует минимум 50 дней для устранения железодефицита. При менее благоприятном сценарии – если это пациент с выраженной ХСН (при которой абсорбция железа снижена примерно на 50%), который способен переносить лишь дозу 100 мг/сут, – ежедневное восполнение дефицита железа составит не более 5 мг, что потребует 200 дней для полного восстановления его запасов. В реальной практике для этого может потребоваться еще больший промежуток времени из-за спорадических пропусков приема очередной дозы по случайным причинам или из-за желудочно-кишечного дискомфорта. Приведенные расчеты свидетельствуют, что надлежащая результативность пероральной ферротерапии может быть достигнута при условии ее длительности более 6 мес. В то же время для полного восстановления запасов железа достаточно от одной до нескольких его внутривенных инъекций. Поэтому внутривенная ферротерапия сегодня рассматривается в качестве приоритетного подхода к коррекции железодефицита и сопряженной с ним анемии.
Внутривенные препараты железа. Современные внутривенные препараты железа воплощены в виде сфероподобных коллоидных микрочастиц железо-углеводной природы. Ядро такой микрочастицы содержит Fe3+ в виде оксигидроксидного комплекса, его окружает углеводная оболочка различной (в зависимости от запатентованной лекарственной формы) природы, обеспечивающая микрочастице стабильность в растворе и в кровотоке. Введенные внутривенно вышеуказанные частицы инкорпорируются фагоцитами РЭС, которые разрушают их оболочку и далее выбрасывают ионы трехвалентного железа в кровоток, где они немедленно связываются с трансферрином для последующего транспортирования в костный мозг. Экспорт железа из микрофагов в кровоток осуществляется транспортным белком ферропортином. При функциональном дефиците железа, свойственном иммуновоспалительному механизму анемии (при АХЗ), повышенные уровни гепсидина вызывают деградацию ферропортина и, соответственно, задержку Fe внутри макрофагов (гепсидиновый, или ретикуло-эндотелиальный, блок). После внутривенной инъекции препаратов железа наблюдается быстрое нарастание его концентрации внутри макрофагов, что индуцирует гиперэкспрессию ферропортина, и тем самым гепсидиновый блок преодолевается. Именно этим механизмом объясняется эффективность внутривенных форм железа при его относительном (функциональном) дефиците.
В настоящее время на европейском рынке доступны четыре внутривенные лекарственные формы железа, различающиеся природой углеводной оболочки, дозированием и технологией назначения, – железа декстран, глюконат железа, сахарат железа и карбоксимальтоза железа. Первые две формы, особенно железа декстран, характеризуются меньшей безопасностью применения в сравнении с последними двумя формами. Так, согласно базе данных FDA, охватившей период 1997-2002 гг., при применении декстрана железа наблюдали 29,2 случая угрожающих жизни анафилактических реакций на 1 млн пациентов, глюконата железа – 10,5, сахарата железа – 4,2. В ныне действующих в США рекомендациях по лечению пациентов с хронической болезнью почек говорится о нежелательности использования внутривенного декстрана железа. Наиболее современной из вышеуказанных лекарственных форм является карбоксимальтоза железа. Ее преимущества – низкий окислительно-восстановительный потенциал и, соответственно, возможность назначения большей, в сравнении с другими названными формами, разовой дозы железа, а также низкая, в сравнении с железа декстраном и глюконатом железа, оксидантная активность.
На сегодняшний день база данных, касающаяся эффективности внутривенной терапии препаратами железа пациентов с ХСН, представлена результатами 4 рандомизированных испытаний сахарата железа и карбоксимальтозы железа, выполненных в 2007-2014 гг.
Доказательная база эффективности при ХСН карбоксимальтозы железа более обширна и представлена двумя многоцентровыми рандомизированными плацебо-контролируемыми испытаниями – FAIR-HF (2009) и CONFIRM-HF (2014).
В исследование FAIR-HF включили 459 пациентов с систолической ХСН (фракция выброса ≤40%) II-III классов по NYHA с уровнем Hb от 95 до 135 г/л и железодефицитом, критерии которого соответствовали таковым в исследовании FERRIC-HF. Испытуемый препарат (с) вводили по 200 мг 1 раз в неделю до полного восполнения дефицита железа, потребность в котором вычислялась по стандартной формуле Ganzoni. После этого, на поддерживающем этапе, ту же дозу вводили 1 раз в месяц до окончания периода наблюдения, составившего 24 недели. В конце вышеуказанного срока наблюдения в группе активного препарата регистрировали, в сравнении с плацебо, существенное достоверное улучшение симптоматики самочувствия по стандартизованной шкале самооценки (Patient Global Assessment score), существенное улучшение индекса качества жизни по обеим использовавшимся шкалам (EQ-SD и KCCQ), снижение класса по NYHA и увеличение дистанции 6-минутной ходьбы (соответственно +39 м и +9 м, р<0,001). Уровень Hb в группе с исходной анемией (Hb <120 г/дл) нормализовался и стал сопоставимым с таковым в подгруппе без анемии. Устранение железодефицита с помощью карбоксимальтозы железа сопровождалось улучшением функции почек, выразившемся в достоверном повышении СКФ.
Наибольшее по продолжительности испытание препаратов внутривенного железа – CONFIRM-HF (2014) – охватило 304 пациента с ХСН II-III класса по NYHA с фракцией выброса ≤45%, повышенным уровнем натрийуретических пептидов и теми же, что и в исследованиях FERRIC-HF и FAIR-HF, критериями абсолютного и относительного железодефицита. В исследование вошли пациенты как со сниженным, так и нормальным уровнем Hb, который в среднем составил 12,4 г/дл. В качестве первостепенной конечной точки рассматривали изменения дистанции 6-минутной ходьбы, а в качестве второстепенных – динамику класса по NYHA, параметров шкал самочувствия, качества жизни и физической слабости, а также частоту госпитализаций в связи с декомпенсацией СН. Феринжект вводили в виде внутривенного болюса, соответствовавшего 500 или 1000 мг железа, при этом суммарная доза последнего за период активной фазы терапии (6 недель) составляла, в зависимости от полноты устранения железодефицита, от 500 до 2000 мг. В поддерживающей фазе вводили по 500 мг Fe на этапах 12, 24 и 36 недель, однако лишь в случаях, если на данный момент железодефицит сохранялся. В качестве плацебо использовали 0,9% раствор хлорида натрия. Срок наблюдения пациентов составил 52 недели.
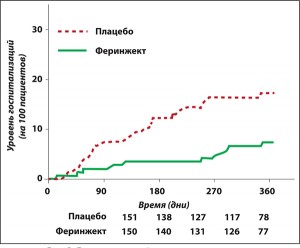
Средняя доза препарата, понадобившаяся для коррекции железодефицита, составила 1500 мг, варьируя от 500 до 3500 мг, причем у 75% пациентов для нормализации и поддержания нормального статуса Fe понадобилось не более 2 инъекций. Лечение Феринжектом ассоциировалось с существенным увеличением дистанции 6-минутной ходьбы на этапах 24 недели (разница с плацебо 33 м; р<0,002) и 52 недели (36 м; р<0,001). Статистически достоверное терапевтическое преимущество группы активного лечения перед плацебо в отношении класса по NYHA, шкал самочувствия, качества жизни и слабости наметилось с 24-й недели и сохранялось до конца исследования. Кроме того, лечение Феринжектом было сопряжено с существенным (на 61%, р=0,009) уменьшением количества случаев госпитализации в связи с усугублением СН (рис. 1), а число смертельных случаев за годичный период наблюдения было сопоставимым с таковым в группе активного лечения (12) и плацебо (14). Безопасность внутривенной терапии Феринжектом оказалась весьма высокой, о чем свидетельствовало практически одинаковое количество задокументированных побочных явлений за период наблюдения в группах активного препарата и плацебо.
Интерпретация результатов исследования CONFIRM-HF, включившего пациентов с железодефицитом независимо от наличия у них анемии, выходит за рамки настоящей публикации, поскольку касается более широкой, нежели лечение анемии при ХСН, и исключительно интересной проблемы, а именно – железодефицита как такового у данной категории пациентов. Так или иначе, на сегодняшний день получены серьезные доказательства высокой клинической эффективности карбоксимальтозы железа как наиболее современной внутривенной формы Fe при ХСН.
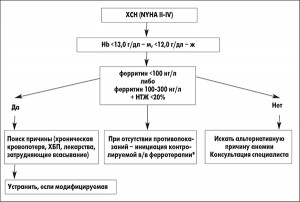 Рис. 2. Схема лечебной тактики при анемии у пациента с ХСН Примечания: м – мужчины, ж – женщины; НТЖ – насыщение трансферрина железом; ХБП – хроническая болезнь почек; *карбоксимальтозат либо сахарат Fe.
Рис. 2. Схема лечебной тактики при анемии у пациента с ХСН Примечания: м – мужчины, ж – женщины; НТЖ – насыщение трансферрина железом; ХБП – хроническая болезнь почек; *карбоксимальтозат либо сахарат Fe.В свете вышеизложенного может быть рекомендован представленный на рисунке 2 алгоритм коррекции анемии, сопряженной с абсолютным либо функциональным железодефицитом у пациентов с ХСН.
В заключение следует еще раз подчеркнуть, что для анемии при ХСН характерно многообразие механизмов, которые, по всей видимости, могут параллельно участвовать в ее формировании. Концепция АХЗ как едва ли не самого актуального механизма развития анемии при ХСН хорошо обоснована и выглядит привлекательно, однако оставляет открытым вопрос о том, почему у значительной части пациентов с клинически выраженной, прогрессирующей ХСН уровень Hb остается нормальным вплоть до финального этапа заболевания. Предстоящие исследования должны дать ответ на этот вопрос.
Наличие при ХСН хронической анемии, сопряженной с лабораторными признаками абсолютного либо относительного железодефицита, должно рассматриваться в качестве сигнала к инициации контролируемой внутривенной ферротерапии, предпочтительно карбоксимальтозой либо сахаратом железа. Важность такой терапии определяется предоставляемыми ею возможностями существенного и стойкого улучшения самочувствия, качества жизни и клинико-функционального состояния таких пациентов.
Список литературы находится в редакции.
UA/XMP/1115/0018