21 червня, 2015
Легочная гипертензия, ассоциированная с заболеваниями левых отделов сердца: новая проблема в кардиологии
 Легочная гипертензия (ЛГ) является одной из наиболее актуальных проблем современной медицины [36]. В настоящее время ЛГ как синдром встречается при различных патологических процессах и заболеваниях. В литературе описано не менее 100 заболеваний, сопровождающихся повышением давления в легочной артерии (ЛА) [6, 10, 12].
Легочная гипертензия (ЛГ) является одной из наиболее актуальных проблем современной медицины [36]. В настоящее время ЛГ как синдром встречается при различных патологических процессах и заболеваниях. В литературе описано не менее 100 заболеваний, сопровождающихся повышением давления в легочной артерии (ЛА) [6, 10, 12].
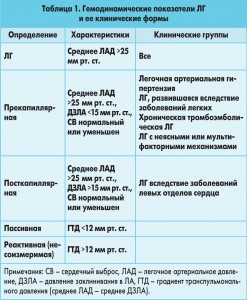
Длительное время, в зависимости от локализации повышенного сопротивления в сосудах легких, выделяли прекапиллярную и посткапиллярную формы ЛГ (табл. 1). В последние годы было обращено внимание, что как и прекапиллярная, так и посткапиллярная форма ЛГ не являются гемодинамически однородными. В большинстве случаев существует гемодинамическое соответствие между повышением давления в левом предсердии (ЛП) и давлением в «капиллярах» при низком легочно-сосудистом сопротивлении (ЛСС), однако в ряде случаев при одних и тех же клинических формах это гемодинамическое равновесие нарушается, в связи с чем возрастает ЛСС и несоизмеримо повышается давление в ЛА. Такая посткапиллярная форма ЛГ становится сходной с прекапиллярной и получила название реактивной, или несоизмеримой (табл. 1).
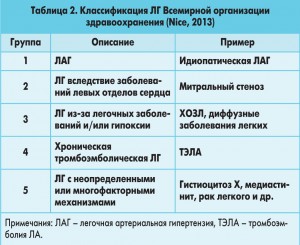
Согласно современной классификации ЛГ с учетом особенностей гемодинамики малого круга кровообращения, патогенеза и клинических проявлений выделяют 5 групп заболеваний (табл. 2).
До последнего времени эксперты и ученые наибольшее внимание уделяли ЛАГ, при которой отмечается наиболее тяжелый прогноз (1 пункт классификации). Для этих больных активно разрабатываются современные виды лечения, которые не всегда могут быть аппроксимированы на другие формы ЛГ.
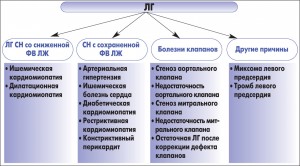
Эпидемиология и особенности лечения ЛГ, ассоциированной с заболеваниями левых отделов сердца, являются, как это ни парадоксально, менее изученніми по сравнению с более редкими формами ЛАГ, например идиопатической ЛАГ [26, 40, 47]. В то же время посткапиллярная форма ЛГ (заболевания 2 группы) является самой многочисленной и составляет 95% среди всех заболеваний, сопровождающихся ЛГ. К ним относятся заболевания, которые сопровождаются систолической и диастолической дисфункцией левого желудочка (ЛЖ), заболевания клапанов (митрального и аортального), врожденная и приобретенная обструкция притока/оттока и врожденная кардиомиопатия (табл. 3). Внимание к этой группе ЛГ в последнее время значительно возрастает в связи с тем, что такие больные относятся к одной из наиболее многочисленных групп, и поэтому более глубокое понимание причин развития ЛГ при этой патологии будет способствовать уменьшению заболеваемости и смертности среди них, так как даст возможность дифференцированно подходить к их лечению [15, 19, 26].
Частота ЛГ (систолическое АД в ЛА – СДЛА - >35 мм рт. ст.), связанной с заболеваниями левых отделов сердца, представляется следующим образом: больные с сердечной недостаточностью (СН) составляют 79%, при этом у лиц с сохраненной фракцией выброса (ФВ) она наблюдается в 50-80% случаев, у лиц с артериальной гипертензией – в 83% случаев; у пациентов с СН со сниженной ФВ – в 16-63% случаев; у больных с заболеваниями митрального клапана – в 73% случаев, при аортальном стенозе – в 30-55% случаев [27, 31, 37] (рис. 1).
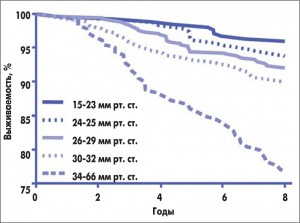
Следует обратить внимание на значение ЛГ для выживаемости этой категории больных (рис. 2). У пациентов с СДЛА в пределах 34-66 мм рт. ст. отчетливо снижается продолжительность жизни по сравнению с аналогичными больными с нормальным СДЛА.
К истории вопроса
В 1909 г. Posselt при морфологическом исследовании сосудов легких при митральном стенозе (МС) в 40% случаев обнаруживал атеросклероз артериальных ветвей ЛА, что было объяснено ЛГ. Анатомически эти изменения выражались в диффузном утолщении интимы, гипертрофии медиа [4, 18]. В своем исследовании Wood (1958) обратил внимание на особенности повышения давления в системе ЛА при МС [50]. Ученый уже тогда выделял пассивную и активную ЛГ. По его данным, при пассивной форме ЛСС остается нормальным, и давление в ЛА повышается соответственно давлению в левом предсердии (ЛП). Активная форма характеризуется повышением ЛСС. При этом давление в ЛА увеличивается несоизмеримо с давлением в ЛП. Активная ЛГ, по данным Wood (1958), наблюдается у 28% больных с МС. В обследованной этим ученым группе пациентов с МС при увеличении СДЛА >100 мм рт. ст., как правило, обнаруживалось повышение ЛСС. При повышении давления в ЛА до 60 мм рт. ст. увеличение ЛСС обнаруживалось в исключительных случаях. Уже в то время было доказано, что разница между средним давлением в ЛА и средним давлением в «легочных капиллярах» >25 мм рт. ст. свидетельствует, по данным его исследования, о повышенном ЛСС. При значительном же увеличении ЛСС эта разница давления составляла >30 мм рт. ст. (до 70 мм рт. ст.) [6]. Между давлением крови в ЛП и ЛСС была обнаружена взаимосвязь – в тех случаях, когда обнаруживалось значительно повышенное ЛСС, в ЛП регистрировалось более низкое давление.
В качестве патогенеза ЛГ при МС Ф. Китаев еще в 1931 г. предположил рефлекторный характер происхождения ЛГ при МС, который был подтвержден экспериментально – при повышении давления в ЛП происходит увеличение ЛСС, что рассматривалось как приспособительная реакция, предотвращающая повышение давления в легочных капиллярах и развитие отека легких [1]. Однако в дальнейшем та же реакция становится стойкой, достигает чрезвычайной степени и приводит к недостаточности правого желудочка. Такой механизм развития ЛГ при МС поддерживался клиницистами [3, 8, 9]. Имеется значительное количество сообщений, которые указывают на то, что хирургическая коррекция МС (митральная комиссуротомия, баллонная дилатация, протезирование) в ряде случаев не приводит к нормализации или существенному снижению давления в ЛА, что может объясняться развитием у этих лиц ЛГ со стойким повышением ЛСС [16, 21, 22, 49]. Так, по данным Национального института сердечно-сосудистой хирургии им. Н.М. Амосова (г. Киев), СДЛА >60 мм рт. ст., которое наблюдалось у больных с МС до операции, спустя 5 лет сохранялось у 3,5% пациентов [7].
В последние годы большое внимание стали уделять не только механизму развития ЛГ при МС, но и всей группе заболеваний, поражающих левые отделы сердца. Из всех возможных причин повышения давления в ЛА одно из первых мест занимает СН – патология, медицинское и социальное значение которой трудно переоценить. СН как финальная стадия большинства заболеваний сердечно-сосудистой системы занимает ведущее место среди причин инвалидности и смертности у пациентов с кардиальной патологией [2, 11, 16]. У больных с СН существенно уменьшается продолжительность жизни, которую современные программы терапии увеличивают всего на 30-35% [2]. В то же время именно наличие ЛГ у пациентов с СН часто является основной причиной смертности. Так, при проведении исследования у 320 больных с СН со сниженной ФВ было обнаружено, что ЛСС было нормальным (до 1,5 ед. по Wood) в 28% случаев, умеренно повышенным (1,5-2,49 ед.) – в 36% случаев, значительно повышенным (2,5-3,49 ед.) – в 17% случаев и резко повышенным (более 3,5 ед.) – в 19% случаев [17]. Данные более поздних исследований [25] свидетельствуют о том, что распространенность реактивной ЛГ одинакова независимо от ФВ. В недавнем исследовании было показано, что у пациентов с СН как со сниженной ФВ, так и с сохраненной в 80-90% случаев ЛСС составляет >1,7 ед., а у более 50% оно достигает >3 ед., а ГТД – >15 мм рт. ст. Среди 388 пациентов с умеренной или тяжелой СН у 60% больных при эхокардиографическом исследовании выявили наличие ЛГ (СДЛА >39 мм рт. ст.), что было связано с худшим выживанием как при сохраненной, так и при сниженной ФВ [14, 24].
Патогенез ЛГ при СН
На сегодня не вполне ясен механизм ретроградной передачи повышенного давления при развитии выраженных застойных явлений. Предполагают, что аккумуляция жидкости в интерстициальной ткани легких вызывает сдавление мелких сосудов и мелких воздухоносных путей, что влечет за собой местную альвеолярную гипоксемию и вазоконстрикцию. К такой реакции приводит повышение давления в ЛП любого генеза – вследствие митрального стеноза, миксомы ЛП, аортальных пороков, ишемической болезни сердца и др. Выраженность ее весьма вариабельна. В ряде случаев, обычно при резком повышении давления в легочных венах (>25 мм рт. ст.), давление в ЛА возрастает в значительно большей степени, чем это требуется для поддержания легочного кровотока. На сегодняшний день патогенез избыточной формы ЛГ можно представить в виде схемы (рис. 3).
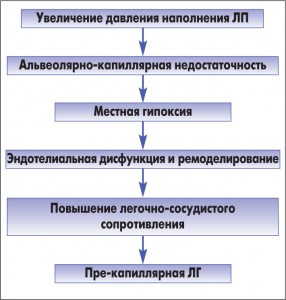
У большинства пациентов с левожелудочковой СН и реактивной легочной вазоконстрикцией может наблюдаться обратное развитие ЛГ при ликвидации основных ее причин – объемной перегрузки (вальвулопластики МС, применения диуретиков при перегрузке объемом). У остальных больных со временем могут произойти структурные изменения легочной артериальной стенки. Эти изменения аналогичны, но часто менее серьезные, чем те, которые наблюдаются при ЛАГ, и включают нарушения эластической мембраны, интимальный фиброз и медиальную гипертрофию. Плексиформную ангиопатию, характерную для идиопатической ЛАГ, не обнаруживают. Вместе с тем у этой категории больных снижается ответ на сосудорасширяющую терапию. Легочно-сосудистому ремоделированию способствует эндотелин, который ассоциируется с развитием хронической СН [23, 38], имеет значение влияние других нейрогормонов, в том числе катехоламинов, ангиотензина II, альдостерона [45]. Биологические и нейрогормональные медиаторы ЛГ могут оказывать свое действие на генетический фон, что приводит к аномальному легочному сосудистому ремоделированию [13].
У пациентов с ЛГ, связанной с заболеваниями левых отделов сердца, наличие фетальных генов в правом желудочке (ПЖ) может способствовать развитию правожелудочковой гипертрофии и последующей СН [26, 39]. Эти вопросы до конца не изучены. Необходимо продолжать исследования для определения роли модифицирующих генов и механизмов повышенной чувствительности к ЛГ на сосудистом уровне у таких пациентов [46].
Диагностика избыточной (непропорциональной) формы при СН
Клинически главной жалобой является одышка, в том числе пароксизмальная ночная, механизм которой представляется многофакторным [20, 26]. Возможны и другие жалобы, характерные для ЛАГ, – боли в области сердца, головокружение, выраженная слабость, отеки нижних конечностей и др. Из анамнеза важными являются указания на артериальную гипертензию, сахарный диабет, мерцательную аритмию, перенесенный инфаркт миокарда. Учитываются также другие факторы риска: возраст >65 лет, наличие ожирения.
При объективном обследовании, кроме наличия отеков, определяется периферический цианоз, набухание шейных вен, возможен положительный венный пульс как проявление относительной недостаточности трехстворчатого клапана. Нередко можно перкуторно определить наличие жидкости в плевральных полостях. При выслушивании сердца выявляют пресистолический или протодиастолический ритмы галопа, нередко выслушиваются шумы, чаще митральной недостаточности. При органических поражениях клапанов определяют соответствующую мелодию сердца. При выслушивании легких – влажные хрипы. Электрокардиография может выявлять гипертрофию ЛЖ, увеличение ЛП, наличие патологического зубца Q, блокады левой ножки пучка Гиса, фибрилляции предсердий.
Допплер-эхокардиография является надежным методом диагностики для скрининговых целей. Она дает возможность дифференцировать систолическую и диастолическую дисфункцию ЛЖ, увеличение ЛП, гипертрофию ЛЖ, концентрическое ремоделирование ЛЖ (относительная толщина стенки >0,45), объем ЛЖ, особенности движения межжелудочковой перегородки. У пациентов с СН и сниженной ФВ степень функциональной митральной регургитации является ключевым фактором для повышения давления в ЛА. Есть возможность измерить систолическое давление в ЛА, хотя известно о частом несовпадении результатов с данными катетеризации. Польза исследования BNP в плазме для диагностики ЛГ, ассоциированной с заболеваниями левых отделов сердца, не доказана, так как повышение значений BNP может наблюдаться при СН независимо от наличия или отсутствия ЛГ. Стандартным исследованием является инвазивное измерение легочного давления заклинивания или конечного диастолического давления ЛЖ для подтверждения диагноза ЛГ, обусловленной заболеваниями левых отделов сердца. Но для применения вазореактивного теста у этой категории больных отсутствует консенсус по стандартизированному протоколу, поэтому применяются различные средства как для группы ЛАГ: вазодилататоры, простаноиды, NO, ингибиторы фосфодиэстеразы-5. Дифференциальная диагностика проводится в первую очередь с группой 1 (ЛАГ), а также с хронической посттромбоэмболической ТЭЛА.
Возможности терапии
Большинство достижений в лечении ЛГ были сделаны для ЛАГ [12]. В то же время практически не был достигнут прогресс для гораздо более распространенных форм ЛГ, которые встречаются у больных с патологией левых отделов сердца.
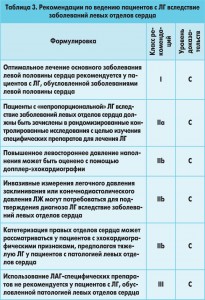
Исходя из патогенеза различных форм ЛГ при заболеваниях левых отделов сердца (пассивной, реактивной, непропорциональной), лечение должно проводиться дифференцированно. При пассивной форме ЛГ терапия основного заболевания является успешной (коррекция клапанных пороков, лечение СН). Таким образом, напрашивается вывод, что больные с непропорциональной формой ЛГ, при которой определяют повышение ЛСС, могут подлежать лечению легочными вазодилататорами. Действительно, в нескольких исследованиях изучалась роль препаратов, которые в настоящее время рекомендуются при ЛАГ. Однако многочисленные рандомизированные контролированные исследования, оценивающие влияние хронического употребления известных легочно-сосудистых дилататоров, – FIRST (эпопростанола), RITZ-1, 2, 5 (тозосентана), ENABLE, REACH-1 (бозентана), HEAT-1, EARTH-2 (дарузентана), – конечными точками которых являлись выживаемость, тест 6-минутной ходьбы, уменьшение клинических признаков СН, сердечный индекс, частота госпитализаций по поводу усиления признаков СН, общая смертность, были досрочно прекращены в связи с увеличением частоты событий в исследуемой группе, получающей препарат, по сравнению с группой традиционной терапии [20, 28, 30, 35, 41, 48]. Только 2 небольших исследования (34 и 46 больных) с применением силденафила в дозах 25-75 мг/сут показали положительный результат [29, 33, 34]. Таким образом, использование ЛАГ-специфических препаратов не рекомендуется до тех пор, пока не будут проведены долгосрочные исследования, в частности при непропорциональной ЛГ, связанной с патологией левых отделов сердца. На сегодняшний день рекомендации по диагностике и лечению отражают современный уровень знаний по этой проблеме. Рекомендации по ведению пациентов с ЛГ вследствие заболеваний левых отделов сердца обобщены в таблице 3 (ЭОК, 2013).
Выводы
1. При заболеваниях левых отделов сердца (клапанных поражениях и СН систолического и диастолического вариантов) ЛГ встречается намного чаще, чем при других формах ЛГ.
2. Необходимо различать пассивную форму ЛГ, реактивную и несоизмеримую. С этой целью определяют во время катетеризации ЛА ГТД (разницу между давлением в ЛА и давлением заклинивания ЛА).
3. От длительной терапии легочными вазодилататорами следует воздержаться в связи с необходимостью продолжения многоцентровых исследований для лечения ЛГ при заболеваниях левых отделов сердца.
Литература
1. Амосов Н.М., Бендет Я.А. Терапевтические аспекты кардиохирургии. – К.: Здоровье. – 1983. – 295 с.
2. Беленков Ю.Н., Мареев В.Ю. Принципы рационального лечения сердечной недостаточности. – М: Медиа-Медика. – 2001. – 266 с.
3. Василенко В.Х. Приобретенные пороки сердца. – К. – Здоровье. – 1972. – 304 с.
4. Есипова И.К. Гипертензия малого круга кровообращения и ее морфологическое отражение // Арх. патологии. – 1961. – № 9. – С. 3.
5. Йонаш В. Частная кардиология // Государственное издательство медицинской литературы. – Прага. – Т. 1. – 1962. – С. 871-872.
6. Коноплева Л.Ф. Легочная гипертензия // Therapia. – 2011. – № 12. – С. 15-24.
7. Коноплева Ю.Л. Эхокардиографическая оценка эффективности закрытых методов хирургического лечения митрального стеноза // Украинский ревматологический журнал. Додаток. – 2001. – С. 13-14.
8. Маколкин В.И. Приобретенные пороки сердца – М.: Медицина. – 1977. – 196 с.
9. Незлин В.Е. Ревматические пороки сердца. – М.: Медицина. – 1968. – 444 с.
10. Нефедов В.П., Цибулькин H.A. Легочная гипертензия и патология легочной артерии // Казанский медицинский журнал. – 2004. – № 4, Т. 85, С. 249-251.
11. Рекомендации Европейского общества кардиологов (ЕОК) по диагностике и лечению острой и хронической сердечной недостаточности 2012 // Российский кардиологический журнал. – 2012. – № 4 (102), Приложение. – С. 3-61.
12. ACCF/AHA 2009 Expert Consensus Document on Pulmonary Hypertension. A Report of the American College of Cardiology Foundation Task Force on Expert Consensus Documents and the American Heart Association. Developed in Collaboration With the American College of Chest Physicans American Thoracic Society, Ins., and Pulmonary Hypertension Association.
13. Archer S.L., Weir E.K., Wilkins M.R. Basic science of pulmonary arterial hypertension for clinicians: new concepts and experimental therapies // Circulation. – 2010. – 121: Р. 2045-66.
14. Aronson D., Eitan A., Dragu R., Burger A.J. The relationship between reactive pulmonary hypertension and mortality in patients with acute decompensated heart failure // Circ Heart Fail. – 2011. – 4: 644-50.
15. Borlaug B.A., Nishimura R.A., Sorajja P., Lam C.S., Redfield M.M. Exercise hemodynamics enhance diagnosis of early heart failure with preserved ejection fraction // Circ Heart Fail. – 2010. – 3. – C. 588-95.
16. Braunwald E., Braunwald N.S., Ross J.Jr., Morrow A.G. Effects of Mitral-Valve Replacement on the pulmonary vascular dynamics of patients with pulmonary hypertension // N Engl J Med. – 1965. – 3. – C. 509-14.
17. Butler J., Chomsky D.B., Wilson J.R. Pulmonary hypertension and exercise intolerance in patients with heart failure // J Am Coll Cardiol. – 1999; 34: 1802-6.
18. Ewans W., Short D.S. Pulmonary hypertension in mitral stenosis // Brit. Heart. J. – 1957. – V. 19. – P. 457.
19. Fang James C., MD, a Teresa DeMarco, MD et al. World Health Organization Pulmonary Hypertension Group.2: Pulmonary hypertension due to left heart disease in the adult – a summary statement from the Pulmonary Hypertension Council of the International Society for Heart and Lung Transplantation The Journal of Heart and Lung Transplantation. – 2012. Vol. 31, № 9. – Р. 914-932.
20. Fang M.D., Martischnig A.M., Tichy A., Nikfardian M., Heinz G., Lang I.M., Bonderman D. Inhaled ilprost for patients with precapillary pulmonary hypertension and right-side heart failure // J Cardiac Fail. – 2011; 17: 813-818.
21. Fawzy M.E., Hassan W., Stefadouros M., Moursi M., El Shaer F., Chaudhary M.A. Prevalence and fate of severe pulmonary hypertension in 559 consecutive patients with severe rheumatic mitral stenosis undergoing mitral balloon valvotomy // J Heart Valve Dis. – 2004. – 13. – C. 942-7.
22. Fawzy M.E., Hassan W., Stefadouros M., Moursi M., El Shaer F., Chaudhary M.A. Prevalence and fate of severe pulmonary hypertension in 559 consecutive patients with severe rheumatic mitral stenosis undergoing mitral balloon valvotomy // J Heart Valve Dis. – 2004.
23. Galie N., Manes A., Branzi A. Prostanoids for pulmonary arterial hypertension // Am J Respir Med. = 2003. – 2. – C. 123-37.
24. Ghio S. Pulmonary hypertension in advanced heart failure. – Herz. – 2005. – C. 30: 311.
25. Ghio S., Gavazzi A., Campana C. et al. Independent and additive prognostic value of right ventricular systolic function and pulmonary artery pressure in patients with chronic heart failure // J Am Coll Cardiol. – 2001; 37: 183-8.
26. Guazzi M., Nazzareno G. Pulmonary hypertension in left heart Disease // Eur Respir Rev. – 2012. – 21. – 126. – C. 338-346.
27. Hart S.A., Krasuski R.A., Wang A. et al. Pulmonary hypertension and elevate transpulmonary gradient in patients with mitral stenosis // J Heart Valve Dis. – 2010. – 19. – C. 708-715.
28. Kalra P.R., Moon J.C., Coats A.J. Do results of the ENABLE (Endothelin Antagonist Bosentan for Lowering Cardiac Events in Heart Failure) study spell the end for non-selective endothelin antagonism in heart failure? // Int J Cardiol. – 2002; 85: 195-197.
29. Katz S.D., Balidemaj K., Homma S., Wu H., Wang J., Maybaum S. Acute type 5 phosphodiesterase inhibition with sildenafil enhances flow-mediated vasodilation in patients with chronic heart failure // J Am Coll Cardiol. – 2000. – 36. – C. 45-51.
30. Kerbaul F., Brimioulle S., Rondelet B., Dewachter C., Hubloue I., Naeije R. How prostacyclin improves cardiac output in right heart failure in conjunction with pulmonary hypertension // Am J Respir Crit Care Med. – 2007; 175: 846-50.
31. Lam R.C.S., Borlaug B.A., Kane G.C., Enders F.T., Rodeheffer R.J., edfield MM. Age-associated increases in pulmonary artery systolic pressure in the general population // Circulation. – 2009. – 119.- C. 2663-70.
32. Levine M., Weinstein J., Diver D., Berman A.D., Wyman R.M., Cunningham M.J., Safian R.D., Grossman W., McKay R.G. Progressive improvement in pulmonary vascular resistance following percutaneous mitral valvuloplasty // Circulation. – 1989. – 79: 1061-1067.
33. Lewis G., Murphy R., Shah R. et al. Pulmonary vascular response patterns during exercise in left ventricular systolic dysfunction predict exercise capacity and outcomes // Circ Heart Fail. – 2011. – 4. – C. 276-85.
34. Lewis G.D., Shah R., Shahzad K. et al. Sildenafil improves exercise capacity and quality of life in patients with systolic heart failure and secondary pulmonary hypertension // Circulation. – 2007. – 116: 1555-62.
35. Martischnig A.M., Tichy A., Nikfardian M., Heinz G., Lang I.M., Bonderman D. Inhaled iloprost for patients with precapillary pulmonary hypertension and right-side heart failure // J Cardiac Fail. – 2011. – 17: 813-818.
36. McLaughlin V.V., Archer S.L., Badesch D.B. et al. ACCF/ANA. Circulation. – 2009. – 119 (16). – 2250-94.
37. Melby S.J., Moon M.R., Lindman B.R. et al. Impact of pulmonary hypertension on outcomes after aortic valve replacement for aortic valve stenosis // J Thorac Cardiovasc Surg. – 2011. – 141: 1424-1430.
38. Melenovsky V., Al-Hiti H., Kazdova L. et al. Transpulmonary B-type natriuretic peptide uptake and cyclic guanosine monophosphate release in heart failure and pulmonary hypertension: the effects of sildenafil // J Am Coll Cardiol. – 2009; 54: 595-600.
39. O’Connor C.M., Starling R.C., Hernandez A.F. et al. Effect of nesiritide in patients with acute decompensated heart failure // N Engl J Med. – 2011. – 365: 32-43.
40. Oudiz R.J. Pulmonary hypertension associated with left-sided heart disease // Clin Chest Med. – 2007. – 28. – C. 233-41.
41. Packer M., McMurray J., Massie B.M., Caspi A., Charlon V., Cohen-Solal A., Kiowski W., Kostuk W., Krum H., Levine B., Rizzon P., Soler J., Swedberg K., Anderson S., Demets D.L. Clinical effects of endothelinreceptor antagonism with bosentan in patients with severe chronic heartfailure: results of a pilot study // J Card Fail. – 2005. – 11: Р. 12-20.
42. Palmer S.M., Robinson L.J., Wang A., Gossage J.R., Bashore T., Tapson V.F. Massive pulmonary edema and death after prostacyclin infusion in a patient with pulmonary veno-occlusive disease // Chest. – 1998. – 113. – Р. 237-40.
43. Pietra G.G., Capron F., Stewart S. et al. Pathologic assessment of vasculopathies in pulmonary hypertension // J Am Coll Cardiol. – 2004. – 43: Р. 25-32.
44. Schwammenthal E., Vered Z., Agranat O., Kaplinsky E., Rabinowitz B., Feinberg M.S. Impact of atrioventricular compliance on pulmonary artery pressure in mitral stenosis: an exercise echocardiographic study // Circulation. – 2000. – 102. – 2378-84.
45. Sun Y., Ramires F.J., Weber K.T. Fibrosis of atria and great vessels in response to angiotensin II or aldosterone infusion // Cardiovasc Res. – 1997. – 35. – 138-47.
46. Townsley M.I., Fu Z., Mathieu-Costello O., West J.B. Pulmonary microvascular permeability. Responses to high vascular pressure after induction of pacing-induced heart failure in dogs // Circ Res. – 1995. – 77: 317-32547.
47. Vamamoto K., Masuyama T., Sakata Y. et al. Roles of renin angiotensin and endothelin systems in development of diastolic heart failure in hypertensive hearts // Cardiovasc. Res. – 2000. – 47. – C. 274-83.
48. Yui Y., Nakajima H., Kawai C., Murakami T. Prostacyclin therapy inpatients with congestive heart failure // Am J Cardiol. – 1982. – 50: 320-324.
49. Zener J.C., Hancock E.W., Shumway N.E., Harrison D.C. Regression of extreme pulmonary hypertension after mitral valve surgery // Am J Cardiol. – 1972; 30: 820-826.
50. Wood P. Pulmonary hypertension // Mod. Conc. Cardiov. Dis. – 1959. – V. 28. – P. 513.