2 липня, 2020
Дослідження «ПАРТНЕР»: оцінка серцево-судинного ризику в українського контингенту хворих на остеоартроз
 За оцінками експертів, на остеоартроз (ОА) у всьому світі хворіє близько 240 млн осіб, серед них приблизно 10% чоловіків та 18% жінок віком понад 60 років. Поширеність ОА вища серед жінок, ніж серед чоловіків, зростає з віком (тенденція наявна до досягнення 70-річного віку). Поширеність ОА зростає з віком так само, як і поширеність багатьох інших хронічних патологій, зокрема хвороб серцево-судинної системи. В Україні, згідно з даними офіційної статистики, на обліку в ревматологів зареєстровано близько 1 млн пацієнтів з ОА.
За оцінками експертів, на остеоартроз (ОА) у всьому світі хворіє близько 240 млн осіб, серед них приблизно 10% чоловіків та 18% жінок віком понад 60 років. Поширеність ОА вища серед жінок, ніж серед чоловіків, зростає з віком (тенденція наявна до досягнення 70-річного віку). Поширеність ОА зростає з віком так само, як і поширеність багатьох інших хронічних патологій, зокрема хвороб серцево-судинної системи. В Україні, згідно з даними офіційної статистики, на обліку в ревматологів зареєстровано близько 1 млн пацієнтів з ОА.
Асоціація між ОА та розвитком серцево‑судинних захворювань
У дослідженні італійських учених показано, що серед пацієнтів із серцево-судинними захворюваннями приблизно у ⅔ діагностовано ОА [8]. При цьому частота серйозних кардіоваскулярних подій протягом дослідження була вищою в осіб з ОА порівняно з пацієнтами без нього (48 та 41% відповідно, відносний ризик (ВР) 1,22; 95% довірчий інтервал (ДІ) 1,02-1,49). Така асоціація спостерігалася у хворих на ОА кульшового та колінного суглобів, але була відсутньою за наявності ОА суглобів кисті. Крім того, асоціація була вираженішою для ОА із залученням багатьох суглобів та для жінок. 
! У масштабному метааналізі, який включав результати 15 досліджень та об’єднував дані майже 360 тис. учасників, у тому числі понад 80 тис. пацієнтів з ОА та майже 30 тис. із серцево-судинними захворюваннями, встановлено, що ризик розвитку серцево-судинної патології на 24% (ВР 1,24; 95% ДІ 1,12-1,37) вищий серед пацієнтів з ОА порівняно із загальною популяцією [9].
Ще один систематичний огляд і метааналіз (15 досліджень, понад 32 млн учасників) показав, що поширеність кардіоваскулярної патології серед пацієнтів з ОА становить 38,4% [10]. Пацієнти з ОА майже втричі (ВР 2,80; 95% ДІ 2,25-3,49) частіше мали серцеву недостатність та майже удвічі (ВР 1,78; 95% ДІ 1,18-2,69) частіше у них розвивалася ішемічна хвороба серця (ІХС) порівняно з особами, які не мали ОА. Не виявлено статистично достовірної різниці між групами з ОА та без ОА щодо ризику розвитку інфаркту міокарда чи інсульту.
В іншому дослідженні, що включало пацієнтів з ОА та велику групу контролю без ОА, протягом 8 років спостереження кількість випадків гострих коронарних подій на 1 тис. осіб становила 5,4 у групі ОА та 4,3 у групі без ОА (ВР 1,15; 95% ДІ 1,08-1,23) [11]. Нетрадиційний підхід було застосовано в одному з недавніх досліджень, у якому вчені рандомізували пацієнтів (усі жіночої статі) на чотири групи: 1) без рентгенологічно підтвердженого OA та без болю; 2) за наявності лише больового синдрому; 3) за наявності лише рентгенологічно підтвердженого OA; 4) за наявності болю та рентгенологічно підтвердженого OA; окремо для ОА суглобів кисті (n=808) та ОА колінного суглоба (n=821) [12]. Відповідно до отриманих результатів, рентгенологічно підтверджений ОА та біль у коліні асоціюються з удвічі вищим ризиком смерті від усіх причин та в 4 (!) рази – ризиком смерті внаслідок кардіоваскулярних подій порівняно з групою осіб без рентгенологічно підтвердженого OA та без болю. Біль у колінному суглобі без рентгенологічно підтвердженого ОА також підвищує ризик смерті внаслідок кардіоваскулярних подій у 3 рази порівняно із групою осіб без рентгенологічно підтвердженого OA та без болю.
! Отже, результати досліджень останніх років переконливо демонструють взаємозв’язок між наявністю ОА, насамперед колінних і кульшових суглобів, та підвищеним ризиком розвитку і поширеністю захворювань серцево-судинної системи, у тому числі гострих коронарних подій та смерті внаслідок кардіоваскулярних захворювань.
Інший бік проблеми – можливий негативний вплив лікарських засобів, що застосовуються в лікуванні ОА, на перебіг серцево-судинних захворювань, зокрема на розвиток гострих кардіоваскулярних подій та серцево-судинну смертність. Ця проблема вже більше двох десятиліть (із часу оприлюднення результатів досліджень, у яких було виявлено зростання частоти гострих коронарних подій та інсульту на тлі лікування рофекоксибом) перебуває в центрі уваги вчених і практичних лікарів.
НПЗП – облігатний клас лікарських засобів у менеджменті пацієнтів з ОА
Нестероїдні протизапальні препарати (НПЗП) посідають важливе місце серед лікарських засобів, що застосовуються у терапії ОА. Велика кількість рандомізованих контрольованих досліджень і відповідний метааналіз підтверджують здатність НПЗП значно зменшувати вираженість болю і пов’язані з ним функціональні порушення, які виникають при ОА [13]. Цей ефект зберігається на тлі тривалого (багатомісячного) застосування НПЗП. За даними кількох рандомізованих контрольованих досліджень, регулярний прийом НПЗП запобігає розвитку рецидивів ОА [14, 15]. Відповідно до нових рекомендацій щодо ведення пацієнтів з ОА колінного суглоба, розроблених міжнародною групою експертів ESCEO, НПЗП слід використовувати при неефективності парацетамолу і повільно діючих протизапальних засобів переривчасто або постійно тривалими курсами [16]. Однак застосування НПЗП може бути пов’язане із розвитком низки побічних реакцій з боку шлунково-кишкового тракту (ШКТ), серцево-судинної системи і нирок, що може нести загрозу здоров’ю та життю пацієнтів, особливо людей похилого віку із серйозними супутніми патологіями, обмежуючи застосування цього класу препаратів та знижуючи їхній терапевтичний потенціал [17]. Це визначає необхідність ретельного аналізу факторів ризику розвитку побічних реакцій та індивідуального підходу при виборі НПЗП з урахуванням особливостей пацієнта та клінічної ситуації [18].
Механізм кардіоваскулярної токсичності НПЗП
Механізм дії НПЗП пов’язаний із блокадою ферменту циклооксигенази (ЦОГ)-2 та інгібуванням продукції синтезу простагландину (ПГ) Е2, який є одним із головних медіаторів, що спричиняють сенситизацію периферичних больових рецепторів і центральних структур ноцицептивної системи. Крім цього, НПЗП виявляють значний вплив на розвиток запальної реакції, знижуючи експресію гена ЦОГ‑2 й опосередковано впливаючи на експресію генів низки інтерлейкінів (ІЛ) – ІЛ‑1, ІЛ‑6, фактора некрозу пухлини α, синтез факторів росту, активацію клітин макрофагального ряду, в тому числі остеокластів. НПЗП зумовлюють локальну і системну протизапальну дію, уповільнюючи неоангіогенез, розвиток гетеротопічної осифікації та зростання остеофітів – процеси, що призводять до незворотних змін у структурі суглобів і хребта [19].
Застосування неселективних НПЗП обмежене розвитком побічних реакцій, пов’язаних із інгібуванням ЦОГ‑1, а саме ускладнень з боку ШКТ, як-от утворення виразок та розвиток кровотеч [18]. Однак селективні НПЗП, що суттєво не впливають на роботу ЦОГ‑1 та мають значно нижчий ризик ускладнень з боку ШКТ, характеризуються підвищеною, порівняно із неселективними НПЗП, кардіоваскулярною токсичністю, оскільки порушують баланс продукції простациклінів і тромбоксанів у клітинах серцево-судинної системи.
Коксиби пригнічують утворення ПГІ2 – простацикліну, який продукується ЦОГ‑2 в ендотелії та інгібує агрегацію тромбоцитів, зумовлює розширення судин і запобігає проліферації клітин непосмугованих м’язів судин in vitro [20, 21]. При цьому вони не впливають на синтез тромбоксану A2 (TXA2), основного продукту ЦОГ‑1 у тромбоцитах, що спричиняє агрегацію тромбоцитів, звуження судин і проліферацію судин, таким чином порушуючи баланс цих сигнальних молекул. Тому коксиби підвищують ризик розвитку тромботичних явищ, зумовлюючи, зокрема, розвиток інсультів та інфарктів. Крім того, показано, що коксиби підвищують ризик розвитку інших захворювань серцево-судинної системи [22]. Водночас неселективні НПЗП інгібують продукцію і TXA2, і простацикліну, тому характеризуються нижчим ризиком кардіоваскулярних ускладнень.
Роль селективних інгібіторів ЦОГ-2 у розвитку атеротромботичних подій чи погіршенні проявів серцево-судинних захворювань дотепер залишається недостатньо вивченою. У ході клінічних досліджень виявлено, що селективні інгібітори ЦОГ‑2 можуть спричиняти розвиток артеріальної гіпертензії або погіршувати перебіг наявної серцево-судинної патології приблизно з такою ж частотою, як і неселективні препарати [23]. Інгібітори ЦОГ‑2 можуть провокувати розвиток ендотеліальної дисфункції, яка є одним із сурогатних маркерів ішемії серця [24]. Деякі автори вважають, що такі впливи можуть призвести до абсолютного збільшення кількості побічних явищ з боку серцево-судинної системи [25]. Ці ефекти набувають особливого значення як фактори ризику у хворих на ОА, оскільки у них і без того підвищена частота розвитку ІХС та серцевої недостатності [10].
Ще одним механізмом негативної дії НПЗП на серцево-судинну систему є прямий токсичний вплив деяких НПЗП на серце шляхом активації продукції реактивних форм кисню мітохондріями [26, 27]. Це може бути причиною підвищення ризику розвитку інфаркту міокарда при застосуванні низки селективних та неселективних НПЗП, що підвищується зі зростанням дози і тривалості застосування [28].
Крім того, інгібітори ЦОГ можуть негативно впливати на продукцію простагландинів, які відіграють важливу роль у підтриманні ниркового кровотоку, що може мати особливо негативне значення для пацієнтів із порушеною функцією нирок [29]. Інгібування ЦОГ‑2-залежної продукції ПГЕ2 нирками може призводити до ниркової недостатності, затримки рідини та, як наслідок, до розвитку артеріальної гіпертензії [27].
! Вищенаведені механізми зумовлюють формування кардіоваскулярної токсичності як селективних, так і неселективних НПЗП.
Так, відповідно до результатів метааналізу, найвищий кардіоваскулярний ризик мають еторикоксиб, етодолак, рофекоксиб, після них у порядку спадання серцево-судинної токсичності – диклофенак, індометацин, мелоксикам, ібупрофен, целекоксиб та ін. [30]. Утім, слід зазначити, що ранжування НПЗП за кардіоваскулярною токсичністю виглядає по-різному в публікаціях різних років і авторів, що, вочевидь, пов’язано з відмінностями в методології досліджень, контингенті хворих, частоті та режимі застосування різних НПЗП, коморбідності тощо. Однак найчастіше серед препаратів високого ризику фігурують коксиби, диклофенак, а найбезпечнішим у цьому сенсі виглядає напроксен.
! Підвищена частота серцево-судинних захворювань та смертності від них у хворих на ОА і здатність багатьох НПЗП – препаратів першого ряду в лікуванні ОА провокувати розвиток атеротромботичних та інших гострих серцево-судинних подій – зумовлюють клінічну актуальність оцінки серцево-судинного ризику у хворих на ОА та вибору найбезпечніших у плані кардіоваскулярних побічних ефектів НПЗП.
При цьому слід зазначити, що якщо стосовно пов’язаних із механізмом дії побічних ефектів НПЗП немає підстав очікувати на національну чи регіональну специфіку, то ступінь кардіоваскулярного ризику суттєво залежить від економічних, медичних і соціокультурних особливостей певного регіону. Нам не вдалося виявити дослідження, в яких би вивчалася поширеність кардіоваскулярного ризику в українських хворих на ОА, що й стало мотивацією для проведення відповідного загальнонаціонального дослідження.
Дослідження «ПАРТНЕР»
Із серпня 2019 р. по березень 2020 р. в Україні проведено багатоцентрове дослідження з вивчення поширеності кардіоваскулярного ризику у хворих на ОА – дослідження «ПАРТНЕР» (поширеність кардіоваскулярного ризику при вперше діагностованому первинному остеоартрозі). Дослідниками були 54 лікарі медичних закладів із 22 областей України. Критеріями включення пацієнтів були вперше діагностований та підтверджений рентгенологічно первинний ОА будь-якої локалізації відповідно до класифікаційних критеріїв R. Altman і співавт. (1986), вік пацієнтів понад 18 років, відомий рівень загального холестерину крові, креатиніну та систолічного артеріального тиску. Під час візиту до лікаря було проведено анкетування хворих за стандартизованою анкетою, яка включала запитання щодо віку, статі, локалізації ОА, вираженості пов’язаного з фізичною активністю болю в суглобах за цифровою рейтинговою шкалою (NRS), потреби в знеболювальній терапії, наявності серцево-судинних захворювань атеросклеротичного генезу, включаючи ІХС, цукрового діабету, хронічної хвороби нирок, рівня загального холестерину крові, артеріального тиску, статусу куріння (на поточний час чи в минулому). До розгляду приймалися тільки повністю заповнені анкети. В осіб віком ≥40 років, за винятком пацієнтів із наявними атеросклеротичними серцево-судинними захворюваннями, цукровим діабетом, хронічною хворобою нирок, дуже високим рівнем загального холестерину (>8,0 ммоль/л) та/або артеріального тиску (>180/110 мм рт. ст.), було оцінено ризик смерті від серцево-судинних захворювань протягом найближчих 10 років за шкалою SCORE. Результати наведено в абсолютних числах та відсотках.
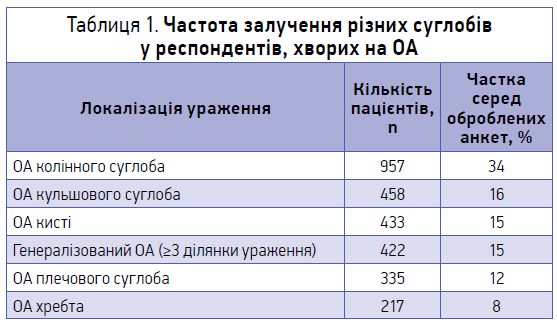 Загалом від лікарів медичних центрів 22 областей України надійшло 4769 анкет пацієнтів, з яких 3936 були заповнені повністю та коректно і включені в розробку, 833 анкети було відхилено через неповноту інформації та/або помилки у заповненні. Найбільше хворих було включено в дослідження з Дніпропетровської, Київської, Харківської, Львівської та Полтавської областей (від 682 до 290). Серед респондентів було 2595 (65,9%) осіб жіночої і 1341 – чоловічої статі. У віковій категорії від 50 до 59 років було найбільше – 50% (1989) – хворих, до 49 років – 20% (774), від 60 до 64-19% (758), найменше – 11% (415) – було осіб віком ≥65 років. Загалом в анкетах лікарями було зазначено 66 варіантів локалізації вперше діагностованого ОА. Найчастіше залучалися колінний (34%), кульшовий суглоби (16%) та суглоби кистей (15%), 15% хворих мали генералізований ОА із залученням ≥3 суглобових зон (табл. 1).
Загалом від лікарів медичних центрів 22 областей України надійшло 4769 анкет пацієнтів, з яких 3936 були заповнені повністю та коректно і включені в розробку, 833 анкети було відхилено через неповноту інформації та/або помилки у заповненні. Найбільше хворих було включено в дослідження з Дніпропетровської, Київської, Харківської, Львівської та Полтавської областей (від 682 до 290). Серед респондентів було 2595 (65,9%) осіб жіночої і 1341 – чоловічої статі. У віковій категорії від 50 до 59 років було найбільше – 50% (1989) – хворих, до 49 років – 20% (774), від 60 до 64-19% (758), найменше – 11% (415) – було осіб віком ≥65 років. Загалом в анкетах лікарями було зазначено 66 варіантів локалізації вперше діагностованого ОА. Найчастіше залучалися колінний (34%), кульшовий суглоби (16%) та суглоби кистей (15%), 15% хворих мали генералізований ОА із залученням ≥3 суглобових зон (табл. 1).
Найбільша кількість пацієнтів (приблизно 77%) повідомляли про біль середнього ступеня вираженості, оціненого у 4-7 балів. При цьому майже всі хворі (97%), на узгоджену думку лікаря та пацієнта, потребували призначення знеболювальних препаратів.
Згідно з наведеними в анкетах результатами, патологія серцево-судинної системи, в основі якої лежить атеросклероз судин (у тому числі ІХС), виявлена у 55% (2162) пацієнтів з уперше діагностованим ОА. Варто зазначити, що цей показник в українських реаліях може не зовсім точно відображати справжню частоту серцево-судинних захворювань атеросклеротичного генезу внаслідок як її завищення, так і заниження, наприклад, в результаті недостатньо широкого застосування методів візуалізації для виявлення аневризми аорти, атеросклеротичних бляшок, у тому числі в периферичних артеріях.
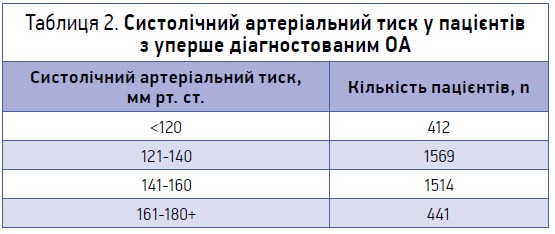 Артеріальну гіпертензію (систолічний тиск >140 мм рт. ст.) мали 50% пацієнтів з уперше діагностованим ОА (табл. 2). Ще в 40% визначалися неоптимальні величини систолічного артеріального тиску (>120 мм рт. ст.), які для певних категорій осіб (наприклад, із цукровим діабетом) можуть розглядатися як патологічні, і лише у 10% пацієнтів він був у межах норми. При цьому в 15% опитаних хворих була артеріальна гіпертензія 3 ступеня (>180/110 мм рт. ст.).
Артеріальну гіпертензію (систолічний тиск >140 мм рт. ст.) мали 50% пацієнтів з уперше діагностованим ОА (табл. 2). Ще в 40% визначалися неоптимальні величини систолічного артеріального тиску (>120 мм рт. ст.), які для певних категорій осіб (наприклад, із цукровим діабетом) можуть розглядатися як патологічні, і лише у 10% пацієнтів він був у межах норми. При цьому в 15% опитаних хворих була артеріальна гіпертензія 3 ступеня (>180/110 мм рт. ст.).
Цукровий діабет 1 чи 2 типу з ураженням органів-мішеней мали 808 (21%) проанкетованих хворих, помірну чи тяжку хронічну хворобу нирок (швидкість клубочкової фільтрації <60 мл/хв/1,73 м2) – 178 (5%) учасників дослідження.
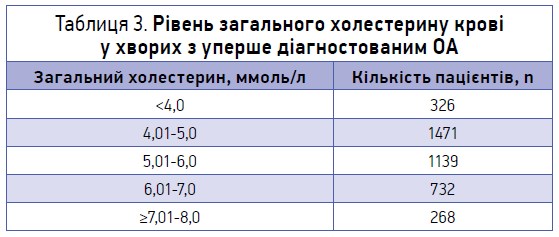 У ході опитування також було зібрано й іншу медичну інформацію, необхідну для розрахунку ризику розвитку серцево-судинних захворювань. Так, куріння на поточний час чи в минулому визнали 1093 (28%) опитані. Розподіл пацієнтів за рівнем загального холестерину сироватки крові наведено в таблиці 3. Як видно, рівень холестерину <5 ммоль/л мали лише 45% проанкетованих хворих. У 7% пацієнтів реєструвалися значно підвищені (>7 ммоль/л) рівні загального холестерину.
У ході опитування також було зібрано й іншу медичну інформацію, необхідну для розрахунку ризику розвитку серцево-судинних захворювань. Так, куріння на поточний час чи в минулому визнали 1093 (28%) опитані. Розподіл пацієнтів за рівнем загального холестерину сироватки крові наведено в таблиці 3. Як видно, рівень холестерину <5 ммоль/л мали лише 45% проанкетованих хворих. У 7% пацієнтів реєструвалися значно підвищені (>7 ммоль/л) рівні загального холестерину.
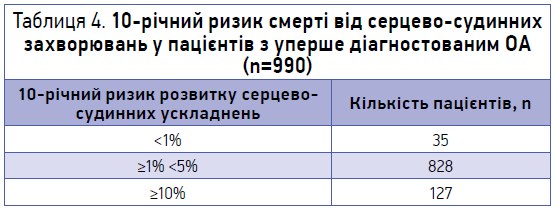 Базуючись на отриманих у ході анкетування даних, було розраховано 10-річний ризик смерті від серцево-судинних захворювань за методикою SCORE у 990 пацієнтів, для яких цю методику може бути застосовано (особи без явних серцево-судинних захворювань, цукрового діабету, хронічних захворювань нирок або значного підвищення рівня одиночного фактора ризику). Виявилося, що серцево-судинний ризик становив ≥10% (дуже високий) для 13% опитаних пацієнтів цієї категорії, від ≥1% до <5% (помірний) – ще для 84% хворих, і лише для 3% він був низьким (табл. 4).
Базуючись на отриманих у ході анкетування даних, було розраховано 10-річний ризик смерті від серцево-судинних захворювань за методикою SCORE у 990 пацієнтів, для яких цю методику може бути застосовано (особи без явних серцево-судинних захворювань, цукрового діабету, хронічних захворювань нирок або значного підвищення рівня одиночного фактора ризику). Виявилося, що серцево-судинний ризик становив ≥10% (дуже високий) для 13% опитаних пацієнтів цієї категорії, від ≥1% до <5% (помірний) – ще для 84% хворих, і лише для 3% він був низьким (табл. 4).
! Відповідно до результатів нашого дослідження, пацієнти з уперше діагностованим первинним ОА в Україні значно частіше мають супутню кардіоваскулярну патологію порівняно із зарубіжними даними.
Значну кількість хворих (2946 (75%)), навіть без розрахунку SCORE, слід віднести до категорії осіб з високим і дуже високим ризиком розвитку серцево-судинних ускладнень, оскільки вони вже мають серцево-судинні захворювання атеросклеротичного генезу (55%), цукровий діабет (21%), дуже високий рівень артеріального тиску (15%) та/або загального холестерину і хронічну хворобу нирок (5%).
Згідно з результатами розрахунку SCORE, до категорії осіб з дуже високим кардіоваскулярним ризиком належать ще 127 пацієнтів, тобто загальна кількість хворих на ОА з високим і дуже високим кардіоваскулярним ризиком сягає 3073, що становить 78% загальної кількості проанкетованих осіб з первинним ОА. Ці особливості необхідно враховувати при призначенні лікування хворим на ОА.
! Отже, поширеність серцево-судинних захворювань в Україні та світі в цілому суттєво вища серед пацієнтів з ОА порівняно із загальною популяцією, крім того, висока поширеність кардіоваскулярної патології призводить до підвищення смертності серед хворих на ОА.
Хоча патофізіологічні взаємозв’язки між ОА та розвитком серцево-судинних захворювань потребують подальшого вивчення, наявність такої асоціації має бути врахована в ході вибору схем лікування пацієнтів з ОА. Зокрема, при призначенні терапії пацієнтам з ОА слід віддавати перевагу препаратам зі сприятливим кардіоваскулярним профілем безпеки.
Можливості профілактики НПЗП‑індукованих кардіоваскулярних подій у хворих на ОА
Головним методом профілактики НПЗП-індукованих ускладнень є застосування безпечніших представників цього терапевтичного класу. Як зазначалося вище, в контексті атеротромботичних кардіоваскулярних ускладнень безпечнішим порівняно з іншими НПЗП вважається напроксен. Однак цьому препарату притаманний один з найгірших профілів гастроінтестинальної безпеки [2, 16, 18], що вимагає обов’язкового додаткового призначення інгібіторів протонної помпи. Це, своєю чергою, підвищує вартість лікування та знижує комплаєнтність. З урахуванням цих реалій значний клінічний інтерес становить такий НПЗП, як амтолметин гуацил.
Амтолметин гуацил (2-метоксифеніл‑1-метил‑5-п-метилбензоїл-пірол‑2-ацетамід ацетат) впливає як на ЦОГ‑1, так і на ЦОГ‑2; співвідношення селективності ЦОГ‑2/ЦОГ‑1 становить 4,4 [22, 31]. Амтолметин гуацил зменшує проникність капілярів; стабілізує лізосомальні мембрани; гальмує синтез або інактивує медіатори запалення (ПГ, гістамін, брадикініни, цитокіни, фактори комплементу). Він блокує взаємодію брадикініну із тканинними рецепторами, відновлює порушену мікроциркуляцію і знижує больову чутливість у вогнищі запалення. Препарат впливає на таламічні центри больової чутливості; знижує концентрацію біогенних амінів, що володіють альгогенними властивостями; підвищує поріг больової чутливості рецепторного апарату. Завдяки цьому механізму дії амтолметин гуацил усуває або знижує інтенсивність больового синдрому, зменшує ранкову скутість та набряки, збільшує амплітуду рухів в уражених суглобах уже через 4 дні лікування [32].
Амтолметин гуацил має виражену протизапальну дію, подібну до ЦОГ‑2-селективних НПЗП, однак він переноситься набагато краще з нижчою частотою ускладнень. Препарат створювався як гастропротекторний НПЗП, утім, застосовані при його розробленні підходи дозволили створити препарат не лише із хорошою переносимістю з боку ШКТ, а й зі сприятливими властивостями щодо серцево-судинної системи та загалом із хорошим профілем безпеки.
! Результати фармакологічних досліджень, проведених на різних експериментальних моделях, свідчать, що амтолметин гуацил не лише не виявляє шкідливого впливу на слизову оболонку шлунка, а й чинить захисний ефект щодо неї [33], а також щодо слизової оболонки кишечнику [34].
У метааналізі 18 рандомізованих клінічних досліджень, у яких взяли участь 780 пацієнтів і які тривали 1-6 міс, показано, що знеболювальний, протизапальний та жарознижувальний ефекти амтолметину гуацилу зіставні з такими піроксикаму, диклофенаку, толметину, напроксену, індометацину, флурбіпрофену, ібупрофену, дифлунізалу [32, 38]. У ході цього метааналізу також проведено ґрунтовне вивчення безпеки амтолметину гуацилу порівняно з такими широко застосовуваними традиційними НПЗП, як диклофенак, толметин, піроксикам, індометацин [38]. Відповідно до отриманих результатів, ризик розвитку будь-яких побічних реакцій при прийомі амтолметину гуацилу був значно нижчим порівняно із традиційними НПЗП – ВР становив 0,2 (0,1-0,3).
У відкритому обсерваційному дослідженні АГАТА було встановлено, що амтолметин гуацил має сильніший анальгезивний ефект, підтверджений зменшенням вираженості болю (≥40%) у 72,5% пацієнтів [17]. Інтенсивність болю за візуальною аналоговою шкалою (ВАШ) знизилася із 65 мм на першому візиті до 27 мм на останньому. Причому значне зменшення було відзначене вже через 14 днів після початку прийому амтолметину гуацилу.
! Відзначено статистично достовірне зменшення вираженості болю, скутості, функціональних обмежень і сумарного показника за індексом WOMAC. Після 14 днів прийому переносимість амтолметину гуацилу 26% пацієнтів оцінили як «відмінну», 57% – як «хорошу», 13% – як «задовільну» і тільки 3% – як «погану».
При цьому після завершення дослідження оцінка переносимості лікування амтолметином гуацилом була тільки позитивною: «відмінна» – 33%, «хороша» – 56% і «задовільна» – 11% пацієнтів.
Щодо ризику розвитку тромботичних явищ, то, на противагу іншим НПЗП, амтолметин гуацил володіє вираженою антитромбоцитарною активністю in vitro й ex vivo [33, 42]. Відповідно до результатів досліджень, амтолметин гуацил має високу антиагрегаційну активність, що опосередковується інгібуванням синтезу тромбоксану. Антиагрегаційна активність амтолметину гуацилу in vitro перевершує таку для ацетилсаліцилової кислоти або толметину.
Автори дослідження КОРОНА вивчали ефективність і профіль кардіоваскулярної безпеки амтолметину гуацилу в пацієнтів із болем, зумовленим ревматологічною патологією [43]. У дослідженні брали участь 48 пацієнтів (середній вік – 38,2±7,2 року), яких розподілили на дві групи: 1-ша група – пацієнти з артеріальною гіпертензією, контрольованою амлодипіном, 2-га група – пацієнти без артеріальної гіпертензії. Усі учасники отримували амтолметину гуацил в дозі 1800 мг/добу протягом 14 днів, у наступні 16 днів – у дозі 600 мг/добу (деескалаційна схема терапії). Через 2 тиж вираженість болю у нижній ділянці спини в обох групах зменшилася з 5,7±2,2 до 3,2±1,1 см за ВАШ, через 4 тиж ступінь болю становив 3,3±0,76 см.
! Кардіоваскулярні події як при застосуванні амтолметину гуацилу у високих дозах, так і при підтримувальних дозах протягом 30 діб не зафіксовані.
Метою дослідження АВРОРА було оцінити профіль безпеки гуацилу при довготривалому застосуванні в пацієнтів з ОА та за наявності супутніх серцево-судинних захворвань [19]. У дослідженні взяли участь 442 пацієнти з ОА, у 52,9% з яких діагностовано артеріальну гіпертензію, у 9,6% – ІХС, у 8,5% – серцеву недостатність, у 3,3% – інфаркт міокарда та у 0,3% – інсульт. Відповідно до отриманих результатів, під час 9-місячного прийому амтолметину гуацилу не відзначено розвитку нових випадків або вираженої дестабілізації артеріальної гіпертензії, а також появи нових симптомів, що свідчать про патологію серцево-судинної системи, як-от задишка, епізоди серцебиття і напади стенокардії.
Слід відзначити, що амтолметин гуацил добре переноситься пацієнтами з ОА [45], а переваги амтолметину гуацилу визначають доцільність вибору цього препарату в тих випадках, коли потрібна тривала терапія НПЗП.
! Як свідчать дослідження, після декількох місяців застосування препарату у високих дозах на фоні покращення можна перейти до підтримувальної терапії, значно знизивши дозу препарату [19].
Резюмуючи вищенаведені дані, зазначимо, що результати дослідження «ПАРТНЕР» продемонстрували високу поширеність серцево-судинної патології та високий (78%) ризик серйозних кардіоваскулярних подій у хворих з уперше діагностованим первинним ОА в Україні. Це вимагає раціонального вибору НПЗП при симптоматичному лікуванні ОА. У цьому контексті заслуговує на увагу НПЗП з оригінальним механізмом дії – амтолметин гуацил, який є ефективним знеболювальним і протизапальним препаратом зі сприятливим профілем безпеки не лише щодо ШКТ, а й стосовно серцево-судинної системи.
Список літератури знаходиться в редакції.
Команда дослідження «ПАРТНЕР»: Н.С. Агафонова, С.В. Брусенцева, Ю.Л. Бурченко, Л.П. Веденкіна, О.П. Володько, Л. О. Гавриш, О.В. Гончар, Н.М. Гречаник, Г.Д. Дорошенко, М.Г. Зябченко, О.Д. Казьмірик, Г.Р. Кальченко, В.В. Кострикіна, С.М. Минка, Є.В. Мовчан, Ю.М. Морозов, Л.В. Різничок, П.Є. Слобода, І.В. Федорук, І.В. Чіжікова.
Медична газета «Здоров’я України 21 сторіччя» № 11 (480), червень 2020 р.


