27 грудня, 2020
Особенности ведения больных с НПВП-индуцированной гастропатией: от понимания механизмов развития к стратегии профилактики и лечения
Риски кратковременного применения нестероидных противовоспалительных препаратов
 Сегодня нестероидные противовоспалительные препараты (НПВП) активно используются в клинической практике и повседневной жизни для лечения множества заболеваний. Ежедневно в мире около 30 млн человек употребляют НПВП как обезболивающие, противовоспалительные и антиагрегантные средства. В последнее время отмечается тенденция к увеличению потребления НПВП в 2-3 раза каждые 10 лет. Более 300 млн человек в год принимают НПВП, при этом лишь треть из них делают это по назначению врача [3, 16].
Сегодня нестероидные противовоспалительные препараты (НПВП) активно используются в клинической практике и повседневной жизни для лечения множества заболеваний. Ежедневно в мире около 30 млн человек употребляют НПВП как обезболивающие, противовоспалительные и антиагрегантные средства. В последнее время отмечается тенденция к увеличению потребления НПВП в 2-3 раза каждые 10 лет. Более 300 млн человек в год принимают НПВП, при этом лишь треть из них делают это по назначению врача [3, 16].
Спектр фармакологических эффектов этих лекарств достаточно широкий: блокада циклооксигеназы (ЦОГ)-2, снижение синтеза важнейшего медиатора воспаления простагландина Е2, опосредованное снижение экспрессии провоспалительных цитокинов, нейромедиаторов, подавление активации металлопротеиназ, NO-синтетазы, дифференциации и активации остеокластов, что позволяет рассматривать НПВП как универсальное патогенетическое обезболивающее и противовоспалительное средство [3].
Однако применение НПВП с аналгетической, противовоспалительной, антипиретической целями нередко может сопровождаться развитием неблагоприятных явлений. Наиболее известным из них является НПВП-гастропатия, которая объединяет комплекс желудочных проявлений (диспепсия, эрозии, язвы, осложнения), возникающих под воздействием НПВП и имеющих определенную клинико-эндоскопическую характеристику – повреждение слизистой оболочки желудка и луковицы двенадцатиперстной кишки (ДПК), с развитием эрозий и язв. Важно также отметить, что частота развития осложнений со стороны желудочно-кишечного тракта (ЖКТ) не зависит от способа введения НПВП (парентеральный, пероральный, ректальный или накожный), поскольку действие лекарственного препарата в организме носит системный характер [14, 16].
Кроме того, НПВП-гастропатия представляет реальную опасность, поскольку может осложниться угрожающими жизни состояниями, такими как кровотечение или перфорация [8, 15, 28].
Вероятность подобных нежелательных явлений у пациентов, регулярно принимающих НПВП, более чем в 4 раза выше, чем в популяции, – 0,5-1 случай на 100 больных в течение года. Пациенты, получающие НПВП, умирают из-за осложнений со стороны ЖКТ в 2-3 раза чаще по сравнению с людьми, не принимающими препараты этой группы [9, 32].
Сегодня в развитых странах в связи со снижением частоты ассоциированных с Helicobacter pylori язв именно НПВП рассматриваются как основная причина развития желудочно-кишечных кровотечений [18, 30].
Клинические варианты НПВП-гастропатий
НПВП-индуцированная гастропатия может протекать в нескольких клинических формах: в виде субъективных симптомов со стороны ЖКТ (желудочной диспепсии), гастрита, эрозивно-язвенного поражения слизистой оболочки желудка и ДПК, в том числе острых язв, кровотечений из эрозий и язв желудка и ДПК, реже – перфорации. Среди больных, регулярно принимающих НПВП, диспепсия возникает у 20-40%, при этом около 10% больных прерывают прием НПВП из-за развития неприятных симптомов со стороны ЖКТ [4].
Патогенез диспепсии в большей степени связан с контактным воздействием НПВП на мембраны эпителиоцитов, приводящим к обратной диффузии ионов водорода в слизистую оболочку, с последующим снижением рН в подслизистом слое и стимуляцией болевых рецепторов, а также способностью НПВП ускорять или замедлять моторику ЖКТ. Диспепсию способны вызывать все НПВП, включая низкие дозы ацетилсалициловой кислоты (АСК). Однако при приеме селективных НПВП она возникает реже, чем при приеме неселективных, и чаще отмечается у пациентов с наличием язвы в анамнезе или принимающих высокие дозы НПВП [6]. Практически в 100% случаев прием НПВП приводит к развитию эндоскопических признаков острого гастрита в течение 1 недели после начала лечения [2].
Между тем очень часто при НПВП-гастропатиях отсутствует субъективная симптоматика, приблизительно в 70% случаев возможно развитие так называемых немых язв, которые могут манифестировать перфорацией или тяжелым гастродуоденальным кровотечением. Отсутствие симптомов у больных с НПВП-индуцированными поражениями ЖКТ обусловлено, с одной стороны, торможением биосинтеза простагландинов – медиаторов боли и воспаления, с другой – сугубо субъективными факторами, состоящими не в истинном отсутствии жалоб, а в том, что они беспокоят пациента больше, нежели возникшие проявления со стороны ЖКТ [5].
Поэтому эндоскопическое исследование является единственным своевременным и точным методом диагностики НПВП-гастропатии. Выявление эрозий и язв слизистой оболочки желудка и/или ДПК, в том числе бессимптомных, имеет важное клиническое значение. Ведь источником большей части опасных желудочно-кишечных кровотечений (ЖКК) становятся именно язвы и множественные эрозии. Кроме того, механизмы развития НПВП-индуцированных эрозий, язв и ЖКК, по сути, едины. Это позволяет рассматривать изменения ЖКТ, выявленные во время эндоскопии, как определенный маркер более опасной патологии [22].
Так, из 6431 обследованных пациентов язвы желудка и/или ДПК были выявлены у 383 (5,9%), в том числе язвы желудка – у 262 (4,0%), язвы ДПК – у 84 (1,3%), сочетание язв желудка и ДПК – у 34 (0,5%), язвы гастроэнтероанастомоза – у 3 (0,04%). Множественные эрозии определялись у 266 (4,1%) пациентов, единичные – у 1042 (16,2%) [20].
Кроме того, в отличие от классической язвенной болезни, к характерным особенностям НПВП-гастропатии относят рецидивирующий характер течения; дебют клинической (или часто только эндоскопической картины), в основном, в первые 1-3 мес. от начала приема НПВП; внезапное развитие поражения ЖКТ, которое может быть спрогнозировано только по совокупности факторов риска.
Механизмы возникновения таких побочных эффектов общеизвестны и обусловлены ульцерогенным действием НПВП на слизистую оболочку ЖКТ. При этом независимо от локализации эрозивно-язвенного поражения возможны два варианта влияния препарата. Первый – непосредственное повреждение слизистой оболочки во время всасывания НПВП (что справедливо и в отношении АСК и ее производных). Второй – повреждение, связанное с ингибированием циклооксигеназы – ключевого фермента в каскаде метаболизма арахидоновой кислоты, которая является предшественником простагландинов, простациклинов и тромбоксанов. Кроме того, возможно повторное попадание активных метаболитов НПВП с желчью в результате печеночной экскреции в ДПК и желудок при дуоденогастральном рефлюксе.
Именно ингибирование ЦОГ-2-индуктивной изоформы (которая в норме в большинстве тканей отсутствует) рассматривается как один из важнейших механизмов противовоспалительной, аналгетической и антипиретической активности. Это связано с тем, что ее экспрессия и активность проявляются локально под действием воспалительных стимулов (митогены, цитокины, фактор роста), приводя к повышению уровня провоспалительных веществ как в месте воспаления, так и системно после контакта с инфекцией. Ингибирование конститутивной изоформы ЦОГ 1 создает дефицит простациклина І2, ухудшая кровоток в стенке желудка, а снижение синтеза простагландина Е2 ведет к уменьшению секреции бикарбонатов и слизи, повышению кислотопродукции, что усиливает дисбаланс факторов защиты и агрессии и способствует ульцерогенезу [5].
Закономерность развития неблагоприятных эффектов, особенно на фоне длительного приема НПВП, отмечается во всех отделах ЖКТ, но чаще всего выражена в участках гастродуоденальной зоны и прежде всего в антральном отделе желудка, где более высокая плотность рецепторов простагландинов. Известно, что побочное действие НПВП проявляется не у всех пациентов, принимающих эти лекарственные средства. Объяснение данного феномена связано с наличием факторов риска развития повреждений слизистой оболочки ЖКТ, ведущими из которых являются:
- возраст старше 65 лет;
- язвенная болезнь (пептическая язва) и ее осложнения в анамнезе;
- высокие дозы НПВП;
- одновременный прием нескольких НПВП или комбинации НПВП с АСК или другим антиагрегантом;
- сопутствующая терапия глюкокортикостероидными гормонами;
- продолжительность терапии;
- заболевание, требующее длительного приема НПВП;
- наличие H. pylori;
- женский пол [17].
При этом при стратификации факторов риска пациентов можно разделить на 3 группы:
- пациенты с высокой степенью риска – имеющие осложнения язвенной болезни в анамнезе, особенно недавние, а также 3 и более факторов риска;
- пациенты со средней/умеренной степенью риска – 1-2 фактора риска;
- пациенты с низкой степенью риска – отсутствие факторов риска [11].
Американская коллегия гастроэнтерологов (American College of Gastroenterology, ACG) к факторам риска дополнительно относит: начальный период приема НПВП (первые 1-2 недели), прием препаратов натощак (до еды), употребление алкоголя, курение, сопутствующие сердечно-сосудистые заболевания [23].
Длительное время в развитии НПВП-гастропатии неоднозначно трактовалась возможная роль инфекции H. pylori. Согласно данным метаанализа рандомизированных исследований [13], положениям Маастрихтских консенсусов, в том числе и Маастрихтского соглашения V, инфекция H. pylori и прием НПВП признаны независимыми факторами риска развития гастродуоденальных язв и язвенных кровотечений [25]. При этом риск развития гастродуоденальной язвы при сочетанном влиянии НПВП и H. рylori возрастает в 6,1 раза, а риск развития язвенных кровотечений – в 6,13 раза по сравнению с изолированным влиянием (4,85 и 1,79 раза соответственно) [34]. Сегодня в отношении инфекции H. pylori и приема НПВП необходимо руководствоваться приведенными ниже международными утверждениями и рекомендациями [24, 25].
- Инфекция H. Pylori ассоциирована с увеличением риска неосложненных или осложненных язв желудка и ДПК у пациентов, принимающих НПВП или АСК в низких дозах.
- Эрадикация снижает риск развития осложненных или неосложненных язв желудка и ДПК у пациентов, принимающих НПВП или АСК в низких дозах.
- Эрадикация H. pylori оказывает благоприятное воздействие перед началом приема НПВП и абсолютно показана пациентам с язвенной болезнью в анамнезе.
- Эрадикация H. pylori не снижает частоту возникновения язв желудка и ДПК у пациентов, принимающих НПВП в течение длительного времени. В этом случае, помимо эрадикации, показан длительный прием ингибиторов протонной помпы (ИПП).
- Пациентам с язвенной болезнью в анамнезе, принимающим АСК, показано проведение тестов на H. pylori. По результатам долгосрочного наблюдения, после эрадикации частота язвенных кровотечений у таких пациентов низкая даже при отсутствии гастропротективного лечения [21].
В 2009 г. было опубликовано Канадское национальное руководство по профилактике НПВП-гастропатии, включившее достижения в этой области и положения международных согласительных документов [31]. Ряд положений и алгоритм профилактики гастропатии, предложенный в этом консенсусе, представлены ниже.
- Традиционные НПВП и АСК увеличивают частоту кровотечений и других осложнений со стороны ЖКТ.
- Увеличение частоты осложнений наблюдается при применении селективных ингибиторов ЦОГ-2, но реже, чем при приеме традиционных. Риск ЖКК возрастает, если пациенту, получающему лечение традиционным НПВП или селективным ингибитором ЦОГ-2, назначить АСК.
- При дополнительном назначении к АСК клопидогрела риск ЖКК возрастает; в случае использования НПВП и/или АСК риск ЖКК возрастает.
- При наличии у пациентов инфекции H. pylori НПВП и АСК повышают частоту клинических жалоб, характерных для патологии верхних отделов ЖКТ.
- Назначение пациентам с предшествующим язвенным кровотечением селективных ингибиторов ЦОГ-2 или добавление ИПП к традиционному НПВП не исключают возможности повторного кровотечения. Однако риск кровотечения при использовании селективных ингибиторов ЦОГ-2 вместе с ИПП значительно ниже, чем при применении одного с ЦОГ-2.
- ИПП уменьшают клинические проявления НПВП-гастропатий.
- Эрадикация H. pylori уменьшает риск верхних ЖК осложнений у больных, уже принимающих АСК.
Вместе с тем при наличии ЖК риска для профилактики НПВП-гастропатии только лишь эрадикации H. pylori недостаточно, необходимо использовать еще и ИПП. Сегодня безопасность применения НПВП является одной из актуальных проблем клинической медицины. Предлагаем клиническое наблюдение НПВП-гастропатии у пациента, получавшего НПВП, в течение короткого периода времени (до 7 дней), и обсуждение возможных мер профилактики и лечения.
Клинический случай
Мужчина, 42 г., острая травма коленного сустава, выраженный болевой синдром, отек. По назначению травматолога в течение 5 дней получал в/м инъекцию 3 мл диклофенака, мелоксикам по 7,5 мг 2 раза в сутки. На 5-е сутки приема препаратов пациент, ранее считавший себя абсолютно здоровым, обратился к семейному врачу с жалобами на жгучие боли в эпигастральной области. При эзофагогастродуоденоскопии (ЭГДС) в антральном отделе желудка по большой кривизне определяется множество плоских полигональных дефектов (эрозий) слизистой оболочки (рис. 1).
 Рис. 1. Эндоскопическое фото (система EvisExeraIII, GifH180): а) исследование в белом свете, антральный отдел желудка, по большой кривизне определяется множество плоских полигональных дефектов слизистой, в центре которых имеется отложение фибрина; б) тот же отдел, исследование в режиме NBI (Narrowbandimaging), перифокально вокруг дефектов слизистой антрального отдела явления застойной гастропатии с полнокровными сосудами подслизистой, ямочный рисунок регулярный, в центре эрозий отложение фибрина
Рис. 1. Эндоскопическое фото (система EvisExeraIII, GifH180): а) исследование в белом свете, антральный отдел желудка, по большой кривизне определяется множество плоских полигональных дефектов слизистой, в центре которых имеется отложение фибрина; б) тот же отдел, исследование в режиме NBI (Narrowbandimaging), перифокально вокруг дефектов слизистой антрального отдела явления застойной гастропатии с полнокровными сосудами подслизистой, ямочный рисунок регулярный, в центре эрозий отложение фибрина
В луковице ДПК на задней стенке имеется полигональный язвенный дефект (рис. 2).
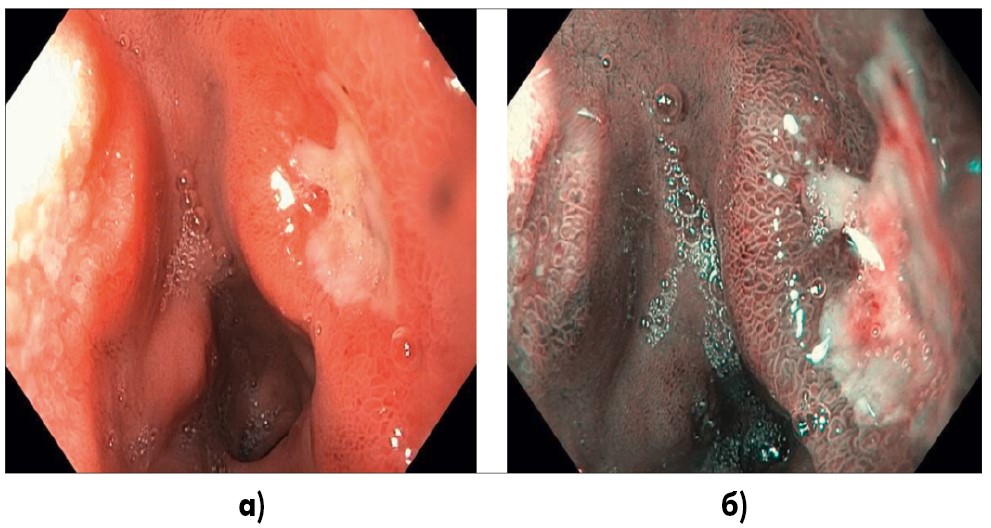 Рис. 2. Эндоскопическое фото (система EvisExeraIII, GifH180): а) исследование в белом свете, луковица ДПК, на задней стенке имеется полигональный язвенный дефект с перифокальным воспалительным валом, размером 1,0×0,7 см, дно покрыто фибрином; б) тот же отдел, исследование в режиме NBI (Narrowbandimaging), перифокально ямочный рисунок структурно сохранен, регулярный, сосуды подслизистой полнокровные, без явной деформации
Рис. 2. Эндоскопическое фото (система EvisExeraIII, GifH180): а) исследование в белом свете, луковица ДПК, на задней стенке имеется полигональный язвенный дефект с перифокальным воспалительным валом, размером 1,0×0,7 см, дно покрыто фибрином; б) тот же отдел, исследование в режиме NBI (Narrowbandimaging), перифокально ямочный рисунок структурно сохранен, регулярный, сосуды подслизистой полнокровные, без явной деформации
Выполненный быстрый уреазный тест оказался положительным.
При патоморфологическом исследовании 3 биоптатов из антрального отдела желудка пациента отмечался отек, участки эрозирования разных размеров, на поверхности слизь, слущенные клетки, признаки субатрофии и атрофии желез, очагово в железах признаки кишечной метаплазии, слабо выраженная преимущественно лимфо-гистиоцитарная инфильтрация, очагово в поверхностных отделах небольших размеров кровоизлияния (рис. 3), в зоне собственной пластинки незначительно выраженный склероз.
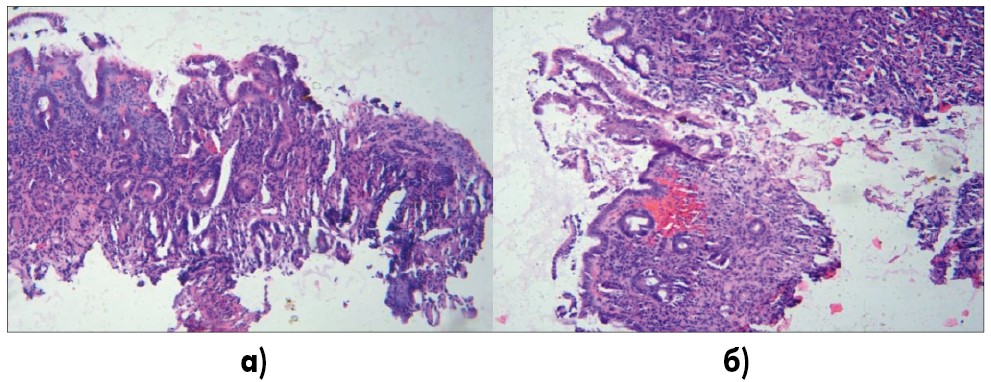 Рис. 3. а) Участки эрозирования слизистой оболочки, на поверхности слущенные клетки эпителия, признаки атрофии, слабо выраженная клеточная инфильтрация; б) кровоизлияние в поверхностном отделе слизистой оболочки, признаки атрофии, железы с признаками кишечной метаплазии, слабо выраженная клеточная инфильтрация
Рис. 3. а) Участки эрозирования слизистой оболочки, на поверхности слущенные клетки эпителия, признаки атрофии, слабо выраженная клеточная инфильтрация; б) кровоизлияние в поверхностном отделе слизистой оболочки, признаки атрофии, железы с признаками кишечной метаплазии, слабо выраженная клеточная инфильтрация
Окраска гематоксилином и эозином, увеличение 1:100.
Функциональное состояние слизистой оболочки в участках эрозирования и атрофии изменено – снижена секреция слизи, вне этих участков – секреция слизи, распределение бокаловидных клеток сохранены (рис. 4).
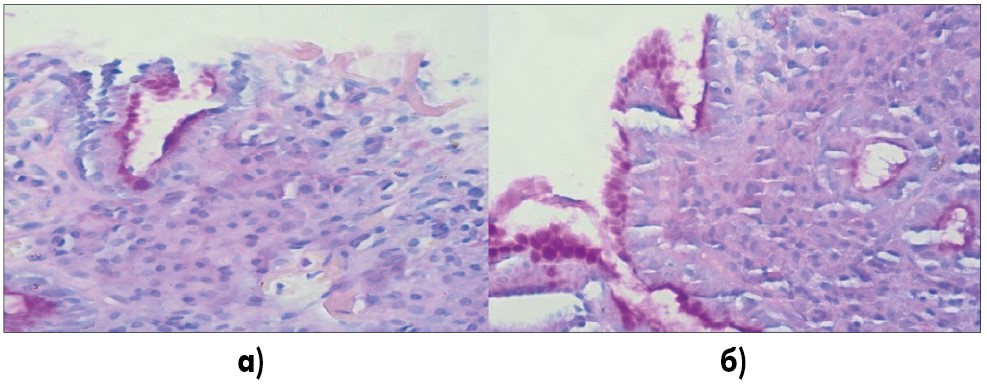 Рис. 4. а) Отсутствие и резкое снижение секреции слизи в зонах эрозирования, незначительное сохранение секреции в части клеток железы; б) сохранение секреции слизи в железах вне эрозирования, снижение интенсивности в части желез с признаками атрофии
Рис. 4. а) Отсутствие и резкое снижение секреции слизи в зонах эрозирования, незначительное сохранение секреции в части клеток железы; б) сохранение секреции слизи в железах вне эрозирования, снижение интенсивности в части желез с признаками атрофии
PAS-реакция, увеличение 1:400.
Комментарии. Причиной осложнения у пациента является прием НПВП на фоне хронической гастродуоденальной патологии (хронического H. pylori-ассоциированного гастрита), протекавшей бессимптомно. Таким образом, приведенный пример подтверждает тезис, что инфекция H. pylori ассоциирована с увеличением риска неосложненных или осложненных язв желудка и ДПК у пациентов, принимающих НПВП или АСК в низких дозах.
При выборе тактики лечения для пациента мы руководствовались персонифицированным подходом с учетом клинико-морфологических проявлений (наличие H. pylori-ассоциированного гастрита, эрозий в антральном отделе желудка и язвенного дефекта в луковице ДПК), данных анамнеза (больной в течение предшествующих 6 месяцев принимал по поводу бронхолегочной инфекции антибиотик из группы макролидов, а по поводу урогенитальной инфекции – препарат нитроимидазол), а также региональной чувствительности к схемам эрадикационной терапии [1].
Пациенту для достижения оптимального результата эрадикации на 14 дней назначили квадротерапию с использованием 1/4 дозы пантопразола (Нольпаза®, KRKA), стандартных доз препаратов висмута субцитрата (Улькавис®, KRKA), амоксициллина и кларитромицина. Затем в течение месяца (с учетом множественных эрозий в антральном отделе желудка и язвы в луковице ДПК) рекомендовано продолжить прием препаратов Нольпаза® и Улькавис® в стандартных дозах. Контроль эффективности эрадикации H. рylori, проведенный через 4 недели после окончания курса с помощью 13С-мочевинного дыхательного теста, подтвердил отсутствие инфекции, а выполненная через 2 месяца эндоскопия показала эпителизацию эрозий в антральном отделе желудка и заживление язвы в луковице ДПК (рис. 5).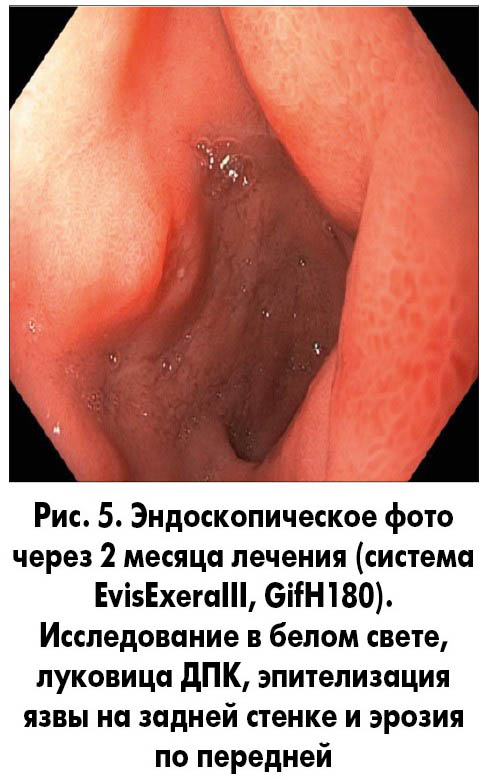
Высокая эффективность выбранной схемы эрадикационной терапии связана с применением высоких доз пантопразола (Нольпаза®) – 40 мг 4 раза в сутки, что обеспечивало постоянную нейтрально-щелочную реакцию желудочного содержимого (уровень рН 6-8). При таких значениях рН бактерии H. pylori находятся в фазе репликации и наиболее уязвимы к действию антибактериальных препаратов [27]. Двухнедельная продолжительность эрадикационной терапии в соответствии с рекомендациями последних консенсусов обеспечивает преодоление резистентности к макролидам, фторхинолонам и нитроимидазолам в большинстве случаев [26, 33].
В ряде исследований, проведенных в последние годы и, в частности, в Украине продемонстрировано увеличение эффективности терапии 1-й линии при добавлении коллоидного субцитрата висмута [7]. Полученные данные подтверждают рациональность такого варианта квадротерапии для достижения оптимального результата эрадикации H. pylorу.
В рассмотренном клиническом примере формальные показания к профилактическому приему ИПП, как и к выполнению ЭГДС, отсутствовали. И в таких острых ситуациях (травма и острая боль) провести ЭГДС перед назначением НПВП не представляется возможным. Однако возникшие у «практически здорового» пациента в данном случае желудочные осложнения демонстрируют риск при краткосрочном приеме НПВП у молодых лиц и нерешенность проблемы профилактики НПВП-гастропатии у этой категории пациентов.
Принимая во внимание рассмотренный клинический пример, в качестве вариантов профилактики НПВП-гастропатий считаем возможным предложить следующее:
- необходимо тщательно оценивать обоснованность назначения НПВП и уточнять анамнез желудочных заболеваний и жалоб;
- информировать пациента о риске приема НПВП и акцентировать внимание на клинических проявлениях возможных осложнений;
- не практиковать рутинное назначение НПВП с целью обезболивания для курсового регулярного приема препаратов, так как пациентам в нетяжелых случаях (например, легкая травма) может быть вполне достаточно однократного или двукратного приема лекарства.
Выбор препаратов для профилактики и лечения НПВП-гастропатий
Клинические особенности НПВП-гастропатий, указанные выше, частое наличие сочетанной медикаментозной нагрузки, связанной с лечением основного заболевания (НПВП в комбинации с препаратами других групп), заставляют врача более тщательно выбирать как профилактические, так и лечебные средства при возникновении диспепсии или эрозивно-язвенных поражений ЖКТ. С учетом существующих рекомендаций, наиболее оптимальными для решения этих задач признаны ИПП.
При выборе ИПП у пациента с коморбидной патологией большую роль играют особенности межлекарственного взаимодействия антисекреторных препаратов с другими средствами, которые вынуждены принимать эти больные (часто на постоянной основе). Важное значение придается их взаимодействию с печеночной системой цитохрома Р450 и, в частности, с изоферментом CYP2С19, участвующим в метаболизме значительного количества лекарственных препаратов. Так, показано, что омепразол и частично лансопразол замедляют метаболизм антипирина, карбамазепина, циклоспорина, диазепама, дигоксина, нифедипина, фенитоина, теофиллина, R-варфарина, клопидогрела. Среди ИПП самую низкую аффинность к системе цитохрома Р450 имеет пантопразол, поскольку после инициального метаболизма в ней дальнейшая биотрансформация происходит под воздействием сульфотрансферазы цитозоля. Это объясняет меньший потенциал межлекарственных взаимодействий пантопразола по сравнению с другими ИПП. Исследования показали, что пантопразол за счет слабого влияния на систему цитохрома P450 обладает меньшим негативным фармакологическим взаимодействием со многими другими лекарствами, в частности, с клопидогрелом [35]. Это подтверждается рядом лабораторных и клинических исследований. В исследовании SPICE, проведенном под руководством А. Harvey (2016), с участием пациентов, перенесших стентирование коронарных артерий, показано, что применение омепразола/эзомепразола в комбинации с клопидогрелом приводит к снижению ферментативной активности CYP2C19, сохранению высокой остаточной реактивности тромбоцитов, что может ассоциироваться с большим риском тромботических событий в послеоперационном периоде. И наоборот, использование пантопразола продемонстрировало отсутствие неблагоприятного межлекарственного взаимодействия и развития симптомов передозировки или уменьшения лечебных эффектов антитромбоцитарных препаратов.Поэтому при необходимости назначения ИПП пациентам, перенесшим стентирование коронарных артерий и получающим клопидогрел, препаратом выбора можно считать пантопразол. Использование пантопразола в комбинации с аспирином и клопидогрелом не сопровождается увеличением частоты возникновения значимых нежелательных сердечно-сосудистых событий у пациентов с острым инфарктом миокарда с подъемом сегмента ST и уменьшает риск гастроинтестинальных кровотечений; поэтому следует поощрять клиническое применение пантопразола, особенно у больных с высоким риском, утверждают Р. Wei и соавт. (2016).
У пациентов с острым инфарктом миокарда с подъемом сегмента ST, принимавших клопидогрел или новые блокаторы аденозиновых рецепторов, Т. Bolek и соавт. (2017) не зафиксировали значимых лекарственных взаимодействий при приеме пантопразола и перечисленных препаратов, а также не обнаружили достоверных изменений индекса реактивации тромбоцитов при использовании этого ИПП. Он предпочтительнее и для длительной профилактики НПВП-гастропатии у лиц пожилого возраста, многие из которых имеют коморбидные заболевания и нередко одновременно получают несколько препаратов различных фармакологических групп [19]. Кроме того, важна рН-селективность ИПП, низкое значение которой обсуждается в качестве патогенетического механизма потенциальных побочных эффектов при длительной терапии ИПП, так как протонные помпы (Н+/К+- или Н+/Na+-АТФазы), помимо париетальных клеток, выявлены в клетках других органов и тканей: в эпителии кишечника и желчного пузыря, почечных канальцах, эпителии роговицы, мышцах, клетках иммунной системы (нейтрофилах, макрофагах и лимфоцитах), остеокластах и др. [12]. Следовательно, при условии активации ИПП за пределами секреторных канальцев париетальной клетки, существует теоретическая возможность их воздействия на все эти структуры. Из известных ИПП пантопразол является наиболее рН-селективным [29].
Блокада протонных помп, расположенных вне обкладочных клеток главных желудочных желез, может вызывать серьезные осложнения при длительном приеме препарата, например: торможение активности нейтрофилов может приводить к увеличению заболеваемости пневмонией, а нарушение созревания остеокластов – к высокому риску перелома шейки бедра, что особенно важно для полиморбидных пациентов пожилого возраста, долговременно принимающих менее селективные ИПП. Пантопразол выгодно отличается от других ИПП отсутствием зависимости между сывороточной концентрацией препарата и принятой дозой лекарства, быстрой (4-6 мин) активацией в кислой среде из пролекарства с ее резким замедлением при повышении уровня рН (5,1), высокой биодоступностью (77%), что обеспечивает высокую селективность и безопасность препарата. Существенным отличием пантопразола от других ИПП является более длительное связывание с протонной помпой за счет образования прочной ковалентной связи с дополнительным остатком цистеина в положении 822, локализованным значительно глубже в клеточной мембране по сравнению с таковым в положении 813, с которым соединяются другие ИПП. Он единственный из всех ИПП вызывает необратимую блокаду протонной помпы, а не временное прерывание химической связи. При этом продукция хлористоводородной кислоты восстанавливается за счет синтеза новых протонных помп. Время для возобновления исходной кислотопродукции составляет для лансопразола около 15 ч, для омепразола и рабепразола – около 30 ч, для пантопразола – примерно 46 ч, то есть последний имеет дополнительное преимущество в виде наиболее продолжительного кислотоснижающего эффекта [21].
С учетом возможности более длительно ингибировать желудочную секрецию именно пантопразол является наиболее предпочтительным ИПП в случае необходимости длительного лечения кислотозависимых заболеваний у пожилых лиц и принимающих большое количество сопутствующих медикаментов (в том числе НПВП). Возникает вопрос: не опасно ли применять ИПП длительно или постоянно и какому конкретному ИПП в этом случае следует отдать предпочтение? Длительный опыт применения ИПП показал, что они являются одними из наиболее безопасных препаратов. В исследовании G. Brunner и соавт. приведены данные о максимально длительном применении (15 лет) пантопразола с постоянным мониторингом лабораторных, эндоскопических и морфологических изменений [10].
На основании результатов исследования сделано несколько важных заключений. Так, длительное применение пантопразола обеспечило высокую клиническую эффективность у больных с пептической язвой и рефлюкс-эзофагитом. У более чем 90% больных отсутствовали симптомы кислотозависимых заболеваний в течение всего времени наблюдения. Установлена благоприятная тенденция гистологической картины на фоне длительного лечения пантопразолом. Терапия приводила к уменьшению воспалительной лимфоплазмоцитарной инфильтрации слизистой оболочки желудка, отсутствию признаков усугубления метаплазии. Умеренное повышение степени атрофии в теле желудка в первое время лечения наблюдали только у H. pylori+ больных, оно было успешно устранено после эрадикации бактерий. Включение пантопразола в схемы антихеликобактерной терапии позволяет добиться хороших результатов. В одном из опубликованных исследований, в котором больных, инфицированных Н. рilori, рандомизировали для проведения 10- или 14-дневной антихеликобактерной терапии (n=341), подтверждена высокая эффективность пантопразола (S. Park et al., 2017). Согласно данным анализа per protocol (пациенты, завершившие исследование в соответствии с протоколом), результативность эрадикации в этих подгруппах оценена в 91,4 и 95,6% соответственно. Следует отметить, что пантопразол относится к В-категории риска (FDA) применения лекарств во время беременности благодаря наименее потенциальной фетотоксичности. Это позволяет использовать препарат для профилактики неблагоприятных желудочно-кишечных явлений у беременных, вынужденных принимать НПВП по тем или иным клиническим причинам. Важным свойством также является отсутствие необходимости коррекции дозы у пациентов пожилого возраста и у больных с почечной и печеночной недостаточностью.
Представителем генерического пантопразола в Украине является препарат Нольпаза® (KRKA). Он соответствует всем требованиям надлежащей клинической (GCP) и производственной практики (GMP), обладает высокой клинической эффективностью, отвечает всем требованиям безопасности применения и, что немаловажно, цена соответствует качеству, а это положительно сказывается на приверженности пациента к лечению препаратом и обусловливает его высокий терапевтический эффект. Вопросы надежной профилактики поражений желудка и ДПК, возникающие при лечении НПВП, остаются предметом дискуссий. ИПП наиболее эффективно предотвращают появление язв желудка и ДПК, ассоциированных с НПВП. Пациенты могут получать ИПП по показаниям настолько длительно, насколько необходимо в конкретной клинической ситуации. Между тем, следует учитывать преимущества отдельных представителей этого класса (пантопразола (Нольпаза®)), позволяющие нивелировать теоретические и потенциальные риски.
Список литературы находится в редакции.
Тематичний номер «Гастроентерологія. Гепатологія. Колопроктологія» № 4 (58) 2020 р.




