19 травня, 2021
Імплементація даних доказової медицини в реальну клінічну практику
За матеріалами доповідей в рамках Першої конференції з міжнародною участю «Простір доказової алергології»
 24-25 березня 2021 року відбулася знакова для української медичної спільноти подія – Перша конференція з міжнародною участю «Простір доказової алергології», присвячена 80-річному ювілею корифея вітчизняної імунології і алергології, засновника кафедри клінічної імунології та алергології із секцією медичної генетики, доктора медичних наук, професора Георгія Миколайовича Дранніка і 180-річчю Національного медичного університету (НМУ) ім. О.О. Богомольця (м. Київ).
24-25 березня 2021 року відбулася знакова для української медичної спільноти подія – Перша конференція з міжнародною участю «Простір доказової алергології», присвячена 80-річному ювілею корифея вітчизняної імунології і алергології, засновника кафедри клінічної імунології та алергології із секцією медичної генетики, доктора медичних наук, професора Георгія Миколайовича Дранніка і 180-річчю Національного медичного університету (НМУ) ім. О.О. Богомольця (м. Київ).
 Програма конференції охопила основні практичні аспекти ведення пацієнтів з алергоімунною патологією, актуальні не лише для вузьких спеціалістів, але й для сімейних лікарів і педіатрів. 18 спікерів з України та Іспанії представили свої доповіді, темами яких стали, зокрема, сучасні можливості молекулярної алергодіагностики, імунологічні аспекти аутоімунних захворювань, діагностика і контроль алергії та бронхіальної астми (БА), а також питання алерген-специфічної імунотерапії (АСІТ).
Програма конференції охопила основні практичні аспекти ведення пацієнтів з алергоімунною патологією, актуальні не лише для вузьких спеціалістів, але й для сімейних лікарів і педіатрів. 18 спікерів з України та Іспанії представили свої доповіді, темами яких стали, зокрема, сучасні можливості молекулярної алергодіагностики, імунологічні аспекти аутоімунних захворювань, діагностика і контроль алергії та бронхіальної астми (БА), а також питання алерген-специфічної імунотерапії (АСІТ).
Ключові слова: алергологія, імунологія, COVID‑19, молекулярна алергодіагностика, специфічна імунотерапія, ALEX, Оралтек, Алксоїд, фавіпіравір, Віусід, Цитовір‑3, NIOX VERO, IgG-залежна харчова гіперчутливість, Food Xplorer, еозинофільне запалення дихальних шляхів, альтернарія, кліщі домашнього пилу
Спікери не обійшли увагою вкрай непросту епідеміологічну ситуацію, яка склалася у світі через пандемію коронавірусної інфекції. Кілька доповідей було присвячено найактуальнішим відкриттям щодо патогенезу і клінічних аспектів ведення пацієнтів із COVID‑19. Так, віце-президент ВГО «Українське товариство фахівців з імунології, алергології та імунореабілітації», завідувач кафедри клінічної імунології та алергології із секцією медичної генетики НМУ ім. О.О. Богомольця, доктор медичних наук, професор Андрій Ігорович Курченко розповів про етіологію та імунопатогенез коронавірусної інфекції, а також перспективи ведення пацієнтів із постковідним синдромом.
 – Зважаючи на те що знайомство із SARSr-CoV‑2 відбулося відносно недавно, поки що ми не маємо цілісної картини патогенезу, яка б допомогла пояснити всі клінічні варіанти перебігу COVID‑19. Утім, певні моменти вже достатньо вивчені та мають бути враховані як під час ведення пацієнтів, так і в разі проведення подальших досліджень цього захворювання.
– Зважаючи на те що знайомство із SARSr-CoV‑2 відбулося відносно недавно, поки що ми не маємо цілісної картини патогенезу, яка б допомогла пояснити всі клінічні варіанти перебігу COVID‑19. Утім, певні моменти вже достатньо вивчені та мають бути враховані як під час ведення пацієнтів, так і в разі проведення подальших досліджень цього захворювання.
Не новою є інформація про те, що родина коронавірусів тропна до альвеолярних епітеліальних клітин типу 1 і що вагома роль у патогенезі коронавірусної інфекції належить імунним клітинам, зокрема альвеолярним макрофагам (Macmillan, 2012). Проте тяжкість перебігу COVID‑19 пов’язана насамперед не з локальним пошкодженням дихальних шляхів (ДШ), а із системними порушеннями, що супроводжують цю інфекцію. SARSr-CoV‑2 особливим чином взаємодіє з імунною системою. Вбудувавшись у геном клітини-хазяїна, вірус певний час може бути прихованим від імунних клітин, що зумовлює його персистенцію в організмі. Крім того, SARSr-CoV‑2 впливає на клітини макрофагально-моноцитарного ряду, тропні до легенової тканини. Останнє зумовлює пошкодження легеневої тканини і виникнення цитокінового шторму. Активація макрофагально-моноцитарного ряду в периферичному кров’яному руслі запускає низку процесів, пов’язаних із тромбоутворенням, що й призводить до тромботичних ускладнень при COVID‑19.
На сьогодні більшість дослідників зосередилися на пошуку та прицільному вивченні тих молекул і клітин, які, з одного боку, могли б слугувати маркерами тяжкості перебігу COVID‑19, а з іншого – стати мішенню для етіологічного і патогенетичного лікування. Так, в японські протоколи вже давно включено препарат фавіпіравір, який являє собою противірусний засіб, активний проти РНК-вірусів, зокрема вірусу Західного Нілу, вірусу жовтої лихоманки та ін. Механізм дії фавіпіравіру полягає у зв’язуванні та інгібуванні РНК-залежної РНК-полімерази, що, зрештою, запобігає вірусній транскрипції і реплікації.
Відповідно до протоколу клінічного дослідження з вивчення ефективності і безпеки фавіпіравіру для профілактики інфікування SARSr-CoV‑2 препарат призначають у дозі 1600 мг перорально двічі на добу в 1-й день, а потім у дозі 800 мг перорально двічі на добу в дні 2-25-й. Для лікування пацієнтів із COVID‑19 легкого та середнього ступеня тяжкості фавіпіравір призначають у дозі 1600 мг перорально двічі на добу в 1-й день, а потім у дозі 800 мг перорально двічі на добу максимум до 14-го дня захворювання.
У разі тяжких форм коронавірусної інфекції насамперед треба використовувати препарати, здатні ефективно зменшувати запальну відповідь, зокрема глюкокортикостероїди (дексаметазон). У цьому аспекті перспективними патогенетичними засобами є інгібітори янус-кінази і моноклональні антитіла, спрямовані на інтерлейкін (ІЛ)-1 і ІЛ‑6, які також внесені в протоколи лікування в деяких країнах (Immunology, 2020).
Індивідуальна вираженість клінічної відповіді на інфікування SARSr-CoV‑2 пов’язана зі станом толл-подібних рецепторів (toll-like receptors, TLR). Вони являють собою групу рецепторів, що розпізнають патоген-асоційовані молекулярні структури (PAMP), експресовані бактеріями, паразитами, вірусами і грибами. Еволюційно TLR були присутні в хребетних і розпізнавали велику різноманітність лігандів, зокрема жири, ліпопротеїни, протеїни і нуклеїнові кислоти. Можна сказати, що сукупність TLR – це певне рецепторне поле, яке стимулює специфічну біологічну відповідь на образи мікроорганізмів, з якими стикалися наші предки протягом еволюційного розвитку. Найважливішу роль в імунній відповіді на коронавірусну інфекцію відіграє TLR7, оскільки саме в ньому міститься образ РНК-вмісних вірусів. Тому однією з перспективних галузей пошуку ефективних ліків від SARSr-CoV‑2 є розробка препаратів, здатних активувати TLR7.
Ще однією прикладною точкою розробки ефективних методів лікування COVID‑19 є стан клітинного імунітету, зокрема NK2G-рецепторів, які блокуються в осіб із тяжким перебігом захворювання. На сьогодні це питання ґрунтовно вивчається та потребує подальших досліджень.
Водночас просто чекати на створення ефективних препаратів ми не можемо, адже маємо рятувати життя пацієнтів уже сьогодні. Крім вакцинації, єдиного поки способу уникнення зараження, необхідно використовувати засоби, які могли б створити «подушку безпеки» для імунної системи пацієнта і забезпечити адекватний супротив організму проти SARSr-CoV‑2. Таким препаратом є імуномодулювальний засіб Віусід із противірусними властивостями. До складу препарату входять антиоксиданти, вітаміни, мікроелементи і гліциризинова кислота, виділена з кореня солодки. Віусід уже встиг зарекомендувати себе як дієвий профілактичний препарат для лікування SARSr-CoV‑2-інфекції в країнах Південно-Східної Азії, Європи і Латинської Америки.
Щодо клітинної ланки імунітету, то єдиний засіб для його підтримки представлений аналогами гормонів тимусу, зокрема препаратом Цитовір‑3. Він містить 3 активні компоненти – тимоген натрію, аскорбінову кислоту і бензадолу гідрохлорид, комплексна дія яких спрямована на забезпечення адекватної клітинної імунної відповіді. Цитовір‑3 призначають дорослим і дітям від 12 років по 1 капсулі тричі на добу впродовж 4 днів. За необхідності профілактичний курс повторюють через 3-4 тижні.
Отже, очікуючи результатів пошуків і досліджень біологічних молекулярних маркерів, за допомогою яких можна буде прогнозувати тяжкість перебігу й наслідки інфікування SARSr-CoV‑2 і розробляти етіопатогенетичне лікування, треба вакцинуватися та використовувати засоби з доведеною в умовах реальної клінічної практики ефективністю.
Виступ члена Європейської академії алергії та клінічної імунології (European Academy of Allergy and Clinical Immunology, EAACI),
наукового директора компанії Inmunotek S.L. (Іспанія), доктора медичних наук, професора Енріке Фернандеса-Кальдаса був присвячений історії, сьогоденню і перспективам АСІТ.
 – У країнах із високим рівнем доходу алергічні захворювання (АЗ) – найпоширеніша хронічна патологія. У країнах із невисоким економічним рівнем АЗ менш поширені, однак їх частота стрімко зростає (ISAAC Steering Committee, 1998; ECRHS, 1996). Згідно з даними ВООЗ, сотні мільйонів людей у світі страждають на алергічний риніт (АР) і приблизно 235 млн – на БА. Алергічні симптоми негативно впливають на якість життя пацієнтів і супроводжуються значними економічними витратами.
– У країнах із високим рівнем доходу алергічні захворювання (АЗ) – найпоширеніша хронічна патологія. У країнах із невисоким економічним рівнем АЗ менш поширені, однак їх частота стрімко зростає (ISAAC Steering Committee, 1998; ECRHS, 1996). Згідно з даними ВООЗ, сотні мільйонів людей у світі страждають на алергічний риніт (АР) і приблизно 235 млн – на БА. Алергічні симптоми негативно впливають на якість життя пацієнтів і супроводжуються значними економічними витратами.
Без належного і вчасно розпочатого лікування природний перебіг алергії характеризується тенденцією до погіршення симптомів, полісенсибілізацією та зв’язком між АР і розвитком БА. Адитивний ефект призводить до посилення запалення і подальшої сенсибілізації. Таким чином, унаслідок перехресної реактивності і полісенсибілізації АЗ дуже часто являють собою діагностичний і терапевтичний виклик для лікаря.
На жаль, уникнення алергену і медикаментозна терапія далеко не завжди можуть забезпечити контроль захворювання. Доброю новиною є те, що вплинути на прогресування захворювання й споживання надмірної кількості симптоматичних препаратів можна за допомогою АСІТ, яка неможлива без специфічної молекулярної діагностики. Лише АСІТ здатна вплинути на перебіг хвороби, тому має бути включена в оптимальні протоколи лікування пацієнтів в усіх країнах світу.
Уже понад століття АСІТ успішно використовують в алергології. І якщо раніше її застосовували емпірично, без чіткого розуміння механізму дії, стандартизації виробництва препаратів для АСІТ і проведення клінічних досліджень, то сьогодні науковцям вдалося досягти значного прогресу в цій галузі. Нещодавні розробки дали можливість підвищити ефективність АСІТ, зменшити кількість побічних реакцій, практично повністю мінімізувати серйозні системні реакції, зробити препарати простішими у використанні і розробити ефективніші та зручніші для пацієнтів інтенсивні і кластерні схеми лікування.
Додатковими перевагами АСІТ, не характерними для симптоматичної терапії, є (Canonica G.W. et al., 2007):
- довготривалий ефект після 3-5 років лікування;
- запобігання новій сенсибілізації;
- зниження ризику розвитку БА в пацієнтів з АР;
- позитивний фармако-економічний профіль.
Говорячи про плюси АСІТ, не можна не згадати про результати дослідження Bozek і співавторів. Метою дослідників було вивчення впливу АСІТ на розвиток алергії в популяції дітей, чиї батьки лікувалися даним методом. У результаті було встановлено, що діти батьків, які отримували АСІТ, мали значно менш виражену клінічну симптоматику АЗ. Співвідношення шансів (СШ) розвитку будь-якого АЗ і БА було значно нижчим у дітей, у яких один або обидва батьки з алергією отримували АСІТ проти дітей, чиї батьки АСІТ не отримували: СШ 0,73 (95% ДІ 0,59-0,86) проти 1,85 (95% ДІ 1,73-2,2) відповідно для будь-якого АЗ і СШ 0,63 (95% ДІ 0,53-0,79) проти 1,36 (95% ДІ 1,22-1,67) відповідно – для БА. Ці дані вкрай важливі для первинної профілактики алергії (Bozek et al., 2016).
Одним із дискусійних питань в алергології є абсолютні й відносні протипоказання до АСІТ, які часто кардинально відрізняються, що потребує прицільної оцінки і формулювання консенсусного заключення.
Загалом абсолютними протипоказаннями до АСІТ є (Pediatr Allergy Immunol. 2020):
- гостра форма БА;
- злоякісні новоутворення в активній формі;
- неконтрольовані системні аутоімунні розлади в активній фазі;
- вагітність на ранніх строках.
Відносними протипоказаннями є частково контрольована БА, первинний і вторинний імунодефіцит і серйозні системні реакції в анамнезі.
Порівнюючи методи АСІТ, тобто сублінгвальної (SLIT) і підшкірної (SCIT) імунотерапії, необхідно зазначити:
- клінічна ефективність SLIT і SCIT як щодо вираженості клінічних симптомів, так і щодо потреби в додатковій симптоматичній терапії є порівнянною (Di Bona D. et al., 2012);
- SLIT безпечніша за SCIT із нативними екстрактами алергенів;
- через меншу тривалість застосування SLIT певні аспекти потребують подальшого вивчення і підтвердження, зокрема оптимальне дозування, тривалість лікування, довготривала ефективність, запобігання розвитку нових алергічних проявів і механізм дії.
Нативні алергенні екстракти для SLIT Oraltek® (Оралтек) від іспанської компанії Inmunotek показали свою високу ефективність і безпеку в лікуванні АЗ у дитячій і дорослій популяції пацієнтів. Головною відмінністю сублінгвальної вакцини Oraltek® від інших вакцин є відсутність фенолу як консерванта. Препарат вводять шляхом впорскування під язик. Доза препарату для одноразового введення відповідає дозі вчетверо більшій, ніж у будь-якого іншого виробника. Використання максимальної безпечної дози з першого дня лікування потенційно скорочує загальний час терапії, а отже – і підвищує прихильність до лікування.
Вакцина для SСIT Alxoid® (Алксоїд) від компанії Inmunotek являє собою алергоїди (алергенні екстракти, модифіковані глютаральдегідом (полімеризованим), які адсорбуються на гелі з гідроксидом алюмінію для специфічної імунотерапії. Особливістю алергоїдів є висока імуногенність і безпечність. Ініціальна фаза лікування за допомогою Alxoid® триває щонайбільше кілька тижнів. Така схема дуже зручна і дає можливість почати терапію напередодні цвітіння і появи пилку весняних дерев.
Сьогодні АСІТ за допомогою cучасних препаратів, зокрема й Oraltek® і Alxoid®, характеризується:
- високою ефективністю в усуненні клінічних симптомів із раннім початком і стійким впливом;
- відсутністю анафілактичного потенціалу і пізньої фази побічних ефектів;
- відтворюваним низьковартісним виробництвом вакцин фармацевтичного рівня;
- можливістю застосування до різних джерел алергенів (інгаляційні, харчові, отрути комах);
- можливістю профілактичного застосування завдяки відсутності сенсибілізувального потенціалу;
- зручністю для пацієнта.
Темою доповіді завідувача кафедри клінічної імунології та алергології Львівського національного медичного університету ім. Данила Галицького, доктора медичних наук, професора Валентини Володимирівни Чоп’як стала харчова IgG-гіперчутливість.
 – Загалом усі патологічні реакції на харчові продукти можна розділити на 2 великі групи: імуно-опосередкована (харчова алергія) і неімуно-опосередкована (харчова непереносимість) гіперчутливість. Причиною останньої може бути недостатність або інгібування ферментів, фармакологічний вплив, прямий вплив на мастоцити шлунково-кишкового тракту (ШКТ) з вивільненням прозапальних медіаторів і прямий токсичний вплив на слизову ШКТ.
– Загалом усі патологічні реакції на харчові продукти можна розділити на 2 великі групи: імуно-опосередкована (харчова алергія) і неімуно-опосередкована (харчова непереносимість) гіперчутливість. Причиною останньої може бути недостатність або інгібування ферментів, фармакологічний вплив, прямий вплив на мастоцити шлунково-кишкового тракту (ШКТ) з вивільненням прозапальних медіаторів і прямий токсичний вплив на слизову ШКТ.
Харчову гіперчутливість поділяють на: а) харчову IgЕ-гіперчутливість, опосередковану антитілами IgE і б) харчову IgG-гіперчутливість, зумовлену підвищеною проникністю кишечнику з подальшим потраплянням харчових продуктів у кровообіг, що супроводжується виробленням специфічних харчових антитіл IgG, зниженням рівнів протизапальних цитокінів ІЛ‑10 і [трансформувального фактора росту β1] TGF-β1 (Shakoor et al., 2016).
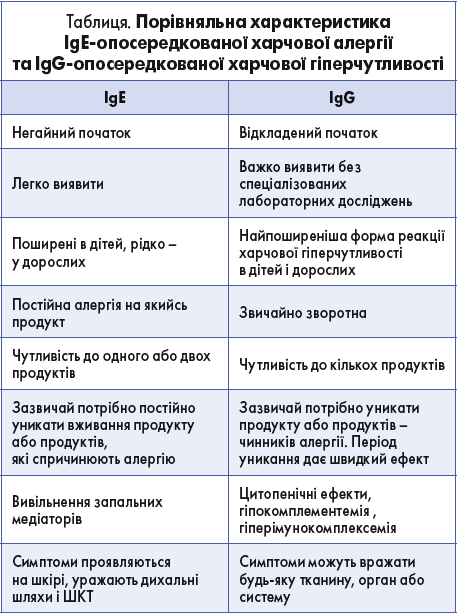
Різниця між IgЕ-опосередкованою харчовою алергією та IgG-опосередкованою харчовою гіперчутливістю передусім полягає в тому, що харчова IgЕ-алергія може бути вкрай небезпечною для життя. Клінічні і патологічні відмінності цих станів подані в таблиці.
Реакції на харчові продукти, опосередковані IgG (їх також називають харчовою гіперчутливістю, непереносимістю їжі), часто проявляються через кілька днів після впливу харчових антигенів. На відміну від IgЕ-опосередкованих харчових реакцій IgG-опосередковані реакції спричинюють симптоми кумулятивного характеру. Антитіла IgG зв’язуються безпосередньо з їжею, потрапляючи в кров і утворюючи фіксовані комплекси на клітинах і/або циркулюючі імунні комплекси.
В одному з досліджень оцінювали поширеність специфічних антитіл IgG до харчових продуктів у пацієнтів (n=71), в яких клінічно проявлялися алергічні симптоми, але лабораторні дані, які вказували б на справжню алергію, були відсутні (Zahid Shakoor et al., 2016). Більшість (85,7%) пацієнтів мали кропив’янку.
Найчастіше виявляли харчові антитіла IgG проти горіха кола – у 80,3% пацієнтів, далі йшли дріжджі – у 78,9%, пшениця – у 77,5%, червона квасоля – у 71,8%, горох – у 63,4%, кукурудза – у 62% і яєчний білок – у 62%. Проти пацієнтів-чоловіків жінки мали вищі рівні специфічних харчових антитіл IgG до часто дуже поширених харчових продуктів, особливо до пшениці (25,5 проти 74% відповідно; р<0,0001), кукурудзи (22,7 проти 77,3%; р<0,0001) і горіха кола (28,1 проти 71,9%; р<0,001). Пацієнти віком до 40 років мали вищий рівень харчових специфічних IgG до гліадину (р<0,003), яєчного білка (р<0,03) та ячменю (р<0,05), порівнюючи з пацієнтами старшого віку. Результати згаданого дослідження свідчать про можливий зв’язок харчової IgG-гіперчутливості з алергічними симптомами.
Сьогодні, завдяки появі в арсеналі лікарів діагностичного напівкількісного тесту Food Xplorer (FOX), стало можливим провести повну і ґрунтовну діагностику харчової IgG-гіперчутливості. Тест являє собою нано-технологію, яка допомагає виявити харчові антитіла IgG (IgG субкласи 1-4) до 287 харчових антигенів із 13 груп продуктів. Панель охоплює не тільки основні продукти харчування, а й ті, що не так давно з’явилися в нашому раціоні. Також тестування охоплює перехресно-реактивні карбогідратні детермінанти.
Food Xplorer можна використовувати для маніпуляцій із сироваткою крові або плазмою. Діагностику за допомогою тесту FOX має виконувати тільки спеціально підготовлений персонал і/або медичні працівники. Перш ніж розпочати дієту за результатами Food Xplorer, необхідна обов’язкова консультація алерголога, сімейного лікаря, терапевта, дієтолога.
Варто зауважити, що якісне узгодження між FOX і іншими методами IgG-тестів доволі високе, наприклад узгодження FOX із RIDA CHIP становить 81,2% для більшості пріоритетних харчових екстрактів.
Головним показанням для проведення тесту FOX є обґрунтована підозра на IgG-залежну харчову непереносимість. Водночас у низці досліджень показано переваги у визначенні харчових антитіл IgG при запальних захворюваннях кишечнику, синдромі подразненого кишечнику, депресії і мігрені.
В одному подвійному сліпому перехресному дослідженні оцінювали наявність харчових антитіл IgG у здорових волонтерів і пацієнтів із хворобою Крона. Були виявлені значущі відмінності між рівнями IgG у тих і інших. На наступному етапі, з урахуванням виявлених антитіл, було заплановано дієту. Як контроль використовували фіктивну дієту, яка не базувалася на рівні IgG. Дотримання IgG-дієти супроводжувалося зменшенням частоти дефекації на 11% проти фіктивної дієти, крім того, у пацієнтів зменшився біль у животі і покращилося загальне самопочуття (Bentz S. et al., 2010).
Підвищені рівні харчових антитіл IgG у пацієнтів із запальними захворюваннями кишечнику були виявлені і в інших дослідженнях, що свідчить на користь потенційного використання підвищених рівнів харчових антитіл IgG як маркера діагностики й лікування цих захворювань (Liu Jian et al., 2018; Hai-Yang Wang et al., 2019).
Таким чином, для належної діагностики харчової гіперчутливості і непереносимості необхідно використовувати диференційний підхід і високочутливі методи діагностики. Один із таких методів, представлений діагностичною технологією FOX, є доступним в Україні для пацієнтів і лікарів.
Питанням діагностики еозинофільного запалення дихальних шляхів присвятила свою доповідь завідувач кафедри професійних хвороб та клінічної імунології Дніпровського державного медичного університету, член Українського товариства фтизіатрів і пульмонологів, доктор медичних наук, професор Катерина Юріївна Гашинова.
 – Мабуть, БА є найпоширенішим захворюванням, у патогенезі і лікуванні якого грає роль еозинофільне запалення. Проте треба пам’ятати, що це стосується не всіх пацієнтів. Ще в 70-80-х роках минулого століття дослідники з’ясували, що популяція пацієнтів з астмою характеризується значною гетерогенністю (Johansson et al., 1969). Так, Khan та співавт. виділили алергічний і неалергічний підтипи БА (Khan et al., 1974). Із розвитком методів діагностики виникло поняття еозинофільної і нееозинофільної БА, яке згодом доповнилося інформацією про роль у патогенезі астми Т-хелперів 2 типу (Th2) і вроджених лімфоїдних клітин 2 типу (Frigas et al., 1986; Brown et al., 1958; Robinson et al., 1992; Bernink et al., 2014).
– Мабуть, БА є найпоширенішим захворюванням, у патогенезі і лікуванні якого грає роль еозинофільне запалення. Проте треба пам’ятати, що це стосується не всіх пацієнтів. Ще в 70-80-х роках минулого століття дослідники з’ясували, що популяція пацієнтів з астмою характеризується значною гетерогенністю (Johansson et al., 1969). Так, Khan та співавт. виділили алергічний і неалергічний підтипи БА (Khan et al., 1974). Із розвитком методів діагностики виникло поняття еозинофільної і нееозинофільної БА, яке згодом доповнилося інформацією про роль у патогенезі астми Т-хелперів 2 типу (Th2) і вроджених лімфоїдних клітин 2 типу (Frigas et al., 1986; Brown et al., 1958; Robinson et al., 1992; Bernink et al., 2014).
Довгий час ці особливості патогенезу не бралися до уваги при веденні хворих на БА, і в усіх пацієнтів застосовували стандартну ступінчасту терапію БА, яка не завжди була успішною. Нарешті в Глобальній ініціативі з бронхіальної астми (The Global Initiative for Asthma; GINA) 2020 на тлі ступінчастої терапії БА з’явилися рекомендації із застосування даних щодо гетерогенності популяції хворих на БА в рутинній лікарській практиці (GINA, 2020). Зокрема, рекомендації щодо терапії антагоністами лейкотрієнових рецепторів у разі 3-го і 4-го ступеня БА, визначення фенотипу БА в разі 5-го ступеня захворювання, а також щодо застосування АСІТ в пацієнтів із БА і АР, сенсибілізованих до кліщів домашнього пилу (HDM).
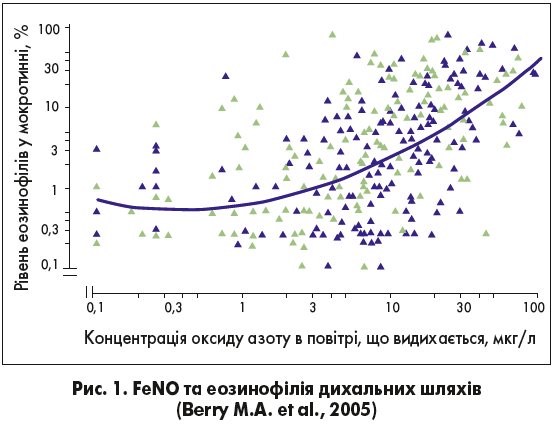
Сьогодні найважливішим завданням у веденні хворих на БА є своєчасне встановлення діагнозу з ідентифікацією типу запалення. Для цього, крім стандартного збору скарг, клінічного огляду і даних спірометрії, необхідно оцінити запальний процес за допомогою лабораторних і інструментальних методів. Зважаючи на те що в пацієнтів із БА мокротиння відходить вкрай погано, визначення в ньому еозинофілів практично неможливе. Оцінка рівня еозинофілів у периферичній крові хоч і нескладний і доволі недорогий метод обстеження, однак дуже неспецифічний. Визначення рівня загального IgG також не може використовуватися у хворих на БА, оскільки він у них часто нормальний, незважаючи на природу запалення. Ще одним методом виявлення запалення в разі БА є визначення рівня періостину, але це обстеження, крім того, що воно високовартісне, неможливо провести в більшості українських лабораторій. Проте вихід є. На сьогодні найбільш специфічним методом виявлення природи запалення при БА є визначення вмісту оксиду азоту в повітрі, що видихається (FeNO), який виражено корелює з рівнем еозинофілів у дихальних шляхах (рис. 1) (Manali Mukherjee et al., 2015; Berry M.A. et al., 2005).
Крім вибору підходу до терапії пацієнтів із БА визначення FeNO під час планових оглядів дає можливість виявити загострення ще до появи клінічної симптоматики або запобігти йому (Hanania N.A. et al., 2013).
Значимість FeNO підтверджується широким впровадженням його визначення в авторитетні світові настанови з ведення пацієнтів із БА, зокрема Американського торакального співтовариства (ATS), Американської академії алергічної астми та імунології (ААААІ), Британської торакальної спілки (ATS) та GINA.
Пристрій для надійного вимірювання FeNO, який зареєстрований у 40 країнах світу та використовується в наукових дослідженнях, рандомізованих клінічних випробуваннях і рутинній клінічній практиці, доступний і в Україні під торговою назвою NIOX FeNO. Завдяки простоті, швидкості і неінвазивності цього методу визначити FeNO можна менш ніж за 2 хв, а одноразові фільтри й можливість обробки дезінфектантами дають можливість проводити це обстеження навіть в умовах пандемії COVID‑19.
У своєму виступі доцент кафедри педіатрії № 1 Національного університету охорони здоров’я України ім. П.Л. Шупика (м. Київ), кандидат медичних наук Олена Вікторівна Шарікадзе зосередила увагу на сучасних аспектах ведення пацієнтів із сенсибілізацією до альтернарії.
 – На сьогодні відомо понад 80 видів грибів, алергенних для людини, з яких ідентифіковано 23 алергенних білки. Головною відмінністю їх від інших алергенів є високий ризик колонізації і пошкодження дихальних шляхів токсинами, ферментами і леткими органічними сполуками (Gravesen S. et al., 1999).
– На сьогодні відомо понад 80 видів грибів, алергенних для людини, з яких ідентифіковано 23 алергенних білки. Головною відмінністю їх від інших алергенів є високий ризик колонізації і пошкодження дихальних шляхів токсинами, ферментами і леткими органічними сполуками (Gravesen S. et al., 1999).
Імунологічні механізми, які лежать в основі розвитку сенсибілізації до грибкових алергенів, представлені реакціями гіперчутливості І, ІІ, ІІІ та ІV типів. Клінічно захворювання може проявлятися симптомами АР, БА, кропив’янки, атопічного дерматиту (АД) та ін.
Грибкова сенсибілізація, основним механізмом якої є молекулярна мімікрія, також призводить до аутореактивності щодо власних антигенів унаслідок наявності спільних епітопів між грибковими і людськими білками. Перехресна реактивність була продемонстрована для MnSOD (Fluckiger S., 2002; Wagner S., 2001), циклофіліну (Glaser A.G., 2006), кислотного рибосомного білка Р2 (Appenzeller U., 1999) і тіоредоксину (Weichel, 2006). У дослідженні патогенезу АД 36% пацієнтів із колонізацією шкіри Malassezia sympodialis мали sIgE проти MnSOD людини (Schmid-Grendelmeier P. et al., 2005).
Частота алергії на цвіль становить від 6 до 24% у загальній популяції, 44% – у хворих на АД, 45% – у дитячій популяції та 80% – у дорослих пацієнтів із БА. При цьому для багатьох цвілевих грибів характерна перехресна реактивність алергенів (альдегіддегідрогенази, лужної серинпротеази, енолази та ін.) з гомологічними IgE-реактивними білками в негрибкових видів. Саме тому для підбору адекватної АСІТ алергії на альтернарію варто використовувати багатокомпонентні дослідження, зокрема кількісне дослідження ALEX2, яке забезпечує тестування максимальної кількості алергенів (178 молекул + 117 екстрактів + tIgE). ALEX2 охоплює більш як 99% усіх стандартних діагностичних тестів і є єдиною системою з інтегрованою здатністю блокування антитіл до CCD. Система RAVEN забезпечує зручну інтерпретацію і повний аналіз результатів ALEX2 окремо для пацієнта і лікаря.
Наступним кроком після молекулярної алергодіагностики є проведення АСІТ, особливо актуальнї в дітей.
Переваги раннього початку АСІТ в педіатричній популяції:
- випадки найтяжчого перебігу БА частіше виникають у ранньому дитячому віці;
- алергічний компонент астми вираженіший у дітей і підлітків;
- АСІТ у дітей знижує ризик розвитку БА і полісенсибілізації;
- у дітей із БА підвищена загроза формування хронічного обструктивного захворювання легень.
Зважаючи на меншу інвазивність, при виборі шляху АСІТ у дітей зазвичай віддають перевагу SLIT препаратом Oraltek®. Вакцина у формі спрею, на відміну від крапель, покриває велику площу слизової оболонки порожнини рота, що забезпечує більше поглинання антигенпрезентувальними клітинами, високу концентрацію алергену без розведення слиною і ефективніший контроль призначеної дози і режиму лікування.
Ефективність SLIT препаратом Oraltek® оцінювалася у власному порівняльному дослідженні за участю дітей, хворих на БА й АР, із сенсибілізацією до алергенів цвілевих грибів Alternaria alternatа. Пацієнти були розділені на 2 групи, одна з яких отримувала симптоматичну терапію і АСІТ впродовж 36 міс, а друга – виключно симптоматичну терапію. Критерієм ефективності були результати шкірного прик-тесту і вираженість симптомів БА за візуальною аналоговою шкалою (ВАШ) перед і після АСІТ. У результаті було виявлено достовірне зменшення вираженості симптомів утрудненого дихання [із 54 (46;61) до 7 (6;9)] і кашлю [із 50 (39;57) до 7 (6;9)] у пацієнтів групи Oraltek® проти групи контролю, де в учасників вираженість утрудненого дихання зменшилася із 45 (41;51) до 40 (32;41), а кашлю – із 55 (47;67) до 37 (33;42).
За весь період спостереження не було зафіксовано тяжких системних реакцій, а побічні ефекти проявлялися у вигляді орального алергічного синдрому (3,4% пацієнтів) та загострення АР.
Таким чином, використання SLIT стандартизованими лікувальними екстрактами (Oraltek®) є ефективним і безпечним методом лікування дітей із сенсибілізацією до Alternaria alternаta.
Сенсибілізація до алергенів кліщів домашнього пилу та їх клінічне значення – такою була тема виступу асистента кафедри клінічної імунології та алергології з курсом медичної генетики НМУ ім. О.О. Богомольця Сергія Дмитровича Юр’єва.
 – У світі від 65 до 130 млн людей страждають на алергію до HDM. Щонайменше 50% пацієнтів із БА і 45% хворих на АР мають сенсибілізацію до HDM (Calderon M.A. et al., 2015).
– У світі від 65 до 130 млн людей страждають на алергію до HDM. Щонайменше 50% пацієнтів із БА і 45% хворих на АР мають сенсибілізацію до HDM (Calderon M.A. et al., 2015).
Клінічно релевантні алергени HDM представлені на рисунку 2.
Згідно з результатами власного дослідження за участю пацієнтів з алергією (n=741), обстежених за допомогою молекулярного мультиплексного тесту ALEX2, 135 (18,22%) учасників були сенсибілізовані принаймні до одного алергену HDM. У профілі сенсибілізації пацієнтів з атопією серед алергенів HDM переважали молекули Der p 2, Der f 2, Der p 1 і Der p 23.
Сенсибілізацію до Der p 1 і Der p 2 виявляють у 63-97% пацієнтів з АР і БА. Рання сенсибілязація дітей до цих алергенів пов’язана з розвитком БА, а Der p 1 є найвагомішим алергенним компонентом для ефективної АСІТ.
Der p 23 – це ще один головний клінічно значущий алерген, який міститься на поверхні фекальних частинок кліщів і до якого сенсибілізовані 74% пацієнтів з алергією до HDM. Ідентичність амінокислотної послідовності між Der p 23 і відповідного гомолога Dermatophagoides farinae Der f 23 становить 87%. Сенсибілізація до Der p 1 і/або Der p 23 у дітей до п’ятирічного віку є предиктором БА в шкільному віці (Becker S. et al., 2016).
Отже, з огляду на вищезазначене і результати нещодавно опублікованого дослідження EAACI, визначення сенсибілізації тільки до Der p 1 і Der p 2 недостатньо для визначення алергії до HDM. Der p 23 незамінний для діагностики і пояснює, чому всі молекулярні тест-системи, що містили Der p 23, були більш чутливі. Додаткове дослідження з Der p 10 і 20 також підвищує чутливість тестування. Крім того, Der p 5, 7, 11 і 21 потребують подальшого клінічного дослідження (Lukas Koch et al., 2020).
Тестовою системою, яка оцінює всі згадані компоненти HDM, є ALEX2, параметри вимірювання якої відповідають еталонним параметрам ВООЗ. Крім широкого спектра алергенів методика характеризується внутрішнім і зовнішнім контролем якості, який проводиться за допомогою штрих-коду і 4 контрольних точок у кожному чіпі, що й забезпечує точність параметрів тестування. Перевірку проводять кожні 60 днів або за потреби. Аналіз зображень на чіпі зчитується за допомогою ImageXplorer і програмного комплексу Raptor (Австрія) – у ньому застосовується штучний інтелект, що нівелює вплив людського фактора. Згідно з результатами формується звіт щодо профілю сенсибілізації пацієнта. Усі ці переваги дають можливість провести належну молекулярну алергодіагностику і відібрати пацієнтів для проведення АСІТ.
Навіть короткий огляд виступів на Першій конференції з міжнародною участю «Простір доказової алергології» показує, що учасники заходу отримали можливість ознайомитися не лише з результатами новітніх досліджень в їх галузі, а також із сучасними настановами, заснованими на доказах, але й із практичними аспектами застосування отриманих знань у своїй повсякденній лікарській практиці.
Підготувала Ганна Кирпач