18 серпня, 2021
Сучасні аспекти лікування акромегалії: практичний досвід застосування пегвісоманту
10-12 червня 2021 року відбулося чергове засідання науково-освітнього проєкту «Школа ендокринолога», на якому, за традицією, було заслухано доповіді на найактуальніші теми ендокринологічної галузі. Однією з таких тем стала акромегалія – серйозна патологія, чиї діагностика й лікування часто ставлять перед лікарями-практиками складні питання. У цьому огляді ми розглянемо дві доповіді, присвячені акромегалії.
Ключові слова: акромегалія, соматотропний гормон, інсуліноподібний фактор росту‑1
Про сучасні аспекти хірургічного лікування акромегалії і місце в ньому пегвісоманту розповів головний науковий співробітник відділу нейроонкології та нейрохірургії дитячого віку ДУ «Інститут нейрохірургії ім. А.П. Ромоданова НАМН України» (м. Київ), голова ГО «Українська гіпофізарна спілка», доктор медичних наук Микола Олександрович Гук. 
Акромегалія – тяжке системне захворювання, яке лімітує тривалість життя хворих. Епідеміологічні дані свідчать, що за відсутності лікування смертність збільшується на 70%. При цьому половина нелікованих пацієнтів помирає у віці до 50 років (Bex et al., 2007; Trepp et al., 2005; Holdaway et al., 2004; Arita et al., 2003).
Згідно з міжнародними протоколами метою лікування акромегалії є:
- контроль біохімічних показників активності інсуліноподібного фактора росту (ІФР)-1 і соматотропного гормону (СТГ);
- контроль розміру пухлини і запобігання локальному мас-ефекту;
- зменшення ознак і симптомів захворювання;
- запобігання супутнім захворюванням і/або поліпшення їх перебігу;
- запобігання передчасній смерті.
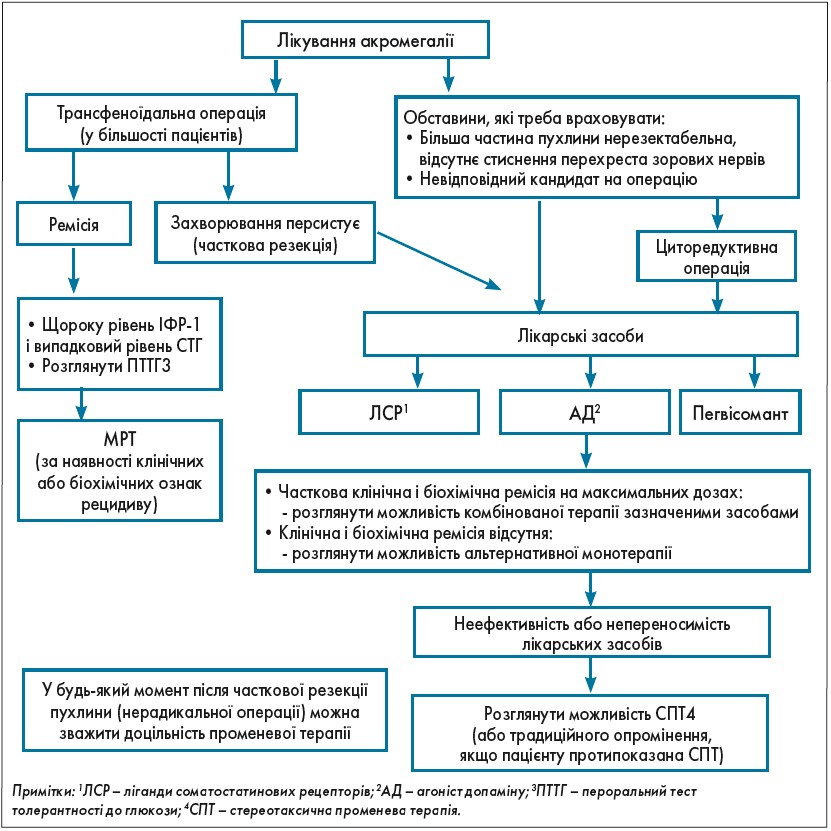
Для досягнення всіх згаданих цілей необхідно якомога раніше призначати ефективну терапію, спрямовану на зниження рівнів ІФР‑1 і СТГ, і регулярно проводити клінічну оцінку і корекцію супутніх захворювань. Лікування акромегалії і коморбідних патологій складне і потребує комплексного підходу із залученням багатопрофільної команди лікарів, які є експертами в лікуванні пухлин гіпофіза. Алгоритм лікування пацієнта з акромегалією подано на рисунку.
Рис. Акромегалія: настанова з клінічної практики ESE (European Society of Endocrinology – Європейського товариства ендокринологів) (Katznelson et al., 2014)
Найкращою терапією акромегалії є хірургічна резекція аденоми гіпофіза досвідченим нейрохірургом. Вимоги до сучасного оперативного лікування акромегалії:
- досвід хірурга не менше ніж 50 трансназальних операцій на рік;
- сучасне оснащення – HD-ендоскоп, мікроскоп, хірургічний доплер, мікроінструментарій;
- робота в спеціалізованому хірургічному центрі з можливістю мультидисциплінарної взаємодії нейрохірургів, ендокринологів і радіологів.
Дані власних спостережень ДУ «Інститут нейрохірургії ім. А.П. Ромоданова НАМН України» свідчать, що впродовж останніх 20 років хірургія соматотропних аденом гіпофіза суттєво вдосконалилася. Так, покращення лабораторної та інструментальної діагностики сприяло зменшенню кількості вкрай тяжких випадків акромегалії (із максимальним загальносоматичним ризиком для операції) з 22% у 1998 р. до 9% у 2008-му і проведенню оперативних втручань на більш ранніх стадіях захворювання. Ендоскопія дала можливість підвищити радикальність нейрохірургічних операцій, а сучасні медикаментозні засоби – покращити передопераційну підготовку хворих на акромегалію. У результаті післяопераційна летальність при акромегалії зменшилася з 4,2% (1992-1997 рр.) спочатку до 1,5% (1998-2008 рр.), а на сьогодні – до нуля.
Незважаючи на те що трансфеноїдальна операція залишається першою лінією терапії в більшості пацієнтів, довготривалий контроль біохімічних показників після хірургічної резекції вдається досягти у менш ніж 65% пацієнтів, навіть при використанні новітніх хірургічних методів.
Згідно з Консенсусним заключенням щодо результатів лікування акромегалії (Shlomo Melmed et al., 2018) медикаментозна терапія рекомендована всім пацієнтам за відсутності клініко-гормональної ремісії (незважаючи на хірургічну резекцію аденоми), а також тим хворим, яким не рекомендоване хірургічне лікування.
У настановах із клінічної практики Європейського та Американського товариств ендокринологів засобами медикаментозної терапії акромегалії є ліганди соматостатинових рецепторів (ЛСР) – ланриотид, октреотид, пасериотид; агоністи допаміну (АД) – каберголін, бромкрептин і блокатор рецепторів гормону росту – пегвісомант. Необхідно зауважити, що кожен клас препаратів має переваги в певних клінічних ситуаціях, і в разі агресивного перебігу захворювання доволі часто призначають комбіноване лікування (ЛСР + пегвісомант, ЛСР + каберголін, пегвісомант + каберголін)
Розглянемо переваги пегвісоманту.
- Згідно з інструкцією блокатор рецепторів гормону росту (пегвісомант) показаний для лікування акромегалії в пацієнтів із недостатньою відповіддю на хірургічне втручання чи радіотерапію або для яких ці види терапії не є прийнятними. Метою лікування є нормалізація рівня інсуліноподібного фактора росту I (IФР-I) в сироватці крові.
- Основна перевага пегвісоманту є доволі швидка нормалізація рівнів сироваткового ІФР-1 у більшості пацієнтів з акромегалією. Зв’язуючися з рецепторами ГР, він нівелює клінічну симптоматику, спровоковану його підвищенням, зокрема збільшення розмірів носа, кінцівок, губ, язика і набряк тканин, останнє може стати на заваді хірургічного лікування пацієнтів. Крім того, перевагою пегвісоманту перед іншими препаратами для лікування цієї патології є достовірний позитивний вплив на толерантість до глюкози і чутливість до інсуліну.
Щодо передопераційної медикаментозної терапії, то її не рекомендується застосовувати рутинно, проте в пацієнтів із вираженим потовщенням тканин глотки й апное уві сні або гіперсистолічною серцевою недостатністю (СН) пропонується застосовувати консервативне лікування перед операцією для зменшення операційного ризику, зумовленого тяжкими супутніми захворюваннями (Katznelson et al., 2014).
Пацієнтам, які отримують пегвісомант, пропонується періодично виконувати МРТ для оцінки розміру пухлини і здійснювати моніторинг показників функції печінки щомісяця впродовж перших 6 міс і надалі – 1 раз на півроку.
Оскільки і АСС, і пегвісомант рекомендовані пацієнтам із вираженими ознаками захворювання, важко визначити, що саме обрати для тих хворих, які раніше не отримували лікування. Відповіддю на це питання стали результати 52-тижневого багатоцентрового відкритого дослідження за участю пацієнтів з акромегалією (n=118), які до цього не отримували променеву або медикаментозну терапію (Chigo E. et al., 2009). Учасників рандомно поділили на 2 групи, перша з яких (n=56) отримувала пегвісомант у дозі 10 мг/добу впродовж перших 8 тиж із підвищенням дози на 5 мг/добу з інтервалами 8 тиж до максимальної дози 30 мг/добу. Учасники другої групи (n=57) спочатку отримували октреотид короткої дії в дозі 50 мг 3 р./добу впродовж 4 тиж, а потім – октреотид ЛАР у дозі 20 мг кожні 4 тиж впродовж 3 міс із підвищенням дози на 10 мг кожні 16 тиж до максимальної дози 30 мг або 40 мг кожні 4 тижні.
Було встановлено, що в пацієнтів із вихідним рівнем ІФР‑1 більш як удвічі вище верхньої межі норми (ВМН) нормалізація біохімічних показників при застосуванні пегвісоманту відбувалася швидше, ніж на октреотиді (р=0,05). Середній відсоток зниження від вихідного рівня ІФР‑1 на 24-му і 52-му тиж також був вищим у групі пегвісоманту, якщо порівняти з октреотидом (р=0,04), особливо в пацієнтів із вихідним рівнем ІФР‑1, більш як удвічі вищим за ВМН. Якщо рівень ІФР‑1 підвищувався менш ніж удвічі, середній відсоток зниження від вихідного рівня ІФР‑1 був зіставним в обох групах (р=0,86). Обидві групи досягли порівнянних покращень у розмірі обручки, загальних і індивідуальних ознаках і симптомах акромегалії, а також загальних балів за шкалою ACROQol. Крім того, індекси контролю глікемії покращилися на пегвісоманті і погіршилися на октреотиді.
Побічні явища, пов’язані з лікуванням, були легкими і середньої тяжкості в обох групах, середні зміни розміру пухлин – порівнянними в обох групах. Клінічно значуще підвищення рівнів печінкових ферментів (>3×ВМН) спостерігали в 4 (7%) пацієнтів групи пегвісоманту і в 4 (7%) – групи октреотиду.
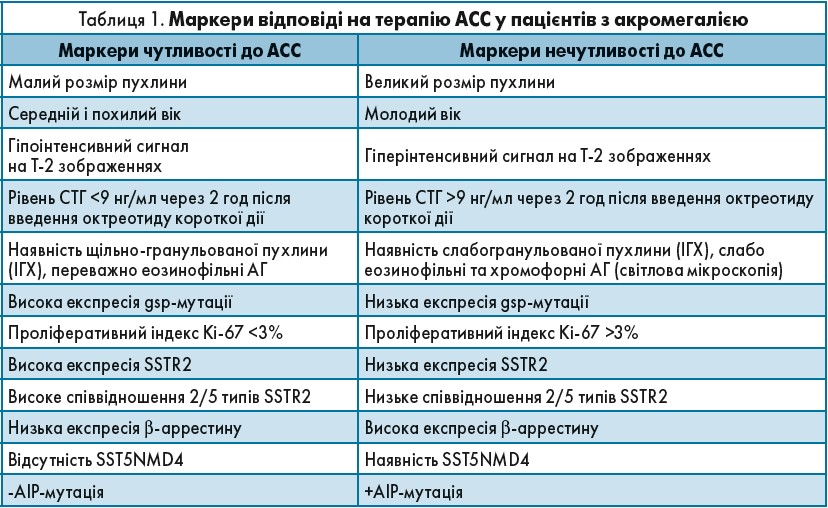
Необхідно зауважити, що в багатьох пацієнтів з акромегалією відсутня відповідь на терапію АСС. Визначальними чинниками відповіді є (Katznelson et al., 2014):
- експресія SST2 у тканині корелює з відповіддю на АСС;
- менші за розміром пухлини і нижчі рівні СТГ і ІФР‑1 є прогностичними чинниками відповіді;
- щільно-гранульовані аденоми частіше реагують на терапію АСС проти більш поширених слабо-гранульованих аденом;
- Т2-зважені зображення пухлини низької інтенсивності на МРТ, які корелюють із щільно-гранульованими пухлинами, прогнозують сприятливу відповідь на АСС.
Таким чином, імуногістохімічна (ІГХ) діагностика пухлин дає можливість визначити відповідь на терапію АСС. Маркери чутливості і нечутливості до АСС представлені в таблиці 1.
Отже, при тотальному аналізі пухлин гіпофіза лише невелика частина відповідатиме на терапію АСС. Проте сьогодні доступні інші терапевтичні опції, зокрема пегвісомант.
Для кращого розуміння практичних аспектів діагностики і ведення пацієнтів з акромегалією варто розглянути один цікавий клінічний випадок.
Клінічний випадок 1
Пацієнтка, 25 років, звернулася на консультацію до ендокринолога зі скаргами на аменорею впродовж 3 міс і зоровий дискомфорт. Під час лабораторних досліджень виявлено підвищення рівня пролактину до 145 нг/мл, а на МРТ – ендосупраселярну аденому гіпофіза. Ендокринолог встановив діагноз: «Пролактинома» і, відповідно, призначив достинекс.
Через 4 міс прийому двох таблеток достинексу на тиждень розміри аденоми гіпофіза зменшилися, менструальний цикл відновився, рівень пролактину знизився до 11 нг/мл, хвора вийшла заміж. Однак на тлі покращення первинної симптоматики з’явилися болі в правій половині обличчя і набряки пальців рук і ніг, із приводу чого вона звернулася до Інституту нейрохірургії.
Треба зауважити, що болі за ходом трійчастого нерва характерні для 30% випадків акромегалії.
Скарги дали підстави запідозрити акромегалію, і пацієнтці був визначений рівень СТГ, який становив 47 нг/мл. Було встановлено діагноз: «Акромегалія. Мамосоматотропінома» (аденома гіпофіза, яка секретує СТГ і пролактин).
Така пухлина спостерігається в 12-15% акромегалії. Її особливість у тому, що в разі пригнічення секреції пролактину зростає продукція гормону росту і з’являються або прогресують симптоми акромегалії.
Згідно з міжнародною консенсусною схемою показано хірургічне лікування, яке і було виконане пацієнтці. Прогноз у хворої сприятливий, і за умови належного подальшого спостереження тривалість і якість її життя не постраждають.
Із власним досвідом клінічного використання пегвісоманту у хворих на акромегалію поділилася провідний науковий співробітник вдділу орфанних захворювань ДУ «Інститут ендокринології та обміну речовин ім. В.П. Комісаренка НАМН України», кандидат медичних наук Лариса Андріївна Луценко. 
Метою лікування хворих на акромегалію є досягнення рівня ІФР-1 у сироватці, що відповідає віковій нормі, і рівня ГР при випадковому визначенні <1,0 мкг/л. При цьому бажано використовувати той самий метод визначення рівнів СТГ і ІФР‑1 упродовж усього періоду лікування (Katznelson et al., 2014).
Незважаючи на те що лікування акромегалії переважно хірургічне, подальший нагляд за пацієнтом і медикаментозну терапію зазвичай здійснює лікар-ендокринолог. Інколи йому доводиться стикатися з низкою практичних питань, тому для кращого розуміння алгоритму їх вирішення розглянемо декілька клінічних випадків.
Клінічний випадок 2
Пацієнтка, 1981 р. н., уперше звернулася до ендокринолога 2016 року зі скаргами на зміну зовнішнього вигляду, набряки кистей і стоп, шкірні висипання. Був запідозрений діагноз: «Акромегалія», у зв’язку з чим було проведено лабораторно-інструментальне дообстеження і консультацію офтальмолога. Результати обстежень подані в таблиці 2.
На основі отриманих даних був встановлений діагноз: «Аденома гіпофіза. Акромегалія» і рекомендоване оперативне лікування. У лютому 2016 року було проведено ендоскопічне видалення пухлини, із залишенням інфільтрованого пухлиною гіпофіза. За допомогою патогістологічного заключення ідентифіковано аденому гіпофіза перехідного типу. Діагноз було доуточнено: «Ендосупрапараселярна (праворуч) аденома гіпофіза. Акромегалія, прогресуючий перебіг».
Оскільки частину пухлини було залишено, у жовтні 2016 року було призначено медикаментозне лікування ланреотидом. Препарат пацієнтка купувала за власні кошти. Їх не завжди вистачало, тому терапію доводилося переривати. Із березня 2016 по грудень 2018 року значення СТГ коливалися в межах 28,2-38,3 нг/мл, а ІФР‑1 – 138-1299 нг/мл, тобто біохімічного і терапевтичного контролю досягти не вдавалося.
У грудні 2018 року хворій було проведено радіохірургічне лікування. Результати лабораторних обстежень із січня 2019 по лютий 2021 року: СТГ – 53,4-10,1 нг/мл, ІФР‑1 – 666-448 нг/мл. Пацієнтка продовжувала отримувати ін’єкції ланреотиду, останню – 16.01.21 р. Оскільки лікування виявилося неефективним, було вирішено додати до схеми терапії пегвісомант у дозі 20 мг/добу підшкірно.
Пегвісомант – антагоніст рецептора СТГ, механізм дії якого полягає у зв’язуванні із сайтом 1 рецептора СТГ, але, на відміну від СТГ, він не залучає сайт 2. Трансдукція сигналу не відбувається, і блокується дія на рецептор ендогенного СТГ (Brooks A.J. et al., 2018). Таким чином, пегвісомант конкурує з ендогенним ГР за зв’язування з його рецептором і блокує периферичне продукування ІФР-1.
Препарат вводять підшкірно, рекомендований діапазон дозування – від 10 до 30 мг 1 раз на добу (переважно при монотерапії) або 1-2 рази на тиждень при комбінації пегвісоманту з ЛСР. Ефект препарату є дозозалежним, а доза 40 мг щоденно сприяє нормалізації рівня ІФР‑1 у 95% пацієнтів (слід зазначити, що ця доза не зареєстрована в Україні). Утім дані моніторингового дослідження (n=1288) показали, що рівень ІФР‑1 на пегвісоманті був контрольованим у 63% учасників. Імовірна причина розбіжностей у показниках ефективності – недотримання режиму лікування в реальній практиці і неналежне титрування дози, якщо порівняти з контрольованими клінічними дослідженнями (Katznelson et al., 2014).
Фактори, які впливають на необхідну дозу пегвісоманту (Parkinson C. et al., 2007; van der Lely A.J. et al., 2014; Neggers S.J. et al., 2007; Droste M. et al., 2014):
- вихідний рівень ІФР‑1 (позитивна кореляція);
- жіноча стать (необхідна вища доза);
- вік;
- індекс маси тіла (ІМТ) / вага (позитивна кореляція);
- попередня променева терапія (необхідна нижча доза);
- застосування пероральних естрогенів (необхідна вища доза);
- наявність цукрового діабету (ЦД).
Залежність дози пегвісоманту від статі зумовлена тим, що в здорових жінок секреція СТГ впродовж 24 год утричі вища, ніж у чоловіків того ж віку (незважаючи на однакові рівні ІФР‑1). Це передбачає можливість потреби більших доз пегвісоманту в жінок.
Ретроспективне дослідження С. Parkinson та співавт. показало, що жінкам були необхідні середні дози пегвісоманту з урахуванням ваги на 4,7 мг/добу вищі, ніж чоловікам (р=0,001). Отримані результати схожі з даними ретроспективного дослідження Marazuela та співавт., в якому було встановлено, що в чоловіків відповідь на однакові дози була краща (більше зниження рівнів ІФР‑1 і вищий шанс нормалізації) за таку в жінок (Parkinson C. et al., 2007; Marazuela М. et al., 2009).
Отже, пацієнтці було призначено пегвісомант у дозі 20 мг/добу підшкірно щодня. На момент призначення рівень СТГ становив 10,1 нг/мл, ІФР‑1 – 448 нг/мл; через 2 тиж після початку ін’єкцій рівень СТГ знизився до 9,91 нг/мл, ІФР‑1 – до 149 нг/мл (норма 43-209). Таким чином, спостерігався біохімічний контроль захворювання, і було рекомендовано продовжити лікування.
ГР-секретуюча пухлина гіпофіза не є мішенню пегвісоманту, тому гіперсекреція ГР може зберігатися під час прийому препарату. Отже, вибір і корекція дози мають здійснюватися на основі концентрації ІФР-1 незалежно від концентрації СТГ
Через 3 тиж після початку ін’єкцій хвора звернулася зі скаргами на погане самопочуття, нудоту, спрагу, сонливість, підвищення артеріального тиску (АТ). Зважаючи на те що пацієнтка тривожна і метеочутлива, їй були призначені седативні препарати і рекомендовано продовжити лікування. Через 5 днів після появи скарг АТ і загальний стан нормалізувалися.
Результати лабораторних обстежень за 10.03.21: ІФР‑1 – 127 нг/мл, аланінамінотрансфераза (АЛТ) – 14 Од/л; аспартатамінотрансфераза (АСТ) – 21 Од/л; білірубін – 8,4-3,0-5,4, глюкоза – 4,7-6,1 ммоль/л. Був рекомендований пегвісомант у дозі 20 мг через день підшкірно з подальшим переглядом дози і зменшенням її до мінімально ефективної.
Треба зауважити, що пацієнтці не проводилася ІГХ оцінка пухлини, яка б дала можливість спрогнозувати відповідь на терапію ЛСР і уникнути дороговартісного лікування. Ця пацієнтка є ідеальним кандидатом для терапії пегвісомантом, оскільки її неможливо вилікувати хірургічним шляхом, а відповідь на монотерапію ЛСР є неадекватною. Підтвердженням цього є нормалізація рівня ІФР‑1 уже через 2 тиж після ініціації пегвісоманту. Прогноз щодо досягнення біохімічної цілі лікування в пацієнтки позитивний. На жаль, проведене радіохірургічне лікування в майбутньому ймовірно спричинить гіпопітуїтаризм, а це може завадити настанню бажаної для хворої вагітності.
Варто пом’ятати, що до початку терапії пегвісомантом необхідно оцінити вихідний рівень показників функції печінки пацієнта (сироватковий рівень аланінамінотрансферази (АЛТ), аспартатамінотрансферази (АСТ), загального білірубіну сироватки крові (ЗБСК) та лужної фосфатази) і врахувати всі рекомендації щодо початку терапії на основі вихідного рівня показників функції печінки. Надалі рекомендовано здійснювати моніторинг показників функції печінки, а саме АЛТ, АСТ під час терапії пегвісомантом.
Це зумовлено повідомленнями про підвищення рівнів указаних показників на тлі терапії згаданим препаратом.
Реєстр ACROSTUDY 1288 пацієнтів показує частоту такого підвищення на рівні 2,5% (van der Lely A.J. et al., 2014). Ці зміни зазвичай минущі і часто повертаються до норми без відміни препарату (Neggers S.J. et al., 2009).
Найчастіше рівні печінкових ферментів підвищуються в разі прийому комбінації АСС + пегвісомант і в пацієнтів із ЦД, які використовують зазначену комбінацію (Neggers S.J. et al., 2007; Neggers S.J. et al., 2009).
Крім того, деякі клінічні дослідження вказують на те, що пацієнти з ЦД можуть потребувати вищих доз пегвісоманту (van der Lely A.J. et al., 2014; Droste M. et al., 2014). Припускають, що це може бути пов’язано з вищим числом печінкових рецепторів СТГ у пацієнтів із ЦД, але така ситуація спостерігається не завжди (Neggers S.J. et al., 2007).
Ще одним аспектом безпеки при використанні пегвісоманту є ріст пухлини.
Згідно з даними ACROSTUDY (n=1213), частота збільшення розміру пухлини гіпофіза, підтвердженого даними МРТ, становить 3,2% загальної когорти (van der Lely A.J. et al., 2014). У 1-3% випадків пухлина продовжує рости незалежно від режиму терапії (Colao A. et al., 2006). Відповідно, у третині випадків ріст пухлини є наслідком персистуючого збільшення розміру пухлини, без додаткового збільшення швидкості росту після початку терапії пегвісомантом. Ще третина випадків асоціювалася із синдромом відміни АСС, тобто пухлина просто відновлювала свій попередній розмір, а не прогресувала (Buchfelder M. et al., 2009).
Клінічний випадок 3
Пацієнтка, 1962 р.н., вважає себе хворою з 2015 року, коли помітила зміну рис обличчя. 2016 року при проведенні МРТ було виявлено аденому гіпофіза і проведено ендоскопічне видалення пухлини. Медикаментозного лікування в післяопераційний період хвора не отримувала.
У кінці 2019 року симптоми повернулися і підвищився рівень СТГ, із приводу чого в березні 2020 року було проведено повторне оперативне видалення аденоми. Однак симптоматика не зникала, рівні СТГ і ІФР‑1 після операції становили 4 нг/мл і 516 нг/мл відповідно.
У червні 2020 року хвора була проконсультована у відділенні радіохірургії, де їй рекомендували медикаментозне лікування. Отримала 2 ін’єкції ланреотиду, але, з огляду на діарею, біль у ногах, наявність каменю в жовчному міхурі, препарат було відмінено.
У лютому 2021 року пацієнтці рекомендували пегвісомант по 10 мг/добу підшкірно, який вона отримувала протягом 3 міс, останні 3 тиж – у дозі 10 мг/добу через день (перейшла самостійно). У результаті скарги зникли, перестав турбувати біль у ногах.
Аналіз крові від 2.06.2021 року: ІФР‑1 – 249 нг/мл, АЛТ, АСТ – у нормі. Повторне МРТ не виявило ознак прогресування пухлини на тлі терапії пегвісомантом.
Таким чином, пацієнтка відповіла на терапію пегвісомантом, однак самостійне зниження дози, імовірно, завадило досягти контролю рівня ІФР‑1. Необхідно продовжити лікування і, за потреби, скорегувати дозу.
Як уже зазначалося, лікування пегвісомантом потребує:
- моніторингу показників функції печінки – 1 р./міс упродовж перших 6 міс і надалі 1 р./6 міс;
- послідовних візуалізаційних досліджень через 6 і 12 міс після початку лікування і, у подальшому (якщо розмір пухлини не змінився за рік) – 1 р./рік.;
- візуалізаційних спостережень за станом шкіри та підшкірно-жирової клітковини в місці ін’єкцій.
***
Блок доповідей завершився відповідями на деякі практичні питання учасників засідання. Перше питання адресувалося Миколі Олександровичу Гуку і стосувалося описаного ним клінічного випадку.
? У наведеному випадку клінічна картина і відповідь на лікування вказували на пролактиному. Чи це означає, що всім пацієнтам із підвищеним рівнем пролактину треба додатково визначати рівні СТГ і ІФР‑1 для раннього виявлення мамосоматотропіном?
– Насправді дещо в описаному випадку не вкладалося в картину пролактиноми, а саме рівень пролактину, який для підтвердження діагнозу мав бути не нижчим 250 нг/мл. У пацієнтки рівень пролактину не підіймався вище 145 нг/мл. Треба розуміти, що на практиці, якщо рівень пролактину становить до 100 нг/мл, навряд вдасться щось виявити в гіпофізі. Водночас при рівнях гормону в діапазоні від 100 до 250 нг/мл доцільно провести скринінг на всі гіпофізарні гормони для уточнення діагнозу, у тому числі і ІФР-1 для виключення або підтвердження саме діагнозу акромегалії.
? Якою має бути клінічна тактика при ізольованому підвищенні рівнів СТГ без ІФР‑1, і навпаки?
– У 98% випадків підвищення рівня ІФР‑1 – це головний біохімічний критерій акромегалії, тому потрібно шукати патологію гіпофіза. У 2% випадків причиною ізольованого підвищення рівня СТГ з невеликим підйомом рівня ІФР‑1 можуть стати пухлини APUD-системи, зокрема гормон-секретувальний карциноїд легень. У такому разі доцільно проводити неодноразові онкоскринінги і МРТ з контрастом для пошуку пухлини. Утім ця патологія надзвичайно рідкісна: за останні 10 років серед 500 випадків пухлин гіпофіза тільки в трьох було виявлено карциноїд легень.
? У дослідженнях було виявлено, що в деяких онкохворих з інсулінорезистентністю зменшується рівень глобуліну, що зв’язує ІФР‑1. Відповідно, у цієї групи пацієнтів рівень ІФР‑1 підвищений. За яких умов таких пацієнтів треба дообстежувати, наприклад робити МРТ мозку?
– Оскільки патогенез цього стану абсолютно зрозумілий, додатково обстежувати пацієнтів без проявів акромегалії недоцільно.
Підготувала Ганна Кирпач