7 листопада, 2021
Тромбопрофілактика при коронавірусній інфекції: від рекомендацій до практики
Збільшення частоти тромбоемболій, спричинених COVID‑19, стало глобальною проблемою. Вважається, що тромбогенний потенціал вірусу SARS-CoV‑2 зумовлений його здатністю викликати надмірну запальну реакцію, що призводить до ендотеліальної дисфункції. Антикоагулянти залишаються основним засобом лікування тромбоемболії протягом десятиліть. Однак немає універсального консенсусу щодо часу проведення, дозування та тривалості антикоагулянтної терапії при COVID‑19, а також щодо необхідності профілактичного введення антикоагулянтів після виписки. У статті переглянуті нинішні вказівки та рекомендації, а також поточні дослідження застосування антикоагулянтів при COVID‑19 і запропонована стратегія щодо застосування цих препаратів під час пандемії.
Ключові слова: тромбопрофілактика, COVID‑19, антикоагулянти, тромбоемболія, ендотеліальна дисфункція.
11 березня 2020 року інфекційне захворювання COVID‑19 було оголошене Всесвітньою організацією охорони здоров’я пандемією і призвело до глобальної кризи системи охорони здоров’я. Протягом останніх кількох місяців у літературі з’явилася велика кількість даних про підвищений ризик тромбоемболії через COVID‑19 [2]. Одна з гіпотез пояснює патофізіологію розвитку протромботичного стану при COVID‑19 надмірною запальною реакцією, що призводить до активації каскаду згортання крові та ушкодження ендотелію [3, 4]. Сьогодні антикоагулянти при COVID‑19 застосовуються навмання, адже не опубліковано чітких вказівок щодо вибору препаратів, а також оптимальних термінів, дозування та тривалості антикоагулянтної терапії. Більшість опублікованих на міжнародному рівні рекомендацій, заснованих на консенсусних заявах та висновках експертів, передбачають уведення терапевтичних доз гепарину лише пацієнтам із діагнозом чи підозрою на тромбоемболію легеневої артерії (ТЕЛА) або тромбоз глибоких вен (ТГВ). Однак ці вказівки, включаючи рекомендації CHEST, рідко містять настанови щодо тромбопрофілактики після виписки пацієнта.
Типи антикоагулянтів та підходи до їх використання
Антикоагулянти є основою профілактики й лікування тромбозу. Вони класифікуються виходячи з механізмів дії.
Гепарин був першим справжнім антикоагулянтом. Очищений гепарин, включно з нефракціонованим (НФГ) та низькомолекулярним (НМГ) гепарином, діє, сприяючи утворенню проміжного комплексу «протеаза – гепарин – антитромбін», який, у свою чергу, сприяє пригніченню тромбіну та активованого фактора X (Ха) [7]. Він використовується для профілактики й лікування макротромбозів, таких як ТГВ та ТЕЛА. Кровотеча є основним ускладненням при використанні гепарину; крім того, у пацієнтів можуть виникати тромбоцитопенія (приблизно у 30%), облисіння, місцеві ускладнення та гіперкаліємія.
Історично антагоністи вітаміну К (АВК), такі як варфарин (дикумарол) та інші похідні кумарину, були одними з найперших антикоагулянтів, схвалених для клінічного застосування. Варфарин конкурентно пригнічує ген комплексу епоксидредуктази вітаміну К (VKORC1), що призводить до зниження печінкового синтезу вітамін К-залежних факторів згортання крові, а також протеїну С та S. Терапія варфарином потребує ретельного моніторингу через вузьке терапевтичне вікно, взаємодію між препаратами та широкий діапазон дозування, необхідний для підтримки рівня міжнародного нормалізованого відношення (МНВ).
Розробка нових оральних антикоагулянтів (НОАК) дозволила підвищити рівень безпеки та ефективності терапії, до того ж лікування цими препаратами не потребує такого ретельного контролю дозування [10, 11]. НОАК включають два класи препаратів, а саме прямі інгібітори тромбіну, такі як дабігатран, та прямі інгібітори фактора Ха, такі як апіксабан, едоксабан та ривароксабан [12]. Побічні ефекти цих препаратів, не пов’язані із кровотечами, відзначаються рідко, але включають тяжке ураження печінки та шлунково-кишкові розлади [13].
Фондапаринукс був схвалений для використання у США у 2001 році. Його антикоагулянтна дія досягається шляхом селективного пригнічення фактора Ха, опосередкованого антитромбіном [15]. Токсичність фондапаринуксу становить додаткову проблему через його тривалий період напіввиведення.
При виборі ідеального антикоагулянту для терапії будь-якого захворювання мають бути враховані різні специфічні для пацієнта фактори, такі як основний тромбоемболічний стан, наприклад ішемічний інсульт або фібриляція передсердь, а також прийнятний ризик кровотечі та наявність супутніх захворювань, таких як захворювання печінки або нирок [16].
Роль антикоагулянтів у профілактиці та лікуванні ТЕЛА
Рівень смертності від ТЕЛА досягає 30% протягом першого місяця від початку розвитку тромбоемболії, при цьому до 30% тих, хто вижив, мають рецидив ТЕЛА або стійку втрату непрацездатності [17, 18]. Враховуючи щорічний рівень захворюваності від 0,2 до 0,8 на 1000 випадків, було висунуто гіпотезу, що ТЕЛА має багатофакторну етіологію [19-21]. Гостра ТЕЛА потребує обов’язкової стратифікації ризиків для визначення відповідної терапевтичної тактики. Індекс оцінки тяжкості ТЕЛА (PESI) та його спрощений варіант (sPESI) є інструментами для ідентифікації пацієнтів із низьким та високим ризиком. Згідно з рекомендаціями Європейського товариства кардіологів (ESC), лікування гострої ТЕЛА високого ризику передбачає ранню оксигенацію, забезпечення гемодинамічної стабільності та лікування серцевої недостатності, включаючи введення вазопресорів та розширену підтримку життя (Advanced Life Support, ALS) у тяжких випадках [23].
Керівництво CHEST містить конкретні рекомендації щодо вибору антикоагулянту відповідно до фази венозної тромбоемболії (ВТЕ) [24]. У гострій фазі рекомендовано введення швидкодіючих парентеральних антикоагулянтів, таких як НФГ, НМГ або фондапаринукс. НМГ та фондапаринукс є кращими за НФГ через менший ризик кровотечі. НОАК, такі як апіксабан, також схвалені для лікування гострого ТГВ та ТЕЛА [25].
АВК із рекомендованим терапевтичним діапазоном МНВ від 2 до 3 (цільовий рівень МНВ – 2,5) або НOAК, такі як дабігатран або ривароксабан, є кращими для тривалого (>10 днів) та подовженого (>3 міс) лікування ТЕЛА [23, 24].
Кілька ключових клінічних випробувань, що оцінювали ефективність АВК для вторинної профілактики, показали наступне:
- лікування АВК має тривати щонайменше 3 міс;
- ризик рецидиву ВТЕ після менш тривалої профілактики (3-6 міс) є вищим порівняно з більш тривалою (12-24 міс).
За оцінками Fernandes та співавт. (2019), тривала антикоагуляція може зменшити ризик рецидиву ВТЕ на 95% [26]. Однак це супроводжується збільшенням ризику кровотечі.
Спектр клінічних проявів COVID‑19
Спектр клінічних проявів COVID‑19 дуже широкий, починаючи від легкої інфекції верхніх дихальних шляхів і закінчуючи тяжкими формами захворювання, такими як небезпечна для життя пневмонія, гострий респіраторний дистрес-синдром (ГРДС), сепсис, коагулопатія та смерть. Крім характерних респіраторних проявів захворювання COVID‑19 також асоціюється із численними позалегеневими проявами (табл. 1) [28].
Більшість тяжких проявів COVID‑19 пов’язані з надмірною запальною реакцією. Переважною мішенню SARS-CoV‑2 є епітелій дихальних шляхів, де вірус через рецептор ангіотензинперетворюючого ферменту 2 (АПФ2) потрапляє всередину клітин-господарів [29]. Близько 83% клітин, що експресують AПФ2 у легенях, складають альвеолоцити ІІ типу. Однак рецептори АПФ2 експресуються також клітинами серця, судин, мозку, кишечника та нирок, що пояснює патогенез позалегеневих проявів COVID‑19. Можливими механізмами позалегеневих проявів, опосередкованих SARS-CoV‑2, є надмірна та нерегульована імунна відповідь, порушення функції опосередкованих АПФ2 шляхів, ушкодження ендотелію через тромбозапалення та прямий вплив на тканини вірусних частинок [29].
Зміни коагуляції при COVID‑19
Хоча респіраторні прояви є головною ознакою захворювання, за останні кілька місяців з’явилося багато даних про те, що COVID‑19 асоціюється із порушеннями згортання крові, які можуть спричиняти такі тромботичні прояви, як ВТЕ і ТЕЛА [2]. Tang та співвавт. (2020) у дослідженні за участю 183 пацієнтів із пневмонією при COVID‑19 представили первинні дані, що підкреслюють зміни параметрів згортання крові серед тих, хто вижив та не вижив [30]. Після вторинного аналізу цих даних було відзначено різке збільшення протромбінового часу (ПТЧ), активованого часткового тромбопластинового часу (АЧТЧ), фібриногену, D-димеру та продуктів розпаду фібрину (ПРФ), а також різке зниження рівня антитромбіну серед осіб, що не вижили.
Дослідження 1561 пацієнта з лабораторно підтвердженим COVID‑19, проведене Yu та співавт. (2020), також показало значне підвищення параметрів згортання крові [31]. Авторами повідомлялося про збільшення D-димеру на 260% у пацієнтів із тяжким захворюванням, із його рівнем від 0,9 до 4,6 мкг/мл із середнім значенням 1,8 мкг/мл. Guan та співавт. (2020) відзначили аномально підвищені рівні D-димеру у 260 (46,4%) із 560 пацієнтів відділення інтенсивної терапії [32].
Точний механізм порушення функції згортання крові у пацієнтів із COVID‑19 невідомий, оскільки сам вірус SARS-CoV‑2 не має прокоагулянтної активності. Було запропоновано кілька гіпотез для розуміння патофізіології розвитку протромботичного стану при COVID‑19 [33]. Одне з можливих пояснень – це вплив інфекції SARS-CoV‑2 на окремі процеси тріади Вірхова, а саме: ушкодження ендотелію, сповільнення кровотоку та гіперкоагуляційний стан [3].
Тромбогенний потенціал SARS-CoV‑2 в основному зумовлений комбінацією надмірної запальної реакції разом із тромбозапаленням та ушкодженням ендотелію. COVID‑19 також асоціюється з підвищеною в’язкістю крові. У дослідженні, проведеному Maier та співавт. (2020), усі 15 оцінених пацієнтів мали в’язкість плазми, на 95% більшу за норму [34]. Пригнічення системи плазміногену, дисфункція тромбоцитів та активація комплементу при COVID‑19 відповідають за розвиток гіперкоагуляційного стану. Застосування центральних венозних катетерів та штучна вентиляція легень (ШВЛ) разом із тривалою іммобілізацією у тяжкохворих пацієнтів можуть виступати додатковими факторами ризику розвитку тромбоемболії [35]. У кількох дослідженнях був виявлений можливий зв’язок між синтезом антифосфоліпідних антитіл, особливо вовчакового антикоагулянту (LAC), та COVID‑19, що також може сприяти гіперкоагуляції. Bowles та співавт. (2020) виявили присутність LAC у 31 із 34 пацієнтів із підвищеним рівнем АЧТЧ [36].
Дослідження в Китаї показало, що до 40% пацієнтів із COVID‑19 мали більший ризик розвитку ТГВ за шкалою оцінки ризику Падуа [39]. У французькій проспективній когорті ТЕЛА виникала незважаючи на профілактичну антикоагуляцію у 16,7% пацієнтів [40]. Нідерландське дослідження повідомило про частоту ВТЕ 27% незважаючи на тромбопрофілактику [41]. Італійське дослідження також виявило високий рівень ВТЕ – 22,2% [42].
Васкулопатія та тромбоз були виявлені у легеневих тканинах пацієнтів, які померли від тяжкої форми захворювання, під час аутопсії. Ackermann та співавт. (2020) досліджували сім зразків легень пацієнтів, які померли від тяжкого COVID‑19, і виявили в них, крім дифузного ушкодження альвеол та периваскулярної Т-клітинної інфільтрації, серйозні ушкодження ендотелію, посилений ангіогенез, а також поширений тромбоз у легеневих судинах [43].
Сучасні методи лікування COVID‑19 також можуть бути пов’язані з порушеннями системи згортання крові, однак доказів у цій галузі вкрай бракує. Відомо, що кортикостероїди підвищують ризик ВТЕ. Утім дослідження RECOVERY широко виступало за використання низьких доз кортикостероїдів, а саме дексаметазону, для боротьби із запаленням та «цитокіновим штормом», вторинним до інфекції SARS-CoV‑2 [44]. Кілька досліджень також намагалися оцінити прокоагулянтну дію ремдезивіру. У дослідженні Grein та співавт. було показано, що у 3 (5,66%) із 53 пацієнтів із діагнозом COVID‑19 після введення ремдезивіру розвинувся ТГВ [45].
Рівень смертності при коагулопатіях, викликаних COVID‑19
Частота тромбоемболій при COVID‑19 у різних опублікованих звітах дуже різниться. Зв’язок між смертністю у пацієнтів із COVID‑19 та тромбоемболією також є предметом дискусій. У кількох дослідженнях виявлено, що тромбоемболічні прояви пов’язані зі збільшенням смертності та захворюваності у пацієнтів із COVID‑19. Дослідження Zhang (2020) показало вищу смертність у пацієнтів із COVID‑19 із тромбоемболією [46]. В іншому дослідженні Tang та співавт. (2019) виявили значно вищий рівень D-димеру та ПРФ на момент надходження до стаціонару серед пацієнтів, які потім померли, що вказує на гірший прогноз у пацієнтів із COVID‑19 та коагулопатією [47].
Метааналіз Malas та співавт. (2020) показав загальну частоту артеріальної тромбоемболії (АТЕ) 2%, ВТЕ – 21%, ТГВ – 20% і ТЕЛА – 13% серед осіб, інфікованих SARS-CоV‑2. Частота АТЕ, ВТЕ, ТГВ і ТЕЛА становила відповідно 5, 31, 28 і 19% у пацієнтів, які знаходилися у відділенні інтенсивної терапії [38]. Навпаки, у дослідженні Hippensteel (2020) автори не виявили істотної різниці у смертності серед тяжкохворих пацієнтів, але також відзначили більш високу поширеність ВТЕ у тяжкохворих пацієнтів із COVID‑19 [48].
Антикоагулянти при COVID‑19: сучасний консенсус
До цього часу не було завершено й опубліковано жодного великого надійного дослідження, де б висвітлювалися терміни початку, тривалість терапії, препарати вибору та їх дозування у пацієнтів із COVID‑19; усі рандомізовані контрольовані дослідження тривають [49]. Настанови, опубліковані на міжнародному рівні до цього моменту, ґрунтуються лише на консенсусних та експертних висновках [55-57]. Таким чином, сьогодні відсутня надійна стратегія використання антикоагулянтів при COVID‑19, і рішення щодо тромбопрофілактики приймаються окремо в кожному конкретному випадку.
Основним обмеженням наявних настанов є рекомендації призначення гепарину у терапевтичних дозах лише при діагностованих або підозрюваних макротромбозах (ТЕЛА/ТГВ), без урахування недіагностованих мікротромбозів. Не існує окремої системи оцінки ризику ВТЕ при госпіталізації пацієнта, специфічної для COVID‑19. Хоча значно підвищений рівень D-димеру, швидше за все, асоціюється з ВТЕ, на даний момент важко визначити поріг, який можна використовувати лише для неінвазивної діагностики тромбозу [58]. Швидше, рішення про подальшу діагностичну візуалізацію має ґрунтуватися на загальній клінічній оцінці. D-димер може бути корисним при дослідженні на наявність можливої гострої ВТЕ/ТЕЛА у пацієнтів, у яких з’являється або посилюється задишка. Однак загальновизнано, що, хоча високий рівень D-димеру є доведеним негативним прогностичним фактором, його рівень не має впливати на тактику антикоагулянтної терапії.
Було проведено одноцентрове рандомізоване дослідження (n=20) для порівняння ефективності профілактичної та терапевтичної антикоагуляції у тяжкохворих пацієнтів на ШВЛ із високим рівнем D-димеру (>1000 мкг/л) [59]. Воно показало значне поліпшення оксигенації у групі, що отримувала терапевтичні дози антикоагулянтних засобів, хоча різниці між двома групами щодо внутрішньолікарняної або 28-денної смертності не відзначалося.
Наразі, після розгляду всіх консенсусних та експертних висновків, було сформовано наступні головні тези:
1. Парентеральні антикоагулянти показані будь-яким госпіталізованим пацієнтам, тобто рекомендовані при помірній, тяжкій та критичній формі захворювання.
2. НМГ/фондапаринукс є кращими за НФГ, оскільки не потребують моніторингу АЧТЧ і дозволяють зменшити контакт із медичним персоналом.
3. Еноксапарин є препаратом вибору серед НМГ.
4. Дозування антикоагулянтів:
I. Захворювання помірної тяжкості (пацієнт зі стандартним ризиком): стандартна профілактична доза, скоригована на вагу (наприклад, еноксапарин 40 мг один раз на день для дорослої людини вагою 70 кг із кліренсом креатиніну (CrCl) >30 мл/хв);
II. Тяжка та критична форми захворювання (пацієнт високого ризику: потребує інвазивної вентиляції/безперервного позитивного тиску в дихальних шляхах (CPAP)/неінвазивної вентиляції/високопотокової кисневої терапії, у тому числі з використанням назальної канюлі: середня доза НМГ (еноксапарин 40 мг двічі на день для дорослого вагою 70 кг із CrCl >30 мл/хв);
III. Діагностований/підозрюваний макротромбоз (ТЕЛА/ТГВ): терапевтична доза (еноксапарин підшкірно 1 мг/ кг/12 год або 1,5 мг/кг один раз на день);
IV. Ниркова недостатність: еноксапарин зі зменшенням дози є кращим порівняно з іншими препаратами НМГ та фондапаринуксом. НФГ із моніторингом АЧТЧ показані при швидкості клубочкової фільтрації (ШКФ) <15 мл/хв/1,73 м².
Тробмопрофілактика після виписки при COVID‑19
Тромбопрофілактика після виписки пацієнтів із COVID‑19 залишається предметом багатьох дискусій. Рутинне призначення пероральних антикоагулянтів усім пацієнтам із COVID‑19 під час виписки не рекомендоване. Настанови Американського коледжу пульмонологів, опубліковані у CHEST, а також настанови Американського коледжу кардіологів (АСС), опубліковані у Журналі Американського коледжу кардіології, не розкривають питання тромбопрофілактики після виписки пацієнтів [5, 55]. Консенсусна заява CHEST спростовує необхідність тромбопрофілактики, спираючись на відсутність доказів. Однак у рекомендаціях Національного інституту здоров’я США (NIH), оновлених 11 лютого цього року, а також у рекомендаціях Міжнародного товариства із тромбозу та гемостазу (ISTH), рекомендаціях Британського торакального товариства (BTS) та Шотландської міжвузівської мережі рекомендацій (SIGN) є інформація щодо тромбопрофілактики після виписки на підставі висновків експертів [50, 51, 61, 62].
На підставі нинішніх рекомендацій, а також минулих та поточних досліджень щодо застосування антикоагулянтів можна зробити висновок, що пацієнти з помірним та тяжким перебігом захворювання, які відповідають будь-якому з нижченаведених критеріїв, були б ідеальними кандидатами для тромбопрофілактики після виписки [50]:
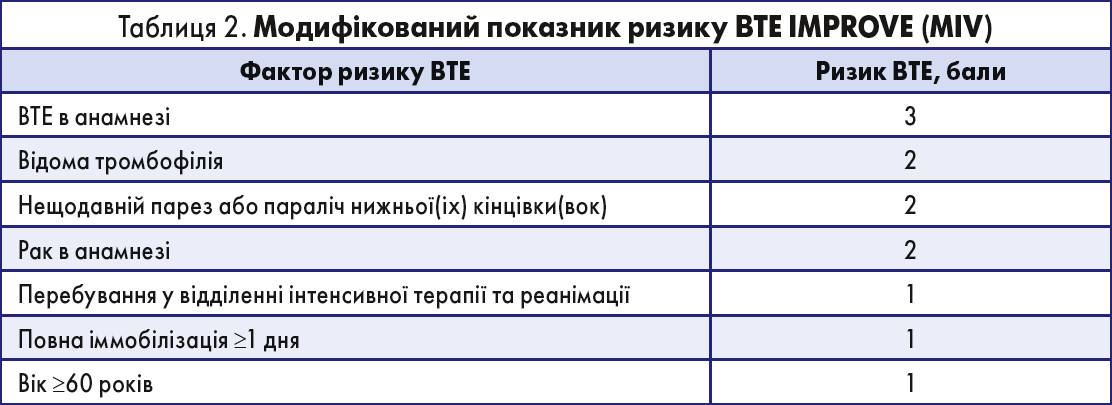
1. Модифікований показник ризику ВТЕ IMPROVE (MIV) ≥4 (табл. 2).
2. MIV ≥2 зі значенням D-димеру, у 2 рази вищим за верхню межу норми.
3. Вік ≥75 років.
4. Вік >60 років зі значенням D-димеру, у 2 рази вищим за верхню межу нормального діапазону.
5. Вік 40-60 років зі значенням D-димеру, у 2 рази більшим за верхню межу нормального діапазону, та ВТЕ або злоякісним новоутворенням в анамнезі.
Таким чином, кандидатів на тромбопрофілактику слід оцінювати на ризик ВТЕ за допомогою показника MIV [63]. Також слід оцінити ризик кровотечі за оцінкою VTE-BLEED або HAS-BLED.
НОАК не потребують моніторингу МНВ і, таким чином, є кращими у цьому відношенні порівняно з АВК. Згідно з результатами дослідження, бажані НОАК включають ривароксабан (10 мг один раз на день), бетриксабан (160 мг у перший день, потім 80 мг один раз на день) та апіксабан (2,5 мг два рази на день) [63, 64].
При нирковій недостатності варфарин має перевагу перед НОАК. Однак при ШКФ 30-15 мл/хв/1,73 м² можна застосовувати 2,5 мг апіксабану двічі на день. При ШКФ <15 мл/хв/1,73 м² та пацієнтам із хронічною хворобою нирок (ХХН), які перебувають на діалізі, бажано уникати НОАК. Управління із санітарного нагляду за якістю харчових продуктів та медикаментів США (FDA) схвалило апіксабан у дозі 2,5 мг двічі на день при ШКФ <15 мл/хв/1,73 м² та 5 мг двічі на день у пацієнтів із ХХН, що перебувають на діалізі, оскільки він частково піддається діалізу. Однак, оскільки європейські рекомендації заперечують використання НОАК при ШКФ <15 мл/хв/1,73 м², можливо все ж раціонально уникати введення цих препаратів у таких випадках.
Що стосується тривалості антикоагулянтної терапії, то FDA рекомендує використовувати ривароксабан (10 мг на день) протягом 31-39 днів та бетриксабан (160 мг у перший день, потім 80 мг на день) протягом 35-42 днів. Експерти ACC запропонували розширену тромбопрофілактику з використанням НМГ або НОАК протягом максимум 45 днів у разі високого ризику ВТЕ, наприклад за рівня D-димеру, що більш ніж у два рази перевищує верхню межу норми, або за наявності активного онкологічного захворювання [55]. Натомість ISTH пропонує тривалість тромбопрофілактики 14-30 днів [54].
Після ретельного дослідження існуючих протоколів, поточних відомостей та досліджень було сформовано єдине керівництво щодо антикоагулянтної терапії у пацієнтів із COVID‑19. У випадках помірного та тяжкого COVID‑19 рекомендована антикоагуляція еноксапарином у комплексі з наступною профілактикою після виписки НОАК, такими як ривароксабан та апіксабан, для запобігання можливим недіагностованим мікротромбозам.
Основні тези
- ВТЕ, вторинна по відношенню до COVID‑19, призводить до збільшення смертності.
- Переважна більшість пацієнтів мають недіагностовану тромбоемболію після COVID‑19.
- Антикоагулянта терапія доцільна у помірних, тяжких та критичних випадках COVID‑19.
- Еноксапарин є кращим низькомолекулярним гепарином для антикоагулянтної терапії у гострій фазі ВТЕ.
- Після оцінки ризику кровотечі у пацієнтів із високим ризиком тромбоемболічних подій можна розглядати профілактику після виписки.
- Ривароксабан та апіксабан є кращими для профілактики після виписки.
Актуальні питання дослідження
- Чи слід рекомендувати тромбопрофілактику антикоагулянтами після виписки усім госпіталізованим пацієнтам із COVID‑19?
- Якщо так, якою має бути тривалість такої профілактики?
- Чи слід застосовувати прямі пероральні антикоагулянти у пацієнтів із COVID‑19 та порушенням функції нирок
1. Що з перерахованого є позалегеневими проявами COVID‑19?
а. Міокардит
b. Гостре пошкодження нирок
c. Ендокардит
d. Енцефалопатія
e. Гіпоглікемія
2. COVID‑19 сприяє виникненню коагулопатії за допомогою всіх перерахованих нижче механізмів, окрім?
а. Запалення, що викликає ушкодження ендотелію
b. Порушення функції тромбоцитів
c. Активація фактора Х
d. Активація комплементу
3. Які з перелічених антикоагулянтів краще призначати пацієнтам із COVID‑19 та порушенням функції нирок?
а. НФГ
b. Фондапаринукс
c. Еноксапарин
d. Варфарин
e. Ривароксабан
4. Які з наведених антикоагулянтів є кращим вибором для тромбопрофілактики після виписки пацієнтів із COVID‑19?
а. Фондапаринукс
b. Еноксапарин
c. Варфарин
d. Ривароксабан
e. Апіксабан
5. Які фактори слід враховувати перед призначенням профілактики після виписки пацієнтам із COVID‑19?
а. Попередня ВТЕ
b. Відома тромбофілія
c. Іммобілізація
d. Рівень D-димеру
e. Наявність вторинної бактеріальної інфекції
Відповіді
1. а+, b+, c-, d+, е-
2. а-, b-, c+, d-
3. а-, b-, c+, d+, е-
4. а-, b-, c-, d+, е+
5. а+, b+, c+, d+, е-
Підготувала Анастасія Романова
Реферативний огляд за матеріалами: Chandra A., Chakraborty U., Ghosh S. et al. Anticoagulation in COVID‑19: current concepts and controversies. Postgrad Med J 2021;0:1-8. doi:10.1136/postgradmedj‑2021-139923.