13 грудня, 2021
Місце бригатинібу у лікуванні ALK+ недрібноклітинного раку легені
Мутацію гена кінази анапластичної лімфоми (ALK) виявляють приблизно у 3-5% хворих на недрібноклітинний рак легені (НДРЛ; J.F. Gainor, 2013; J.P. Koivunen, 2008). На сьогодні доступні кілька поколінь ALK-інгібіторів, які демонструють хорошу ефективність та істотно подовжують виживаність пацієнтів з НДРЛ та мутацією ALK (ALK+ НДРЛ). Застосування ALK-інгібітору першого покоління кризотинібу дозволяє досягти хороших результатів у лікуванні хворих, проте з часом до препарату формується резистентність, що потребує зміни стратегії лікування. Крім того, кризотиніб чинить недостатній вплив на метастази у центральній нервовій системі, які часто діагностуються у пацієнтів з ALK+ НДРЛ. У сучасних міжнародних рекомендаціях особливе місце у лікуванні таких хворих посідають ALK-інгібітори наступних поколінь, котрі дозволяють досягти безпрецедентного подовження виживаності.
У рамках цьогорічного XIV З’їзду онкологів та радіологів України, який проходив із 30 вересня по 2 жовтня, активно обговорювалася тема ведення пацієнтів з раком легені. Крім українських експертів, власним досвідом впровадження сучасних міжнародних стандартів ділилися зарубіжні колеги.
 Про підходи до лікування ALK+ НДРЛ у 1-й лінії розповіла онколог та хіміотерапевт, завідувачка відділення клінічних і наукових досліджень Лікарні ізраїльської онкології LISOD (м. Київ), кандидат медичних наук Дінара Есенбеківна Риспаєва.
Про підходи до лікування ALK+ НДРЛ у 1-й лінії розповіла онколог та хіміотерапевт, завідувачка відділення клінічних і наукових досліджень Лікарні ізраїльської онкології LISOD (м. Київ), кандидат медичних наук Дінара Есенбеківна Риспаєва.
– НДРЛ слід розглядати як гетерогенну групу хвороб із різноманітними варіантами мутацій, що стають мішенями для нових таргетних препаратів. Перебудова у гені ALK є причиною близько 5% випадків НДРЛ (F. Barlesi et al., 2016). Гістологічний тип ALK+ НДРЛ – аденокарцинома. Особливостями ALK+ НДРЛ є ураження осіб молодого віку, в основному некурців, з тенденцією до зростання кількості хворих жіночої статі.
Найчастішою мутацією гена ALK є злиття двох генів – ALK та EML4. Химерний ген ALK-EML4 не є спадковою мутацією, як мутації BRCA1 та BRCA2. Встановлено, що активуючі мутації ALK є онкогенними факторами розвитку пухлини.
Згідно з останніми клінічними настановами Національної онкологічної мережі США (NCCN, 2021), при ALK+ НДРЛ у 1-й лінії терапії слід віддавати перевагу застосуванню інгібіторів тирозинкінази (ІТК) другого покоління алектинібу та бригатинібу, призначення кризотинібу розглядається за певних обставин. У разі прогресування хвороби (симптомного та безсимптомного) після 1-ї лінії терапії алектинібом або бригатинібом наступною терапевтичною опцією є застосування цих самих лікарських засобів. При виборі терапії у пацієнтів із симптомним прогресуванням ALK+ НДРЛ після 1-ї лінії має значення локалізація метастатичних вогнищ: при метастазах у головному мозку віддають перевагу алектинібу та бригатинібу, при множинних метастазах – лорлатинібу (ред. – не зареєстрований в Україні). Якщо у 1-й лінії терапії пацієнту призначали кризотиніб, то після прогресування хвороби потрібно розглянути застосування ІТК другого покоління.
Бригатиніб – це низькомолекулярний ІТК гена ALK при НДРЛ з унікальними молекулярними особливостями (наявність у структурі оксиду диметилфосфіну), що визначає його активність і селективність дії. У рандомізованому клінічному дослідженні III фази ALTA-1L порівнювали ефективність кризотинібу та бригатинібу у пацієнтів з ALK+ НДРЛ, які раніше не отримували ALK-інгібітори. 275 пацієнтів були рандомізовані у групи кризотинібу (n=137) та бригатинібу (n=137). Учасники також були стратифіковані за наявністю метастазів у головному мозку на початку дослідження (наявні/відсутні). Із 275 хворих 81 (29%) пацієнт мав метастази у головному мозку (29% у групі бригатинібу та 30% – кризотинібу). У ході дослідження дозволявся кросовер з групи кризотинібу в групу бригатинібу у разі зафіксованого у засліпленому режимі незалежним контрольним комітетом (BIRC) прогресування хвороби при лікуванні кризотинібом. Первинними кінцевими точками дослідження були виживаність без прогресування (ВБП) за оцінкою BIRC відповідно до критеріїв RECIST версії 1.1. Вторинні кінцеві точки: частота об’єктивної відповіді (ЧОВ), ефективність відносно інтракраніальних метастазів (ВБП, ЧОВ), безпека, якість життя. Результати дослідження ALTA-1L показали істотну перевагу бригатинібу у лікуванні пацієнтів з ALK+ НДРЛ порівняно з кризотинібом (медіана спостереження 24,9 міс): відношення ризиків (ВР) для прогресування хвороби чи смерті становило 0,49 (95% довірчий інтервал – ДІ – 0,35-0,68), медіана ВБП у групі бригатинібу та кризотинібу 24,0 та 11,0 міс відповідно (рис. 1; D.R. Camidge et al., 2020).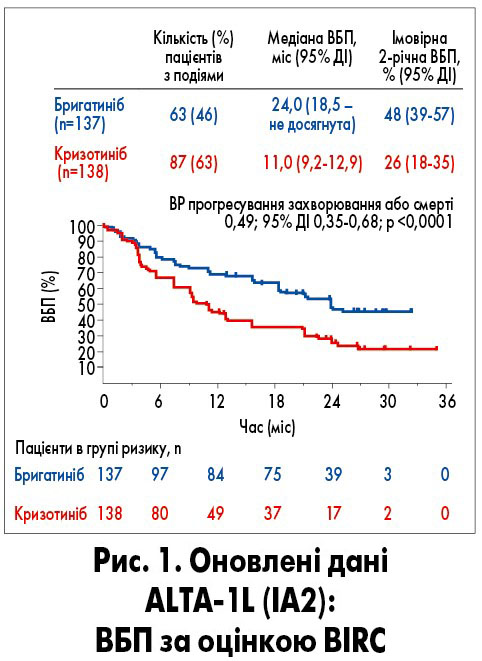
Метастази в головному мозку є актуальною медико-соціальною проблемою. Близько 30% пацієнтів із вперше встановленим діагнозом ALK+ НДРЛ уже мають метастази в головному мозку, майже у 75% інтракраніальні метастази розвиваються протягом наступних років (часто уже впродовж 2 років). Це зумовлює потребу у застосуванні потужної 1-ї лінії терапії у хворих на ALK+ НДРЛ, що забезпечить вплив на екстра- й інтракраніальний розвиток хвороби. Призначення ефективного лікування на ранній стадії дозволить підтримати функцію головного мозку, сповільнити прогресування хвороби та зменшити тяжкість симптомів. У дослідженні ALTA-1L бригатиніб показав істотну перевагу порівняно з кризотинібом у 81 пацієнта з початково наявними інтракраніальними метастазами. За оцінкою BIRC 2-річна ВБП у хворих з інтракраніальними метастазами у групі бригатинібу становила 43% (95% ДІ 25-59) порівняно з 10% (95% ДІ 2-25) у групі кризотинібу (ВР 0,25; 95% ДІ 0,14-0,46; рис. 2). Таким чином, отримані дані свідчать на користь призначення бригатинібу пацієнтам з ALK+ НДРЛ і метастазами у головному мозку (R. Camidge et al., 2020). 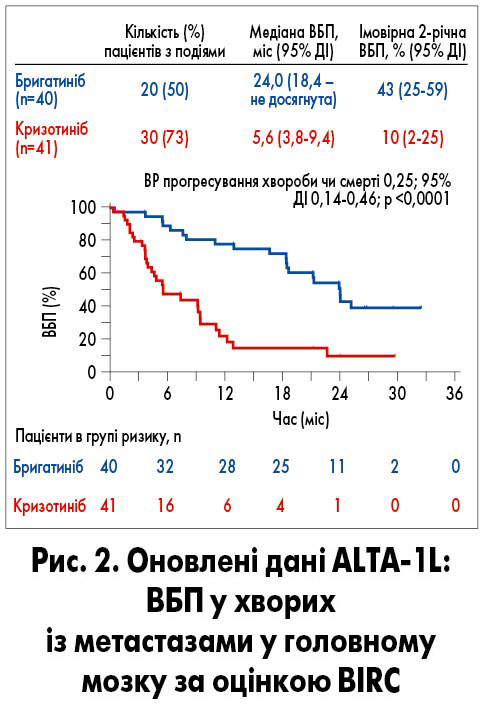
Прийом усіх ІТК ALK супроводжується розвитком побічних явищ (ПЯ). Важливо приділяти увагу тим ПЯ, котрі знижують якість життя хворого та потребують редукції дози препарату. У дослідженні ALTA-1L найчастішими (у 25% усіх хворих) ПЯ будь-якого ступеня тяжкості були гастроінтестинальні розлади, підвищення рівня креатинінфосфокінази й амінотрансфераз у крові та кашель. Пневмоніт, який частіше виявляли у пацієнтів з групи бригатинібу (5% – 7/136 порівняно з 2% – 3/137 – у групі кризотинібу), зазвичай розвивався протягом перших 3 міс лікування і був добре контрольованим. Слід зауважити, що пневмоніт є ПЯ, яке асоціюється з прийомом усіх ІТК, проте для різних ІТК час його виникнення різний (наприклад, при застосуванні алектинібу пневмоніт зазвичай розвивається пізніше).
Важливим параметром оцінювання ефективності терапії є її переносимість, що впливає на якість життя хворого. Для цього у ході дослідження пацієнтам пропонують заповнювати спеціальні опитувальники. Результати дослідження ALTA-1L показали перевагу бригатинібу над кризотинібом і за цим показником: медіана часу до погіршення загального стану здоров’я/якості життя становила 26,7 міс (95% ДІ 8,3 – не досягнуто) у групі бригатинібу та 8,3 міс (95% ДІ 5,7-13,5) – кризотинібу (ВР 0,70; 95% ДІ 0,49-1,00; рис. 3; R. Camidge et al., 2020).
Слід зазначити, що активність різних ALK-інгібіторів наступного покоління за медіаною ВБП є зіставною, проте для різних препаратів характерний різний профіль токсичності. Медіана ВБП при застосуванні бригатинібу становить 30,8 міс відповідно до фінальних результатів дослідження ALTA-1L. Однак слід враховувати те, що у цьому дослідженні був дозволений кросовер, і майже третина учасників отримували 1-шу лінію хіміотерапії, а це вплинуло на отримані показники.
У рамках нещодавнього конгресу Європейського товариства медичної онкології (ESMO, 2021) були представлені фінальні результати дослідження ALTA-1L, згідно з якими зберігається перевага бригатинібу над кризотинібом: ВР щодо ВБП згідно з оцінкою BIRC дорівнювало 0,48 (95% ДІ 0,35-0,66), медіана ВБП – 24,0 міс (95% ДІ 18,4-43,2) та 11,1 міс (95% ДІ 9,1-13,0), 3-річна ВБП – 43 та 19% відповідно. Медіана ВБП у групах бригатинібу та кризотинібу за оцінкою дослідника склала 30,8 та 9,2 міс відповідно. У пацієнтів із метастазами в головному мозку на початку лікування ВР щодо загальної виживаності склало 0,43 (95% ДІ 0,21-0,89; S. Popat et al., 2021).
Таким чином, бригатиніб демонструє високу загальну ефективність та ефективність щодо внутрішньочерепних метастазів за прийнятної переносимості. Це дає підстави рекомендувати цей лікарський засіб для 1-ї лінії терапії пацієнтів з ALK+ НДРЛ.
 Завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук Ярослав Васильович Шпарик представив доповідь на тему «Вибір лікування після невдачі 1-ї лінії терапії ALK+ НДРЛ».
Завідувач відділення хіміотерапії КНП ЛОР «Львівський онкологічний регіональний лікувально-діагностичний центр», кандидат медичних наук Ярослав Васильович Шпарик представив доповідь на тему «Вибір лікування після невдачі 1-ї лінії терапії ALK+ НДРЛ».
– Представником ALK-інгібіторів першого покоління є кризотиніб. Проблемою ALK-інгібіторів є розвиток резистентності до них, в основі якої можуть бути фармакологічні або біологічні чинники: недостатня концентрація лікарського засобу в пухлині (особливості проникнення через гематоенцефалічний бар’єр), еволюція ракових клітин при наявності ефективного лікарського засобу, поява нових мутацій ALK або інших мутацій активації клітинного циклу проліферації (R. Camidge et al., 2014). Механізми розвитку набутої резистентності при ALK+ НДРЛ різноманітні і можуть включати формування мутацій стійкості до ALK-інгібіторів та альтернативних сигнальних шляхів. Мутації у кіназному домені ALK відповідальні за більшість випадків резистентності до ALK-інгібіторів. При деяких мутаціях, що виникають при лікуванні кризотинібом (наприклад, ALK L1196M, яка аналогічна мутації EGFR T790M), ефективними є ALK-інгібітори наступних поколінь. Зокрема, бригатиніб продемонстрував інгібуючу активність щодо ALK «дикого» типу і всіх значущих стійких мутантів ALK in vitro: при клінічно досяжних концентраціях бригатиніб пригнічував ріст клітин Ba/F3, що експресують 17 мутантних білків ALK, які давали клітинам стійкість до інших інгібіторів (S. Zhang et al., 2016; M.J. Hochmair et al., 2017).
ІТК наступного покоління алектиніб і бригатиніб є основною терапевтичною опцією у пацієнтів після прогресування ALK+ НДРЛ на тлі застосування кризотинібу у 1-й лінії, особливо при наявності метастазів у головному мозку. Що стосується випадків прогресування хвороби на тлі 2-ї лінії терапії ІТК наступного покоління, то рекомендується продовжувати терапію цими ж препаратами, це дозволить сповільнити подальше прогресування хвороби (NCCN, 2021).
Ефективність бригатинібу у 2-й лінії терапії пацієнтів з рефрактерним до кризотинібу ALK+ НДРЛ вивчали у рандомізованому дослідженні II фази ALTA. У дослідження було включено 222 пацієнти, яких розподілили у групу А (n=112, отримували бригатиніб у дозі 90 мг/добу) та групу В (n=110, застосовували бригатиніб по 180 мг/добу після попереднього 7-денного прийому в дозі 90 мг/добу). Більша частина (69%) хворих мала ураження головного мозку, 74% пацієнтів попередньо отримували хіміотерапію. Первинною кінцевою точкою дослідження була ЧОВ за оцінкою дослідника, вторинні кінцеві точки – тривалість відповіді, загальна виживаність (ЗВ), ЧОВ за оцінкою незалежного комітету (IRC), ВБП, інтракраніальна ЧОВ та ВБП у пацієнтів з активними метастазами у головному мозку, безпека та токсичність, якість життя пацієнтів за даними опитувальника EORTC QLQ-C3.
За результатами дослідження ЧОВ склала 51% (95% ДІ 41-61) у групі А та 56% (95% ДІ 47-66) у групі В. Медіана ВБП за оцінкою IRC становила 9,2 міс (95% ДІ 7,4-12,8) та 16,7 міс (95% ДІ 11,6-21,4) в групах А та В відповідно. Імовірна 1-річна та 2-річна ЗВ у групі А становила 70 і 55%, у групі В – 80 та 66% (R.M. Huber et al., 2019).
Важливою перевагою ІТК наступних поколінь є їх ефективність при метастазах у головному мозку. За оцінкою IRC ЧОВ у пацієнтів з вимірюваними вогнищами у головному мозку становила 50% (13 із 26 пацієнтів) у групі А та 67% (12 з 18 пацієнтів) у групі B. Медіана ВБП щодо інтракраніальних метастазів дорівнювала 12,8 (95% ДІ 9,2-18,3) та 18,4 міс (95% ДІ 12,6-23,9) у групах А та В відповідно (R.M. Huber et al., 2019).
На цьогорічному конгресі ESMO були представлені результати дослідження щодо застосування бригатинібу у клінічній практиці США за участю 413 хворих на НДРЛ. До лікування бригатинібом 195 пацієнтів отримували кризотиніб у 1-й лінії з/без наступних ALK-ІТК, 133 хворих – кризотиніб із подальшим застосуванням алектинібу та/або церитинібу, 62 – лише кризотиніб, 99 – лише алектиніб, 80 – не отримували ALK-ІТК. 167 (40,4%) пацієнтів припинили лікування бригатинібом або перейшли на інший ALK-ІТК. Середня тривалість лікування бригатинібом становила 10,3 (95% ДІ 8,2-15,0) міс. Серед пацієнтів, які припинили лікування бригатинібом, 100 (59,9%) отримали наступні ALK-ІТК. Ще одним найчастіше застосовуваним препаратом був лорлатиніб (57,0%), далі за частотою – бригатиніб повторно (16,0%), алектиніб (13,0%), церитиніб (10,0%) та кризотиніб (4,0%). Ці дані демонструють реальну користь бригатинібу та тривалий ефект у пацієнтів з ALK+ НДРЛ (M.O. Jahanzeb et al., 2021).
Таким чином, усіх пацієнтів з неплоскоклітинним НДРЛ слід тестувати на наявність мутації ALK. Найкращим методом дослідження є комплексне геномне профілювання. При мутації ALK ефект лікування є кращим, якщо в 1-й лінії застосовується ALK-інгібітор, а не хіміотерапія. Нові ALK-інгібітори забезпечують вищі показники ВБП та ефективність щодо метастазів у головному мозку порівняно з кризотинібом. Крім того, алектиніб, бригатиніб, церитиніб затверджені для застосування у 1-й лінії терапії НДРЛ, у 2-й лінії терапії – у разі резистентності до кризотинібу. Багато хворих отримують користь від послідовного призначення різних ALK-інгібіторів.
 Досвід застосування бригатинібу у лікуванні ALK+ НДРЛ у Республіці Білорусь представив провідний науковий співробітник ДУ «Республіканський науково-практичний центр онкології та медичної радіології (РНПЦ ОМР) ім. М.М. Александрова» (м. Мінськ, Республіка Білорусь), кандидат медичних наук Микола Борисович Єрмаков.
Досвід застосування бригатинібу у лікуванні ALK+ НДРЛ у Республіці Білорусь представив провідний науковий співробітник ДУ «Республіканський науково-практичний центр онкології та медичної радіології (РНПЦ ОМР) ім. М.М. Александрова» (м. Мінськ, Республіка Білорусь), кандидат медичних наук Микола Борисович Єрмаков.
– За даними M. Wahbah і співавт. (2007), у світі спостерігається тенденція до збільшення частоти аденокарциноми (сьогодні є домінантним гістологічним підтипом раку легені) порівняно з плоскоклітинним і великоклітинним раком легені. Щороку у Республіці Білорусь виявляють близько 20 пацієнтів з ALK+ НДРЛ. Так, за 2020 р. було виконано 320 тестів на наявність мутації в гені ALK, результати 20 (6,3%) з них були позитивними, що відповідає світовій статистиці. До середини 2018 р. лікування таких хворих проводилося винятково кризотинібом. Сьогодні за рахунок республіканського бюджету закуповуються ALK-інгібітори наступного покоління (бригатиніб або алектиніб) у кількості, достатній для лікування 20 хворих на рік. Однак у зв’язку з підвищенням ЗВ пацієнтів з ALK+ НДРЛ кількість хворих, які потребують лікування ALK-інгібіторами, щорічно зростає (крім 20 нововиявлених випадків залишаються пацієнти, яким діагноз був встановлений минулого чи позаминулого року).
У 2018-2019 рр. до програми розширеного доступу за підтримки фармацевтичної компанії Takeda було включено 6 пацієнтів. Середній вік хворих – 56,7 року, 3 хворих – жінки. Слід зазначити, що лише 1 пацієнт до включення у програму розширеного доступу отримував бригатиніб у 1-й лінії терапії, 5 з 6 пацієнтів – стандартну хіміотерапію, 2 з них – також кризотиніб. Результати лікування бригатинібом були дуже добрими: медіана ЗВ склала 30,4 міс (95% ДІ 22,09-38,63). На сьогодні 3 із 6 хворих продовжують лікування бригатинібом. Медіана ВБП дорівнює 12,2 міс (95% ДІ 5,39-18,96). Слід зазначити, що у пацієнтів, які отримували кризотиніб у 1-й лінії терапії, застосування бригатинібу дозволило досягти повторного регресування захворювання тривалістю 6 та 12 міс. Переносимість лікування задовільна. В 1 хворого виникла необхідність тимчасово знизити добову дозу препарату, ще в 1 лікування було тимчасово припинене у зв’язку з розвитком пульмоніту.
Клінічний випадок
Пацієнтка Н., 50 років. Не курить.
При плановому профілактичному обстеженні (20.02.2017) виявлено новоутворення у S2 правої легені та множинні дрібновогнищеві тіні по всіх легеневих полях.
За даними комп’ютерної томографії (КТ) органів грудної клітки (23.06.2017), зміни в легені можуть відповідати лімфогенному канцероматозу легені.
26.06.2017 – виконана атипова резекція легені.
05.07.2017 – висновок морфологічного дослідження: морфологічна структура близька до великоклітинного світлоклітинного раку легені.
Попередній діагноз – метастази в легенях без виявленої первинної пухлини. Пацієнтку направлено до РНПЦ ОМР ім. М.М. Александрова. У зв’язку з відсутністю даних щодо локалізації первинної пухлини була призначена стандартна емпірична хіміотерапія для лікування раку з невиявленим первинним вогнищем (карбоплатин + паклітаксел). За липень-вересень пацієнтка отримала 4 курси хіміотерапії.
Перегляд мікропреператів у РНПЦ ОМР ім. М.М. Александрова: тканина легені з ростом злоякісної епітеліальної пухлини, імовірно метастаз, за морфологією найбільше відповідає світлоклітинному раку.
11.07.2017 – за даними позитронно-емісійної комп’ютерної томографії (ПЕТ-КТ) – ознаки метаболічно-активного дисемінованого ураження обох легень, лімфатичних вузлів середостіння, надключичних лімфатичних вузлів з обох боків, шийних лімфатичних вузлів зліва. Склеротичні зміни в кістках без ознак метаболічної активності. Гідроторакс. Гідроперикард.
Під час хіміотерапії проводилися додаткові імуногістохімічні дослідження, за допомогою яких було виявлено реаранжування гена ALK.
Остаточний висновок лікаря-морфолога: морфологічна картина та імуногістохімічний фенотип характерні для солідної аденокарциноми легені, G3 (ALK+). Діагноз – ALK+ НДРЛ.
З жовтня 2017 р. почала лікування кризотинібом, що супроводжувалося суб’єктивною та об’єктивною відповіддю.
За даними контрольної ПЕТ-КТ (15.05.2018) – виражена позитивна динаміка за рахунок зменшення розмірів пухлини та повної редукції метаболічної активності в раніше виявлених вогнищах.
Пацієнтка отримувала кризотиніб до жовтня 2018 р., коли було зафіксовано прогресування хвороби.
КТ (18.10.2018) – картина легеневого канцероматозного лімфангіту, метастази в лімфатичних вузлах середостіння та заочеревинних лімфатичних вузлах (рис. 4). 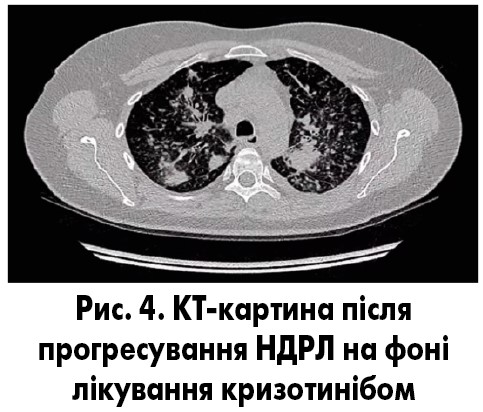
Жовтень-листопад 2018 р. – пацієнтка приймала вінорелбін, без ефекту. Наростав гідроторакс.
З грудня 2018 р. почала отримувати бригатиніб у рамках програми розширеного доступу. Було досягнуто суб’єктивну й об’єктивну відповідь.
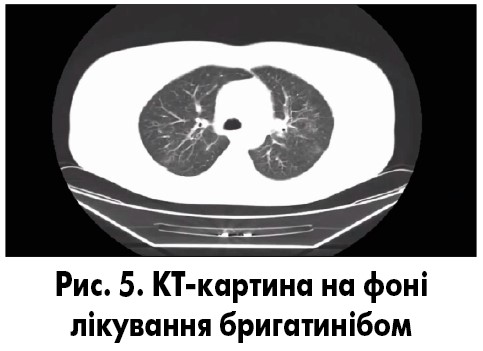
КТ (14.01.2019) – значна позитивна динаміка з боку інтерстиціального процесу в легенях. Рідина в плевральній і перикардіальній порожнинах не визначається. Лімфатичні вузли не збільшені (рис. 5).
Пацієнтка продовжувала лікування бригатинібом. КТ-контроль виконувався через кожні 2 міс. 24.09.2019 – КТ-картина без ознак погіршення.
 30.12.2019 – прогресування хвороби. Спроба лікування церитинібом невдала. Пацієнтка померла 06.02.2020 р.
30.12.2019 – прогресування хвороби. Спроба лікування церитинібом невдала. Пацієнтка померла 06.02.2020 р.
Таким чином, послідовне призначення ALK-інгібіторів продовжило життя пацієнтки більш як на 3 роки.
Застосування бригатинібу є ефективною терапевтичною опцією при ALK+ НДРЛ, що продемонстровано у рандомізованих клінічних дослідженнях і клінічній практиці.
Підготувала Ілона Цюпа
Тематичний номер «Онкологія, Гематологія, Хіміотерапія» № 5 (72) 2021 р.




