9 грудня, 2022
Диференційована профілактика природжених вад розвитку плода в жінок репродуктивного віку з урахуванням поліморфізму гена метилентетрагідрофолатредуктази
Фолієва кислота (ФК), також відома як вітамін B9, є життєво важливим мікроелементом, який відіграє значну роль у процесах синтезу пуринових і піримідинових попередників нуклеїнових кислот, метаболізмі метіоніну, серину, гліцину та гістидину й утворенні метилювальних агентів, потрібних для забезпечення нормального обміну речовин і регуляції генів. Є наукові дані й про роль ФК у профілактиці онкологічних, неврологічних і психіатричних захворювань [1].
Організм людини не здатний синтезувати ФК, тому низький її рівень у крові може бути спричинений споживанням їжі з недостатнім умістом ФК, поганим засвоєнням її з харчових продуктів і порушеннями метаболізму ФК унаслідок генетичних дефектів або взаємодії лікарських засобів. За участю реакцій ферментативного відновлення, що каталізуються ферментом дигідрофолатредуктазою, ФК метаболізується в дигідрофолат, потім у тетрагідрофолат і згодом у 5-10-метилентетрагідрофолат, який під дією рибофлавінозалежного ферменту метилентетрагідрофолатредуктази (МТГФР) перетворюється на біологічно активну сполуку ФК – 5-метилтетрагідрофолат (5-МТГФ), який бере участь у реакціях транспорту одновуглецевих груп, потрібних для синтезу пурину/піримідину в процесі зшивання ДНК і РНК, метилювання ДНК та регуляції метаболізму гомоцистеїну [2].
Із метою вивчення біодоступності ФК та 5-МТГФ було проведено серію довгострокових досліджень, у яких фолатний статус аналізувався за даними визначення концентрації ФК у сироватці крові й еритроцитах, а також за функціональним показником статусу ФК (гомоцистеїном у плазмі крові). У 24-тижневому подвійному сліпому дослідженні за участю жінок дітородного віку ефективність щоденного застосування біологічних добавок ФК та 5-МТГФ вивчалася шляхом визначення рівня ФК в еритроцитах, які повільно реагують на зміни концентрації ФК у крові, що є корисним у довгостроковій оцінці фолатного статусу. Було встановлено, що рівень ФК в еритроцитах після прийому біологічної добавки був вищим у групі застосування 5-МТГФ порівняно з прийомом ФК. Тобто в цьому довгостроковому дослідженні було показано вищу ефективність 5-МТГФ, аніж ФК, в еквімолярній дозі щодо підтримання фолатного статусу в жінок дітородного віку [3]. В іншому дослідженні, проведеному за участю жінок, які годують, було показано, що середня концентрація ФК в еритроцитах після прийому біологічної добавки була вищою при застосуванні 5-МТГФ порівняно з прийомом ФК [4]. Дані Fohr і співавт. (2002) свідчать про те, що 8-тижневе застосування еквімолярних доз 5-МТГФ у здорових жінок дітородного віку супроводжувалося вираженішим зростанням концентрації ФК у плазмі крові порівняно з призначенням ФК, тоді як її концентрація в еритроцитах не відрізнялася в обох досліджуваних групах [5].
При вивченні біодоступності ФК було встановлено, що існують певні генетичні чинники, пов’язані з мутацією генів, які кодують ключові ферменти метаболізму ФК, що впливає на підтримку оптимального фолатного статусу. Зокрема, наявність мутацій гена є чинником ризику розвитку природжених дефектів нервової трубки (ВДНТ) плода. У європейській популяції 12% населення є носіями гомозиготного генотипу TT, 43% – гетерозиготного генотипу СТ і 45% – гомозиготного «дикого типу» генотипу CC поліморфізму гена МТГФР [7]. Згідно з даними об’єднаного аналізу О. А. Фесай і співавт. (2018), проведеного в різних регіонах України за участю жінок репродуктивного віку, середня частота низькофункціональних поліморфізмів (C/T + T/T) локусу С677->Т гена МТГФР, яка є найвивченішою, становить 50,9%. На думку авторів, це свідчить про те, що в кожної другої української жінки репродуктивного віку ФК не метаболізується в активну форму та не засвоюється [8]. У багатьох дослідженнях наводяться дані про взаємозв’язок цього поліморфізму з хронічним невиношуванням вагітності в жінок (втратою двох або більше послідовних вагітностей до 20-го тижня) [9]. E. Servy та співавт. (2017) у результатах огляду даних літератури відзначили необхідність проведення тестування на виявлення поліморфізму гена МТГФР у разі тривалого порушення фертильності та повторних викиднів, а також переваги застосування 5-МТГФ над ФК у цієї групи пацієнток [10]. Окрім того, щоденне споживання 800 мкг 5-МТГФ жінками з поліморфізмом гена МТГФР може бути ефективним щодо підвищення ймовірності зачаття та зменшення частоти ановуляторних циклів порівняно із застосуванням ФК [11]. Наявність поліморфізму генів фолатного циклу в жінок негативно впливає на зростання ризику природжених вад розвитку (ПВР) плода. У такому випадку пряме введення 5-МТГФ матиме низку переваг, пов’язаних із безпосередньою біологічною доступністю активної форми ФК та відсутністю потреби в її метаболізмі [12].
Хронічний дефіцит ФК може спостерігатись як у чоловіків, так і в жінок. Зокрема, зниження рівня ФК у сироватці крові в чоловіків може негативно впливати на процес утворення сперматозоїдів, що відображається на їхній фертильності та може призводити до безпліддя. Тому сьогодні активно вивчається питання необхідності прийому ФК чоловіками перед планованим зачаттям [13].
! Низький рівень ФК у жінок під час вагітності пов’язаний із підвищеним ризиком передчасних пологів, низькою масою тіла дитини при народженні та затримкою розвитку плода. Крім того, дефіцит ФК у матері спричиняє підвищення рівня гомоцистеїну в сироватці крові, який асоційований з ускладненнями перебігу вагітності (повторними викиднями, прееклампсією, передчасними пологами, відшаруванням плаценти, затримкою росту плода й гестаційним цукровим діабетом), онкологічними та серцево-судинними захворюваннями.
Тому варто рекомендувати визначення рівня гомоцистеїну жінкам з обтяженим акушерським і сімейним анамнезом [14, 15]. Дефіцит ФК у жінок пов’язаний із можливим розвитком ПВР плода, вроджених вад серця й орофаціальних розщелин [16]. Згідно з міжнародними настановами рекомендовано призначати ФК у дозі 400-800 мкг/день принаймні 4 тиж до та 12 тиж після зачаття для забезпечення життєдіяльності, росту та розвитку ембріона, що знижує ризик розвитку ПДНТ плода на 50-70% [17], причиною якого в більшості випадків є багатофакторний комбінований негативний вплив тератогенних чинників навколишнього середовища та порушення регуляції активності генів. Утім, причинами ПДНТ плода також можуть бути й хромосомні аномалії. Попри те що роль екзогенних та ендогенних чинників ризику ПДНТ плода продовжує вивчатися, в літературі трапляються дані про те, що причиною їхнього спільного механізму дії є дефіцит ФК, похідні якої беруть участь у процесі перетворення гомоцистеїну на метіонін, що призводить до гіпергомоцистеїнемії. Наявність поліморфізму С677T й A1298C гена МТГФР пов’язана з підвищеною експресією рівня гомоцистеїну, зокрема серед жінок із дефіцитом ФК [15].
У вітчизняному дослідженні, в якому аналізували дані серед матерів Одеської області, було показано, що найвагомішими чинниками ризику ПДНТ плода є: дані акушерського анамнезу щодо кількості викиднів та/або пренатальної смертності, проживання в екологічно забрудненому регіоні, обтяжений сімейний анамнез щодо перенесених інсультів, інфарктів, варикозної хвороби, тромбоемболій, онкопатологій шлунково-кишкового тракту та/чи репродуктивної системи, ПВР серед близьких родичів першого ступеня спорідненості та в інших дітей цієї сім’ї, а також вік матері понад 35 років. За даними Н. В. Котової та співавт. [18], наявність одного з перелічених чинників у жінок репродуктивного віку є критерієм її включення до групи ризику розвитку ПДНТ плода. Крім того, автори встановили, що зниження ФК у сироватці крові та гіпергомоцистеїнемія в прегравідарному періоді та першому триместрі вагітності, а також підвищення температури тіла чи прийом гарячих ван у першому триместрі є предикторами розвитку ПДНТ плода.
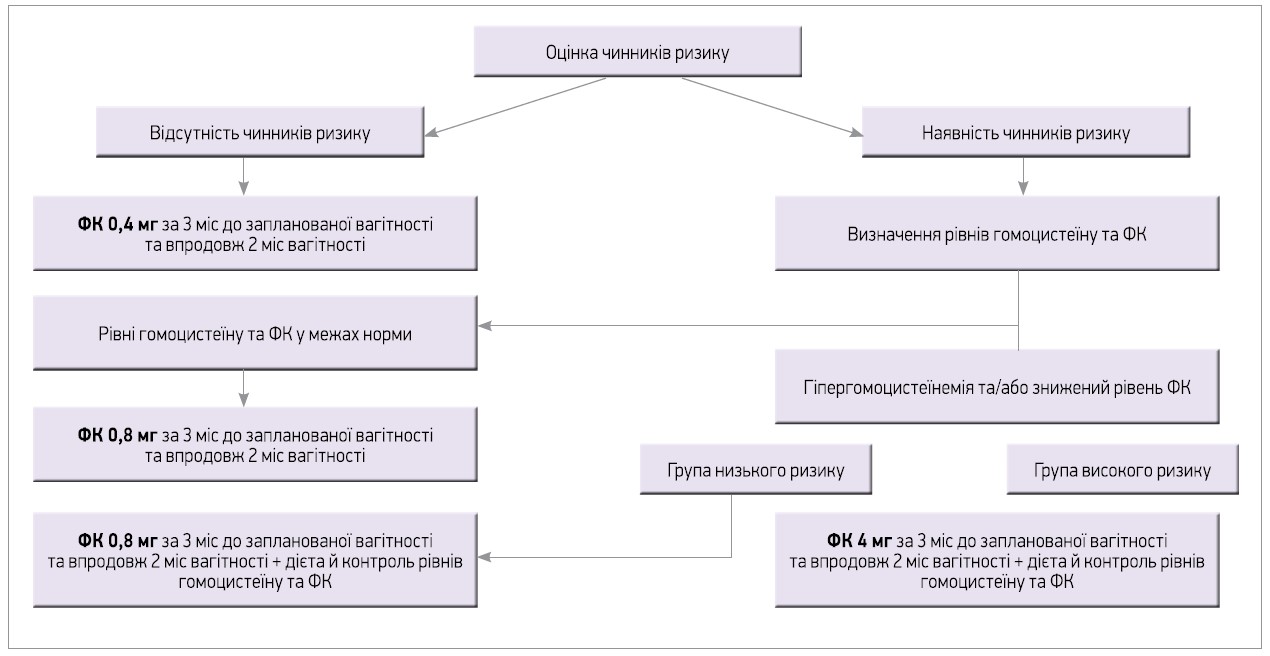
З огляду на наявність або відсутність чинників ризику ПДНТ плода вітчизняні автори [18] розробили алгоритм диференційованої профілактики його розвитку серед жінок репродуктивного віку (рис.). Зокрема, за відсутності чинників ризику рекомендовано призначати ФК у дозі 0,4 мг за 3 міс до планової вагітності та протягом 2 міс вагітності, а за наявності – визначати гомоцистеїн і ФК, що впливатиме на подальшу тактику ведення жінок. Якщо рівні гомоцистеїну та ФК у межах норми, рекомендовано призначати ФК у дозі 0,8 мг за 3 міс до планової вагітності та протягом 2 міс вагітності, а при зниженні цих показників варто визначати поліморфізм гена МТГФР і диференціювати осіб гомозигот 677С та/або 1298A в групу низького ризику, а пацієнток гомозигот 677T та/або 1298С чи гетерозигот C677T та/або A1298C – у групу високого ризику. Слід рекомендувати жінкам обох груп дотримуватися дієти, контролювати рівень гомоцистеїну, а також приймати ФК у дозі 0,8 мг (за низького ризику) чи 4 мг (за високого ризику) за 3 міс до планової вагітності та протягом 2 міс вагітності [18]. Сьогодні активно вивчається питання можливості використання 5-МТГФ як альтернативи ФК у профілактиці ПДНТ плода. В огляді літературних джерел R. Obeid і співавт. [12] висловили думку про те, що застосування добавки 5-МТГФ може бути ефективнішим в оптимальній підтримці фолатного статусу в молодих жінок на ранніх термінах вагітності з метою запобігання розвитку ПДНТ порівняно з призначенням ФК.
Рис. Алгоритм призначення ФК під час вагітності
Переваги застосування 5-МТГФ над ФК відзначалися й у серії інших досліджень. Дані рандомізованого контрольованого дослідження показали, що застосування як ФК, так і 5-МТГФ у здорових жінок супроводжувалося аналогічним зниженням рівня гомоцистеїну в плазмі, але застосування 5-МТГФ не характеризувалося маскуванням дефіциту вітаміну B12 порівняно з призначенням ФК [19]. Тому призначення неметаболізованої форми ФК з її потенційним окислювальним ефектом у крові потребує періодичного моніторингу ФК в еритроцитах і вітаміну B12, тоді як уведення еквімолярних доз 5-МТГФ дає змогу досягти тієї самої концентрації ФК у сироватці крові матері без утворення неактивних метаболітів [20]. У ретроспективному аналізі, проведеному за участю вагітних, було показано, що при застосуванні біологічної добавки 5-МТГФ у поєднанні з вітаміном B12 відзначався значно вищий рівень гемоглобіну в жінок наприкінці другого триместру та під час пологів порівняно з учасницями, які отримували ФК. Тобто призначення 5-МТГФ у поєднанні з вітаміном B12, на думку авторів, дає змогу досягти вираженішого зниження частоти анемії та потреби в додатковому прийомі препаратів заліза порівняно з призначення ФК [21]. Є дані й про те, що застосування 5-МТГФ може посилити антидепресивну дію деяких ліків. Це свідчить про можливу користь цього препарату в лікуванні депресії під час вагітності та в післяпологовому періоді, але наразі немає переконливих доказів щодо профілактичного застосування 5-МТГФ проти депресії [22].
Згідно з рекомендаціями Інституту медицини США застосування ФК передбачає призначення дози біологічної добавки не вище 1000 мкг у зв’язку з можливістю маскування ознак дефіциту вітаміну B12, водночас для 5-МТГФ не визначено верхньої межі рекомендованої дози. Проте накопичення неметаболізованої форми ФК через обмежену активність дигідрофолатредуктази було пов’язане з несприятливими наслідками для здоров’я, асоційованими зі зниженням функції мозку та соматосенсорної системи, заячою губою, астмою, аутизмом, анемією, несприятливими серцево-судинними подіями, онкологічними захворюваннями та когнітивними порушеннями [23]. В експериментальному дослідженні не було встановлено виникнення побічних явищ (ПЯ) в дослідних щурів у разі призначення біологічної добавки 5-МТГФ у щоденній (високій) дозі 17 мг протягом 12 тиж [24]. Під час вагітності не повідомлялося про розвиток ПЯ при застосуванні 5-МТГФ у дозі 1,13 мг [21], а також у разі призначення добавки в дозуванні 7,5 та 15 мг у пацієнтів із депресією [25]. Проте в окремих випадках у разі прийому 5-МТГФ може спостерігатися розвиток шлунково-кишкових розладів, безсоння, дратівливості та втоми.
У світлі можливих ПЯ при надлишковому застосуванні ФК варто розглянути альтернативний варіант поповнення дефіциту ФК шляхом застосування 5-МТГФ (біологічної добавки Фоленса фармацевтичної компанії World Medicine в дозуванні 400 мкг). Перевагами призначення 5-МТГФ над ФК є те, що добавка не накопичується у вигляді неметаболізованої форми ФК у крові (може спричиняти розвиток ПЯ), при цьому її застосування супроводжується відсутністю ознак маскування дефіциту вітаміну B12 поряд зі збереженням еквівалентної ефективності щодо запобігання розвитку ПДНТ плода та дещо вищої – в жінок із поліморфізмом гена МТГФР порівняно з використанням ФК. Тому варто рекомендувати жінкам, які планують вагітність, і вагітним приймати біологічну добавку Фоленса по 1 таблетці (400 мкг) під час або після їди 1 раз на добу (максимально до 2 таблеток на добу). Тривалість прийому визначається індивідуально залежно від наявності чинників ризику розвитку ПДНТ плода (рис.).
Отже, наявність у значної частки жінок України (50,9%) низькофункціональних поліморфізмів (C/T + T/T) локусу С677->Т гена МТГФР [8] призводить до того, що ФК не метаболізується в активну форму та не засвоюється в організмі. Дослідження поліморфізму гена МТГФР не є поширеною практикою сьогодні в нашій країні, тому застосування біологічної добавки Фоленса буде ефективним методом забезпечення диференційованої профілактики ПВР плода в жінок репродуктивного віку, яку неможливо повноцінно забезпечити звичним застосуванням ФК.
Список літератури знаходиться в редакції.
Підготувала Ірина Пікалюк
Медична газета «Здоров’я України 21 сторіччя» № 14 (531), 2022 р.