23 лютого, 2023
Використання молнупіравіру в терапії COVID-19 серед імуноскомпрометованих пацієнтів: ефективність, безпечність та вірологічні результати подвійного сліпого рандомізованого плацебо-контрольованого дослідження III фази MOVe-OUT
Пацієнти з імунокомпрометувальними станами, як-от імуносупресія внаслідок лікування онкологічних, автоімунних захворювань чи перенесеної трансплантації гемопоетичних клітин та солідних органів, а також ВІЛ-позитивний статус, становлять групу підвищеного ризику щодо тяжкого перебігу COVID-19 і пролонгованої реплікації SARS-CoV-2. Затримка елімінації та тривале носійство інфекційно спроможного збудника імунодефіцитними особами є загрозливими з погляду інфекційного контролю, оскільки створюють можливості для підвищеної трансмісії, а також виникнення нових варіантів SARS-CoV-2. За даними літератури, в імуноскомпрометованих пацієнтів спостерігалися нижчі рівні антитіл, нейтралізувального спайк-протеїну, а також виникнення резистентних варіантів збудника внаслідок терапії моноклональними антитілами. У цьому матеріалі пропонується огляд ретроспективного аналізу вірологічних даних, а також клінічної ефективності та безпечності використання молнуправіру в когорті імуноскомпрометованих учасників дослідження III фази MOVe-OUT.
Імуноскомпрометовані пацієнти при інфікуванні SARS-CoV-2 є схильнішими до тяжкого перебігу COVID-19 та несприятливих клінічних наслідків [1-6]. Окрім того, особи з імунодефіцитом, як-от реципієнти трансплантованих гематопоетичних стовбурових клітин і солідних органів, а також ВІЛ-інфіковані пацієнти із кількістю CD4+ Т-лімфоцитів <200 клітин/мм3, можуть триваліший час бути носіями вірусу, а також виділяти вірусні частинки SARS-CoV-2 в навколишнє середовище після перенесеної коронавірусної хвороби, порівняно з індивідами без імуноскомпрометованого статусу [7-11]. До факторів, що негативно впливають на клінічні наслідки COVID-19 і запобігають елімінації SARS-CoV-2 в пацієнтів з імунною супресією, належать, зокрема, кількість CD4+ Т-лімфоцитів <200 клітин/мм3, тип злоякісного захворювання, тип алотранспланту, термін із моменту трансплантації, а також тип та дозування хіміотерапії, імунотерапії чи підтримувальної імуносупресивної терапії після індукції [3, 4, 6-11].
Молнупіравір - пероральний низькомолекулярний рибонуклеозидний препарат, активним метаболітом якого є β-D-N4-гідроксицитидин (NHC), що демонструє потужну противірусну активність стосовно всіх досліджених варіантів SARS-CoV-2 [12-14]. NHC інгібує SARS-CoV-2 упровадженням випадкових нуклеотидних змін на вірусній РНК збудника, що призводить до зниження його інфекційності [15, 16]. За результатами доклінічних досліджень та клінічних випробувань ІІ та ІІІ фази, молнупіравір знижує інфекційну спроможність SARS-CoV-2 [17-20]. Так, пацієнти з легким і середнім ступенями тяжкості COVID-19, у яких на початку дослідження був виявлений вірулентний збудник, після курсу лікування молнупіравіром у дозі 800 мг 2 р/добу протягом 5 днів не демонстрували носійства інфекційно спроможного SARS-CoV-2 [19, 20].
Ефективність молнупіравіру для лікування негоспіталізованих дорослих пацієнтів із легким та середньотяжким перебігами COVID-19, які належали до групи підвищеного ризику щодо прогресування коронавірусної хвороби до тяжкого стану, вивчали в клінічному дослідженні MOVe-OUT. Проміжний аналіз цього подвійного сліпого рандомізованого плацебо-контрольованого дослідження III фази із даними пацієнтів, що приєдналися до дослідження в часовий проміжок із 6 травня по серпень 2021 року, показав перевагу молнупіравіру порівняно із плацебо в зниженні ризиків госпіталізації та смерті з усіх причин на 29-ту добу захворювання (7,3 та 14,1% відповідно; різниця -6,8%; довірчий інтервал (ДІ) 95% від -11,3 до -2,4). За результатами фінального аналізу даних усіх рандомізованих пацієнтів, які приєдналися до дослідження із 6 травня до 2 жовтня 2021 року, молнупіравір продемонстрував зменшення ризиків госпіталізації та смерті з усіх причин (6,8 проти 9,7% у групі плацебо; різниця -3,0%; ДІ 95% від -5,9 до -0,1), а також зниження відносного ризику смертності від усіх причин на 89% порівняно із плацебо [21].
В цьому матеріалі представлені результати ретроспективного аналізу вірологічних даних, а також клінічної ефективності та безпечності використання молнупіравіру в когорті імуноскомпрометованих учасників дослідження MOVe-OUT. Було проведене порівняння частоти госпіталізації та смертності з усіх причин і виникнення небажаних явищ серед пацієнтів з ослабленим імунітетом і хворих із нормальним імунним статусом, які отримували молнупіравір або плацебо. Водночас досліджувалася вірусна РНК SARS-CoV-2 та інфекційна спроможність збудника, частоти виникнення нуклеотидних змін у вірусній РНК і змін амінокислотного складу, спричинених терапією молнупіравіром, а також вироблення антитіл до SARS-CoV-2 в групах імуноскомпрометованих та здорових осіб, які отримували молнупіравір або плацебо.
Результати
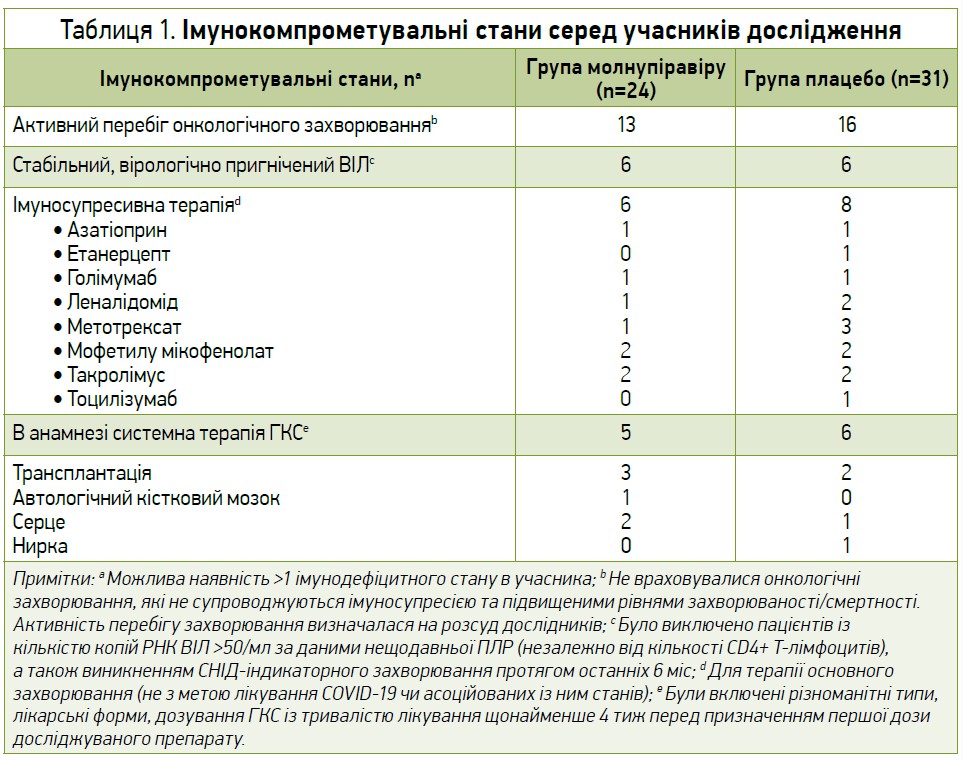
Серед усіх учасників, що потрапили до модифікованої вибірки залежно від призначеного лікування, 3,9% осіб (55/1408) були імуноскомпрометованими. 2 учасників з історією попереднього прийому ГКС (1 пацієнт із групи молнупіравіру, котрий отримував інгаляції флутиказону та сальметеролу, і 1 хворий з групи плацебо, який отримував бетаметазон/дексхлорфенірамін перорально, а також інгаляції флутиказону, сальметеролу) не були залучені до аналізу. Під час проведення дослідження дозування кортикостероїдів та інших імуносупресантів, що отримували учасники, не знижувалися. Найчастішими імунокомпрометувальними станами серед пацієнтів в обох групах були онкологічні захворювання в активній фазі. Перелік імунодефіцитних станів, що спостерігалися в учасників дослідження, представлено в таблиці 1.
Частота госпіталізації та смертність серед пацієнтів з ослабленим імунітетом станом на 29-й день у групі молнупіравіру (8,3%, 2/24) були нижчими, ніж у групі плацебо (22,6%, 7/31) (різниця -14,2%, ДІ 95% від -33,5 до 6,6).
Слід зазначити, що одним із госпіталізованих учасників групи молнупіравіру був 81-річний чоловік із дифузною великою В-клітинною лімфомою, який отримував циклофосфамід, доксорубіцин, вінкристин, преднізон та ритуксимаб за 10 днів до першої дози досліджуваного препарату; він був госпіталізований щодо непозалікарняної пневмонії на 7-й день дослідження і помер від поліорганної недостатності на 26-й день випробування. Другим госпіталізованим імуноскомпрометованим пацієнтом із групи молнупiравіру був 49-річний чоловік з активним перебігом неуточненого онкологічного захворювання та перенесеною геміколектомією, який був госпіталізований на 8-й день дослідження у зв’язку з періанальним абсцесом. За даними підтверджувального аналізу, серед госпіталізованих або померлих станом на 29-й день дослідження хворих, в 1 (4,2%, 1/24) учасника групи молнупіравіру та 5 (16,1%, 5/31) пацієнтів із групи плацебо госпіталізація чи смертність, на думку дослідників, були пов’язані з COVID-19.
У групі молнупіравіру частка пацієнтів, які були госпіталізовані або померли, була схожою в обох підгрупах незалежно від наявності імунодефіциту. В групі плацебо серед імуноскомпрометованих хворих частота госпіталізації та смертність були вищими порівняно з учасниками без імунодефіциту. Пропорційно смертність була вищою серед імуноскомпрометованих пацієнтів (5,5%, 3/55) порівняно з учасниками без ослабленого імунітету (0,5%, 7/1353).
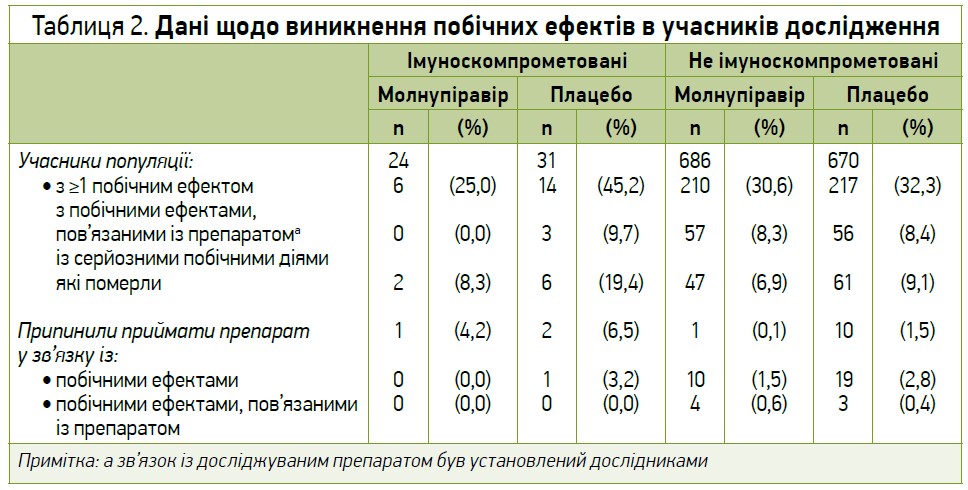
Молнупіравір загалом добре переносився учасниками з ослабленим імунітетом, а профіль його небажаних явищ був схожим у підгрупах пацієнтів незалежно від імунодефіцитного статусу. В учасників з ослабленим імунітетом спостерігалося менше побічних явищ та серйозних побічних явищ у групі молнупіравіру (25%, 6/24 та 8,3%, 2/24 відповідно) порівняно із групою плацебо (45,2%, 14/31 та 19,4%, 6/31 відповідно), тоді як у пацієнтів без імунодефіциту профіль небажаних явищ у групі молнупіравіру був схожим до такого в групі плацебо. Було зафіксовано 3 летальні випадки внаслідок небажаних явищ серед учасників з імуносупресією (1 – у групі молнупіравіру та 2 – в групі плацебо), жоден з яких, за оцінкою дослідників, не був пов’язаний з прийомом досліджуваного препарату. Дані щодо виникнення побічних ефектів в учасників дослідження наведено в таблиці 2.
Середній титр РНК SARS-CoV-2 (log10 копій/мл) станом на 1-й день дослідження був дещо вищим серед імуноскомпрометованих учасників (6,98, n=17 у групі молнупіравіру та 7,07, n=28 у групі плацебо) порівняно з учасниками без імунодефіциту (6,88, n=597 у групі молнупіравіру та 6,90, n=569 у групі плацебо).
Серед учасників без імунодефіциту середнє зниження титрів РНК SARS-CoV-2 стосовно вихідного рівня було значнішим у пацієнтів, які отримували молнупіравір (порівняно з підгрупою плацебо), в усіх часових точках, тоді як середні зміни титрів РНК у когорті учасників з ослабленим імунітетом виявилися схожими в підгрупах препарату та плацебо.
Серед пацієнтів групи молнупіравіру, в яких на початку дослідження виявили інфекційно спроможний вірус, у жодного учасника незалежно від їхнього імунного статусу інфекційний вірус не був виявлений у жодній часовій точці після початку лікування.
У групі плацебо 42,9% (3/7) учасників когорти з ослабленим імунітетом мали інфекційно спроможний вірус, виявлений на 3-й день дослідження, а в когорті пацієнтів без імуносупресії - 19,1% (17/89), 2,4% (2/82) учасників мали інфекційний вірус, виявлений на 3-й та 5-й день відповідно.
Висновки
Згідно з результатами ретроспективного аналізу даних, отриманих у подвійному сліпому рандомізованому плацебо-контрольованому дослідженні ІІІ фази MOVe-OUT, використання молнупіравіру в терапії негоспіталізованих імуноскомпрометованих дорослих пацієнтів із легким та середньотяжким перебігом COVID-19, які належали до групи підвищеного ризику щодо прогресування коронавірусної хвороби до тяжкого стану, є ефективним і безпечним. Молнупіравір демонстрував зіставні позитивні вірологічні ефекти в обох підгрупах пацієнтів незалежно від імунного статусу. За даними дослідження інфекційної спроможності вірусу SARS-CoV-2, а також генетичного аналізу збудника методом NGS до початку і після терапії дослідним препаратом, було визначено, що когорта імуноскомпрометованих учасників не демонструє підвищеної схильності до розвитку нових варіантів SARS-CoV-2 після лікування молнупіравіром.
Підготувала Ганна Гаврюшенко
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (537-538), 2023 р.