1 березня, 2023
Есциталопрам – антидепресант нової генерації: від наукових даних до практичного використання
 Кожному з нас добре відома істина, що найдорожчим скарбом у житті є здоров’я, при цьому фізичний та психологічний стани – однаково вагомі складові загального здоров’я і добробуту. Однією з важливих проблем охорони здоров’я та суспільства загалом є депресія – захворювання, що характеризується постійним пригніченим станом, втратою інтересу до будь-якої діяльності, що зазвичай приносить задоволення, а також нездатністю виконувати повсякденні справи протягом щонайменше 2 тиж. Вважається, що депресія може виникнути в будь-якої людини незалежно від статі, економічного стану або рівня освіти [1-3]. В усьому світі, за оцінками фахівців, на депресію страждають ≈280 млн осіб, або 3,8% населення [4]. Вона є однією з найпоширеніших психічних патологій та основною причиною інвалідності у всьому світі [5].
Кожному з нас добре відома істина, що найдорожчим скарбом у житті є здоров’я, при цьому фізичний та психологічний стани – однаково вагомі складові загального здоров’я і добробуту. Однією з важливих проблем охорони здоров’я та суспільства загалом є депресія – захворювання, що характеризується постійним пригніченим станом, втратою інтересу до будь-якої діяльності, що зазвичай приносить задоволення, а також нездатністю виконувати повсякденні справи протягом щонайменше 2 тиж. Вважається, що депресія може виникнути в будь-якої людини незалежно від статі, економічного стану або рівня освіти [1-3]. В усьому світі, за оцінками фахівців, на депресію страждають ≈280 млн осіб, або 3,8% населення [4]. Вона є однією з найпоширеніших психічних патологій та основною причиною інвалідності у всьому світі [5].
В загальній медичній практиці частота депресій сягає 22-33%. Депресивні розлади (ДР) часто супроводжують хронічні неінфекційні захворювання (ХНІЗ), як-от серцево-судинні (ССЗ), хронічні респіраторні, а також цукровий діабет (ЦД). Серед пацієнтів, які звертаються по медичну допомогу до лікарів, котрі надають первинну медичну допомогу, ДР мають 17% осіб. У хворих із ХНІЗ депресія виявляється в 2-4 рази частіше, ніж у популяції. Майже 80% пацієнтів із депресією лікуються в лікарів загальної практики, в сімейних лікарів – щодо інших захворювань [1, 6, 7].
Ситуація, що зараз склалася в Україні, негативно позначається на стані психосоматичного здоров’я практично всіх верств населення. Повномасштабна воєнна агресія, небачена жорстокість агресора щодо мирного населення, примусове переміщення та пов’язані з ними негаразди, як-от бідність, безробіття, соціальна ізоляція, значно підвищують уразливість до психосоціального стресу і сприяють поширеності психічних розладів. Депресія, тривога, постстресові розлади спостерігаються орієнтовно в 30% населення. Загалом психологічної підтримки, за оцінкою Міністерства охорони здоров’я України, в подальшому потребуватимуть ≈15 млн громадян, при цьому спостерігатимуться такі найчастіші стани, як депресія, тривожність, безсоння [8, 9]. Безумовно, ці стани, як завжди, часто поєднуватимуться із ХНІЗ, а пацієнти звертатимуться до лікарів загальної практики – сімейної медицини. Всесвітня організація охорони здоров’я (ВООЗ) рекомендує спільне ведення пацієнта із ХНІЗ лікарем-інтерністом та фахівцем із психічного здоров’я [8, 10]. Водночас у реальному житті більшість осіб із депресією звертаються саме до сімейного лікаря, а певна частка самостійно встановлює діагноз та лікується самотужки або, в кращому випадку, користується порадами фармацевта. Згідно з результатами дослідження компанії Gradus Research, з початку широкомасштабної війни 57% українців зазнали психічних розладів, із них лише 13% зверталися по професійну медичну допомогу. Для терапії ДР використовуються антидепресанти (АД), споживання яких у першому півріччі 2022 р. зросло на 32% [9].
З огляду на вищезазначену інформацію для якнайранішого менеджменту симптомів депресії актуальним є пошук шляхів медикаментозної терапії, яка може використовуватися як у психіатричній, так і в загальномедичній практиці, є одночасно ефективною, безпечною, економічно доцільною, простою та зрозумілою [8]. У цьому плані таким критеріям більшою мірою відповідають АД останніх генерацій – селективні інгібітори зворотного захоплення серотоніну (СІЗЗС).
Біологічні механізми розвитку ДР на клітинному й молекулярному рівнях через свою складність та гетерогенність, що визначаються генетичними факторами і факторами зовнішнього середовища, на жаль, дотепер остаточно не з’ясовані. Це суттєво ускладнює розробку ліків для патогенетичної фармакотерапії депресії, адже ймовірність створення високоефективного й одночасно безпечного лікарського препарату (ЛП) для лікування неінфекційних захворювань буде вищою тоді, коли патогенез таких лікарських засобів вивчатиметься детальніше. Саме патогенетична терапія, спрямована на усунення або гальмування механізмів розвитку неінфекційних захворювань, є найефективнішою.
Наявні наукові дані обґрунтовують декілька гіпотез складного та мультифакторного патогенезу ДР. Розглянемо ключові положення тих, що найбільше пов’язані з механізмом дії сучасних АД.
Гіпотези патогенезу ДР
Теорія дефіциту моноамінів є першою і на сьогодні найпоширенішою гіпотезою, котра розглядає ДР як захворювання дефіциту моноамінів, за якого низькі рівні моноамінів у синаптичній щілині – серотоніну, норадреналіну та/або дофаміну – лежать в основі депресивних симптомів. Відповідно до цієї гіпотези ліки, які підвищують концентрацію моноамінів у синаптичній щілині, повинні мати антидепресантні властивості; зусилля фармакологів багато років були спрямовані на створення саме таких ЛП [11, 12].
Теорія дефіциту моноамінів при ДР підтверджується експериментальними та клінічними даними, проте вона не може пояснити того, чому АД не діють відразу, а надають відтермінований на 2-4 тиж ефект. Саме тому існують ії модифікації.
Суть рецепторної модифікації моноамінової гіпотези ДР є такою: у відповідь на дефіцит моноамінів відбувається компенсаторне збільшення кількості (чутливості) рецепторів. АД збільшує концентрацію моноаміну, в результаті чого кількість (чутливість) рецепторів зменшується. Внаслідок цього на рівні постсинаптичних рецепторів розвивається толерантність до гострих побічних ефектів; на рівні пресинаптичних рецепторів реалізується антидепресивна дія АД. Зменшення кількості (чутливості) рецепторів потребує певного часу, отже, дія АД є відтермінованою.
Порушення функціонування гіпоталамо-гіпофізарно-надниркової осі – головної стрес-системи нашого організму – розглядається як одна з важливих причин виникнення ДР [13].
Теорія нейропластичності останнім часом набуває все більшого поширення, адже пояснює відтермінований вплив дії АД [14]. Під нейропластичністю слід розуміти здатність мозку зазнавати певних змін у відповідь на зовнішні та/або внутрішні стимули. Ці зміни можуть візуалізуватися на структурному (кількість нейронів, розгалуженість дендритних відростків, щільність і морфологія дендритних шипиків, кількість синаптичних контактів, рівні синаптичних білків), а також функціональному рівні (наприклад, синхронна відповідь нейронів різних відділів мозку) [12, 14, 15]. Важливу роль у процесах нейропластичності відіграє специфічний білок із класу цитокінів – мозковий нейротрофічний фактор (BDNF). Він виявляється переважно в нейрональних клітинах, а також клітинах глії. BDNF діє на певні нейрони центральної та периферичної нервової системи, сприяє формуванню, диференціації, виживанню нових нейронів і синапсів під час розвитку, а також збільшує чисельність синаптичних контактів, створює відповідні умови для виживання нейронів дорослого мозку. В головному мозку BDNF активний у гіпокампі, корі та передньому мозку – ділянках, які піддаються змінам при ДР. За ДР відбувається порушення внутрішньоклітинного каскаду нейрохімічних реакцій на рівні вторинних месенджерів, що контролюють експресію певних генів. Одним із таких є ген, який кодує синтез білка BDNF. Стрес спричиняє репресію гена, зменшує синтез BDNF, що, своєю чергою, сприяє розвитку ДР. Вважається, що саме здатність окремих АД впливати на синтез нейротрофічного білка BDNF відіграє важливу роль у прояві антидепресивної дії [16-19].
Теорія мікроглії – ще одна гіпотеза для пояснення відтермінованої дії АД (активно розробляється останнім часом). Вона стосується не нейронів, а інших клітин мозку, а саме мікроглії. Мікроглія – це первинні імунні клітини центральної нервової системи, схожі на периферичні макрофаги. Клітини мікроглії характеризуються функціональною різноманітністю: контролюють мікрооточення нейронів очищенням його від апоптотичних клітин шляхом фагоцитозу, регулюють синаптичну пластичність, збереження синаптичних контактів. Мікроглія здатна реагувати на ушкоджувальний вплив щодо клітин мозку (травми, інфекції, тривалий стрес) розвитком нейрозапалення шляхом вивільнення запальних цитокінів та відіграє важливу роль у завершенні запальної реакції виробленням протизапальних цитокінів [19, 20]. Вважається, що нейрозапалення та гіпоталамо-гіпофізарно-надниркова вісь функціонують скоординовано та відіграють певну роль у виникненні ДР [22, 23].
Теорія нейрозапалення, опосередкованого мікроглією, поєднує всі вищезазначені теорії: дефіцит моноамінів, вплив на нейропластичність та порушення координації гіпоталамо-гіпофізарно-надниркової осі [22, 23].
Отже, можна припустити, що ефективність та особливості клінічної дії різних АД можуть бути пов’язані з їх неоднаковим впливом на різні відомі ланки патогенезу ДР.
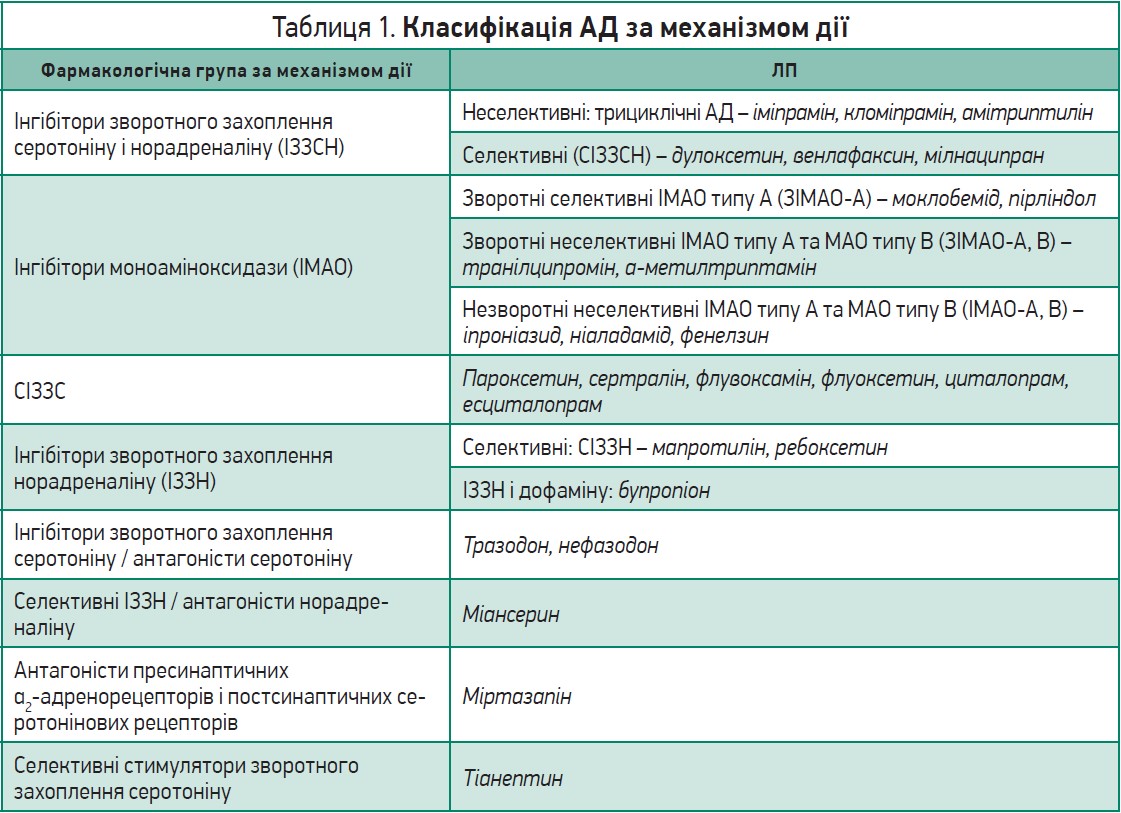
Класифікація АД за механізмом дії ґрунтується на теорії дефіциту моноамінів при ДР і розподіляє наявні ЛП на декілька груп (табл. 1) [24].
Препарати кожної групи по-різному впливають на різні моноаміни, отже, мають особливості клінічних ефектів та виразності побічних реакцій.
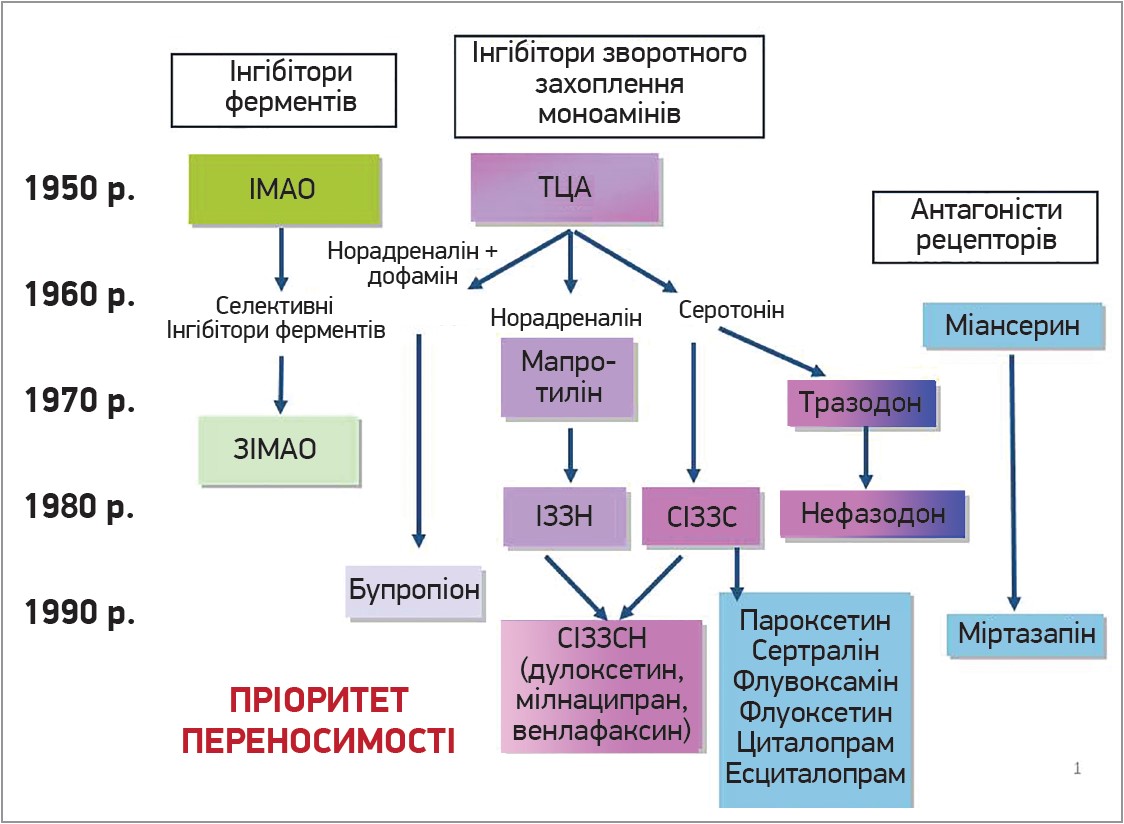
Упродовж останніх десятиліть кількість препаратів групи АД значно зросла і головною метою створення нових був пріоритет безпеки та переносимості (рис. 1).
Рис. 1. Еволюція створення АД
За наявності значної кількості препаратів проблема вибору, оптимального для лікування конкретного хворого, є досить складною. Саме тому знання особливостей та переваг того чи іншого препарату є запорукою їхнього успішного застосування на практиці.
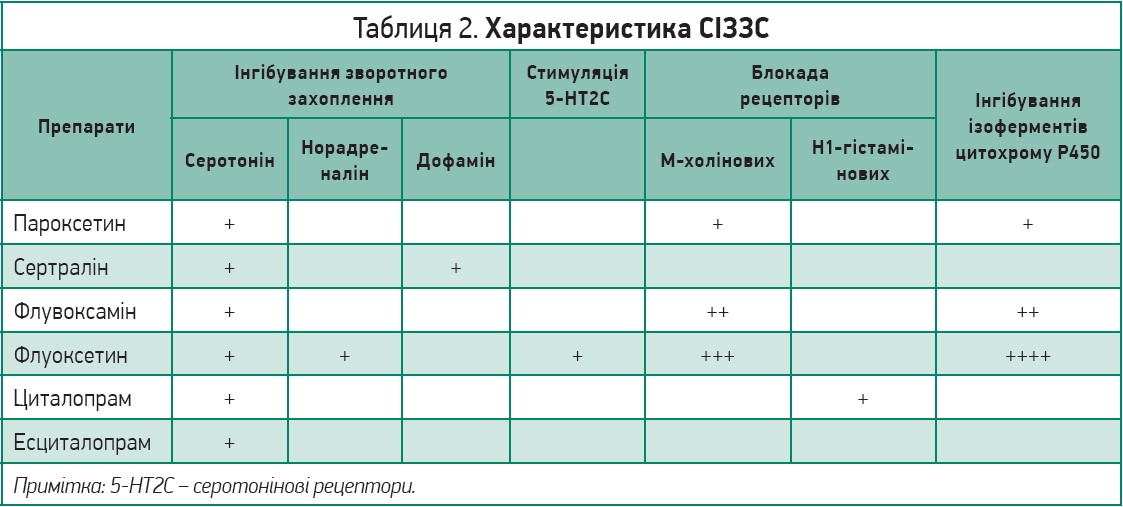
СІЗЗС наразі найчастіше використовуються в терапії депресій. У національних та міжнародних настановах вони рекомендовані як терапія першої лінії для більшості пацієнтів із великою депресією [1, 2]. СІЗЗС не поступаються «класичним» АД за ефективністю, але мають порівняно з ними переваги за переносимістю, що пов’язано з більш вибірковим впливом на динаміку рівня різних моноамінів та їхніми фармакокінетичними особливостями, зокрема впливом на активність печінкових ферментів (табл. 2). Останнє визначає можливості їхнього безпечного використання в поєднанні з іншими препаратами, призначеними для лікування супутньої хвороби.
Провідний механізм дії – блокада зворотного захоплення серотоніну – є загальним для всіх СІЗЗС, проте між препаратами існують суттєві відмінності за своїми клініко-фармакологічними ефектами та профілем безпеки. Ці відмінності пов’язані з додатковими механізмами дії та особливостями фармакокінетики окремих СІЗЗС.
Есциталопрам – препарат нового покоління групи СІЗЗС
Есциталопрам був виведений на фармацевтичний ринок у рекордно стислі терміни (впродовж 3,5 років) і схвалений Управлінням з контролю за якістю продуктів харчування та лікарських засобів (FDA) у 2002 р. Це стало можливим тому, що есциталопрам створено на основі добре вивченого циталопраму на ґрунті наукової теорії про стереоізомерію. Сьогодні добре відомо, що значна кількість лікарських речовин мають стереоізомери – молекулярні структури з однаковими атомами та характером зв’язків, проте по-різному орієнтованими в просторі. Для багатьох лікарських речовин доведена різна фармакологічна активність стереоізомерів і створені препарати, що відрізняються саме ізомерним складом (наприклад, цетиризин та левоцитиризин, кетопрофен і декскетопрофен). Циталопрам, що з’явився на фармацевтичному ринку в 1989 р., являє собою рацемат (тобто суміш) S‑стереоізомерів (лівобічна версія) та R‑стереоізомерів (правобічна версія). В дослідженнях іn vitro та in vivo було доведено, що здатність інгібувати зворотне захоплення серотоніну в S‑ізомера є у 100 разів вищою, ніж у R‑ізомера, у зв’язку із чим R‑ізомер не має корисної дії при лікуванні депресії. Крім того, неактивний R‑ізомер спроможний протидіяти активності S‑ізомера, адже здатен займати його місце в зворотному захопленні серотоніну. Отже, циталопрам – суміш активного S- та неактивного R‑стереоізомерів, а есциталопрам містить винятково активний S‑стереоізомер, що відображено в назві ЛП. Різний склад ізомерів становить основу для фармакологічних та клінічних відмінностей між циталопрамом та есциталопрамом [24-28].
Механізм дії есциталопраму
Механізм дії есциталопраму має вагомі відмінності від інших СІЗЗС. Оскільки саме механізм – основа властивостей будь-якого лікарського засобу, в есциталопраму є важливі особливості порівняно із ЛП цієї групи.
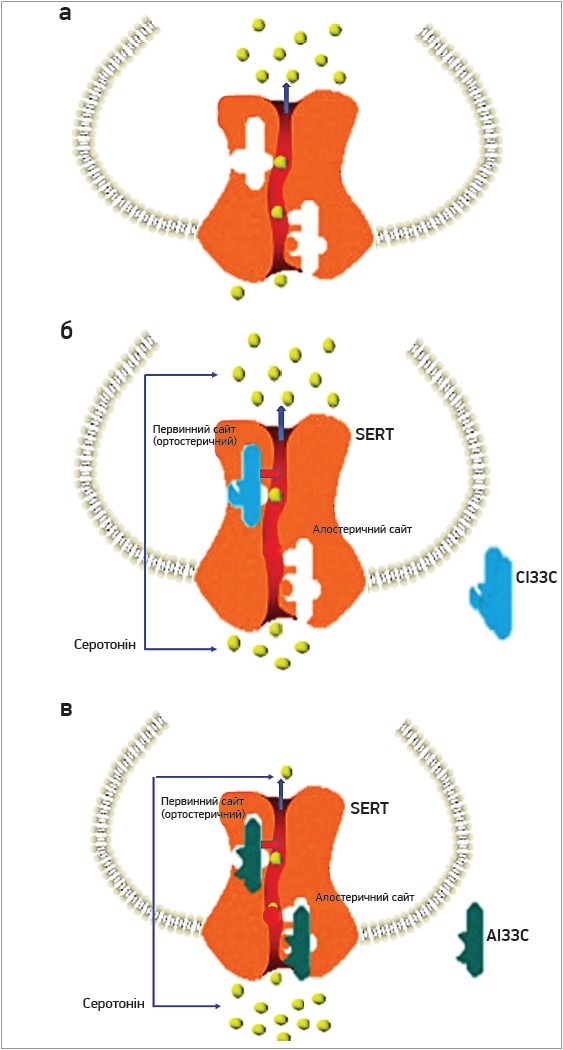
Усі СІЗЗС мають один і той самий субстрат для фармакологічного впливу – білок-транспортер серотоніну (Serotonin transporter, SERT). Фізіологічною функцією білка SERT є зворотне захоплення і транспорт нейромедіатора серотоніну із синаптичної щілини назад у пресинаптичний нейрон, з якого він був виділений. СІЗЗС зв’язуються із SERT, що призводить до порушення його здатності транспортувати серотонін усередину нейрона і підвищення рівня серотоніну в позаклітинному просторі синаптичної щілини. Встановлено, що білок SERT має два типи ділянок (сайтів) зв’язування, взаємодія з якими змінює його здатність до транспорту серотоніну. Це ортостеричний (первинний) та алостеричний сайт. Більшість СІЗЗС зв’язуються з ортостеричним сайтом, що спричиняє певне інгібування функції SERT. Есциталопрам здатний зв’язуватися як з ортостеричними, так і з алостеричними сайтами зв’язування SERT (рис. 2). Цей унікальний механізм дозволяє есциталопраму здійснювати повніше та стійкіше інгібування зворотного транспорту серотоніну до пресинаптичного закінчення нейрона, що призводить до його більш високих позаклітинних рівнів [28, 29]. Щоб підкреслити цю суттєву відмінність у механізмі дії, у рекомендаціях Канадської мережі з лікування розладів настрою та тривоги (CANMAT) есциталопрам відносять до окремої підгрупи АД – алостеричний інгібітор зворотного захоплення серотоніну (АІЗЗС) [30, 31].
Рис. 2. Модель дії СІЗЗС (модифіковано за Sanchez C. et al., 2014)
Примітки: SERT розташований на серотонінергічних нейронах і має первинний (ортостеричний)
та алостеричний сайти зв’язування, взаємодія з якими зумовлює збільшення позаклітинного рівня серотоніну;
а) без препаратів-інгібіторів SERT виконує свою транспортну функцію, видаляючи позаклітинний серотонін;
б) СІЗЗС, як-от сертралін, не здатні зв’язуватися з алостеричним сайтом, отже, їхня дія щодо підвищення
позаклітинного рівня серотоніну опосередковується тільки через первинний сайт;
c) АІЗЗС, як-от есциталопрам, зв’язуються як із первинними, так і з алостеричними сайтами, що спричиняє
вираженіше збільшення позаклітинного рівня серотоніну.
Вплив есциталопраму на механізм розвитку депресії не обмежується блокуванням SERT та зменшенням зворотного захоплення серотоніну.
За допомогою низки досліджень виявлено здатність есциталопраму впливати на другу важливу ланку розвитку депресії – нейропластичність. На моделі депресії у тварин показано статистично достовірне збільшення BDNF у сироватці крові та тканинах головного мозку [32]. Доведено, що есциталопрам не лише підвищував рівень BDNF у нейронах тих відділів головного мозку, що беруть участь у розвитку депресії (гіпокамп, лобова частина), а й достовірно збільшував кількість дендритів, їхню розгалуженість та міжнейронні зв’язки у цих відділах, що підтверджувалося гістоморфологічними даними [33]. В клінічних дослідженнях на тлі лікування есциталопрамом продемонстровано достовірне збільшення рівня BDNF у сироватці літніх пацієнтів із депресією та встановлено чіткий взаємозв’язок цього підвищення з позитивною динамікою симптомів захворювання [34]. У хворих із посттравматичним стресовим розладом і низьким рівнем BDNF спостерігався найвираженіший клінічний ефект есциталопраму [35]. З огляду на наявні дані про вплив есциталопраму на нейропластичність низка авторів пропонує розглядати рівень BDNF у сироватці як маркер для прогнозування його ефективності в пацієнтів із депресією [34, 36].
Наразі також наявні дані, що підтверджують дію есциталопраму на ще одну можливу ланку патогенезу депресії – стан мікроглії та опосередковане нею нейрозапалення. Так, на тваринах показано модулювальну дію есциталопраму на кількість клітин мікроглії [33], а в хворих із депресією на тлі успішного лікування есциталопрамом спостерігалося зниження маркерів запалення [37, 38].
Отже, есциталопрам має багатогранний механізм дії, поєднуючи властивості АД і нейропротектора, що принципово виокремлює його серед інших СІЗЗС.
Сприятливі фармакокінетичні особливості та незначний вплив есциталопраму на активність ізоферментів Р450 поряд з унікальним механізмом дії обґрунтовує доцільність його використання в широкого кола пацієнтів із депресією.
До його сприятливих фармакокінетичних особливостей належать:
- добре всмоктування та висока біодоступність (80%) при пероральному прийомі, що не залежать від прийому їжі;
- легкість проходження через гематоенцефалічний бар’єр;
- біотрансформація в печінці з утворенням метаболітів, що мають украй низьку фармакологічну активність;
- низький потенціал лікарської взаємодії;
- відсутність клінічно значущих відмінностей у фармакокінетиці в підлітків, людей похилого віку і пацієнтів із печінковою недостатністю порівняно зі здоровими молодими людьми, що не потребує коригування дози для цих груп хворих [39, 40].
Доказова база ефективності есциталопраму
Основними цілями антидепресивної терапії є повне усунення симптомів; повернення активності на рівень до захворювання; профілактика загострень чи поновлення симптоматики. Різні ЛП групи СІЗЗС порівнюються між собою за ефективністю відповідно до досягнення цих цілей.
Доказова база ефективності наразі є важливою характеристикою будь-якого ЛП. АД вважається ефективнішим, якщо наявні хоча би два подвійні сліпі рандомізовані клінічні дослідження (РКД), за результатами яких він є кращим за первинним показником ефективності, ніж препарат порівняння [28]. Для есциталопраму таких досліджень проведено значно більше. Загалом вивченню різних клінічних аспектів його застосування присвячено 664 РКД, 435 з яких уже завершено (з проаналізованими результатами) [41]. Відповідно до принципів доказової медицини до 1 рівня доказів (висока якість) належать систематичні огляди або метааналіз декількох РКД.
Есциталопрам широко порівнювався з іншими АД у метааналізах та систематичних оглядах за ефективністю і безпекою застосування. Так, монотерапія ним великого ДР (ВДР) проаналізована в об’єднаному аналізі результатів 4 РКД за участю 649 пацієнтів. Есциталопрам продемонстрував клінічно значущу відповідь на терапію в 76,9, 63,7 та 63,0% при легкій, середній, середньотяжкій формі захворювання, а також тривалу ремісію в 64,0, 41,6, 27,2% пацієнтів відповідно. За шкалою загального клінічного враження (Clinical global impression scale, CGI) значне поліпшення стану відзначено у 86,7%. Висока ефективність есциталопраму поєднувалася з хорошою переносимістю та безпекою – впродовж 6 міс лікування від нього відмовилися лише 3,39% пацієнтів [42].
На підставі аналізу 10 досліджень за участю 2687 хворих із ВДР було встановлено, що есциталопрам має значно вищий загальний ефект лікування, частоту відповіді та частоту ремісії порівняно з усіма препаратами порівняння, в т. ч. пароксетином і сертраліном [43].
У подальшому метааналізі, під час якого порівнювали есциталопрам з активним контролем, у т. ч. СІЗЗС (циталопрам, флуоксетин, пароксетин, сертралін) і СІЗЗСН (венлафаксин, дулоксетин), за участю 4549 пацієнтів у 16 РКД есциталопрам знову виявився значно ефективнішим за частотою відповіді та ремісії [44]. Провідні позиції він також мав у великому мережевому метааналізі 522 випробувань за участю 116 477 хворих щодо порівняльної ефективності та переносимості 21 АД [45].
В експериментальних дослідженнях доведено сприятливий вплив есциталопраму на процеси нейропластичності та нейрогенезу, насамперед у корі й гіпокампі, які відіграють значну роль у розвитку як депресивних, так і когнітивних розладів. Поєднання властивостей АД та нейропротектора може бути одним із критеріїв вибору есциталопраму в лікуванні постінсультної депресії [46]. Це підтверджується даними метааналізу 51 РКД, за результатами якого есциталопрам виявився найкращим серед 9 АД і асоціювався зі швидшим усуненням депресії [47]. Його позитивний вплив на перебіг постінсультної депресії у поєднанні з високою безпекою підтверджено в останньому метааналізі, який включав РКД до травня 2021 р. [48]. Існують дані, що есциталопрам, який призначається впродовж раннього терміну після інсульту профілактує депресію та сприяє відновленню функції нервової системи [49].
Крім ВДР, есциталопрам слід розглядати як препарат першого вибору і за інших станів, для яких існують докази його ефективності та безпеки. Так, за результатами метааналізу 41 РКД щодо 11 АД при лікуванні генералізованого тривожного розладу есциталопрам показав найкращу ефективність [50]. Об’єднаний аналіз 87 досліджень, що включають загалом 12 800 учасників і 12 класів препаратів, був проведений нещодавно з метою визначення класів препаратів та окремих СІЗЗС із високими показниками ремісії, а також низьким ризиком небажаних явищ при лікуванні панічного розладу. За результатами цього дослідження серед СІЗЗС есциталопрам поряд із сертраліном асоціювався з високою ремісією та низьким ризиком небажаних явищ [51].
Безпека есциталопраму
Безпека есциталопраму, як і будь-якого ЛП, є не менш важливою характеристикою, ніж ефективність. Для АД цей аспект особливо важливий, оскільки лікування має проводитися тривало, а прояви навіть незначної побічної дії можуть призводити до відмови від терапії та погіршення стану. Існування зв’язку між селективністю впливу на зворотне захоплення серотоніну та рівнем безпеки СІЗЗС дозволяє розглядати есциталопрам як один із найбезпечніших представників цієї групи препаратів [28, 52]. При лікуванні депресій, тривожних розладів він перевершував за цим критерієм (кількість та вираженість побічних реакцій, кількість випадків відмови від лікування) СІЗЗСН (венлафаксин, дулоксетин), СІЗЗС (флуоксетин, пароксетин) і навіть циталопрам (у якому наявні помірно виражені гістаміноблокувальні властивості, що практично відсутні в есциталопраму) [44, 45, 48, 50].
У вищезазначених метааналізах ефективність есциталопраму вивчалася паралельно з безпекою його застосування. Побічні ефекти за його прийому відзначалися досить рідко (зазвичай на початку лікування), характеризувалися слабкою або помірною вираженістю, переважно проходили після 2 тиж терапії та вкрай рідко були причиною відмови від терапії. Особливо слід зазначити, що ризик розвитку побічних ефектів під час лікування есциталопрамом залежить від тривалості його прийому [28, 53-55].
Можливості застосування есциталопраму в пацієнтів особливих категорій – важлива складова клінічної ефективності. Висока селективність та особливості фармакокінетики забезпечують низький потенціал лікарської взаємодії, отже, доцільність застосування в коморбідніх пацієнтів [56]. У хворих старшого віку найрозповсюдженішими є ССЗ, ЦД 2 типу, хронічні хвороби легень, онкологічні захворювання. Всі ці хвороби потребують постійної медикаментозної терапії, тому питання раціонального вибору АД є украй актуальним. Клінічні дослідження, проведені останніми роками, надають вагомі докази доцільності використання в коморбідних пацієнтів саме есциталопраму.
У великому мережевому метааналізі 12 РКД вивчалися короткострокові ефекти лікування різними АД на тяжкість депресії та рівень HbA1c у пацієнтів із депресією на тлі ЦД 2 типу. Порівнювали есциталопрам, агомелатин, циталопрам, флуоксетин, нортриптилін, пароксетин, сертралін, вортіоксетин, відсутність антидепресивної терапії та плацебо. Результати аналізу довели, що есциталопрам не лише перевершував усі препарати порівняння за антидепресивним ефектом, а й чинив сприятливу дію на показники глікемії [57]. Отримані дані підтвердили результати попереднього метааналізу 16 РКД, у якому за впливом на глікемію есциталопрам перевищував як плацебо, так і препарати порівняння групи СІЗЗС [58].
Відомо, що депресія в пацієнтів із ССЗ пов’язана з поганим прогнозом. Водночас одним із побічних ефектів СІЗЗС є подовження інтервалу QT [59]. Оновлена інформація за останні 5 років свідчить про те, що есциталопрам подовжує інтервал QT меншою мірою, ніж інші психотропні препарати [60]. Ці дані узгоджуються з результатами вивчення ризику негативних реакцій з боку серцево-судинної системи при прийомі СІЗЗС. Метааналіз 15 випробувань, що включають 1432 літніх пацієнтів із депресією, продемонстрував явні переваги есциталопраму порівняно з іншими СІЗЗС. Ряд СІЗЗС щодо серцево-судинної безпеки від більш безпечного до менш безпечного був таким: есциталопрам > сертралін > циталопрам > пароксетин > флуоксетин [61]. Також важливо відзначити, що есциталопрам має сприятливий профіль взаємодії зі статинами [62].
Як препарат вибору есциталопрам рекомендується для профілактики та лікування депресії в онкологічних хворих, у т. ч. у дітей та підлітків з онкопатологією [63, 64].
Існує величезна щораз вища потреба у вирішенні проблеми геріатричних розладів психічної діяльності. Дослідження останніх років дозволяють розглядати есциталопрам як перспективний препарат для корекції психоневрологічних симптомів деменції. Його перевагами в цього контингенту є ефективність, безпечність, можливість застосування в різних дозах, відсутність змін фармакокінетики в літньому та старечому віці, можливість спільного застосування з більшістю ЛП, економічна доступність [65-67].
Економічна доцільність застосування ЛП у сучасних умовах набуває все більшого значення, при цьому не слід змішувати поняття вартості препарату та витрат, потрібних для досягнення бажаних результатів лікування. Проведені в різних країнах дослідження підтверджують фармакоекономічні переваги есциталопраму перед іншими СІЗЗС, що є додатковим аргументом для його вибору [68-72].
З огляду на вищезазначене стає зрозумілим, чому есциталопрам входить до переліку життєво необхідних препаратів ВООЗ [73] і вже не один рік є лідером продажів [9, 74].
Висновки
Отже, аналіз останніх наукових та клінічних даних дозволяє визначити переваги та відмінності есциталопраму від інших СІЗЗС:
- ексклюзивний механізм дії, що поєднує вплив на всі відомі ланки патогенезу депресій;
- поєднання антидепресивної та нейротрофічної дії;
- відсутність вікових змін фармакодинаміки та фармакокінетики (можливість широкого застосування в пацієнтів літнього та старечого віку);
- можливість застосування фіксованої дози (добової та курсової) або мінімальна необхідність її титрування;
- широта клініко-фармакологічного спектра – ефективність за різних клінічних форм депресій (БДР, депресії у соматичних пацієнтів, ТДР);
- безпека – мінімальна частота розвитку побічних ефектів, зокрема відсутність серйозних побічних реакцій;
- мінімальний ризик лікарських взаємодій з іншими ЛП (безпека застосування в коморбідних пацієнтів);
- фармакоекономічна доцільність.
На українському фармацевтичному ринку представлено декілька препаратів есциталопраму. Один із них – Гіацинтія виробництва АТ «Київський вітамінний завод». Гіацинтія випускається у формі таблеток, що містять 10 і 20 мг оксалату есциталопраму, вони повністю відповідають стандартам Європейського союзу. Гіацинтія має досвід клінічного використання в Україні впродовж кількох років, є одним із найдоступніших препаратів есциталопраму на українському фармацевтичному ринку.
Слід пам’ятати, що в Україні АД належать до рецептурних препаратів; їх повинні призначати кваліфіковані психіатри. Водночас лікування легких і помірно виражених депресій у більшості країн Європи та Північної Америки проводиться лікарями, які надають первинну медичну допомогу (лікарями загальної практики – сімейними лікарями, терапевтами) й лікарями-спеціалістами (неврологами, кардіологами, гастроентерологами), а не лікарями-психіатрами. В реаліях сьогодення істотний спектр проявів депресій має відношення до практики сімейного лікаря і саме він вирішує те, в якому обсязі надавати допомогу відповідно до чинного протоколу [1]. Сподіваємося, що наданий нами оглядовий матеріал допоможе лікарям у вирішенні складного питання вибору ЛП із групи АД для конкретного хворого.
Список літератури знаходиться в редакції.
Медична газета «Здоров’я України 21 сторіччя» № 1-2 (537-538), 2023 р.